低温沼气发酵高效菌系的筛选及微生物群落解析
2017-05-03曹广丽张军政宋金柱
杜 洋, 曹广丽, 张军政, 宋金柱, 丛 华 , 张 达
(1.东北农业大学 生命科学学院, 黑龙江 哈尔滨 150030; 2. 哈尔滨工业大学 生命科学与技术学院, 黑龙江 哈尔滨 150001; 3哈尔滨工业大学 化工学院, 黑龙江 哈尔滨 150001)
低温沼气发酵高效菌系的筛选及微生物群落解析
杜 洋1, 曹广丽2, 张军政3, 宋金柱2, 丛 华2, 张 达1
(1.东北农业大学 生命科学学院, 黑龙江 哈尔滨 150030; 2. 哈尔滨工业大学 生命科学与技术学院, 黑龙江 哈尔滨 150001; 3哈尔滨工业大学 化工学院, 黑龙江 哈尔滨 150001)
为提高低温下沼气发酵效果,该研究使用不同接种物进行沼气发酵,并利用MiSeq高通量测序技术对优良接种物发酵沼液的群落结构进行分析。结果显示,以牛粪作为接种物在日产气量、产气速率和甲烷含量方面均优于其他组。高通量测序结果分析表明接种牛粪接种物后在细菌群落上形成的优势类群为Bacteroidetes,Firmicutes,Proteobacteria和Spirochaetae,并以Firmicutes和Bacteroidetes占主要优势地位;在古菌群落结构上形成的优势菌群在目的分类水平主要为Methanosarcinales、Miscellaneous Crenarchaeotic Group(MCG)和Methanomicrobiales,并以Methanomicrobiales为主,在属的分类水平上主要为Methanosaeta,MCG和Methanosarcina,其中Methanosaeta占主要地位。该研究为低温沼气发酵接种物的筛选和相关菌系分离及利用提供了科学依据。
沼气; 牛粪; 高通量测序; 微生物群落结构; 产甲烷古菌
化石燃料储备的耗竭和持续的环境污染,已成为当今世界面临的主要问题。随着人口增长和经济发展,未来全球能源需求将继续上升。能源和环境双重危机促使世界各国积极寻找可再生的、环境友好型的化石燃料替代物—生物质能源[1-2]。沼气作为一种可再生的清洁生物质能源,有着广阔的发展前景,目前已得到全世界广泛的关注和应用。但在沼气发酵过程中仍存在一些普遍性问题,如发酵周期长、产气量小、发酵体系不稳定等,而低温下进行的沼气发酵,这些问题则更加突出[3-6]。沼气发酵是一个非常复杂的厌氧消化过程,涉及物料分解,酸化和产甲烷等阶段,是多种微生物协同作用的结果。因此,探索适宜在低温条件下发酵产沼气的微生物,对解决寒冷地区产气量低的问题尤为重要[7-9]。
本研究通过使用不同环境接种物进行沼气发酵,筛选耐低温且发酵性能优良的微生物菌系,并采用高通量测序技术解析筛选出的优良菌系中与低温沼气发酵产气性能相关的微生物群落结构组成,以期为后期运行工艺的优化、相关菌系的分离和利用提供科学依据。
1 材料与方法
1.1 材料
试验所用污泥样品分别采于自然生境的黑龙江省扎龙自然保护区和群力湿地;沼液取自长期运行的沼气发酵罐;牛粪采于哈尔滨阿城区养殖场,与水等比例混合后置于实验室备用。
1.2 方法
1.2.1 低温沼气发酵接种物的筛选
试验所用发酵装置为1 L反应器,上口接两个玻璃管,一个连接排水集气装置,一个深入瓶底取样。发酵物料为牛粪秸秆(总固体含量为12%,碳氮比为30∶1)常温发酵20 d的酸化液,将pH值调节到7左右后使用。接种物分别为群力湿地污泥、扎龙湿地污泥、沼液与牛粪,发酵体系为600 mL,接种量为20%。将发酵装置整体置于恒温培养箱中,温度维持在20℃下进行发酵,发酵周期为30天。使用排水集气法收集气体,利用气相色谱仪测定气体甲烷含量及发酵液样品挥发性脂肪酸(volatile fatty acid,VFA)含量。
1.2.2 样品总DNA提取
取接种牛粪组发酵前后的发酵沼液,使用CTAB法[10]提取微生物基因组DNA,之后利用1%琼脂糖凝胶验证。
1.2.3 PCR扩增细菌、古细菌16S RNA基因及高通量测序
细菌16s RNA基因扩增使用通用引物338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)[11],以接种牛粪发酵反应液中的总DNA 为模板进行PCR 扩增,反应条件为95℃ 3 min, 95℃ 30 s, 55℃ 30 s, 72℃ 45 s, 共27 个循环;72℃ 10 min。古细菌使用通用引物Arch344F(5′-ACGGGGYGCAGCAGGCGCGA-3′)和Arch915R(5′-GTGCTCCCCCGCCAATTCCT-3′)[12]进行扩增。反应条件为95℃ 3 min, 95℃ 30 s, 55℃ 30 s, 72℃ 45 s, 共32个循环;72℃ 10 min。同一样本的PCR产物混合后用2%琼脂糖凝胶电泳进行检测后切胶回收。产物使用Miseq PE300测序,由上海美吉生物医药科技有限公司协助完成。
采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析并在各个水平统计每个样品的群落组成[13]。OTU分布统计使用Usearch(vsesion 7.1 http://drive5.com/uparse/)。稀释性曲线(Rarefaction curve),多样性指数(Alpha-diversity),Shannon-Wiener曲线应用mothur version v.1.30.1指数分析[14]。
2 结果与分析
2.1 低温沼气发酵高效菌系的筛选
2.1.1 日产气量的比较
在20℃条件下接种不同接种物,考察其对沼气发酵影响。其中沼气产量的高低可直接反映出沼气发酵的效果。由图1可见各组日产气量变化呈现先上升后下降的趋势,其中牛粪组日产气量明显高于其他组,峰值出现在13 d,最大日产气量为310 mL,其他组均有产气,但日产气量均低于170 mL,由此可见,产气量受接种物的影响很大。

图1 不同接种物日产气量的变化
2.1.2 产气率的比较
由图2可见,使用不同接种物条件下,沼气发酵的速率由有明显差异。扎龙污泥组产气速率最低,仅为0.02 m3·m-3d-1,群力污泥组与沼液组产气速率在0.035 m3·m-3d-1左右,牛粪组产气速率最大,为0.11 m3·m-3d-1,是其他组的两倍以上。据统计,沼气的产气速率在0.05 m3·m-3d-1以上时即可满足日常烹饪的要求。可见在20℃下,牛粪作为接种物的沼气发酵可满足农户的基本生活需求。

图2 不同接种物产气速率的比较
2.1.3 甲烷含量的比较
沼气是一种多组分的混合气体,主要成分是甲烷[15-17]。试验中甲烷含量与日产气量变化趋势一致,各组甲烷含量均为先升高后下降(见图3)。结合日产气量变化情况,这可能是由于在发酵初期,整个反应处于启动阶段,接种物中的产甲烷微生物仍处在适应环境的过程中,故产气量和甲烷含量均较低。随着发酵的进行,发酵体系中产甲烷微生物迅速生长并产生大量气体,使得产甲烷量大幅度提高,甲烷含量也随之升高。随着底物的消耗及代谢产物的积累,产甲烷微生物的数量与活性下降,导致产甲烷能力下降,产生的甲烷量逐渐减少,甲烷含量也随之下降。总之,相比于其他组,牛粪组甲烷含量最高,在发酵第13天出现峰值(40.8%),而其他组含量较低,均低于3%。

图3 不同接种物甲烷含量的变化
2.1.4 发酵液中VFA含量的变化
产甲烷菌只能利用甲酸、乙酸等简单碳水化合物,故本试验通过测定VFA变化以探究微生物的发酵过程。由于使用牛粪秸秆发酵酸化液作为底物,所以在发酵开始时就有一定量的VFA积累(见图4)。由图4可见,在起始发酵的前5天,各组的VFA仍呈上升趋势,表明发酵初期接种物中产酸菌活跃,VFA含量的增加。之后VFA含量迅速下降,说明以VFA为底物的产甲烷菌数量及活性升高,迅速消耗积累的VFA,导致VFA含量下降。相比于其他接种物组,以牛粪作为接种物组VFA的下降速度最快,VFA消耗量最大。
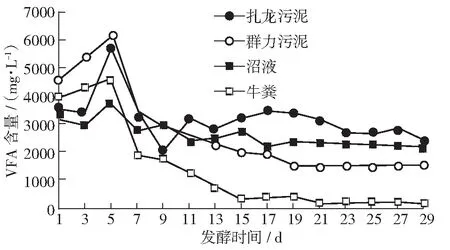
图4 不同接种物VFA含量的变化
2.2 细菌群落多样性分析
对接种牛粪组的样品进行菌群结构分析,其中N1为发酵初始样品,N4为发酵终止样品。
2.2.1 细菌多样性评价
OTU(Operational Taxonomic Units)是在系统发育学或群体遗传学研究中为了便于进行分析,人为给某一个分类单元(品系,属,种等)设置的同一标志,通常在97%的相似水平下的OTU进行生物信息统计分析。chao是用chao1算法估计样品中所含OTU数目的指数,在生态学中常用来估计物种总数。Coverage是指各样本文库的覆盖率,其数值越高,则样本中序列被测出的概率越高,该指数反映本次测序结果是否代表了样本中微生物的真实情况。
利用mothur软件对样品N1 和N4的测序结果进行序列比对,在此基础上对两个样品的OTU进行多样性分析。从表1中可以看出,在序列相似度为97%时,所取样品N1和N4分别产生533和551个OTU。所有chao指数均大于OTU数目,覆盖率在99%以上,说明OTU相似度的选取比较合理,且继续增加测序量对继续发现新的OTU影响不大。

表1 发酵样品中细菌多样性指数统计
2.2.2 细菌群落组成的系统发育分析
笔者研究从初始发酵样品N1和终止发酵样品N4中分别获得18802和25095条高质量有效的微生物序列,根据序列相似度97%时的聚类分析,产生500左右OTU,相比传统常用微生物研究的分子生物学手段、DGGE和克隆文库技术体现出巨大优势。
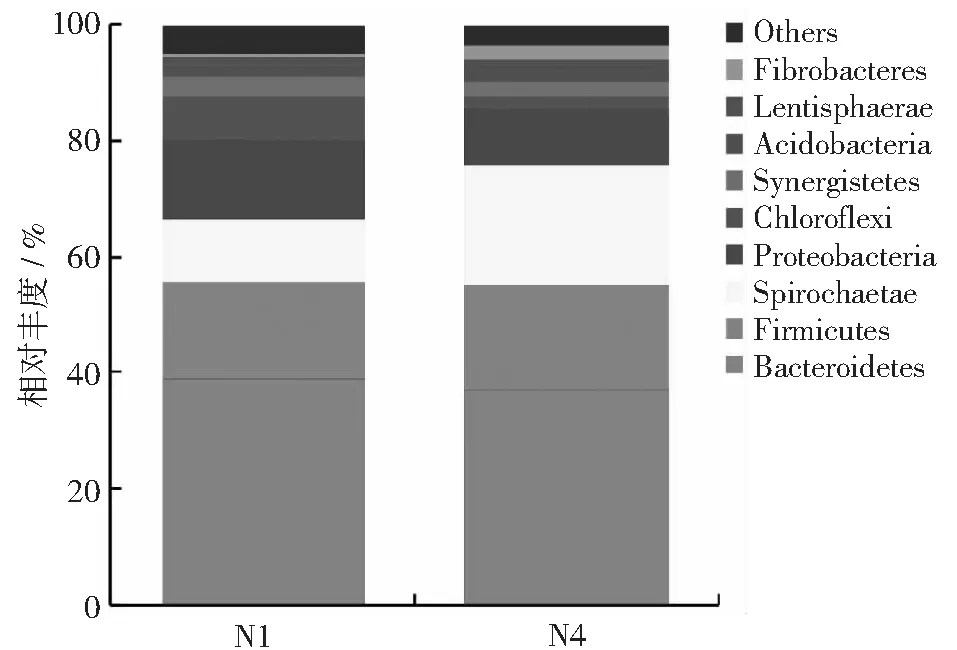
图5 细菌在门分类水平上的微生物组成
如图5所示,发酵前后的细菌多样性十分丰富,在门的分类水平上共有9个类群,分别为拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、螺旋体门(Spirochaete)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、互养菌门(Synergistetes)、酸杆菌门(Acidobacteria)、黏胶球形菌门(Lentisphaerae)和纤维杆菌门(Fibrobacteres)。整体而言,在细菌结构群落变化过程中,发酵体系中出现了以Bacteroidetes、Firmicutes、Proteobacteria和Spirochaetae为优势类群的水解酸化体系,约占整个细菌微生物系统的85%以上。通过对系统发酵前后的比较发现,在发酵后Chloroflexi门微生物受到明显抑制,由原来的7.21%下降至后期的2.15%,Proteobacteria前后变化不大,Spirochaete略有升高,而 Firmicutes和Bacteroidetes在发酵前后稳定在60%左右,始终占据着优势地位。
2.3 古细菌群落多样性分析
2.3.1 古细菌多样性评价
表2中可以看出,在序列相似度为97%时,N1和N4分别产生39与42个OTU,所有chao指数均大于或等于OTU数目,覆盖率在99%以上,说明OTU相似度的选取比较合理,且继续增加测序量对继续发现新种的影响不大。

表2 发酵样品中古菌多样性指数统计
2.3.2 古细菌群落组成的系统发育分析
如图6(A)所示在门的分类水平上主要为两个类群:广古菌门(Euryarchaeota)和奇古菌门(Thaumarchaeota)。此两类群微生物在N1中分别为66.16%和33.79%,N4中分别为75.40%和24.56%。在发酵后,广古菌门微生物略有增加,而奇古菌门微生物所占比例略有下降。如图7所示在目的分类水平上主要为5个类群:甲烷八叠球菌目(Methanosarcinales)、Miscellaneous Crenarchaeotic Group(MCG),

图6 古细菌在门分类水平上的分布

图7 古细菌在目分类水平上的分布
甲烷微菌目(Methanomicrobiales)、甲烷杆菌目(Methanobacteriales)和热原体目(Thermoplasmatales),其中甲烷八叠球菌目占主要地位,其在发酵前后分别占总体的56.05%和62.69%。
在属的分类水平上主要为甲烷鬃菌属(Methanosaeta),MCG和甲烷八叠球菌属(Methanosarcina),其在N1中的比例分别为52.13%,33.79%和3.92%,N4中比例分别为44.36%,24.56%和18.34%(见表3)。
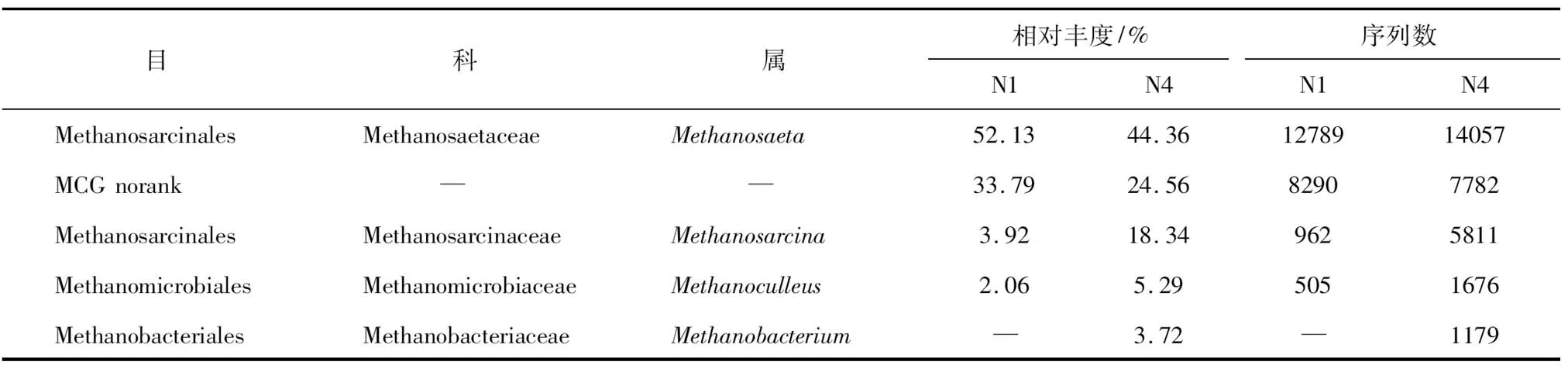
表3 发酵样品相对丰度高于2%的古细菌组成
注:分类学数据库中会出现一些分类学谱系中的中间等级没有科学名称,以norank作为标记。
3 讨论
沼气发酵过程是一个由多种微生物协同,交替作用的复杂生化过程。微生物的种类及组成是决定沼气发酵性能的重要决定因素之一。本研究选用不同环境来源的微生物菌源作为接种物,采用沼气模拟发酵与高通量测序技术相结合的方法,进行了低温优良菌系的筛选及微生物群落结构解析。通过日产气量、产气率、甲烷含量及发酵过程中挥发酸的测定,对不同接种物的沼气发酵性能进行了分析,牛粪组的发酵效果最佳,其日产气量、产气速率、甲烷含量等均高于其他组,产气速率达到了0.11 m3·m-3d-1。孔维涛[18]等人在不同接种源的低温沼气发酵试验中发现,16℃下最优接种物的产气速率约为0.05 m3·m-3d-1。丁福贵[19]等对污泥的低温驯化过程中发现,15℃下的产气速率最大值为0.105 m3·m-3d-1。裴占江[20]等采用牛粪和稻秆混合作为原料,20℃下最佳TS的产气速率为0.09 m3·m-3d-1左右。可见,本研究中以牛粪作为接种具有较高的产气速率。
为了探明牛粪作为接种物的沼气发酵过程中功能微生物的群落结构特征,应用高通量测序技术解析了牛粪组发酵前后的细菌与古菌的菌群结构。分析表明细菌在门分类水平上的主要菌群为Bacteroidetes、Firmicutes、Proteobacteria和Spirochaetae,占序列总数的85%以上,其中Proteobacteria发酵前后变化不大,Firmicutes和Bacteroidetes则一直处于主要优势菌的地位。据报道Firmicutes微生物在降解纤维素、蛋白质等大分子物质中起到关键作用[21],Bacteroidetes微生物可将糖类分解成乙酸[22]。由此表明,这两个门类微生物的活跃保证了发酵水解酸化阶段的正常启动与运行,同时为产甲烷阶段提供了可利用的底物,保证了沼气发酵的持续进行。古菌在目的水平主要优势类群为Methanosarcinales,Miscellaneous Crenarchaeotic Group和Methanomicrobiales,并以Methanosarcinales占主要地位。其在的属的分类水平上主要为Methanosaeta,MCG和Methanosarcina。其中发酵前后相对丰度最高的是Methanosaeta,发酵前(52.13%)与发酵后(44.36%)所占丰度均最大,而相对丰度增长最大的是Methanosarcina,对比发酵前后其相对丰度增加5倍以上(由发酵前3.92%增加到发酵后18.34%)。Methanosaeta与Methanosarcina是以低碳酸代谢为主的产甲烷菌属[23],在已报到的文献中也推测Methanosaeta与Methanosarcina微生物是低温条件下产甲烷过程的主要功能菌群[18,24],结合试验中VFA水平的下降,笔者研究进一步证明了Methanosaeta与Methanosarcina是低温环境下维持沼气发酵系统正常产气的关键菌属。
综上所述,接种物的筛选在沼气发酵中具有重要的作用,优良的接种物可以很大程度上提高沼气发酵的效果。同时也说明,调控微生物种群结构形成活性较强的水解酸化和产甲烷菌类群是提高系统运行效率的关键。由于沼气发酵过程涉及的微生物众多,其中有大量未培养的微生物,而高通量测序技术可以使我们更好的了解发酵的菌群及其变化情况。本研究为进一步优化低温沼气发酵条件和功能菌系的分离及利用奠定了基础。
[1] Sreekrishnan T,Kohli S,Rana V. Enhancement of Biogas Production From Solid Substrates Using Different Techniques——a Review[J]. Bioresource Technology, 2004, 95(1):0960-8524.
[2] Weiland P. Production and Energetic Use of Biogas From Energy Crops and Wastes in Germany[J]. Applied Biochemistry and Biotechnology, 2003, 109(1): 263-274.
[3] 刘树民,韩靖玉. 中国北方寒冷地区沼气的综合开发利用[J]. 内蒙古农业大学学报: 自然科学版, 2002, 23(4): 83-86
[4] 赵 光,马 放,魏 利,等. 北方低温沼气发酵技术研究及展望[J]. 哈尔滨工业大学学报, 2011, 43(6): 29-33
[5] Jiao Y,Yuan W,Ma L, et al. Initial Studies on the Influencing Factor of Biogas-fermentation at Low Temperature[J]. Environmental Science & Technology, 2013,S1.
[6] Chen Y,Hu W,Feng Y, et al. Status and Prospects of Rural Biogas Development in China[J]. Renewable and Sustainable Energy Reviews, 2014, 39: 679-685.
[7] Zhang T,Yang L,Wang Y. Comparison of Different Inoculums in Anaerobic Fermentation to Produce Biogas [J]. Energy Engineering, 2008, 4: 16.
[8] Fan X,Guo R,Yuan X, et al. Biogas Production From Macrocystis Pyrifera Biomass in Seawater System[J]. Bioresource Technology, 2015, 197: 339-347.
[9] Li N,Xu F,Zhao Z, et al. Screening and Cultivation of High Efficient Methanogenic Microbes for Dry Methane Fermentation at Low-temperature[J]. China Biogas, 2012, 5: 5.
[10] 沈 萍,陈向东. 微生物学实验[M].北京: 高等教育出版社, 2007.
[11] Dennis KL,Wang Y,Blatner NR, et al. Adenomatous Polyps Are Driven By Microbe-instigated Focal Inflammation and Are Controlled By Il-10-producing T Cells[J]. Cancer Research, 2013, 73(19): 5905-5913.
[12] Ohene-adjei S,Teather RM,Ivan M, et al. Postinoculation Protozoan Establishment and Association Patterns of Methanogenic Archaea in the Ovine Rumen[J]. Applied and Environmental Microbiology, 2007, 73(14): 4609-4618.
[13] Wang Q,Garrity GM,Tiedje JM, et al. Naive Bayesian Classifier for Rapid Assignment of Rrna Sequences Into the New Bacterial Taxonomy[J]. Applied and Environmental Microbiology, 2007, 73(16): 5261-5267.
[14] Schloss P D,Gevers D,Westcott S L. Reducing the Effects of Pcr Amplification and Sequencing Artifacts on 16s Rrna-based Studies[J]. Plos One, 2011, 6(12):e27310.
[15] Rasi S,Läntelä J,Rintala J. Trace Compounds Affecting Biogas Energy Utilisation-a Review[J]. Energy Conversion and Management, 2011, 52(12): 3369-3375.
[16] Makaruk A,Miltner M,Harasek M. Membrane Biogas Upgrading Processes for the Production of Natural Gas Substitute[J]. Separation and Purification Technology, 2010, 74(1): 83-92.
[17] Mussgnug JH,Klassen V,Schlüter A, et al. Microalgae as Substrates for Fermentative Biogas Production in a Combined Biorefinery Concept[J]. Journal of Biotechnology, 2010, 150(1): 51-56.
[18] 孔维涛. 低温沼气发酵优良菌系的筛选及优势菌群分析[D].保定: 河北农业大学, 2013.
[19] Li A,Chu Y,Wang X, et al. A Pyrosequencing-based Metagenomic Study of Methane-producing Microbial Community in Solid-state Biogas Reactor[J]. Biotechnol Biofuels, 2013, 6(3).
[20] Kampmann K,Ratering S,Kramer I, et al. Unexpected Stability of Bacteroidetes and Firmicutes Communities in Laboratory Biogas Reactors Fed with Different Defined Substrates[J]. Applied and Environmental Microbiology, 2012, 78(7): 2106-2119.
[21] Zhu J,Zheng H,Ai G, et al. The Genome Characteristics and Predicted Function of Methyl-group Oxidation Pathway in the Obligate Aceticlastic Methanogens, Methanosaeta Spp[J]. Plos One, 2012, 7(5): 1932-6203.
[22] 赵 光. 两段式厌氧工艺产甲烷发酵特性及微生物生态调控机制研究[D].哈尔滨: 哈尔滨工业大学, 2013.
Screening of High Efficient Inoculum for Low Temperature Biogas Fermentation And Its Microbial Community Analysis /
DU Yang1, CAO Guang-li2, ZHANG Jun-zheng3, SONG Jin-zhu2, CONG Hua2, ZHANG Da1/
(1.College of Life Science, Northeast Agricultural University, Harbin 150030, China; 2.School of Life Science and Technology, Harbin Institute of Technology, Harbin 150001, China, 3.School of Chemical Engineering and Technology, Harbin Institute of Technology, Harbin 150001, China)
In order to improve the efficiency of biogas fermentation at low temperature, the effects of several kinds of inoculums were compared, the better one was selected, and its microbial community was analyzed by the method of MiSeq high-throughput sequencing. The results showed that cow dung was the better inoculum comparing with other inoculums, for it obtained higher biogas production. High-throughput sequencing analysis demonstrated that the main bacterial wereBacteroidetes,Firmicutes,ProteobacteriaandSpirochaetaein cow dung inoculum, and the dominant wereFirmicutesandBacteroidetes. The main archaea wereMethanosarcinales,MiscellaneousCrenarchaeoticgroup(MCG), andMethanomicrobialesat order level classification and theMethanosarcinaleswas the dominant. At the genus level classification, the main archaea wereMethanosaeta,MCGandMethanosarcinawithMethanosaetaas dominant.
biogas; cow manure; high throughput sequencing; microbial community structure; methanogenic archaea
2016-03-02
2016-05-02
项目来源: 国家科技支撑计划(2014BAJ21B02-04)
杜 洋(1990-),男,主要从事植物生物质生物转化研究等工作,E-mail: duy126@126.com
张 达,E-mail: zhangda2011@126.com
S216.4; X713
A
1000-1166(2017)02-0009-06
