小鼠性染色体在精子发生过程中的转录活性与基因表达
2017-05-03周浩上官爱哨南梁康梁秋曼张淑君
周浩,上官爱哨,南梁康,梁秋曼,张淑君
(华中农业大学农业动物遗传育种与繁殖教育部重点实验室,武汉 430070)
小鼠性染色体在精子发生过程中的转录活性与基因表达
周浩,上官爱哨,南梁康,梁秋曼,张淑君
(华中农业大学农业动物遗传育种与繁殖教育部重点实验室,武汉 430070)
小鼠性染色体在精子发生过程中经历了与常染色体不同的基因表达水平。性染色体在减数分裂过程中会发生转录失活(MSCI,meiotic sex chromosome inactivation),并且还会有部分基因表达(PSCR,postmeiotic sex chromosome repression)。本文综述了小鼠性染色体在减数分裂过程中发生转录失活的过程及机制,然后利用最近的小鼠减数分裂后精细胞测序的RNA数据,对小鼠精子发生过程中起重要作用的Akap4、Cypt、Asb9基因进行了功能描述。
精子发生;减数分裂;MSCI;PSCR
小鼠是哺乳动物实验中研究得比较多的动物模型。近几年有报道指出,小鼠精卵受精时精子携带RNA进入卵细胞会调控卵子的表观遗传特征,进而影响后代性状。即后天雄性动物的环境因素通过精子RNA也可以遗传给后代改变后代表型。所以了解和借鉴小鼠性染色体在精子发生过程中的基因表达情况对改善奶牛等哺乳动物的繁殖性能有重要意义。小鼠精子的发生是严密的周期过程,精原干细胞经历了两次减数分裂,由双倍体的精原干细胞分化成单倍体的精母细胞,再分化成圆形精细胞(RS,Round Sperm)。随后在精子发生过程中,单倍体的圆形精细胞经历延长过程形成长形精细胞(ES,Elongated Sperm)。精细胞在这个过程中发生显著的形态变化,如丢失一部分细胞质,生成顶体和鞭毛,精细胞的核发生浓缩,包裹DNA的组蛋白逐步由鱼精蛋白取代[1,2]。之前有研究通过H-uridineincorporation和放射自显影技术观察小鼠精子发生过程中基因的转录情况,发现减数分裂粗线期精细胞(PS,Pachytene Sperm)性染色体的转录活性被抑制[3],这个过程称为MSCI。而减数分裂完成后,在长形精子形成过程中会有一部分性染色体的基因表达。这部分表达的基因逃脱了性染色体的抑制(PSCR),对减数分裂后长形精细胞的形成起了重要的作用(图1)。
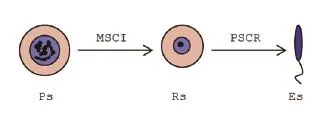
图1 精子生成过程中性染色体经历了MSCI和PSCR过程(注:PS-粗线期精母细胞;RS-圆形精细胞;ES-长形精细胞)
精细胞经历发生过程后转移到附睾中成熟,成熟的精子具有高密度的核结构,细胞质较少。精细胞核包含RNA转录酶和丰富的转录因子[4],但是Grunewald研究发现在精子中没有放射性的尿苷[1],即证明在成熟的精细胞中没有转录活性。现在有研究表明在精子中只有线粒体里存在转录和翻译活性[5,6]。成熟的精子缺少28S 和18S rRNAs,它们是组成细胞质核糖体80S的重要成分,80S核糖体是翻译的主要细胞器[7]。总体上来说,在成熟精子的细胞质中是不具备转录和翻译功能的。所以成熟精子中携带的RNA主要是精子发生过程中产生的并且大部分都是由这个过程遗留下来的。性染色体对精子的发育具有极其重要的作用,所以研究这个时间段性染色体基因的表达,对了解精子的生成过程及精子携带的转录本的作用有重要意义。
1 精子形成过程中性染色体的转录活性
在小鼠精细胞减数分裂的粗线期,XY染色体会形成一种特殊的结构,称之为XY小体,性染色体会在这一过程中转录失活[8~10]。性染色体转录失活会产生一个潜在的问题,即精子发生过程中需要来自性染色体的基因参与,因此,所需的性染色体基因要么在MSCI过程之前转录,要么它们在减数分裂后精子发生过程中摆脱转录抑制进行转录。已经明确的是,虽然在MSCI后性染色体的基因大部分还是沉默不表达的,但是其中有一部分性染色体上的基因会摆脱转录抑制具有转录活性[11,12]。Gennady Margolin通过对小鼠精子发生波各个阶段的精细胞进行测序,证实了MSCI的存在[13]。之前有报道13%~18%的X染色体基因在小鼠减数分裂后的精细胞中表达。在作者的分析中,相对于X染色体,常染色体在减数分裂之后有46%~59%的基因表达,小鼠X染色体只有27%的基因表达。表1中列举了作者在小鼠减数分裂后精细胞中测序得到的RNA(RPKM>50,Reads Per Kilobases per Millionreads,RPKM为代表每百万reads中来自于某基因每千碱基长度的reads数)。
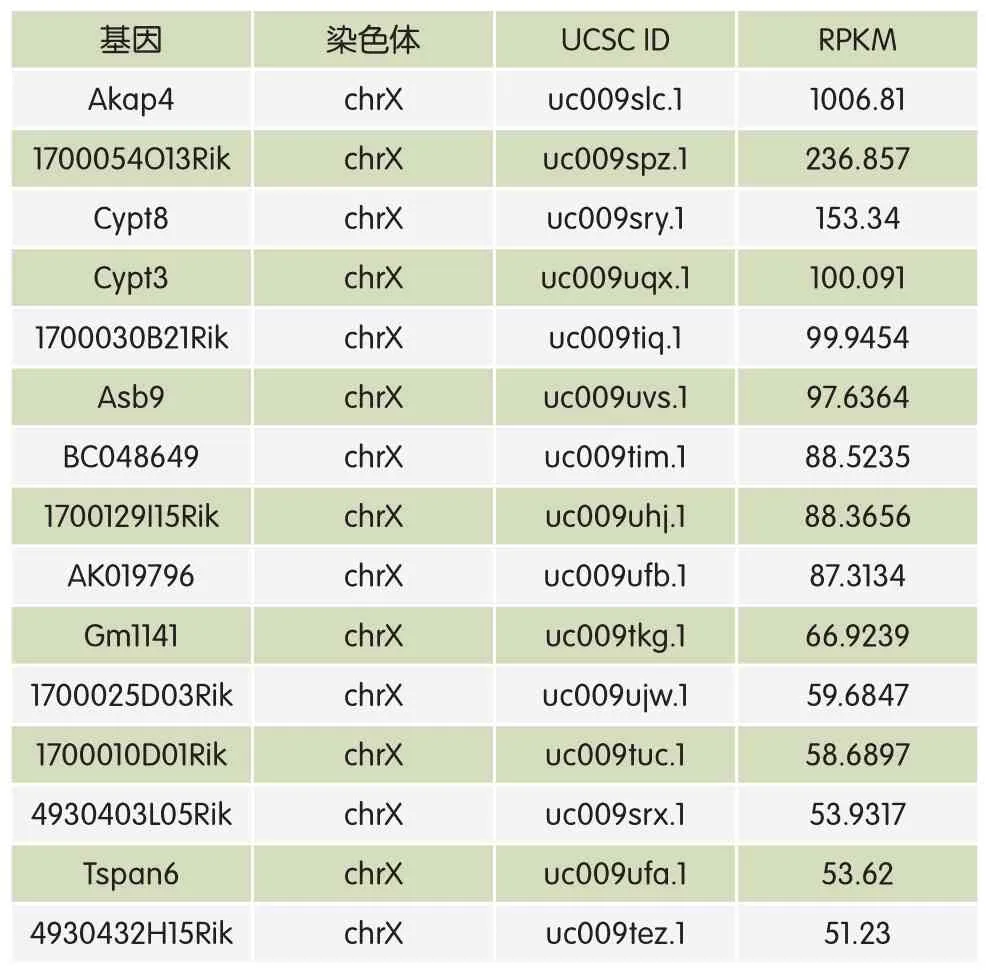
表1 减数分裂后小鼠精细胞中高表达的RNA(RPKM>50)
2 性染色体减数分裂时期的转录失活机制
在精细胞减数分裂过程中,性染色体形成的XY小体中也存在Xist RNA (Xist基因参与X染色体转录失活),这种现象与在雌雄动物中存在一条不转录的X染色体一致,其中Xist RNA参与了对其转录失活的调控,Xist RNA招募一些蛋白复合物调节转录失活的X染色体[14]。这种现象表示雄性动物在减数分裂中性染色体失活,可能与雌性动物一条X染色体失活的原理一样[15]。虽然,研究已经证实对于MSCI过程,Xist RNA并不能启动沉默和维持X染色体的失活[16,17],但是目前也不排除可从其他方面导致X染色体失活。
关于XY小体形成的机制也有研究表明:在粗线期,BRCA1蛋白会招募ATP激酶,使H2AX蛋白磷酸化,随后启动了一系列反应导致染色体浓缩和转录抑制。与此相同的是,在雌性动物失活的一条X染色体中,BRCA1蛋白和磷酸化的H2AX蛋白结合发生在S阶段的细胞周期[18]。推测BRCA1蛋白和磷酸化的H2AX蛋白能快速招募各种各样的修复因子和染色体重塑及整合特定的组蛋白。在雌性动物中,这是维持X染色体失活所必须的[15,19]。在小鼠精细胞减数分裂期精细胞中的BRCA1蛋白和磷酸化H2AX(γН2АХ)蛋白,也能起快速形成性染色体失活结构的作用。如,γН2АХ蛋白能招募Mre11和Rad50蛋白,这些蛋白涉及到染色体重组和核小体的替换[18,20]。但是,BRCA1蛋白和γН2АХ蛋白能引起X染色体失活的原理至今仍不清楚,确定的是BRCA1蛋白和磷酸化的H2AX蛋白会绑定在一些失活的基因上。另一方面,在小鼠的XY小体中还发现了MAEL蛋白可以与MILLI 和 MIWI蛋白作用,这些蛋白能对生殖细胞系的特异RNA起到干扰作用。这个过程也会参与到XY小体转录沉默的过程中。
3 常染色体的转座补偿
常染色体基因在减数分裂和减数分裂后阶段的转录活性没有很大变化。相比之下,性染色体基因经历了在减数分裂阶段完全转录失活到减数分裂后部分转录失活的过程[12]。性染色体基因在减数分裂前期和减数分裂后对精子的发生和成熟有很重要的作用,虽然在减数分裂过程中缺乏作用,但是在MSCI过程中因阻断了一部分X染色体上基因表达能阻断重要的细胞生物过程,而正常的MSCI过程却没有对减数分裂造成干扰,这说明可能这些基因能被常染色体上的转座子基因替代表达,称之为减数分裂时期常染色体对性染色体的表达补偿。研究共发现14个只在睾丸中表达的转座基因,它们的X连锁转座子是看家基因[21]。其中磷酸激酶就是一个例子,在人类的PGK1/PGK2中,PGK2定位于6号染色体,只在睾丸中表达,然而PGK1定位在X染色体,在任何组织都表达,但在MSCI时期沉默[22],相反的是PGK2会在减数分裂终止时表达,补偿在减数分裂后被抑制的PGK1基因。
4 在精子发生过程中性染色体的转录丰度
Akap4基因在减数分裂后X染色体上表达的丰度最高,为1006.81 RPKM. 其编码的蛋白为A-激酶锚定蛋白4。Akap4基因编码蛋白质与纤维鞘的形成有关系,纤维鞘是一种细胞骨架,结构位置在精子鞭毛的主段。敲除AKAP4基因的雄鼠,精子缺乏AKAP4蛋白,精子的数量虽没有减少,但精子没有向前的运动能力和缺失受精能力。虽然可以形成纤维鞘间叶原基,但完整的纤维鞘没有形成,鞭毛不仅缩短,而且与纤维鞘相联系的蛋白质在数量上大幅减少。所以,AKAP4是维持纤维鞘完整性的支架蛋白,因为缺失AKAP4蛋白,与其相关联的信号转导和糖酵解酶无法进行,精子将失去能动性[23]。Cypt基因编码Cysteine-rich perinuclear theca蛋白,其中高表达的RNA中存在两个转录本Cypt8和Cypt3,Cypt的转录本由过渡蛋白Tnp2和鱼精蛋白Prm1启动,这两个蛋白都是涉及到精子的核浓缩,Cypt家族的蛋白可能与精子染色质的形成和其核浓缩有关[24]。Asb9基因编码Ankyrin repeat and SOCS box protein 9,这个基因是编码锚定蛋白重复区和细胞因子传导抑制因子家族成员之一。这个家族的成员可以通过SOCS域与延伸适配器B-C复合物相互作用,再与滞环蛋白相互作用,形成E3泛素连接酶复合物。它们可以起到介导底物识别E3泛素连接酶的作用[25]。减数分裂完成后,精子的形态发生很大的变化,这其中涉及很多蛋白降解过程。Asb9蛋白可能在其中起泛素化作用。
5 小结
性染色体作为染色体中特殊的一部分,在减数分裂中基因的表达与常染色体基因表达不一样。Jacob L Mueller通过微阵列分析精子发生过程中基因的表达证实了X染色体在减数分裂过程中经历转录失活,后有约18%的X染色体重新恢复转录活性。而这部分基因主要是X染色体上的多拷贝基因,而具有重要作用的单拷贝基因即使不表达,与其同源的常染色体的基因也会表达对其进行补偿。Gennady Margolin 近些年通过对精子发生过程中细胞表达转录组测序,相对于常染色体在减数分裂之后有46%~59%的基因表达,小鼠X染色体只有27%表达。进一步证实了小鼠生殖细胞减数分裂完成后性染色体只有部分表达。通过对作者在此阶段细胞X染色体表达测序数据分析,根据Spermatogenesis和MGI数据库中的注解,可以推测Akap4、Cypt、Asb9基因在减数分裂后期精子形成过程起了重要作用。随着第三代转录组测序时代的到来,对精子发生过程中的各个时间段的精细胞进行测序,将会得到精子发生过程中各个时间段染色体基因表达更为准确的数据,推进对其表达RNA功能的了解。同样,由于受精时精子携带RNA进入卵细胞,携带的RNA会调控卵子的表观遗传特征,后天雄性动物的环境因素通过精子也可以遗传给后代改变后代表型。Upasna Sharma研究发现,亲代小鼠饮食的蛋白质含量会影响子代的表型[8]。未来,对已知种公牛RNA数据分析找出能影响其产奶量的RNA,通过调控RNA改善后代母牛的产奶量也是繁殖方面很有意义的课题。
[1] Grunewald S,Paasch U,Glander H, et al. Mature Human Spermatozoa Do Not Transcribe Novel Rna[J]. Andrologia, 2005, 37(2):69-71.
[2] Moldenhauer JS,Ostermeier GC,Johnson A, et al. Diagnosing Male Factor Infertility Using Microarrays[J]. Journal of Andrology, 2003, 24(6):783-789.
[3] Dadoune J,Siffroi J,Alfonsi M. Transcription in Haploid Male Germ Cells[J]. International Review of Cytology, 2004, 237(3):1-56.
[4] Pittoggi C,Magnano AR,Sciamanna I, et al. Specific Localization of Transcription Factors in the Chromatin of Mouse Mature Spermatozoa[J]. Molecular Reproduction and Development, 2001, 60(1):97-106.
[5] Maclaughlin J,Terner C. Ribonucleic Acid Synthesis By Spermatozoa From the Rat and Hamster[J]. Biochemical Journal, 1973, 133(4):635-639.
[6] Miller D,Ostermeier GC. Towards a Better Understanding ofRna Carriage By Ejaculate Spermatozoa[J]. Human Reproduction Update, 2006, 12(6):757-767.
[7] Cappallo-obermann H,Schulze W,Jastrow H, et al. Highly Purified Spermatozoal Rna Obtained By a Novel Method Indicates an Unusual 28s/18s Rrna Ratio and Suggests Impaired Ribosome Assembly[J]. Molecular Human Reproduction, 2011, 17(11):669-678.
[8] Sharma U,Conine CC,Shea JM, et al. Biogenesis and Function of Trna Fragments During Sperm Maturation and Fertilization in Mammals[J]. Science, 2016, 351(6271):391-396.
[9] Turner JM. Meiotic Sex Chromosome Inactivation[J].Development, 2007, 134(10):1823-1831.
[10] Burgoyne PS,Mahadevaiah SK,Turner JM. The Consequences of Asynapsis for Mammalian Meiosis[J]. Nature Reviews Genetics, 2009, 10(3):207-216.
[11] Namekawa SH,Park PJ,Zhang L, et al. Postmeiotic Sex Chromatin in the Male Germline of Mice[J]. Current Biology, 2006, 16(7):660-667.
[12] Mueller JL,Mahadevaiah SK,Park PJ, et al. The Mouse X Chromosome Is Enriched for Multicopy Testis Genes Showing Postmeiotic Expression[J]. Nature Genetics, 2008, 40(6):794-799.
[13] Margolin G,Khil PP,Kim J, et al. Integrated Transcriptome Analysis of Mouse Spermatogenesis[J]. Bmc Genomics, 2014, 15(1):1.
[14] Heard E,Disteche CM. Dosage Compensation in Mammals: Fine-tuning the Expression of the X Chromosome[J]. Genes & Development, 2006, 20(14):1848-1867.
[15] Ayoub N,Richler C,Wahrman J. Xist Rna Is Associated with the Transcriptionally Inactive Xy Body in Mammalian Male Meiosis[J]. Chromosoma, 1997, 106(1):1-10.
[16] Mccarrey JR,Watson C,Atencio J, et al. X-chromosome Inactivation During Spermatogenesis Is Regulated By an Xist/ tsix-independent Mechanism in the Mouse[J]. Genesis, 2002, 34(4):257-266.
[17] Turner JM,Mahadevaiah SK,Elliott DJ, et al. Meiotic Sex Chromosome Inactivation in Male Mice with Targeted Disruptions of Xist[J]. Journal of Cell Science, 2002, 115(21): 4097-4105.
[18] Fernandez-capetillo O,Mahadevaiah SK,Celeste A, et al. H2ax Is Required for Chromatin Remodeling and Inactivation of Sex Chromosomes in Male Mouse Meiosis[J]. Developmental Cell, 2003, 4(4):497-508.
[19] Shevchenko A,Pavlova S,Dementyeva E, et al. Chromatin Modifications During X-chromosome Inactivation in Female Mammals[J]. Russian Journal of Genetics, 2006, 42(9):1019-1029.[20] Van attikum H,Gasser SM. The Histone Code at Dna Breaks: a Guide to Repair?[J]. Nature Reviews Molecular Cell Biology, 2005, 6(10):757-765.
[21] Wang PJ. X Chromosomes, Retrogenes and Their Role in Male Reproduction[J]. Trends in Endocrinology & Metabolism, 2004, 15(2):79-83.
[22] Mccarrey JR,Thomas K. Human Testis-specific Pgk Gene Lacks Introns and Possesses Characteristics of a Processed Gene[J].Nature, 1987, 326(6112):501-505.
[23] Miki K,Willis WD,Brown PR, et al. Targeted Disruption of the Akap4 Gene Causes Defects in Sperm Flagellum and Motility[J].Developmental Biology, 2002, 248(2):331-342.
[24] Elliot MK. Tales of Parenthood From the Crypt: the Predicament of the Posthumously Conceived Child[J]. Real Prop. Prob. & Tr.J., 2004, 39(4):47.
[25] Kwon S,Kim D,Rhee JW, et al. Asb9 Interacts with Ubiquitous Mitochondrial Creatine Kinase and Inhibits Mitochondrial Function[J]. Bmc Biology, 2010, 8(1):1.
The Transcription of Sex Chromosome of Mouse in Spermatogenesis
ZHOU Hao, SHANGGUAN Ai-shao, NAN Liang-kang, LIANG Qiu-man, ZHANG Shu-jun
(Key Laboratory of Agricultural Animal Genetics, Breeding and Reproduction, Education Ministry of China, Huazhong Agricultural University, Wuhan 430070)
The mouse sex chromosomes exhibit a different degree of expression as autosomal genes in spermatogenesis. Mouse sex chromosomes become transcriptional inactivation at meiosis (MSCI). But after meiosis, post-meiotic sex chromosome repression (PSCR) is incomplete, it still has expression of some genes. This paper reviews transcriptional inactivation process and mechanism of mouse chromosomes during meiosis and choose Akap4, Cypt, Asb9 from recent RNA sequencing data of mouse germ cell at post meiosis, to show their important role in spermatogenesis.
Spermatogenesis; Meiosis; MSCI; PSCR
S823.3
A
1004-4264(2017)04-0017-04
10.19305/j.cnki.11-3009/s.2017.04.005
2016-11-20
周浩(1992-),男,硕士研究生。
张淑君,教授。
