纤维素降解菌的筛选、鉴定和糖化水平研究
2017-04-27张海鹏宋艳培刘孟浩何时雨马旭东覃新导李伯松
郑 丽,张海鹏,宋艳培,刘孟浩,何时雨,马旭东,覃新导,李伯松
(1.中国热带农业科学院广州实验站,广东 广州 510140;2.华南农业大学农学院,广东 广州 510642;3.华南农业大学材料与能源学院,广东 广州 510642;4.中国热带农业科学院,海南 海口 571101)
纤维素降解菌的筛选、鉴定和糖化水平研究
郑 丽1,2,张海鹏2,宋艳培3,刘孟浩3,何时雨1,马旭东1,覃新导4,李伯松1
(1.中国热带农业科学院广州实验站,广东 广州 510140;2.华南农业大学农学院,广东 广州 510642;3.华南农业大学材料与能源学院,广东 广州 510642;4.中国热带农业科学院,海南 海口 571101)
将前期从木薯生境中分离、保存的298个菌株,通过平板测试,筛选到57个可产纤维素酶活的菌株,其中酶活性效果最好的菌株(水解圈最大,将其赋值得分为3)所占比例为40.9%,酶活性依次减弱的菌株所占比例(赋值得分为2和1)分别占27.9%和24.6%。采用DNS法测定57个菌株的糖化水平和酶活力,结果显示,10株细菌具有较好潜力降解纤维素,其中菌株HWY-3-9的糖化和酶活力最好,产糖量为0.1852 mg/mL,酶活力为0.0012 U/mL,经鉴定为解淀粉芽孢杆菌。
细菌;纤维素酶;糖化水平
随着化石能源的不断开发利用,人类正面临着能源枯竭的危机。纤维素作为一种生物质能源倍受瞩目,它在自然界中分布广泛,主要存在于可再生的木质纤维素材料中[1]。随着我国农业及农产品加工产业的发展,农业废弃物不断增加,给环境带来沉重负担[2-3]。其中秸秆废弃物的主要组成为半纤维素和木质素,它们交织在一起形成难降解的复合物[4]。因此,筛选能降解纤维素的菌株成为近年的研究热点。国内外对纤维素降解菌的研究有相关报道,如冯玉杰等[5]筛选出具有较好降解纤维素活性的菌株,根据菌株本身产酶特点进行复配,实现纤维素的快速水解,利用纤维素降解菌株群和酵母菌进行联合作用,最终实现纤维素类物质较高水平的利用;罗萍等[6]从自然发酵的菠萝渣中分离得到了降解菠萝纤维素菌株;林捷等[7]从自然界中筛选出了6株纤维素分解菌并进行复配,大幅提高纤维素酶活力以及对还原糖的耐受力;李嘉薇等[8]对纤维素酶水解糖化木薯秸秆工艺条件进行优化,结果表明,在温度为45℃,反应体系pH为4.5,酶用量为2 g/L,反应时间为42 h,还原糖得率最大;卢月霞等[9]将细菌和放线菌经过混菌培养后发现,组合菌株的酶活相当于其各自单独培养时的两倍;王丽等[10]、张晓伦等[11]也发现类似的结果。二战期间分离得到的纤维素降解菌“瑞氏木霉”,其强大的纤维素分泌能力得到验证并已被广泛应用于纤维素酶生产及合成的研究[12]。据报道,好氧细菌以胞外酶形式分泌3种纤维素酶水解纤维素,厌氧细菌则可将3种纤维素酶组装成纤维小体[13];Faterstam等[14]也发现两种外切酶(CBHⅠ、CBHⅡ)联合降解结晶纤维素的毒素和程度是单组分酶的两倍。
本研究通过纤维素降解菌的筛选得到1株具有较好纤维素酶活性菌株,并对该菌株进行纤维素酶活力和糖化水平测定,纤维素降解菌有利于减少各种农业纤维化废弃物对环境带来的影响,还可以变废为宝,为燃料乙醇的原料提供来源,为可持续发展带来较好的经济和社会效益。
1 材料与方法
1.1 试验材料
试验菌株由中国热带农业科学院广州实验站植保实验室保存。
1.2 试验方法
1.2.1 菌株纤维素酶活性的筛选 将前期分离得到的298个菌株,参照文献 [15]的方法进行纤维素酶活性测定。把准备好的菌株接到纤维素酶活性测定平板(蛋白胨 10 g,酵母粉 10 g,羧甲基纤维素钠 10 g,氯化钠 5 g,磷酸二氢钾 1 g,琼脂 18 g,定容至 1 000 mL,pH=7.0),30℃培养 48 h,用 1 g/L刚果红染 1 h ,倒掉染液后用1 mol/L NaCl 浸泡 1 h。检测透明圈的有无并测量其内径和外径。
1.2.2 糖化水平测定 还原糖(葡萄糖)测定采用DNS显色法[16],将培养好的细菌接种到纤维素富集的液体培养基上培养24 h后进行离心,获得粗酶液,50℃水浴30 min后,立即加入DNS试剂测定还原糖的含量。
1.2.3 酶活力测定 将1.2.2糖化水平测得的葡糖糖含量进行酶活力测定,在50℃、pH为4.8的条件下,1 min内可以将底物转化成1 μmol葡萄糖所需要的酶量定义为一个酶活力单位(U/mL)[16]。
1.2.4 赋值评估 根据抑菌圈(抑菌圈外径与内径之差)的大小,将产纤维素酶活性的菌株赋值得分:0分,无水解圈;1分,0 mm <水解圈 ≤ 3.0 mm;2分,3.0 mm < 水解圈≤ 6 mm;3分,水解圈> 6 mm。
1.2.5 菌株鉴定 采用试剂盒(赛百盛公司)提取细菌基因组后,参照文献[17]的方法从基因组中扩增出16S rRNA基因片段的PCR扩增。所得产物在华大基因测序分析,并将相关序列在NCBI上进行比对。
2 结果与分析
2.1 细菌产纤维素酶活性
从298株细菌中,筛选到57株产纤维素酶的菌株。按以上赋值方法,结果(表1,图1)赋值得分为3的菌株占比为40.9%;赋值得分为2和1的菌株,分别占供试菌株总数的27.9%和24.6%。说明不同菌株之间的纤维素酶活性存在差异。
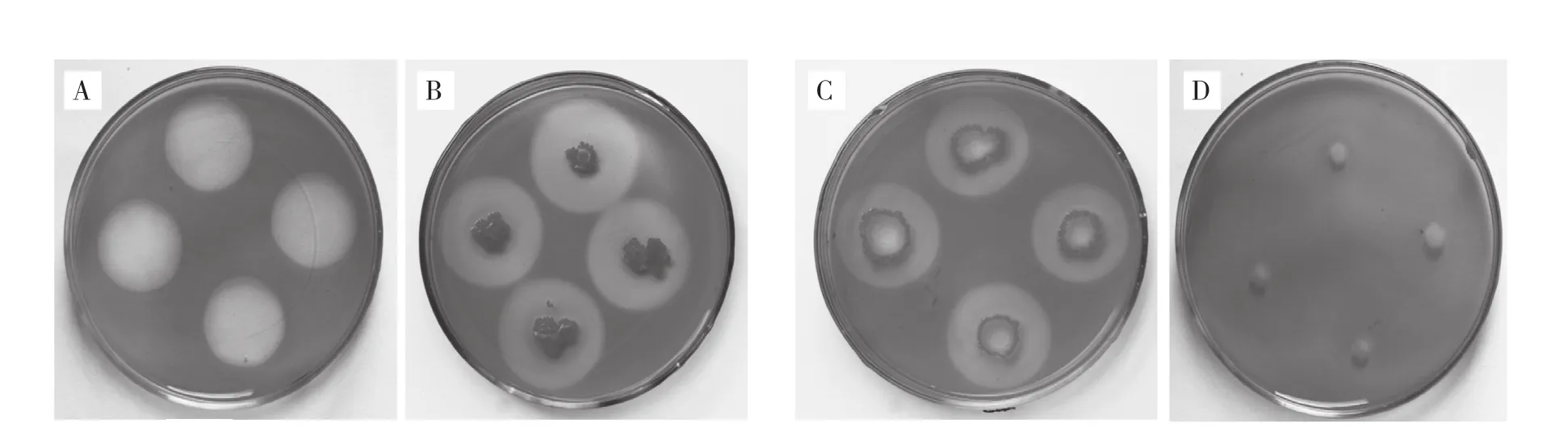
图1 不同细菌水解纤维素酶活性
2.2 糖化水平与酶活力测定
对获得的57个菌株分别测定其糖水平,发现大部分菌株产糖水平较低,挑选其中10株具有较好糖化潜力的细菌进行复筛选(葡萄糖测定标准曲线的回归方程为Y=1.523X-0.0526,R2=0.9902),结果(图2)显示,HWY-3-9菌株产糖量为0.1852 mg/mL;DHNY-3-4 和DDNR-3-3的产糖量分别为0.1644 mg/mL和0.1532 mg/mL,且二者差异不显著;产糖量最低的菌株为DDWR-4-4,仅0.0643 mg/mL。同时,对这10株细菌进行酶活力测定,结果(图3)表明,10株细菌的酶活力存在差异,其中HWY-3-9菌株的酶活力最高,达0.0012 U/mL;其次是DHNY-3-4菌株,达0.0011 U/mL;酶活力最低的菌株为DHS-4-1,仅0.0004 U/mL。

图2 10个菌株糖化水平测定结果

图3 菌株酶活力测定结果
2.3 菌株鉴定
对4个产糖能力和酶活力水平存在差异的菌株进行测序分析,结果见表2、图4~图7,产糖水平和酶活力最高的菌株HWY-3-9为解淀粉芽孢杆菌;仅次于HWY-3-9的菌株为DHWS-3-6,经过鉴定该菌株为成团泛菌;产糖水平和酶活力最低的菌株为DHS-4-1,鉴定为短小芽孢杆菌。

表2 菌株鉴定结果

图4 菌株HNR-3-7的系统进化树

图5 菌株HWY-3-9的系统进化树

图6 菌株DHWS-3-6的系统进化树

图7 菌株DHS-4-1的系统进化树
3 结论与讨论
本研究的298个菌株分离自木薯不同生境,前期经过聚类分析,发现丰度较好。通过分析细菌的纤维素降解酶活性,并测定酶活性较好菌株的糖化水平,找到1株综合效率最好的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
纤维素酶主要由外切葡聚糖酶、内切葡聚糖酶和β-葡萄糖苷酶组成,3种酶之间相互协调作用将复杂的纤维素多糖降解为易于利用的单糖[15]。β-葡萄糖苷酶是纤维素酶体系产葡萄糖的重要组成部分,调节另外两部分的功能,其活性影响了纤维素酶的总活性,从而影响葡萄糖的产量[16]。本研究通过CMC法测定菌株的纤维素酶活性,DNS法测定高酶活性菌株的产葡萄糖能力,发现不同菌株的糖化水平和酶活力存在差异,原因可能有两个:一是和菌株本身特性有关,不同种属菌株的纤维素酶种类和活力存在差异会影响其酶活力和糖化能力。金迪等[17]分离得到的1株降解纤维素菌株,在28℃、pH为7.0~7.5和32 h条件下,其羧甲基纤维素酶(CMCase)活力为 651.75 U/mL;葛春辉[18]筛选出一株纤维素降解菌,其酶活力为0.581 U/mL;陈丽燕等[19]筛选出两株纤维素降解菌,经鉴定该菌株为地衣芽孢杆菌和枯草芽孢杆菌,液体摇瓶培养4 d,其CMC酶活力分别可达 163.3、167.17 U/mL,而本研究解淀粉芽孢杆菌的酶活力为0.0012 U/mL。杨培周等[20]对康宁木霉、绿色木霉、黑曲霉和里氏木霉表达纤维素酶的酶学特性初步研究结果表明,不同属菌株的产酶活性存在差异,其中黑曲霉产酶活性最好,是发酵产纤维素酶的理想菌株;徐杰[21]对水稻主产区的土壤进行分离得到10株细菌,发现在相同条件下,10株细菌对纤维素分解能力表现不一,这与本研究结果一致。另一个原因可能是菌株发酵通气量、发酵液浓度、碳氮源以及平板测定抑菌圈所用培养基类型等影响菌株产酶能力和活性。林捷等[7]利用木薯渣进行纤维素分解菌混合发酵工艺研究表明,菌株发酵通气量、发酵液浓度等对菌株产酶能力有很大影响;罗萍等[6]发现功能菌株在6种不同培养基平板上的 FPA 酶活性表现不一,并最终选出最适合该菌的培养基为蛋白胨纤维素培养基;发酵液中微生物产酶和还原糖也具有反馈作用,Guo等[22]对产黄纤维单胞菌的葡萄糖耐受力进行试验,结果表明,葡萄糖含量高于5.0 μg/mL时,该菌的纤维酶活力急剧下降;Wang等[23]报道,黑曲霉在还原糖浓度为1.5 μg/mL时产酶受阻。
纤维素降解酶活性高低决定了降解纤维素能力的大小。随着现代分子生物学、基因工程及蛋白质工程等的发展,提供了改变纤维素酶分子催化活性、最适温度和pH等生物特性的方法,为获得高效转化纤维素提供了可能[24]。Qu Y B[25]对一株嗜酸耐热纤维素降解菌进行了定点突变,将其降解活性提高了20%;Heinzelman等[26-27]以3种真菌运用SCHEMA 重组方法得到了最高的热稳定性约比热稳定性最强的亲本提高7℃;Lin等[28]通过定点突变,实现了β-葡聚糖酶催化活性分别比野生型提高50%和80%;吴华伟等[29]通过易错PCR技术,将纤维素酶活提高到59.6、90.8、105.1 U/m L,分别是原始菌株的2.1倍、3.2倍和3.7倍;李永仙等[30]构建重组质粒,将编码β-1,3-1,4-葡聚糖酶基因置于T7启动子和lac启动子双重启动子的调控下表达,其催化活性达到1 883.3 U/mL,远远超过原始菌株。因此本研究获得的降解菌株有可能通过这些技术方法提高其酶活力,从而提高产糖水平。
本研究筛选到的糖化水平最高的菌株,经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),关于该菌株具有纤维分解作用的文献也有报道。Leelasuphakul等[31]对从芽孢杆菌中提取得到的β-葡聚糖酶进行了产酶条件、酶学活性、基因克隆等方面的研究;陈丽燕等[19]报道了两株具有很好纤维素分解作用的菌株均为芽孢杆菌;刘海艳等[32]通过筛选得到一株高效纤维素降解菌短小芽孢杆菌,并针对该菌进行了基因克隆;李红亚等[33]利用解淀粉芽孢杆菌对玉米秸秆进行降解,发现该菌的酶活力可达45.4 U/g;罗伟光[34]从土壤中分离得到降解纤维素的枯草芽孢杆菌,刘永生等[35]从旧稻草堆中分离得到了1株具有纤维素降解能力的地衣芽孢杆菌,并针对该菌的一个纤维素基因进行了克隆和测序分析。本研究分离出的解淀粉芽孢杆菌也是芽孢杆菌家族的一员,因此很有可能可以通过分子手段来提高该菌降解纤维素提高糖化水平的能力。
为了得到更好的纤维素降解菌株,有效利用秸秆等农业废弃物,变废为宝,在接下来的工作中,可以利用分子生物学方法对本研究得到的菌株朝着高效利用纤维素的方向进行改造,从而获得高效分解纤维素的工程菌株。
[1]张纪伟. 瑞氏木霉Ras信号途径对形态建成和纤维素酶合成的作用研究及酶系改良[D]. 济南:山东大学,2013.
[2]董佳程. 黑曲霉降解马铃薯纤维素作用强化的研究[D]. 哈尔滨:哈尔滨工业大学,2013.
[3]王拓一,张杰,吴耘红,等. 马铃薯渣的综合利用研究[J]. 农产品加工学刊,2008(7):103-105.
[4]Somerville C,Bauer S,Brininstool Q,et al. Toward a systems approach to understanding plant cell walls[J]. Science,2004,306:2206-2211.
[5]冯玉杰,李冬梅,任南琪. 混合菌群用于纤维素糖化和燃料酒精发酵的试验研究[J].太阳能学报,2007,28(4):375-379.
[6]罗萍,陈永辉,贺军军,等. 菠萝渣纤维素降解菌的筛选及鉴定[J]. 微生物学杂志,2011 (2):59-63.
[7]林捷,谭兆赞,罗伟诚. 利用木薯渣进行纤维素分解菌混合发酵工艺研究[J]. 安全与环境学报,2005(6):26-29.
[8]李嘉薇,张庭婷,王双飞. 纤维素酶水解糖化木薯秆的影响因素分析[J]. 造纸科学与技术,2009(5):17-20,45.
[9]卢月霞,吕志伟,袁红莉,等. 纤维素降解菌的筛选及其混合发酵[J]. 研究安徽农业科学,2008(10):3952-3953.
[10]王丽,颜贤仔,周美凤,等. 多菌种复合酶降解稻草纤维素的研究[J]. 江西农业大学学报,2005(4):521-524.
[11]张晓伦,刘旭,饶泽昌. 高效纤维素分解菌混合培养及其降解能力[J]. 南昌大学学报(理科版),2005(5):96-98.
[12]Peterson R,Nevalainen H. Trichoderma reesei RUT-C30 thirty years of strain improvement[J]. Microbiology,2012,158:58-68.
[13]Schwarz W. The cellulosome and cellulose degradation by anaerobic bacteria[J]. Applied Microbiology and Biotechnology,2001,56:5-6.
[14]Faterstam L T. The β-1.4-D-glucan cellobiohydrolases of Trichoderma reesei QM9414:A new type of cellulolytie synergism[J]. FEBS Lett,1980,119(1):97-100.
[15]Lee S J,Lee K S,Kim S R,et al. A novel cellulase gene from the mulberry longicorn beetle,Apriona germari:gene structure,expression,and enzymatic activity[J]. Comparative Biochemistry and Physiology,2005,140(4):551-560.
[16]陈梅. 斜卧青霉β-葡萄糖苷酶的性质和功能研究及基因表达谱分析[D]. 济南:山东大学,2013.
[17]金迪,彭清静,易浪波,等. 一株纤维素降解细菌的筛选、鉴定及产酶条件分析[J]. 中国微生态学杂志,2010(4):289-292,295.
[18]葛春辉,徐万里,邵华伟,等. 一株产纤维素酶细菌的筛选、鉴定及其纤维素酶的部分特性[J]. 生物技术,2009(1):36-40.
[19]陈丽燕,张光祥,黄春萍,等. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J]. 微生物学通报,2011(4):531-538.
[20]杨培周,姜绍通,郑志,等. 4种工业微生物产纤维素酶酶学特性的比较研究[J]. 可再生能源, 2011(4):68-71.
[21]徐杰. 水稻秸秆降解放线菌的分离鉴定及其降解机理研究[D]. 哈尔滨:哈尔滨工业大学,2011.
[22]Guo A L,Yang L,Liu M,et al. Studies on the cultural condition of strain cellulomonas flavigena cel1ulase[J]. Journal of Northwest University (Natural Science Edition),1999,29(6):575-577.
[23]Wang M,Zhao X H. Regulation of enzyme synthesis of asp. niger strain W25[J]. Industrial Microbiology,1995,25(3):13-15.
[24]Himmel M E,Ding S Y,Johnson D K,et al. Biomassrecalcitrance:engineering plants and enzymes for biofuelsproduction[J]. Science,2007,315(5813):804-807.
[25]Qu Y B. Lignocellulose degrading enzymes and biorefinery[M]. Beijing:Chemical Industry Press,2011:121-154.
[26]Heinzelman P,Snow C D,Smith M A,et al. SCHEMA recombination of a fungal cellulase uncovers a single mutation that contributes markedly to stability[J]. J Biol Chem,2009,284(39):26229-26233.
[27]Heinzelman P,Snow C D,Wu I,et al. A family of thermostable fungal cellulases created by structure-guided recombination[J]. Proc Natl Acad Sci USA,2009,106(14):5610-5615.
[28]Lin Y S,Tsai L C,Lee S H,et al. Structural and catalytic roles of residues located in beta 13 strand and the following beta-turn loop in Fibrobacter succinogenes 1,3-1,4-beta-D-glucanase[J]. Biochimica Et Biophysica Acta-General Subjects,2009,1790:231-239.
[29]吴华伟,张展,李相前,等. 易错PCR定向进化大幅度提高极耐热β-葡聚糖酶的活性[J]. 食品与发酵工业,2010(5):1-4.
[30]李永仙,谢焱,朱林江,等. 淀粉液化芽孢杆菌β-1,3-1,4-葡聚糖酶基因的克隆及表达[J]. 生物工程学报,2009(4):542-548.
[31]Leelasuphakul W,Sivanunsakul P,Phongpaichit S. Purification,characterization and synergistic activity of β-1,3-glucanase and antibiotic extract from an an-tagonistic Bacillus subtilis NSRS 89-24 against riceblast and sheath blight [J]. Enzyme and Microbial Technology,2006,38(7):990-997.
[32]刘海艳,白龙,赵海波,等. 纤维素酶高产菌的筛选鉴定及纤维素酶基因的克隆与表达[J].中国农业大学学报,2012(5):92-98.
[33]李红亚,李术娜,王树香,等. 解淀粉芽孢杆菌MN-8对玉米秸秆木质纤维素的降解[J]. 应用生态学报,2015(5):1404-1410.
[34]罗伟光. 枯草芽孢杆菌源纤维素酶基因的克隆、表达及其酶学性质[D]. 洛阳:河南科技大学,2015.
[35]刘永生,冯家勋,段承杰,等. 能降解天然纤维素的地衣芽孢杆菌GXN151的分离鉴定及其一个纤维素酶基因(cel5A)的克隆和测序分析[J]. 广西农业生物科学,2003(2):132-138.
(责任编辑 邹移光)
Isolation,identification and saccharification level of cellulose degrading bacteria
ZHENG Li1,2,ZHANG Hai-peng2,SONG Yan-pei3,LIU Meng-hao3,HE Shi-yu1,MA Xu-dong1,QIN Xin-dao4,LI Bo-song1
(1. Guangzhou Experimental Station,Chinese Academy of Tropical Agricultural Sciences,Guangzhou 510140,China;2. College of Agriculture,South China Agricultural University,Guangzhou 510642,China;3. College of Materials and Energy,South China Agricultural University,Guangzhou 510642,China;4. Chinese Academy of Tropical Agricultural Sciences,Haikou 571101,China)
In this study,298 bacteria were isolated from cassava microenvironments and 57 strains with cellulase activity were gained by in vitro detection test. Results showed that strains with big hydrolysis circle (the score of 3) accounted for 40.9% and strains with weakly hydrolysis circle(the score of 2 and 1) accounted for 27.9% and 24.6%,respectively. The saccharification level and enzyme activity were tested by DNS method,and we found 10 potential strains with efficient ability of degradation of cellulose,in which strain HWY-3-9 had the best saccharification and enzyme activity, the sugar content was 0.1852 mg/mL and enzyme activity was 0.0012 U/mL,and it was identified as Bacillus amyloliquefaciens.
bacteria; cellulase; saccharification level.
S182
A
1004-874X(2017)02-0104-08
2016-11-14
中国热带农业科学院院本级基本科研业务费专项资金(1630052015047);海南省自然科学基金(314185);广东省科技计划项目(2015A020209027)
郑丽(1984-),女,在职博士生,助理研究员,E-mail:catas_lzheng@163.com
李伯松(1982-),男,博士,助理研究员,E-mail:84490477@qq.com
郑丽,张海鹏,宋艳培,等.纤维素降解菌的筛选、鉴定和糖化水平研究[J].广东农业科学,2017,44(2):104-111.
