雷替曲塞联合奥沙利铂与FOLFOX 4方案治疗中晚期原发性肝癌的疗效评价
2017-04-26沈永奇陈超庭王志祥谢华东孔祥应刘金娥韩朝稳
沈永奇, 黄 军, 陈超庭, 斯 韬, 王志祥, 谢华东,孔祥应, 刘金娥, 韩朝稳
(1. 广西医科大学附属柳铁中心医院 肿瘤科, 广西 柳州, 545007;2. 贵阳中医学院第三附属医院 肿瘤科, 贵州 都匀, 558004;3. 广西科技大学第二附属医院 化疗二科, 广西 柳州, 545006;4. 广西中医药大学第三附属医院 肿瘤二科, 广西 柳州, 545001;5. 广西中医药大学第三附属医院 肿瘤一科, 广西 柳州, 545001;6. 广西壮族自治区柳州市融水县人民医院 肿瘤科, 广西 柳州, 545300)
雷替曲塞联合奥沙利铂与FOLFOX 4方案治疗中晚期原发性肝癌的疗效评价
沈永奇1, 黄 军2, 陈超庭3, 斯 韬4, 王志祥5, 谢华东6,孔祥应2, 刘金娥1, 韩朝稳1
(1. 广西医科大学附属柳铁中心医院 肿瘤科, 广西 柳州, 545007;2. 贵阳中医学院第三附属医院 肿瘤科, 贵州 都匀, 558004;3. 广西科技大学第二附属医院 化疗二科, 广西 柳州, 545006;4. 广西中医药大学第三附属医院 肿瘤二科, 广西 柳州, 545001;5. 广西中医药大学第三附属医院 肿瘤一科, 广西 柳州, 545001;6. 广西壮族自治区柳州市融水县人民医院 肿瘤科, 广西 柳州, 545300)
目的 探讨雷替曲塞联合奥沙利铂(RALOX方案)与5-氟尿嘧啶+亚叶酸钙+奥沙利铂(FOLFOX 4方案)对中晚期原发性肝癌(PLC)的疗效及药物毒性反应。方法 选取72例中晚期PLC患者,随机分为RALOX组(n=34)与FOLFOX 4组(n=38)。化疗后每6周评价客观疗效,观察客观缓解率(OR)、疾病控制率(DCR)、中位生存期(mOS)、中位无进展生存期(mPFS)、1年存活率(SR)及毒副反应。结果 RALOX组可评价31例, OR为19.4%, DCR为51.6%, mOS为7.2个月, mPFS为3.4个月, 1年SR为22.6%; FOLFOX 4方案组可评价29例, OR为13.8%, DCR为48.3%, mOS为6.9个月, mPFS为3.3个月, 1年SR为20.7%, 2组差异无有统计学意义(P>0.05)。RALOX组消化道反应、肝毒性、心脏毒性、外周神经毒性及手足综合征的发生率均低于FOLFOX 4组,肾毒性、骨髓抑制的发生率2组相当。结论 RALOX方案应用于中晚期PLC患者安全有效,疗效不劣于FOLFOX 4方案且副反应较轻。
原发性肝癌; 奥沙利铂; 雷替曲塞; FOLFOX 4方案; 化疗
Clinical efficacy of raltitrexed combined with oxaliplatin and FOLFOX 4 protocol in treatment of patients with middle and advanced primary liver cancer
原发性肝癌(PLC)是常见的恶性肿瘤之一,在中国恶性肿瘤发病率中居第4位[1], 每年约有38.3万人死于肝癌,占全球肝癌死亡病例数的51%[2-3], 患者的总体5年生存率不到5%[4]。手术切除及介入治疗是治疗肝癌的有效方法,但大部分肝癌患者就诊时已为中晚期,失去手术及介入治疗的机会。以索拉菲尼为代表的分子靶向药物虽然已被列为中晚期肝癌的一线治疗药物,但其客观疗效依然较低且价格昂贵[5-6]。化疗成为了该类患者的主要治疗手段,但目前肝癌化疗总体疗效不理想,尚无标准方案。秦叔逵等[7]EACH研究提示,奥沙利铂联合5-氟尿嘧啶(FOLFOX 4方案)使中晚期肝癌患者获益,该方案正式被中华医学会推荐用于中国中晚期肝癌的治疗。但FOLFOX 4方案治疗中晚期肝癌疗效仍较低,仅比阿霉素单药化疗延长了1个月的中位生存期(mOS)和中位无进展时间(mPFS)[8-9]。研究[10]表明雷替曲塞联合奥沙利铂(RALOX方案)治疗结直肠癌疗效优于FOLFOX方案且副反应较轻。本研究采用RALOX方案治疗中晚期PLC, 并与FOLFOX 4方案对照,现报告如下。
1 资料与方法
1.1 一般资料
选取2013年7月—2015年7月肿瘤中心收治的72例中晚期PLC患者。纳入标准: ① 临床、甲胎蛋白水平(AFP)、影像学或病理学证实为中晚期PLC, 既往未接受全身化疗者; ② 具有可测量病灶(CT诊断≥2 cm), 可测量病灶影像诊断时间<15 d; ③ 年龄15~70岁; ④ Karnofsky评分≥60; ⑤ 预计生存期≥3个月; ⑥ 有随访可能; ⑦ 心脏功能、肝肾功能、血象基本正常; ⑧ 病人签署知情同意书。排除标准: ① 患者伴有其他恶性肿瘤; ② 伴有严重的活动性感染或严重的心肝肾和造血系统疾病; ③ 病人无可测量或可评价的病灶; ④ 依从性差; ⑤ 病人要求终止治疗,尚不能评价疗效和不良反应者; ⑥ 临床资料不全者。随机将入选患者分为RALOX组(n=34)与FOLFOX 4组(n=38), 2组的性别、年龄等一般资料比较,差异无统计学意义(P>0.05), 具有可比性,见表1。
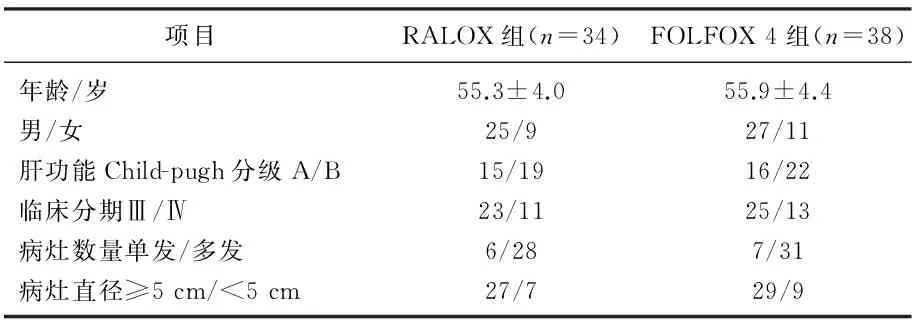
表1 72例中晚期PLC患者的一般资料
1.2 方法
RALOX方案组:雷替曲塞3 mg/m2, 静脉滴注15 min, 第1天; 奥沙利铂130 mg/m2, 静脉滴注3 h, 第1天, 21 d为1个周期,至少完成2周期方可评价。FOLFOX 4方案组: OXA 85 mg/m2, 继以600 mg/m2, 持续静脉滴注22 h, 第1、2天, 14 d为1个周期,至少完成3个周期方可评价。
1.3 疗效判定
治疗前进行基线评价,包括CT、磁共振成像(MRI)、AFP等。疗效评价在治疗后每6周进行(RALOX方案2周期, FOLFOX4方案3周期),采用实体肿瘤评价标准RECIST 1.1进行评价。按WHO标准分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。毒性反应评价按NCI标准分为0~Ⅳ级。电话随访间隔为半个月,总随访时间为12个月。评价目标包括客观 缓解率(OR)、疾病控制率(DCR)、中位生存时间(mOS)、中位无进展生存期(mPFS)、1年存活率(SR)及毒副反应。OR=CR+PR, DCR=CR+PR+SD。
1.4 统计学方法
采用SPSS 18.0软件进行统计分析。OR、DCR、1年SR采用χ2检验进行分析, mOS和PFS采用Log-rank检验进行分析并绘制Kaplan-Mweier生存曲线,以P<0.05为差异有统计学意义。
2 结 果
2.1 2组疗效比较
RALOX组可评价31例,其中PR 6例, SD 10例, PD 15例, OR为19.4%, DCR为51.6%, mOS为7.2个月, mPFS为3.4个月, 1年SR为22.6%; FOLFOX 4组可评价29例,其中PR 4例, SD 10例, PD 15例, OR为13.8%, DCR为48.3%, mOS为6.9个月, mPFS为3.3个月, 1年SR为20.7% ,2组差异无统计学意义(P>0.05)。2组OS、PFS生存曲线见图1、2。

图1 RALOX方案与FOLFOX4方案治疗中晚期PLC的OS生存曲线
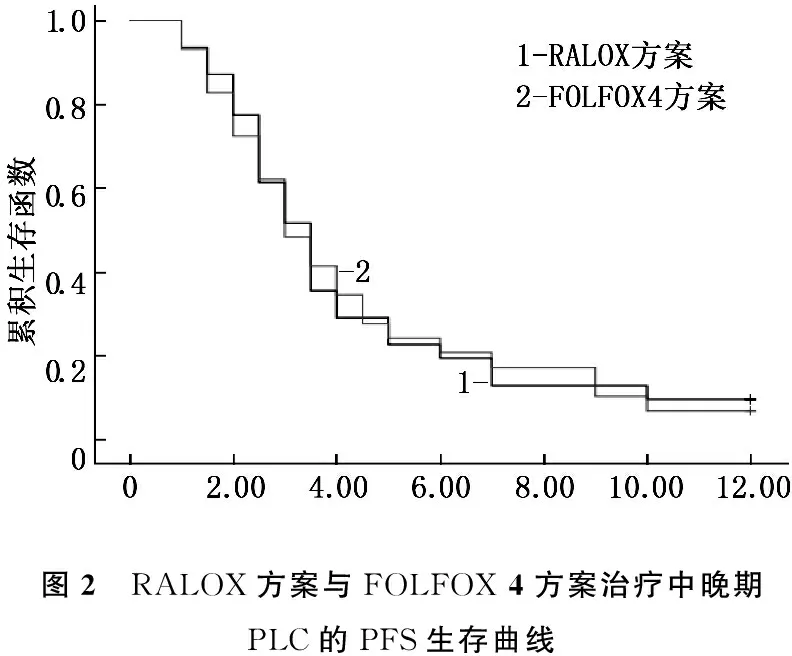
图2 RALOX方案与FOLFOX4方案治疗中晚期PLC的PFS生存曲线
2.2 2组化疗毒副反应比较
RALOX组3例患者因毒副反应退出, FOLFOX4组9例患者因毒副反应退出。2组Ⅰ~Ⅳ度毒副反应、Ⅲ~Ⅳ度毒副反应发生率见表2、3。经积极处理毒副反应均缓解。

表2 RALOX方案组、FOLFOX 4方案组总的Ⅰ~Ⅳ毒副反应发生率比较[n(%)]
与RALOX组比较, *P<0.05。
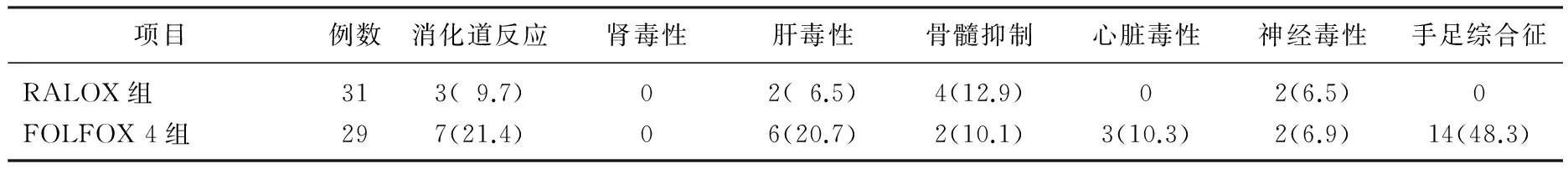
表3 RALOX方案组与FOLFOX 4方案组严重毒副反应(Ⅲ-Ⅳ)发生率比较
3 讨 论
中晚期肝癌化疗疗效不佳且副反应较大,导致诸多患者拒绝化疗。肝癌细胞对化疗药物具有普遍耐药性,传统的化疗方案疗效较差,主要原因有: ① 需接受全身化疗的患者多数为晚期肝癌,肿瘤负荷较大,此时肝癌的大多数细胞不处在增殖周期中,对化疗不敏感; ② 多数肝癌患者的肝癌细胞表达多药耐药基因,致使肝癌对化疗存在固有的耐药性; ③ 同时原发性肝癌患者本身有基础肝脏疾病,例如肝炎、肝硬化等,肝功能已有损害,而化疗药物多经肝脏代谢,故化疗引起的副反应较大,患者对化疗的耐受性差,一定程度上限制了化疗药物的剂量强度[11]。在奥沙利铂应用于肝癌前,治疗肝癌的化疗药物主要为阿霉素、氟尿嘧啶、顺铂及丝裂霉素等,但总有效率均偏低,毒副反应明显,生存期无明显改善。FOLFOX 4方案的应用是肝癌化疗的巨大进步,奥沙利铂也因此成为全球首个获美国食品药品监督管理局(FDA)批准用于肝癌的化疗药物。但FOLFOX 4方案治疗的平均生存期仅比阿霉素单药治疗延长了1.5个月,且相对较重的消化道反应、心脏毒性、容易诱发血栓等副反应,使得患者无法坚持化疗。可见选择一种高效低毒的化疗方案对中晚期PLC患者至关重要。
雷替曲塞取代5-FU与奥沙利铂联合(RALOX方案)近年来被广泛应用于食管癌、胃癌及结直肠癌[12-15], 其疗效与FOLFOX方案相当但毒副反应更轻。本研究34例患者应用RALOX方案,因毒副反应退出3例; 38例患者应用 FOLFOX 4方案,因毒副反应退出9例,提示RALOX方案的耐受性相比于FOLFOX 4方案更加。RALOX方案组可评价31例, FOLFOX 4方案组可评价29例,均未取得CR患者,且2组的PR、SD、OR、DCR、mOS、mPFS及1年SR差异无统计学意义(P>0.05), 提示2组疗效相当。在毒副反应方面, RALOX组与FOLFOX 4组的毒副反应高于治疗结直肠癌时的毒副反应[16], 可能与肝癌患者肝功能不良、腹水、对药物生物转化能力下降有关。RALOX组的消化道反应、肝毒性、心脏毒性、周围神经毒性及手足综合征发生率及严重程度上均明显轻于FOLFOX 4组,但2组肾毒性、骨髓抑制的发生率及严重程度无差别。目前认为, RALOX方案毒副反应较低,是因为雷替曲塞毒的副反应低于5-FU。5-FU是一种抗嘧啶类物,作用于胸苷合酶(TS酶)的嘧啶结合部位而起作用,半衰期5~10 min, 多推荐48 h持续给药,长时间静脉给药易发生静脉血栓。5-FU最常见的副反应是消化道反应、心脏毒性及骨髓抑制,晚期肝癌患者常有肝功能受损及腹水,患者出现恶心、呕吐、纳差等消化道症状, 5-FU的使用会加重上述症状。5-FU持续给药可致心脏毒性发生率达18%, 有心脏病史患者的发生率增加4~10倍,是化疗引起的心脏毒性的第2常见原因,仅次于蒽环类药物[17-18]。雷替曲塞是一种叶酸类似物,可经主动摄取途径进入肿瘤细胞内,其代谢产物为多聚谷氨酸类化合物,可显著性抑制胸腺嘧啶合成酶的生理学功能,阻碍机体内三磷酸胸苷(dTFP)的合成速度,并长期积蓄在肿瘤细胞内而起到毒性损伤细胞。与5-FU结合TS酶嘧啶结合部位不同,雷替曲塞结合TS酶的叶酸结合部位,半衰期198 h, 目前推荐15 min推注。由于与5-FU结构不同且作用位点不同,故不会产生5-FU代谢产物氟柠檬酸,心脏毒性及消化道毒性较轻。本研究RALOX方案与FOLFOX 4方案的心脏毒性分别为6.5%、27.6%, 3例发生严重心脏毒性的患者均来自FOLFOX 4方案组。
综上所述, RALOX方案治疗中晚期PLC患者疗效与FOLFOX 4方案相当,且毒副反应明显轻于FOLFOX 4方案,值得临床进一步观察、推广应用。
[1] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] 吕桂帅, 陈磊, 王红阳. 中国肝癌研究的现状与前景[J]. 生命科学, 2015, 27(3): 237-248.
[3] Wallace M C, Preen D, Jeffrey G P, et al. The evolving epidemiology of hepatocellular carcinoma: a global perspective[J]. Expert Rev Gastroenterol Hepatol, 2015, 9(6): 765-779.
[4] 杨柳青, 秦叔逵, 华海清, 等. XELOX方案治疗中晚期原发性肝癌的临床观察[J]. 临床肿瘤学杂志, 2013, 18(8): 704-708.
[5] Di Marco V, De Vita F, Koskinas J, et al. Sorafenib: from literature to clinical practice[J]. Ann Oncol, 2013, 24(Suppl 2): 30-7.
[6] Kermiche-Rahali S, Di Fiore A, Drieux F, et al. Complete pathological regression of hepatocellular carcinoma with portal vein thrombosis treated with sorafenib[J]. World J Surg Oncol, 2013, 11(1): 171-8.
[7] Qin S, Bai Y, Lim H Y, et al. Randomized, multicenter, open-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia[J]. J Clin Oncol, 2013, 31(28): 3501-3508.
[8] Meydan N, Kundak I, Yavuzsen T, et al. Cardiotoxicity of de Gramont's regimen: incidence, clinical characteristics and long-term follow-up[J]. Jpn J Clin Oncol, 2005, 35(5): 265-270.
[9] Jensen S A, Baeksgaard L, Petersen L N, et al. Cardiotoxicity induced by 5-fluorouracil or capecitabine[J]. Ugeskr Laeg, 2010, 172(1): 48-51.
[10] 王晓元, 李曙光, 赵轶锋, 等. 雷替曲塞或氟尿嘧啶联合奥沙利铂治疗晚期结直肠癌疗效的 Meta分析[J]. 实用癌症杂志, 2015, 30(9): 1354-1356.
[11] Chen P J, Furuse J, Han K H, et al. Issues and controversies of hepatocellular carcinoma-targeted therapy clinical trials in Asia: experts' opinion[J]. Liver Int, 2010, 30(10): 1427-1438.
[12] 吕会来, 张丽, 温士旺, 等. 雷替曲塞联合奥沙利铂治疗术后复发转移性食管癌的临床对照研究[J]. 实用医学杂志, 2015, 31(22): 3781-3783.
[13] 杨全良, 马剑, 毕延智. 雷替曲塞联合奥沙利铂治疗晚期胃癌的疗效及安全性研究[J]. 临床合理用药杂志, 2015, 8(6): 11-12.
[14] 刘文稚, 李孟考, 陈祥明. 雷替曲塞联合奥沙利铂治疗结直肠癌肝转移的临床研究[J]. 中华临床医师杂志: 电子版, 2015, 9(1): 146-148.
[15] Avallone A, Di Gennaro E, Silvestro L, et al. Budillon A Targeting thymidylate synthase in colorectal cancer: critical re-evaluation and emerging therapeutic role of raltitrexed[J]. Expert Opin Drug Saf, 2014, 13(1): 113-129.
[16] 潘维, 杨虎. 雷替曲塞联合奥沙利铂与5-氟尿嘧啶、亚叶酸钙联合奥沙利铂治疗转移性结直肠癌的疗效比较[J]. 现代医院, 2016, 16(4): 471-473.
[17] Jensen S A, Baeksgaard L, Petersen L N, et al. Cardiotoxicity induced by 5-fluorouracil or capecitabine[J]. Ugeskr Laeg, 2010, 172(1): 48-51.
[18] Sorrentino M F, Kim J, FoderaroA E, et al. 5-fluorouracilinduced cardiotoxicity: review of the literature[J]. Cardiol J, 2012, 19(5): 453-458.
SHEN Yongqi1, HUANG Jun2, CHEN Chaoting3, SI Tao4, WANG Zhixiang5, XIE Huadong6, KONG Xiangying2, LIU Jine1, HAN Chaowen1
(1.DepartmentofOncology,LiuTieCentralHospitalAffiliatedtoGuangxiMedicalUniversity,Liuzhou,Guangzhou, 545007; 2.DepartmentofOncology,TheThirdAffiliatedHospitalofGuiyangUniversityofTraditionalChineseMedicine,Duyun,Guizhou, 558004; 3.TheSecondDepartmentofChemotherapy,TheSecondAffiliatedHospitalofGuangxiUniversityofScienceandTechnology,Liuzhou,Guangxi, 545006; 4.TheSecondDepartmentofOncology,TheThirdAffiliatedHospitalofGuangxiUniversityofTraditionalChineseMedicine,Liuzhou,Guangxi, 545001; 5.TheFirstDepartmentofOncology,TheThirdAffiliatedHospitalofGuangxiUniversityofTraditionalChineseMedicine,Liuzhou,Guangxi, 545001; 6.DepartmentofOncology,ThePeople′sHospitalofRongshui
County,Liuzhou,Guangxi, 545300)
Objective To explore the clinical efficacy and drug-toxic reactions of raltitrexed combined with oxaliplatin (RALOX protocol) and 5- fluorouracil + calciumfolinate + oxaliplatin (FOLFOX 4 protocol) in the treatment of patients with middle and advanced primary liver cancer (PLC). Methods A total of 72 patients with PLC were selected and randomly divided into RALOXgroup (n=34) and FOLFOX 4 group (n=38). The objective response rate (RR) was evaluated every 6 weeks after chemotherapy, while objective remission rate (OR), disease-control rate (DCR), median survival rate (mOS), median progression-free survival (mPFS), 1-year survival rate (SR) as well as toxic and adverse reactions were observed. Results In RALOX group, 31 patients were evaluable, with OR, DCR, mOS, mPFS, and 1-year SR being 19.4%, 51.6%, 7.2 months, 3.4 months, and 22.6%, respectively. In FOLFOX 4 group, 29 patients were evaluable, with OR, DCR, mOS, mPFS, and 1-year SR being 13.8%, 48.3%, 6.9 months, 3.3 months and 20.7%, respectively. RALOX group was significantly lower than FOLFOX 4 group in the incidence rates of gastrointestinal reactions, liver toxicity, cardiac toxicity, peripheral nervous toxicity and hand-foot syndrome, but there were no significant differences in the incidence rates of renal toxicity and myelosuppression between two groups. Conclusion RALOX is safe and effective in the treatment of patients with middle and advanced PLC, and is superior to FOLFOX 4 protocol in clinical efficacy with mild adverse reactions.
primary liver cancer; oxaliplatin; raltitrexed; FOLFOX 4 protocol; chemotherapy
2017-02-05
广西壮族自治区卫计委科研项目(Z2014408); 广西壮族自治区柳州市科技攻关项目(2014J030424)
R 735.7
A
1672-2353(2017)07-039-04
10.7619/jcmp.201707011
