三维适形放射治疗原发性肝癌患者发生放射性肝损伤相关因素分析*
2017-04-26吕东来卢虎生胡宗涛
吕东来,陆 林,卢虎生,胡宗涛,秦 峰
三维适形放射治疗原发性肝癌患者发生放射性肝损伤相关因素分析*
吕东来,陆 林,卢虎生,胡宗涛,秦 峰
目的研究三维适形放射治疗原发性肝癌患者发生放射性肝损伤(RILD)的相关危险因素。方法 对2009年3月至2015年12月期间收治的三维适形放射治疗的原发性肝癌患者的临床资料进行归纳整理,以假设检验筛选相关危险因素,并进行多因素非条件Logistic回归分析。结果 本组纳入研究的原发性肝癌患者39例,在完成放射治疗后发生RILD 14例(35.9%);各类别单因素的假设检验提示肝癌患者的年龄和肝功能CTP评分与放疗后RILD的发生相关(P<0.05);进一步的非条件多因素Logistic回归分析显示,年龄≥60岁(OR:15.72,P=0.020)和肝功能CTP评分≥6(OR:24.95,P=0.005)是三维适形放射治疗原发性肝癌后发生RILD的2个独立危险因素。结论通过对三维适形放射治疗原发性肝癌患者发生RILD的研究,初步识别了肝癌患者接受放疗后发生RILD的相关危险因素,为日后制定治疗计划时减少RILD的发生,或建立适当的干预措施提供了科学依据。
肝癌;三维适形放疗;放射性肝损伤;回归分析
随着放疗技术的不断进步,精确放疗已日渐成为原发性肝癌的一个重要治疗手段[1]。然而,随着肝脏肿瘤放射治疗患者的增多,肝脏放疗的最重要并发症 -放射性肝损伤(radiation-induced liver disease,RILD)也在我们的临床工作中越来越常遇见。RILD患者会在放疗后出现非肝癌相关性的乏力、腹痛、肝肿大、黄疸以及血清碱性磷酸酶(alkaline phosphatase,AKP)升高,部分病人还会出现明显升高的血清转氨酶,这些症状不但给患者带来极大的痛苦,严重者还会直接导致治疗失败。一般,RILD的中位发生时间在放疗开始后4~8周,但也有报道RILD最早于放疗数日后即可发生,最晚则可见于放疗后7个月,而发生的时间与RILD的程度无明显相关性[2]。以往多数学者认为,常规分割全肝照射的安全剂量为30~35 Gy,1/3至1/2肝脏可以接受40 Gy的照射量[3]。肝癌患者常常伴有慢性活动性肝炎或肝硬化等基础肝病,在这种病理状态下,肝脏对放射线的耐受量要低于正常肝组织,因此往往容易诱导严重的RILD发生[4]。此外,随着治疗手段的进步,患者生存期的延长,RILD所带来的问题也日渐突出。目前,还没有肝癌放射治疗的患者规避严重RILD发生的相关指南。因此,我们开展了一项关于原发性肝癌患者接受三维适形放疗后发生RILD的相关危险因素分析,以探讨RILD与临床治疗中多种指标的相关性,明确不同人群或不同放疗参数下的风险因素,为接受放射治疗的肝脏肿瘤患者规避RILD发生提供一定的参考依据。
1 资料与方法
1.1 病例选择 2009年3月~2015年12月我院收治的原发性肝癌患者39例,男性33例,女性6例;年龄36~79岁,平均年龄(54.6±12.3)岁。根据中国原发性肝癌规范化诊治专家共识的诊断标准进行诊断[5]。纳入标准:预期患者生存期>3个月,东方合作肿瘤学团体 (eastern cooperative oncology group,ECOG)发布的体力状况评分≤2。其中肝功能(Child-Turcotte-Pugh,CTP)评分≥6为15例,<6为24例;5例存在丙型肝炎病毒感染,23例为乙型肝炎病毒感染。I期6例,II期9例,IIIa期18例,IIIb或IIIc期6例。排除出现远处转移病例。
1.2 三维适形放射治疗方法 使用美国瓦里安23EX双光子直线加速器。所有患者取仰卧位,双手交叉上举置于前额部,用水解塑料体模固定于定位板上,体表行纹身标记。患者在平静呼吸状态下行CT薄层(3 mm)增强扫描,自气管隆突平面下至肝下缘(或右肾下极)。将定位CT图像经网络传输至Eclips治疗计划系统。以增强CT和MRI显示的肿瘤区域确定GTV范围,CTV在GTV外均匀扩大5~10 mm,PTV在CTV基础上,在三维方向外扩5~10 mm。对于因呼吸动度可能遗漏的层面,复制邻近层面肝轮廓归入临床靶区。正常组织的肝、胃、十二指肠、结肠、肾和脊髓不超过其耐受剂量,其中平均肝剂量<25 Gy,肝接受≥30 Gy照射体积占总体积百分比(V30)<30%[6]。设2~6个照射野,并以共面为主,剂量180~400 cGy,5次/w,总剂量为3600~6400 cGy。在完成计划后,采用Matrics系统进行相关验证,确保各治疗参数与治疗计划一致无误。
1.3 检查方法 使用日本东芝TBA120型全自动生物化学分析仪及其配套试剂检测血清生化指标;采用ELSIA法检测血清乙型肝炎病毒标记物及抗丙型肝炎病毒抗体(试剂由美国Abbott公司生产,上海科华生物工程股份有限公司提供);使用Acuson Sequoia512彩色多普勒超声诊断仪观察肝脏,阳性图片及彩色多普勒血流图像储存于PACS系统中,以作为回顾性影像学分析。所有患者放疗前均接受肝功能检测,放疗结束后2周之内完成第1次肝功能检测,随后4个月内,每月至少检测1次肝功能。检测指标为静脉血丙氨酸氨基转移酶(alanine aminotransferase,ALT)或天冬氨酸氨基转移酶(aspertate aminotransferase,AST)、AKP水平,以及是否出现肝脏肿大。参考经典和非经典定义,本研究诊断RILD的标准为:放疗结束后4个月内出现:(1)不伴随黄疸的肝脏肿大;(2)出现AKP水平超过正常值上限2倍[7];(3)出现总胆红素水平大于正常值上限3倍;(4)出现ALT或AST大于正常值上限的5倍[8]。符合以上任一条者,即诊断为RILD。
1.4 疗效判断 按照2000年世界卫生组织制定的实体瘤治疗疗效评价标准(RECIST),分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。
1.5 统计方法 应用SPSS 13.0软件(SPSS Inc. Chicago,IL,USA)进行统计学分析,采用Logistic回归分析与RILD发生相关的因素。计量资料以(±s)表示,组间比较采用t检验。计数资料的比较采用卡方检验。以P<0.05为差异具有显著统计学意义。
2 结果
2.1 疗效情况 在39例纳入统计的患者中,完成三维适形放射治疗4月内,发生RILD患者14例(35.9%),未发生RILD患者25例(64.1%)。所有患者中无死亡病例,CR 6例,PR 15例,SD 11例,PD 7例。在发生RILD和未发生RILD的患者中,疗效的差异无统计学意义(P>0.05,表1),反映RILD的发生与疗效之间并无特定的关系。
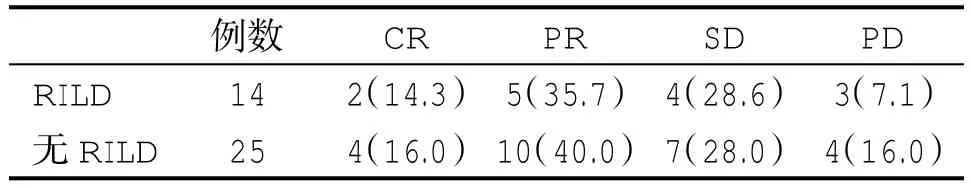
表1 发生与未发生RILD患者疗效(%)比较
2.2 发生与未发生RILD患者相关危险因素比较 经过对各类别临床相关资料的单因素假设检验,发现发生与未发生RILD患者之间的年龄和肝功能CTP评分有显著性差异(P<0.05),而性别、肿瘤分期、所接受其他局部治疗、病毒感染情况和放疗情况均无统计学差异(P>0.05,表2)。
表2 发生与未发生RILD患者的一般资料(%,±s)比较
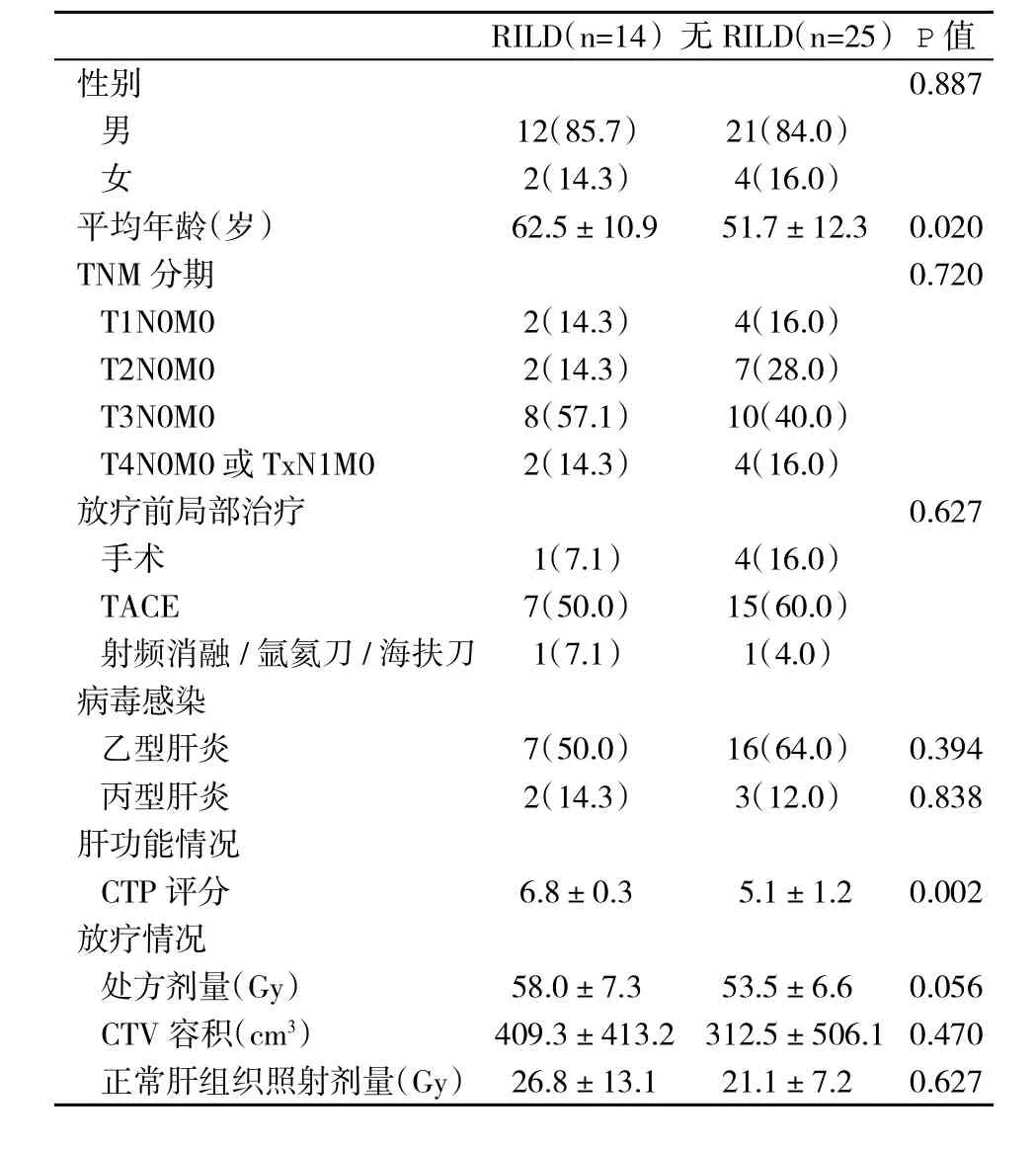
表2 发生与未发生RILD患者的一般资料(%,±s)比较
RILD(n=14)无RILD(n=25)P值性别 0.887男12(85.7) 21(84.0)女2(14.3) 4(16.0)平均年龄(岁) 62.5±10.9 51.7±12.3 0.020 TNM分期 0.720 T1N0M0 2(14.3) 4(16.0)T2N0M0 2(14.3) 7(28.0)T3N0M0 8(57.1) 10(40.0)T4N0M0或TxN1M0 2(14.3) 4(16.0)放疗前局部治疗 0.627手术 1(7.1) 4(16.0)TACE 7(50.0) 15(60.0)射频消融/氩氦刀/海扶刀 1(7.1) 1(4.0)病毒感染乙型肝炎 7(50.0) 16(64.0) 0.394丙型肝炎 2(14.3) 3(12.0) 0.838肝功能情况CTP评分 6.8±0.3 5.1±1.2 0.002放疗情况处方剂量(Gy) 58.0±7.3 53.5±6.6 0.056 CTV容积(cm3) 409.3±413.2 312.5±506.1 0.470正常肝组织照射剂量(Gy) 26.8±13.1 21.1±7.2 0.627
2.3 发生RILD相关危险因素的多因素Logistic回归分析 将这两个相关危险因素赋值,其中年龄以60岁为阈值界限(<60岁和≥60岁),CTP评分以6分(<6和≥6)为阈值界限行二分类,再行多因素Logistic回归分析。各相关危险因素引入多因素非条件二分类Logistic回归模型后,发现患者年龄和CTP评分是三维适形放射治疗原发性肝癌引发RILD的独立危险因素(表3)。
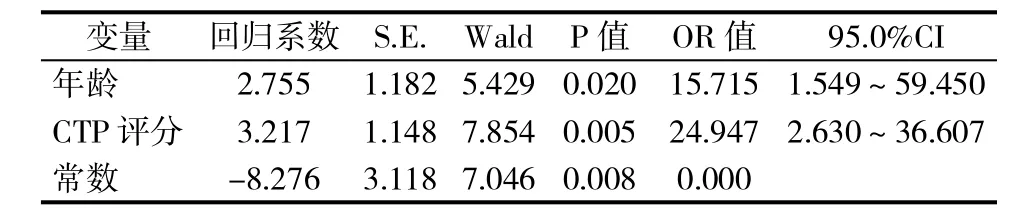
表3 发生RILD相关危险因素的多因素Logistic回归分析
3 讨论
在原发性肝癌的治疗中,放疗可以有效地延迟肿瘤继续进展的时间,并且降低瘤体破裂出血的风险[9]。然而,这种获益也伴随着放疗相关副反应的发生,其中最常见的就是RILD。肝脏属于更新缓慢的晚反应组织,其剂量-效应曲线弯度大,α/β值较低(1~5 Gy),具备较强的亚致死性损伤的修复能力,而增殖能力较弱,其放射耐受受多种因素的影响[10]。目前,普遍认为肝脏为放射敏感器官。既往研究发现常规分割全肝照射剂量低于35 Gy者无一例发生放射性肝炎。而在全肝照射超过35 Gy的患者中RILD的发生率达到48%[11]。还有报道,通过钇后装治疗动物模型肝癌,24小时后查血清IL-6,即发现早期急性RILD已发生[12]。这些都反映了RILD在放射治疗过程中发生的普遍性。如果不加以重视,将会增加治疗的风险,甚至使患者获益小于受到的伤害。目前,药物干预RILD发生的相关研究也已经开展,比如在动物实验中发现维生素E可减轻放疗小鼠的肝脏损伤[13],还有应用阿米福汀对放射治疗中的肝脏进行保护的I期临床试验也已完成[14],但是后续的临床试验和研究却一直没有开展,真正能应用于临床防治RILD的药物仍遥遥无期。因此,对于现阶段防治RILD的临床研究仍应立足于防。基于上述原因,我们团队进行这样的一项回顾性研究,以期对三维适形放射治疗原发性肝癌引起的RILD危险因素加以甄别,并以此为借鉴在治疗前采取适当选择,在治疗计划的制订中施加适当的干预,以利于减少放疗后相关的严重肝损伤,增加患者获益。
在统计学方法的选择上,我们借鉴既往在肿瘤治疗方面的类似回顾性研究文献[15],采用多因素Logistic回归方法,并将所有入组变量进行二分类化,既简化回归模型的形式,又可提高准确性。临床上,RILD患者也有临床表现较轻微,经对症处理后即可恢复,也可见到严重致死性的结果。但是,由于目前还没有达成共识的RILD分级标准,我们在研究中放弃了对RILD严重程度的细分研究,主要着眼于预测RILD是否发生。而对于RILD的判定,我们则借鉴最新的相关研究,汇总了经典与非经典的判别标准,将肝脏肿大、AKP升高、总胆红素变化和血清转氨酶升高均纳入判定标准,提高了对RILD识别的灵敏性[16]。
通过本次研究,发现在三维适形放射治疗原发性肝癌患者的过程中,主要影响RILD发生与否的危险因素为患者的年龄和肝功能CTP分级情况,而与患者性别、肿瘤分期、是否接受了其他治疗以及是否感染病毒等因素关系不大。此外,我们也没有发现放疗的照射剂量、CTV体积以及正常肝组织照射剂量与RILD的发生相关。这与既往放射生物学的认识不同,我们考虑与我们研究的特点有关,作为回顾性研究,我院所有纳入病例的治疗计划都是严格按照靶区剂量要求和正常组织安全剂量来勾画完成的,体现不出超安全剂量后可能对肝脏损害的差异,但同时也反映出严格将照射剂量和靶器官保护限定在安全范围内是可以有效保护靶器官,避免严重放射风险的。在随后的多因素回归分析中,进一步明确了患者肝功能CTP评分和年龄这两个变量对于RILD的发生最为重要。在接受三维适形放射治疗的原发性肝癌患者中,肝功能CTP评分≥6的患者发生RILD的可能性很大。患者年龄在60岁以上也是发生RILD的高危因素。其中以肝功能CTP评分与RILD的发生关系最为密切,与2013年的一项RILD相关研究结果吻合,该项研究发现在应用立体定向放射治疗小肝癌的多项临床和放射剂量参数中,肝功能Child-Pugh B分级是出现较严重RILD的独立危险因素[17]。而在最新的一项RILD相关风险因素研究也发现除了在接受二次放疗的患者中,肝功能的状态也是最重要的独立危险因素[18],再次验证了我们的结果。此外,值得我们注意的还有,在放疗处方剂量的比较中,单因素分析虽无统计学差异,但P值为0.056,接近我们设定的检验水准,也提醒我们不能放松照射剂量加大后可能造成的严重危害。
随着技术的进步,三维适形放射治疗技术为大部分中晚期肝癌患者提供了一条新的治疗方法。但是,三维适形放射治疗原发性肝癌引起RILD的相关研究远较放射性肺损伤的研究少,关于放射治疗安全剂量和多种风险因素的评价尚无统一标准[19]。与其他类型放射性损伤相比,RILD有其自身的特征,应对其进行单独的回顾和分析。我们在对三维适形放射治疗肝癌与RILD的相关性研究中,初步识别了容易引发RILD的相关危险因素。当然,我们的研究同样也存在着样本量较少的问题,因此我们期待着更多的RILD相关研究,并且以这些研究为基础采取合理的科学预防和治疗措施,减少RILD在肝癌患者中的发生,让三维适形放疗给患者带来更多的获益。
[1]Feng M,Ben-Josef E.Radiation therapy for hepatocellular carcinoma.Semin Radiat Oncol,2011,21:271-277.
[2]Benson R,Madan R,Kilambi R,et al.Radiation induced liver disease:A clinical update.J Egyp N Ca Inst,2016,28:7-11.
[3] 申文江,王绿叶.放射治疗损伤.北京:中国医药科技出版社,2001:131.
[4] 高东伟,于甬华.细胞因子与放射性肝损.实用肝脏病杂志,2006,9:249-251.
[5]原发性肝癌规范化诊治的专家共识.实用肝脏病杂志,2009,12:321-327.
[6]Marks LB,Yorke ED,Jackson A,et al.Use of normal tissue complication probability models in the clinic.Int J Radiat Oncol Biol Phys,2010,76:10-19.
[7]Guha C,Kavanagh BD.Hepatic radiation toxicity:avoidance and amelioration.Semin Radiat Oncol,2011,21:256-263.
[8]Cheng JC,Wu JK,Huang CM,et al.Radiation-induced liver disease after radiotherapy for hepatocellular carcinoma:clinical manifestation and dosimetric description.Int J Radiat Oncol Biol Phys,2002,53:156-162.
[9]Liang SX,Zhu XD,Lu HJ,et al.Hypofractionated three dimensional conformal radiation therapy for primary liver carcinoma. Cancer,2005,103:2181-2188.
[10]Stenmark MH,Cao Y,Wang H,et al.Estimating functional liver reserve following hepatic irradiation:adaptive normal tissue response models.Radiother Oncol,2014,111:418-423.
[11]Ingold JA,Reed GB,Kaplan HS,et al.Radiation hepatitis.Am J Roentgenol,1965,93:200-208.
[12]Wickremesekera J K,Chen W,Cannan R J,et al.Serum proinflammatory cytokine response in patients with advanced liver tumors following selective internal radiation therapy with 90 Yttrium microspheres.Int J Radiat Oncol Biol Phys,2001,49:1015-1021.
[13]Gencel O,Naziroglu M,Celik O,et al.Selenium and vitamin E modulates radiation induced livertoxicity in pregnantand nonpregnantrat:effects ofcolemanite and hematiteshielding. Biol Trace Elem Res,2010,135:253-263.
[14]Feng M,Smith DE,Normolle DP,et al.A phase I clinical and pharmacology study using amifostine asa radioprotectorin dose-escalated whole liver radiation therapy.Int J Radiat Oncol Biol Phys,2012,83:1441-1447.
[15]Kim TH,Kim DY,Park JW,et al.Dose-volumetric parameters predicting radiation-induced hepatic toxicity in unresectable hepatocellular carcinoma patients treated with three-dimensional conformal radiotherapy.Int J Radiat Oncol Biol Phys,2007,67(1):225-231.
[16]Liang SX,Huang XB,Zhu XD,et al.Dosimetric predictor identification for radiation-induced liver disease after hypofractionated conformal radiotherapy for primary liver carcinoma patients with Child-Pugh grade A cirrhosis.Radiat Oncol,2011,98:265-269.
[17]Jung J,Yoon SM,Kim SY,et al.Radiation-induced liver disease after stereotactic body radiotherapy for small hepatocellular carcinoma:clinical and dose-volumetric parameters.Radiat Oncol,2013,8:249.
[18]Huang Y,Chen SW,Fan CC,et al.Clinical parameters for predicting radiation-induced liver disease after intrahepatic reirradiation for hepatocellular carcinoma. Radiat Oncol,2016,11:89.
[19]张宁宁,程晓静,刘建勇,等.非手术治疗原发性肝癌研究进展.实用肝脏病杂志,2016,19:249-252.
(收稿:2016-09-02)
(本文编辑:陈从新)
Risk factors for predicting radiation-induced liver disease after three-dimensional conformal radiotherapy for patients with hepatocellular carcinoma
Lyu Donglai,Lu Lin,Lu Husheng,et al.Clinical Oncology Centre,105th Hospital,Hefei 230031,Anhui Province,China
ObjectiveThis study was aimed to investigate the possible clinical factors contributing to the development of radiation-induced liver disease(RILD)in patients with hepatocellular carcinoma receiving threedimensional conformal radiotherapy.Methods Between March 2009 and December 2015,we included 39 patients with hepatocellular carcinomawho received three-dimensional conformalradiotherapy.Clinicaldata,including gender,age,other treatments,liver function test results,and three-dimensional conformal radiotherapy parameters were retrieved for analysis.Multivariate non-conditional Logistic regression analysis was used to identify the predictors of RILD.Results Out of 39 patients with hepatocellular carcinoma,fourteen(35.9%)developed RILD after three-dimensional conformal radiotherapy;The unconditional multivariate Logistic analysis showed that the pretreatment Child-Turcotte-Pugh score≥6[odds ratio(OR):24.95,P=0.005]and age≥60 years(OR:15.72,P= 0.020)were independent risk factors for the development of RILD.Conclusion The occurrence of RILD must be taken into consideration when the three-dimensional conformal radiotherapy is applied to the patients with hepatocellular carcinoma,and the primary identification of the risk factors for RILD is important.
Hepatocellular carcinoma;Three-dimensional conformal radiotherapy;Radiation-induced liver disease;Logistic analysis
10.3969/j.issn.1672-5069.2017.01.023
原南京军区卫生科技基金重点资助项目(编号:12MA031)
230031合肥市 解放军第105医院肿瘤中心(吕东来,陆林,卢虎生,胡宗涛);第81医院(秦峰)
吕东来,男,36岁,医学博士,主治医师。主要从事胶质瘤和消化道肿瘤的基础和临床研究。E-mail:lvxunhuan@163.com
秦峰,E-mail:18909698003@163.com
