经皮穿刺门静脉栓塞术联合射频消融治疗肝恶性肿瘤患者疗效及安全性评价
2017-04-26张少伟刘德见
张少伟,刘德见
经皮穿刺门静脉栓塞术联合射频消融治疗肝恶性肿瘤患者疗效及安全性评价
张少伟,刘德见
目的 评估经皮穿刺门静脉栓塞术联合射频消融治疗直径>3 cm的肝恶性肿瘤患者疗效及其安全性。方法 选择2011年1月-2013年2月在我院诊治的肝脏恶性肿瘤患者93例【肝细胞癌(HCC)78例,肝转移性癌15例】,分为联合组54例和射频消融组39例;联合组患者接受经皮穿刺门静脉栓塞术联合射频消融治疗,射频消融组仅接受射频消融治疗;比较两组患者术后并发症,并随访3年肝脏局部残留复发率及无瘤生存率。结果 联合组术后肝周积血4例(7.41%)、胸腔积液2例(3.70%)、远端胆管扩张1例(1.85%),并发症发生率为12.96%(7/54);射频消融组术后肝周积血2例(5.13%)、胸腔积液1例(2.56%)、远端胆管扩张2例(5.13%),并发症发生率为12.82%(5/39),两组术后并发症发生率无统计学差异(x2=0.000,P=0.984);联合组术后1 a、2 a和3 a局部肿瘤残留复发率分别为0.00%、3.70%和11.11%,射频消融组分别为7.69%、20.51%和35.90%,联合组局部残留复发率显著低于射频消融组(x2=4.292、6.667、8.242,P=0.038、0.010、0.004);联合组术后1 a、2 a和3 a无瘤生存率分别为72.22%、61.11%和55.56%,射频消融组分别为53.85%、43.60%和38.46%,但两组生存率差异比较无统计学意义(x2=3.340、2.797、2.650,P=0.068、0.094、0.104)。结论 相比较于单纯射频消融,经皮穿刺门静脉栓塞术联合射频消融术治疗直径>3 cm肝恶性肿瘤在不增加术后并发症的情况下,显著降低了3年内局部肿瘤残留复发率。
肝肿瘤;经皮穿刺;门静脉栓塞术;射频消融;疗效
肝脏的恶性肿瘤包括原发性肝癌和转移性癌,其中以原发性多见。肝细胞癌(HCC)是最常见的类型,大体病理上可分为巨块型、结节型和弥漫型。一般将直径小于3 cm的肿瘤称为小肝癌[1,2]。肝癌的病因未明,但病毒性肝炎、肝硬化、黄曲霉毒素、遗传因素等与其发生相关[3]。近年来,原发性肝癌的发病率在全球范围均有升高趋势,我国是肝癌的高发国家。有报道称我国肝癌约占全球病例的56%[4]。由于肿瘤早期临床表现缺乏特异性,大多数患者确诊时已是中晚期。在我国,仅约30%HCC患者能接受手术治疗,由于大部分肿瘤的解剖位置和肝功能等因素的影响无法手术。此外,中晚期肝癌常伴门静脉癌栓,也是临床治疗的难点之一[5]。射频消融术对小肝癌的治疗效果确切,但其对直径>3 cm的肿瘤治疗效果一般。有研究表明,血流是影响射频消融疗效的重要因素,而栓塞后再行射频消融能有效提高消融效果。经皮门静脉栓塞术后能即刻进行射频消融,且安全、简便,为现代治疗肝脏恶性肿瘤提供了全新思路[6]。我们开展了经皮穿刺门静脉栓塞术联合射频消融治疗直径>3 cm肝恶性肿瘤患者,以评价其疗效和安全性,现将结果报道如下。
1 资料与方法
1.1 临床资料 2011年1月-2013年2月在我院诊断为肝脏恶性肿瘤患者93例,男66例,女27例;年龄44~79岁,平均年龄(55.2±12.2)岁;病程2~36个月,平均(8.4±2.3)月。肝细胞癌(HCC)78例,肝转移性癌15例。纳入肝内单发肿瘤,最大直径>3 cm,肿瘤完全或绝大部分(>90%)位于同一肝段内,凝血酶原活动度>50%,PLT>5×109/L,除转移性肝癌外,肝外其他组织、器官无肿瘤病灶,肝功能Child-Pugh A级和B级,未合并心、肾等重要脏器功能障碍。随机抽取39例作为射频消融治疗,剩余54例接受经皮穿刺门静脉栓塞术联合射频消融治疗。所有93例患者均已被告知本研究的相关内容,自愿参与本研究,并签署知情同意书。两组患者性别、年龄、肿瘤直径、肝功能分级、病程等临床一般资料比较均无统计学差异(P>0.05),具有可比性。
1.2 门静脉栓塞术 使用百胜公司生产的Technos DU8和GE Logiq 9超声诊断仪,探头频率2.5~5.0 MHz。先行超声造影检查,明确肿瘤动、静脉血供,确定穿刺点。在超声引导下,用20 G PTC针穿入门静脉分支,轻轻回抽,见血后注入少许肝素。取SonoVue造影剂25 mg,加入生理盐水5 ml,震荡混匀,抽出1 ml,再加生理盐水19 ml稀释,经PTC针以0.5 ml/s的速度注入静脉。启动超声造影模式,观察所穿刺的门静脉分支供血区域,在确定门静脉分支供血区域包绕全部或大部分肿瘤病灶后,经PTC针先注入替加氟1000 mg,再注入超乳化碘油与丝裂霉素(5 mg/m1)的混合液(1mg丝裂霉素/1ml碘油)5 ml。注入造影剂,行超声造影,了解栓塞情况。待超声造影显示造影剂沿所穿刺的门静脉逆向灌注时,停止注入栓塞剂,并拔除PTC针。
1.3 射频消融方法 在门静脉栓塞术完成后2 h进行。使用德国CelonLab POWER射频消融系统,主机最大功率250 w,额定输出频率(470±10)kHz,裸针区针尖长3~4 cm。使用ALOKAα-10型或飞利浦IU22彩超仪,探头频率2.5~5.0 MHz。进行射频消融术前,先进行超声造影检查,确认肿瘤动、静脉血供。手术采用三步法进行:第一步,使用高功率消融,阻断肿瘤的供血血管;第二步,于肿瘤近侧非荷瘤肝组织处进针穿刺,消融肿瘤,进入肿瘤时快速加压,灭活肿瘤;第三步,消融肿瘤近心端与非荷瘤肝组织相连区域,阻断微血供,确认消融成功后,拔出穿刺针。
1.4 术后随访观察 两组患者术后1个月,使用德国西门子公司生产的SOMATOM.Definition.AS型螺旋 CT和百盛 MyLab Twice超声(探头 型号:CA541,频率 3~7 mHz)检查,此后每3~4个月行螺旋CT增强扫描。消融区域表现为边界清晰的无增强区,则为肿瘤完全灭活;消融区周边出现动脉期增强或两次随访间消融区有明显增大,则为肿瘤局部残留;其他肝组织出现新的动脉期增强病灶或静脉期低增强病灶,则为肝内新发病灶。随访3年,计算术后生存率。
1.5 统计学方法 应用SPSS 13.0软件行数据分析,计数资料行卡方检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者术后并发症发生情况比较 两组患者术后并发症发生率比较,差别无统计学意义(P=0.984,表1)。
2.2 两组局部肿瘤残留发生率比较 随访3年,联合组局部肿瘤残留发生率明显低于射频消融组,差异有统计学意义(P<0.05,表2)。
2.3 两组无瘤生存率比较 随访3年,两组患者无瘤生存率差异无统计学意义(P>0.05,表3)。
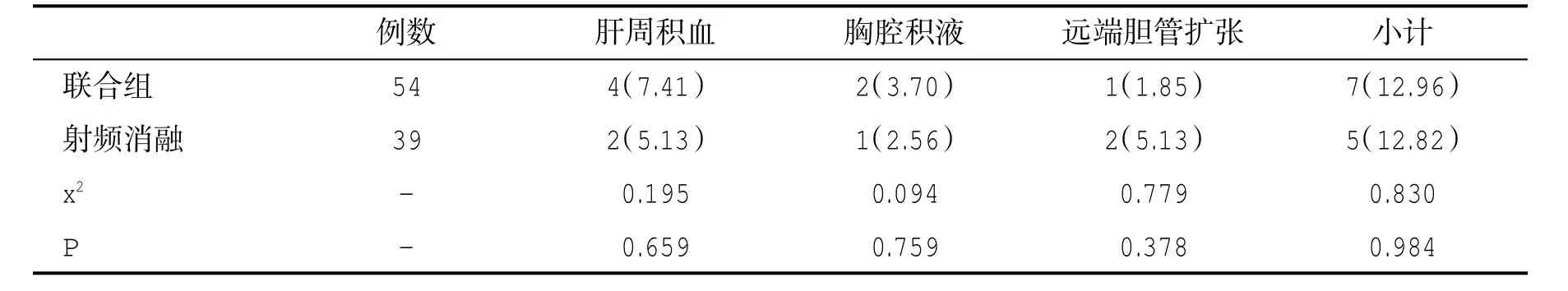
表1 两组患者术后并发症发生情况 [n(%)]比较

表2 两组局部肿瘤残留发生率[n(%)]比较

表3 两组无瘤生存率 [n(%)]比较
3 讨论
肝脏肿瘤的治疗已经取得了较大的进展,手术、介入等方法日趋成熟和完善。射频消融术已广泛应用于临床治疗肝恶性肿瘤。经过大量临床试验证明,射频消融对肿瘤直径小于3 cm的小肝癌的治疗效果确切,因手术操作简单、并发症少而轻微、患者术后住院时间短等,其综合效果甚至优于传统的手术切除[7]。但是,射频消融对直径>3 cm的肿瘤治疗效果较差。有报道称[8,9],射频消融术治疗直径在3 cm以内的肝癌,完全消融率达90%以上,但对于3~5 cm的肝脏肿瘤,其完全消融率为59.8%~81.4%,而对直径在5 cm以上的HCC,其完全消融率仅为22.4%~47.3%。经过大量的研究表明[10],术后肿瘤残留的主要原因是射频消融对于肿瘤的杀灭范围有限,而这也是术后肿瘤复发的最直接的原因。研究发现,造成消融范围不足的主要原因是血流的影响[11,12]。肝脏是人体血供最丰富的脏器之一,血运丰富也是肝脏肿瘤的一个重要特点。因此,在行射频消融术时,其产生的一部分热量将不可避免地被肿瘤及其周边组织丰富的血液循环带走,从而影响疗效。此后的研究也证实,射频消融在实际临床应用中产生的消融范围往往小于其理论值[13]。
基于上述理论,如何最大限度地减少血流对射频消融效果的影响无疑是提高其疗效的关键所在,切入点在于如何减少肿瘤及其周围组织的血流量,或者减缓术区周围组织的血流速度。有研究报道称[14,15],采用同时闭塞肝动脉和门静脉再行射频消融术能达到与体外射频消融相当的杀灭范围,而单纯闭塞门静脉亦能明显扩大消融的范围。此外,有研究显示[16],采用门静脉栓塞术降低门静脉的灌注速度也能明显增大消融的面积。在本研究中,联合组术后肿瘤局部复发率明显低于射频消融,可以说明联合治疗能加大射频消融的杀灭面积,也印证了上述研究结果。肝脏恶性肿瘤术后并发症的发生也是临床医师和患者关注的重要问题,射频消融术后主要并发症有急性胆囊炎、肝脓肿、肝周积血、胸腔积液、远端胆管扩张、腹壁血肿、周围脏器损伤等[17]。大量研究显示,射频消融术发生急性胆囊炎、肝脓肿等严重并发症概率较低,仅有3.2%左右,轻型并发症发生率约为12.3%,总体上属于较为安全的手术方式[18,19],而此前有研究表明,经皮穿刺门静脉栓塞术联合射频消融术治疗肝恶性肿瘤术后并发症的发生率并无太大的提高,约为12.6%,因此可以认为门脉栓塞联合射频消融不会增加安全风险[20]。
本研究数据显示,术后两组患者均未发生急性胆囊炎、肝脓肿等需急诊处理的严重并发症,但所有93例患者均出现轻度的术区疼痛及体温升高(均<38.5℃)。联合组术后肝周积血4例(7.41%)、胸腔积液 2例(3.70%)、远端胆管扩张 1例(1.85%),总并发症发生率为12.96%(7/54);射频消融术后发生肝周积血2例(5.13%)、胸腔积液1例(2.56%)、远端胆管扩张2例(5.13%),总并发症发生率为12.82%(5/39)。两组患者术后并发症的发生情况比较差别无统计学意义(P=0.984),联合组局部肿瘤残留发生率明显低于射频消融治疗,差异有统计学意义。两组生存率比较,差异无统计学意义。本研究结果说明,对于直径在3 cm以上的巨大肝脏肿瘤,经皮穿刺门静脉栓塞术联合射频消融术比单纯行射频消融术具有更好的治疗效果,患者术后并发症明显减少且症状较轻,但如何提高患者术后生活质量和生存率,还需要探讨。
[1]Sono mura T,Kawai N,Kishi K,et al.N-butyl cyanoacrylate embolization with blood flow control of an arterioportal shunt that developed after radiofrequency ablation of hepatocellular carcinoma.Korean J Radiol,2014,15(2):250-253.
[2] 陈丽羽,钱超文,陈俊英,等.经皮穿刺选择性门静脉栓塞术对增强肝恶性肿瘤射频消融作用的初步研究.中华超声影像学杂志,2013,22(4):329-332.
[3]Koizumi M,Kumagi T,Kuroda T,et al.Difficulty in management of intraductal papillary mucinous neoplasm-associated pancreatobiliary fistulas and the role of“pig-nose”appearance and intraductal ultrasonography in diagnosis.Endosc Int Open,2016,4(4):E446-450.
[4]Park JK,Song BJ,Ryu JK,et al.Clinical outcomes of endoscopic ultrasonography-guided pancreatic cystablation.Pancreas,2016,13(3):205-208.
[5] 常中飞,王茂强,刘凤永,等.综合治疗巨大肝癌的临床疗效及预后因素分析.中华肿瘤杂志,2014,36(1):59-62.
[6]Shiozawa K,Watanabe M,Ikehara T,et al.Evaluation of sorafenib for hepatocellular carcinoma with low α-fetoprotein by arrival time parametric imaging using contrast-enhanced ultrasonography with sonazoid.Gan To Kagaku Ryoho,2016,43(2):215-218.
[7] 胡鸿涛,黎海亮,郭晨阳,等.经肝动脉化疗栓塞联合射频消融治疗第二肝门区恶性肿瘤的临床疗效观察.中华肝脏病杂志,2016,24(2):133-135.
[8]Toshikuni N,Takuma Y,Tomokuni J,et al.Planning sonography using real-time virtual sonography and contrast-enhanced sonography for radiofrequency ablation of inconspicuous hepatocellular carcinoma nodules.Hepatogastroenterology,2015,62(139):661-666.
[9]Tochio H,Sugahara M,Imai Y,et al.Hyperenhanced rim surrounding liver metastatic tumors in the postvascular phase of sonazoid-enhanced ultrasonography:A histologicalindication of the presence of Kupffer cells.Oncology,2015,89(2):33-41.
[10]Badea R,Meszaros M,Al Hajjar N,et al.Benign nodular hyperplasia of the liver-pedunculated form:diagnostic contributions of ultrasonography and consideration of exophytic liver tumors.J Med Ultrason,2015,42(1):97-102.
[11]Martin RC,North DA.Enhanced ultrasound with navigation leads to improved liver lesion identification and needle placement.J Surg Res,2016,200(2):420-426.
[12]赵素斌,张小芳,李守霞.射频消融术治疗原发性肝癌患者外周血淋巴细胞和NK细胞的变化.实用肝脏病杂志,2016,55(1):98-99.
[13]Kodama R,Saegusa H,Ushimaru H,et al.Endoscopic ultrasonography-guided drainage ofinfected intracystic papillary adenocarcinoma of the liver.Clin J Gastroenterol,2015,8(5):335-339.
[14]Jrearz R,Hart R,Jayaraman S,et al.Intraoperative ultrasonography and surgical strategy in hepatic resection:What difference does it make.Can J Surg,2015,58(5):318-322.
[15]屈中玉,王文廉,万里新,等.肝动脉化疗栓塞联合射频消融治疗原发性肝癌40例分析.重庆医学,2014,28(28):3779-3781.
[16]Spinczyk D.Towards the clinical integration of an image-guided navigation system for percutaneous liver tumor ablation using freehand 2D ultrasound images.Comput Aided Surg,2015,20(1):61-72.
[17]刘国岩,荚卫东,葛勇胜,等.腹腔镜射频消融治疗乙型肝炎肝硬化并发小肝癌.实用肝脏病杂志,2013,12(1):56-58.
[18]Sugimoto M,Takagi T,Hikichi T,et al.Efficacy of endoscopic ultrasonography-guided fine needle aspiration for pancreatic neuroendocrine tumor grading.World J Gastroenterol,2015,21(26):8118-8124.
[19]王健琳,刘颖.超声引导射频消融治疗原发性及继发性肝癌对免疫功能的影响.重庆医学,2013,26(26):3097-3099.
[20]Viganò L,Costa G,Procopio F,et al.Parenchyma-sparing liver surgery for large segment 1 tumors:Ultrasound-guided lateral and superior approaches as safe alternatives to major hepatectomy.J Am Coll Surg,2015,221(4):e65-73.
(收稿:2016-05-26)
(本文编辑:陈从新)
Efficacy and safety ofpercutaneous portalvein embolization and radiorequency ablation in the treatment of patients with liver cancer
Zhang Shaowei,Liu Dejian.Department of General Surgery,Hunan Aerospace Hospital,Changsha 410205,Hunan Province
Objective To evaluate the efficacy and safety of portal vein emb1olization and radiorequency ablation in treating patients with liver cancer(diameter>3 cm).Methods Ninety-three patients with liver cancer(78 with HCC,and 15 with metastasis)between January 2011 and February 2013 in our hospital were divided into combination group(n=54)and control group(n=39).The patients in combination group were treated with portalvein embolization and radiorequency ablation,while in the controlgroup were treated with radiorequency ablation.The patients were followed-up for three years.The complications,local tumor residual recurrences and disease-free survivals in the two groups were compared.Results After treatment,there were 4(7.41%)patients with hepatic subcapsular hematoma,2(3.70%)with hydrothorax,1(1.85%)with dilation of distal common bile duct and the complications rate was 12.96%(7/54)in the combination group,while the hydrothorax,distal bile duct expansion and complications rate in the control group were 2(5.13%),1(2.56%),2(5.13%)and 12.82%(5/39),respectively(the differences between the two groups were not statistically significant(x2=0.000,P=0.984);In combination group,local tumor recurrence rates at 1 a,2 a and 3 a were 0.00%,3.70%and 11.11%,respectively,while they were 7.69%,20.51%and 35.90%,respectively,in the control group(x2=4.292,6.667,8.242,P= 0.038,0.010,0.004);In combination group,the disease-free survival rates at 1 a,2 a and 3 a were 72.22%,61.11%and 55.56%,while in the control group,they were 53.85%,43.60%and 38.46%,respectively[the differences were notsignificant(x2=3.340,2.797,2.650,P=0.068,0.094,0.104)].Conclusion Percutaneous portalvein embolization and radiorequency ablation in the treatment of patients with liver cancer(diameter>3 cm)might decrease significantly the local tumor recurrence in three years,which warrants further investigation.
Hepatic neoplasms;Percutaneous portal vein embolisation;Radiofrequency ablation;Outcome
10.3969/j.issn.1672-5069.2017.01.022
410205长沙市 湖南航天医院普外科
张少伟,男,39岁,副主任医师。E-mail:zhangsaow2016@163.com
