甘草酸二铵脂质配位体对非酒精性脂肪性肝病大鼠肝组织AMPK信号通路的影响*
2017-04-26崔小萌史海涛
崔小萌,刘 欣,史海涛,赵 刚,程 妍,杨 娟,方 媛
甘草酸二铵脂质配位体对非酒精性脂肪性肝病大鼠肝组织AMPK信号通路的影响*
崔小萌,刘 欣,史海涛,赵 刚,程 妍,杨 娟,方 媛
目的 研究甘草酸二铵脂质配位体(DGLL)对非酒精性脂肪性肝病(NAFLD)大鼠的治疗作用,并探讨其可能的作用机制。方法以高脂饲料喂养建立NAFLD大鼠模型,在造模成功后分别给予DGLL或多烯磷脂酰胆碱(PPC)灌胃16周。采用免疫组化法检测肝组织磷酸化的磷酸腺苷激活蛋白激酶α(P-AMPKα)蛋白表达,采用Real-time PCR法检测肝组织过氧化物酶体增殖物激活受体γ(PPAR-γ)、肉毒碱棕榈酰基转移酶-1(CPT-1)、葡萄糖转运蛋白4(GLUT-4)、酰基辅酶A氧化酶(ACO)、肝脏型脂肪酸结合蛋白(L-FABP)、乙酰辅酶A羧化酶(ACC)mRNA。结果DGLL组血清瘦素为(3.87±0.38)ng/ml,显著低于模型组【(4.68±0.39)ng/ml,P<0.01】或PPC组【(4.55±0.24)ng/ml,P<0.01】;DGLL组脂联素为(12.27±0.64)μg/ml,显著高于模型组【(10.46±0.28)μg/ml,P<0.01】,但与PPC组【(12.13±0.56)μg/ml,P>0.05】比,无统计学差异;DGLL组大鼠肝组织P-AMPKα蛋白阳性表达面积为(8.38±3.27)%,显著高于模型组【(1.81±0.90)%,P<0.01】或PPC组【(5.50±0.73)%,P<0.05】;DGLL组肝组织PPAR-γ、CPT-1、GLUT-4 mRNA水平分别为(1.07±0.14、0.91±0.05、1.61±0.54),显著高于模型组【分别为(0.26±0.12、0.14±0.01、0.10±0.03,P<0.05】,但ACO mRNA水平(0.23±0.09)与模型组比,无统计学差异【(0.24±0.02),P>0.05】;PPC组PPAR-γ和CPT-1 mRNA水平分别为(0.65±0.16)和(0.22±0.05),显著低于DGLL组(P<0.05),而GLUT-4和ACO mRNA水平(1.32±0.12和0.14±0.05)与DGLL组比,无统计学差异(P>0.05);DGLL组肝组织ACC mRNA水平为(1.67±0.23),显著低于模型组【(3.31±0.02),P<0.05】或PPC组【(2.69±0.14),P<0.05】;DGLL组L-FABP mRNA水平为(1.06±0.04),显著低于模型组【(1.26±0.02),P<0.05】,而与PPC组【(1.06±0.09),P>0.05】比,无统计学差异。结论DGLL能降低NAFLD大鼠血脂、血糖、胰岛素、HOMA-IR、瘦素水平,升高脂联素,并增加肝组织P-AMPKα蛋白表达,上调PPAR-γ、CPT-1、GLUT-4 mRNA水平、下调L-FABP和ACC mRNA水平,这些作用可能与其激活AMPK通路和改善NAFLD糖脂代谢紊乱有关。
非酒精性脂肪性肝病;甘草酸二铵脂质配位体;多烯磷脂酰胆碱胶囊;磷酸腺苷激活蛋白激酶α;大鼠
甘草酸二铵脂质配位体(Diammonium glycyrrhi zinate lipid ligand,DGLL)为18α-甘草酸二铵与大豆卵磷脂形成的脂质配位体,是中药甘草有效成分的第三代提取物。与甘草酸比,DGLL可有效被胃肠道吸收,获得较高的血药浓度,并且在体内清除速度较慢,具有较强的抗炎、保护肝细胞膜和改善肝功能作用[1]。本实验在非酒精性脂肪性肝病(Nonalcoholic fatty liver diseases,NAFLD)大鼠观察了DGLL的干预作用,发现DGLL能够改善NAFLD大鼠的糖脂代谢紊乱,其机制可能与激活磷酸腺苷激活蛋白激酶(AMPK)信号通路及调节糖脂代谢相关基因水平有关。
1 材料与方法
1.1 动物、主要药品、试剂和仪器 清洁级雄性SD大鼠(180~200 g),由西安交通大学医学部动物中心提供。高脂饲料由北京科奥协力饲料有限公司配制而成。DGLL由江苏正大天晴药业集团股份有限公司提供,多烯磷脂酰胆碱胶囊(Polyene phosphatidy lcholine capsules,PPC)由赛诺菲制药有限公司提供。检测瘦素、脂联素的ELISA试剂盒购于美国RDsystem公司,检测胰岛素的ELISA试剂盒购于西安凯新生物科技公司。抗P-AMPKα兔抗鼠单克隆抗体购于美国CST公司。高速离心机(北京时代北利),酶标仪(芬兰Thermo公司),微波炉(中国温州),-80℃冰箱(青岛海尔)等。
1.2 NAFLD模型的建立 取大鼠38只,随机分为正常组(n=11)和高脂组(n=27)。给予正常组普通饲料,而在高脂组,给予高脂饲料。12 w后,在正常组和高脂组中分别随机选出3只大鼠,处死后取肝脏组织行病理学检查,观察模型是否制备成功。将确认造模成功的24只高脂组大鼠随机分为模型组、PPC组和DGLL组,每组8只。在继续给予高脂饲料喂养的同时,每日给予不同药物(PPC 140 mg·kg-1或DGLL 140 mg·kg-1)灌胃,每日给予模型组和正常组动物生理盐水l ml/100 g灌胃,连续4 w。16 w末,处死大鼠,留取血清和肝组织备检。
1.3 血生化指标检测 使用全自动生化检测仪检测。
1.4 血清瘦素、脂联素和胰岛素检测 采用ELISA法。根据空腹血糖(FBG)和空腹胰岛素(FINS)水平计算抗胰岛素性稳态模式评估法(HOMA-IR),即HOMA-IR=FINS×FBG/22.5。
1.5 肝组织P-AMPKα蛋白检测 采用SP法检测,兔抗鼠p-AMPKα单克隆抗体(工作浓度1∶200)。应用Image J计算机图像分析系统计算蛋白表达的阳性面积。
1.6 肝组织过氧化物酶体增殖物激活受体 γ(PPAR-γ)、肉毒碱棕榈酰基转移酶-1(CPT-1)、葡萄糖转运蛋白4(GLUT-4)、乙酰辅酶A羧化酶(ACC)、酰基辅酶A氧化酶(ACO)和肝脏型脂肪酸结合蛋白(L-FABP)mRNA检测 采用Real-time PCR法。引物(表1)设计和合成由陕西脉元生物公司完成。反应结束后由电脑自动得出荧光曲线及CT值,采用 2-△△CT计算出 PPAR-γ、CPT-1、GLUT-4、FABP-3、ACC、ACO mRNA的相对水平。
1.7 统计学处理 应用SPSS 18.0软件包处理数据。计量资料以(±s)表示,多组计量资料的比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肝组织学表现 光镜下,正常组大鼠肝组织无异常变化;模型组大鼠肝组织呈弥漫性肝细胞脂肪变性,脂变肝细胞极度肿胀,体积增大,胞浆内充满大量脂肪空泡;DGLL和PCC组肝组织学均有不同程度的改善,尤以DGLL组明显(图1)。

表1 引物序列

图1 各组大鼠肝组织病理学表现(HE,400×)
2.2 大鼠血清生化指标变化 与模型组比,DGLL组和PPC组血生化指标均显著降低(P<0.01);与PPC组比,DGLL组上述指标也显著降低(P<0.05,表2)。
2.3 各组血糖、胰岛素和HOMA-IR比较 见表3。
2.4 各组血清瘦素和脂联素水平比较 见表4。
2.5 各组大鼠肝组织p-AMPKα表达比较 正常组肝组织P-AMPKα蛋白表达阳性面积为(11.12± 3.83)%,模型组为(1.81±0.90)%,表达极弱;DGLL组P-AMPKα蛋白表达阳性面积为(8.38±3.27)%,而PPC组为(5.50±0.73)%,P<0.05,图2)。2.6各组大鼠肝组织PPAR-γ、CPT-1、GLUT-4、FABP-3、ACC和ACO mRNA水平比较 与正常组比,模型组PPAR-γ、CPT-1、GLUT-4、ACO mRNA水平降低(P<0.01),而L-FABP和ACC mRNA水平升高(P<0.01);与模型组比,DGLL组和PPC组PPAR-γ、CPT-1和 GLUT-4mRNA水平升高(P<0.05),而L-FABP和ACC mRNA水平降低(P<0.01);与PPC组比,DGLL组 PPAR-γ和CPT-1mRNA水平升高 (P<0.01),L-FABP mRNA水平降低(P<0.01),而GLUT-4、ACO和ACC mRNA水平与PCC组比,无统计学差异(P>0.05,表5、6)。
表2 各组大鼠血生化指标(±s)比较

表2 各组大鼠血生化指标(±s)比较
与对照组比,①P<0.01;与PPC组比,②P<0.05
例数 ALT(U/L) AST(U/L) CHOL(mmol/L) TG(mmol/L)正常组 8 119.33±24.54 75.33±7.37 1.30±0.26 0.17±0.06模型组 8 211.67±32.96① 189.33±45.01① 13.59±1.69① 0.55±0.11①PPC 8 107.20±16.90 126.625±26.90 8.74±1.50 0.18±0.03 DGLL 8 70.71±5.47② 95.00±26.90② 6.95±0.74② 0.13±0.02②
表3 各组大鼠血清血糖、胰岛素和HOMA-IR水平(±s)比较
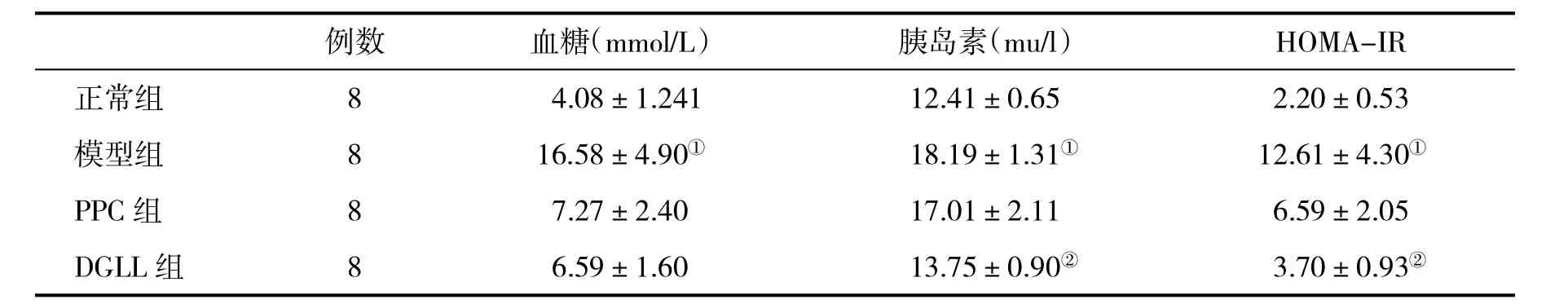
表3 各组大鼠血清血糖、胰岛素和HOMA-IR水平(±s)比较
与对照组比,①P<0.01;与PPC组比,②P<0.05
例数 血糖(mmol/L) 胰岛素(mu/l) HOMA-IR正常组 8 4.08±1.241 12.41±0.65 2.20±0.53模型组 8 16.58±4.90① 18.19±1.31① 12.61±4.30①PPC组 8 7.27±2.40 17.01±2.11 6.59±2.05 DGLL组 8 6.59±1.60 13.75±0.90② 3.70±0.93②

图2 各组大鼠肝组织P-AMPKα蛋白表达情况(SP,200×)
表4 各组血清瘦素和脂联素水平(±s)比较

表4 各组血清瘦素和脂联素水平(±s)比较
与对照组比,①P<0.01;与PPC组比,②P<0.05
例数 瘦素(ng/ml) 脂联素(μg/ml)正常组 8 3.47±0.51 13.14±0.22模型组 8 4.68±0.39① 10.46±0.28①PPC组 8 4.55±0.24 12.13±0.56 DGLL组 8 3.87±0.38② 12.27±0.64
表5 各组肝组织PPAR-γ、CPT-1、GLUT-4、ACO mRNA水平(±s)比较

表5 各组肝组织PPAR-γ、CPT-1、GLUT-4、ACO mRNA水平(±s)比较
与对照组比,①P<0.01;与PPC组比,②P<0.05
例数 PPAR-γ正常组 8 1.01±0.20模型组 8 0.26±0.12①PPC 8 0.65±0.16 DGLL 8 1.07±0.14②CPT-1 1.00±0.03 0.14±0.01①0.22±0.05 0.91±0.05②GLUT-4 ACO 1.69±0.42 1.00±0.01 0.10±0.03① 0.24±0.02①1.32±0.12 0.14±0.05 1.61±0.54 0.23±0.09
表6 各组肝组织L-FABP和ACC mRNA水平(±s)比较

表6 各组肝组织L-FABP和ACC mRNA水平(±s)比较
与对照组比,①P<0.01;与PPC组比,②P<0.05
例数 L-FABP ACC正常组 8 1.00±0.03 1.01±0.12模型组 8 1.26±0.02① 3.31±0.02①PPC 8 1.06±0.09 2.69±0.14 DGLL 8 1.06±0.04 1.67±0.23②
3 讨论
本实验采用高脂饮食成功建立NAFLD大鼠模型,16周后模型组大鼠肝细胞脂变率为100%,主要呈中、重度脂肪变性,血清AST、ALT、TG、CHOL、瘦素、胰岛素明显增高,HOMA-IR增高,血清脂联素下降。DGLL组大鼠肝细胞脂肪变有不同程度的改善,表明DGLL对NAFLD大鼠有明显的治疗作用[7~10]。DGLL的作用优于PCC。
AMPK包括α、β、γ三个亚单位。在组织缺血、缺氧、运动、热休克等情况下,细胞ATP减少,AMP/ATP比值增加,AMPK被激活(P-AMPK),发挥其激酶活性[11]。AMPKα的磷酸化形式是其活性形式,测定胞质内磷酸化AMPKα(P-AMPKα)的蛋白表达可反映AMPKα的活性[12],近年研究表明AMPK与糖脂代谢相关[13,14]。
激活后的AMPK可诱导GLUT-4基因表达,促进外周组织葡萄糖的摄取,增加胰岛素敏感性。除调节机体能量代谢外,在高脂环境下,AMPK表达和活性的变化可能是胰岛素抵抗(IR)发生的上游机制[15]。本实验结果表明,DGLL可增强NAFLD大鼠肝组织P-AMPKα蛋白表达,与模型组比,DGLL组肝组织ACC水平下降,CPT-1和GLUT-4升高,提示DGLL可能通过激活AMPK-ACC通路,促进脂肪酸β氧化,改善肝脏脂质代谢,并能激活AMPK-GLUT-4通路,改善糖代谢,发挥治疗作用。
PPAR-γ调节脂肪酸代谢的各个环节[16],对糖代谢的调节主要是增加外周组织对胰岛素的敏感性[17]。同时,PPAR-γ可减少TNF-α和瘦素的生成,减轻肝脏炎症反应[18]。本实验结果表明,与模型组比,DGLL组大鼠肝组织PPAR-γ水平升高,推测DGLL可能通过增加PPAR-γ的表达而改善肝脏炎症及糖脂代谢紊乱。ACO是脂肪酸在过氧化体中进行氧化的第一步,也是限速步骤。ACO可促进肝脏摄取经脂肪酶脂解生成的游离脂肪酸(FFA),并转化为乙酰辅酶A,防止脂肪酸进入细胞后的流失,具有降低血清甘油三酯的作用[19]。本实验结果表明,DGLL组大鼠肝组织ACO水平与模型组无显著性差异,提示DGLL的作用机制可能不是通过调控ACO表达而发挥的,而该机制仍有待于进一步研究。在NAFLD动物模型动物,L-FABP表达比对照组显著升高,说明L-FABP对NAFLD的发生发展有重要意义[20]。本实验结果表明,模型组大鼠肝组织L-FABP水平显著升高。经过DGLL治疗后,大鼠肝组织L-FABP水平有一定程度的下降。
[1]Donati G,Stagni B,Piscaglia F,et al.Increased prevalence of fatty liver in arterial hypertensive patients with normal liver enzymes:role of insulin resistance.Gut,2004,53(7):1020-1023.
[2]Diehl AM.Fatty liver,hypertension,and the metabolic syndrome. Gut,2004,53(7):923-924.
[3]常珊珊,徐济良.非酒精性脂肪肝发病相关因子的机制研究新进展.南通大学学报(医学版),2013,33(1):56-60.
[4]Forbes S,Taylor-Robinson SD,Patel N,et al.Increased prevalence of non-alcoholic fatty liver disease in european women with a history of gestational diabetes.Diabetologia,2011,54(3):641-647.
[5]Yatsuji S,Hashimoto E,Kaneda H,et al.Diagnosing autoimmune hepatitis in nonalcoholic fatty liver disease:s the international autoimmune hepatitis group scoring system useful.J Gastroenterol,2005,40(12):1130-1138.
[6]Marchesini G,Bugianesi E,Forlani G,et al.Nonalcoholic fatty liver,steatohepatitis,and the metabolic syndrome.Hepatology,2003,37(4):917-923.
[7]茹仁萍,吴锡铭.18α甘草酸及其脂质配位体的生物利用度与抗肝损害作用的比较.浙江医学,2001,23(8):18-20.
[8]Xu P,Zhang XG,Li YM,et al.Research on the protection effect of pioglitazone for non-alcoholic fatty liver disease(NAFLD)in rats.J Zhejiang Univ Sci B,2006,7(8):627-633.
[9]Savvidou S,Hytiroglou P,Orfanou-Koumerkeridou H,et al.Low serum adiponectin levels are predictive of advanced hepatic fibrosis in patients with NAFLD.J Clin Gastroenterol,2009,43(8):765-772.
[10]Emoto M,Nishizawa Y,Maekawa K,et al.Homeostasis model assessment as a clinical index of insulin resistance in type 2 diabetic patients treated with sulfonylureas.Diabetes Care,1999,22(5):818-822.
[11]Hawley SA,Davison M,Woods A,et al.Characterization of the AMP-activated protein kinase kinase from rat liver and identification of threonine 172 as the major site at which it phosphorylatesAMP-activated protein kinase.JBiolChem,1996,271(44):27879-27887.
[12]Kemp BE,Stapleton D,Campbell DJ,et al.AMP-activated protein kinase,supermetabolic regulator.Biochem Soc Trans,2003,31(Pt 1):162-168.
[13]Rutter GA,Da Silva Xavier G,Leclerc I.Roles of 5'-AMP-activated protein kinase(AMPK) in mammalian glucosehomoeostasis.Biochem J,2003,375(Pt 1):1-16.
[14]MacLean PS,Zheng D,Jones JP,et al.Exercise-induced transcription of the muscle glucose transporter(GLUT 4)gene. Biochem Biophys Res Commun,2002,292(2):409-414.
[15]Liu Y,Wan Q,Guan Q,et al.High-fat diet feeding impairs both the expression and activity of AMPKa in rats'skeletal muscle. Biochem Biophys Res Commun,2006,339(2):701-707.
[16]Rangwala SM,Lazar MA.Peroxisome proliferator-activated receptor gamma in diabetes and metabolism.Trends Pharmacol Sci,2004,25(6):331-336.
[17]Lazar MA.PPAR gamma,10 years later.Biochimie,2005,87(1):9-13.
[18]Tamori Y,Masugi J,Nishino N,et al.Role of peroxisome proliferator-activated receptor-gamma in maintenance of the characte risticsofmature 3T3-L1 adipocytes.Diabetes,2002,51(7):2045-2055.
[19]王兆君,叶平,张秀锦.衰老对大鼠肝脏组织酰基辅酶A氧化酶水平的影响.中国动脉硬化杂志,2005,13(1):10-12.
[20]王乐,张霞.非酒精性脂肪肝分子机制的研究进展.现代预防医学,2010,37(11):2027-2030.
(收稿:2016-07-03)
(本文编辑:陈从新)
Effectsofdiammonium glycyrrhizinatelipid ligand on AMPKα signaling pathwaysin ratswith nonalcoholic fatty liver diseases
Cui Xiaomeng,Liu Xin,Shi Haitao,et al.Department of Gastroenterology,Second Affiliated Hospital,Jiaotong University,Xi’an 710004,China
ObjectiveTo study the therapeutic effect of diammonium glycyrrhizinate lipid ligand(DGLL)on non-alcoholic fatty liver disease(NAFLD)and to explore its possible mechanism.Methods The model of NAFLD wasestablished in ratsby feeding high fatdiet,and then the DGLL wasgiven with polyene phosphatidylcholine capsules(PPC)as control.Serum liver function index,blood lipids and glucose,insulin,leptin,adiponectin were detected.The expression of P-AMPKα was immunohistochemically assayed,and PPAR-γ,CPT1,GLUT-4,ACO,L-FABP and ACC mRNA were detected by real time PCR.Results The serum levels of leptin in DGLL group were(3.87±0.38)ng/ml,much lower than in the model group [(4.68±0.39)ng/ml,P<0.01]or in PPC group[(4.55±0.24)ng/ml,P<0.01];serum adiponectin levels was(12.27±0.64)μg/ml,much higher than in the model【(10.46±0.28)μg/ml,P< 0.01】,while itwas notsignificantly different from in PPC group【(12.13±0.56)μg/ml,P> 0.05】;the P-AMPKα expression area in liver tissue was(8.38±3.27)%,much higher than in the model【(1.81±0.90)%,P<0.01】or in PPCgroup【(5.50±0.73)%,P<0.05】;the PPAR-γ,CPT-1,GLUT-4 mRNA in liver tissues were(1.07±0.14,0.91± 0.05,1.61±0.54,respectively),much higher than in the model【(0.26±0.12,0.14±0.01,0.10±0.03,respectivelyt,P<0.05】,while the ACO mRNA was not significantly different from in the model [(0.23±0.09)vs.(0.24±0.02),P>0.05】;the hepatic PPAR-γ and CPT-1 mRNA in PPC group were(0.65±0.16)and(0.22±0.05),much lower than in DGLL group(P<0.05),while the GLUT-4 and ACO mRNA were not significantly different from in the DGLL group(P>0.05);the hepatic ACC mRNA in DGLL group was(1.67±0.23),much lower than in the model【(3.31± 0.02),P<0.05】or in the PPC group【(2.69±0.14),P<0.05】;the hepatic L-FABP mRNA in DGLL group was(1.06± 0.04),much lower than in the model【(1.26±0.02),P<0.05】,but not significantly diferent from in PPC group【(1.06±0.09),P>0.05】.Conclusion We found DGLL could reduceserum transaminase,blood lipids,blood glucose,insulin,HOMA-IR and leptin,increase hepatic PPAR-γ,CPT-1 and GLUT-4 mRNA and decrease the LFABP and ACC mRNA levels in rats with NAFLD.DGLL could significantly improve liver function and lipid metabolism in NAFLD,which may be related to the activation of AMPK pathway.
Nonalcoholic fatty liver diseases;Diammonium glycyrrhizinate lipid ligand;Polyene phosphatidyl choline capsules;AMPK;Rats
10.3969/j.issn.1672-5069.2017.01.015
2014年天晴肝病研究基金资助项目(TQGB20140095)
710004西安市 西安交通大学第二附属医院消化科
崔小萌,女,25岁,硕士研究生。E-mail:1055480672@qq.com
刘欣,E-mail:docliuxin@126.com
