ARID1a及性激素受体在子宫内膜增生病变组织中的表达及意义
2017-04-26要秀娥
要秀娥,赵 敏*
(1.山西医科大学第二临床医学院,山西 太原 030001;2.山西省妇幼保健院,山西 太原 030013)
ARID1a及性激素受体在子宫内膜增生病变组织中的表达及意义
要秀娥1,赵 敏2*
(1.山西医科大学第二临床医学院,山西 太原 030001;2.山西省妇幼保健院,山西 太原 030013)
目的 探讨ARID1a基因在子宫内膜增生病变组织中的表达及与性激素受体表达的相关性,为子宫内膜增生症的防治提供新的思路。方法 采用免疫组化SP(streptavidin peroxidase-biotin,SP)法,检测132例子宫内膜病变组织(单纯性增生40例,复杂性增生40例,不典型增生52例)及28例增殖期子宫内膜组织中ARID1a、雌激素受体(ER)、孕激素受体(PR)、雄激素受体(AR)的阳性表达率。结果 (1)在子宫内膜组织中,普遍存在ER、PR、AR受体的表达。ER、PR阳性表达率各组间比较,差异无统计学意义(P>0.05);AR在不典型增生症组中表达率最低,与其余各组间比较,差异有统计学意义(P<0.05),增殖期内膜组、单纯性增生组、复杂性增生组各组间比较,差异无统计学意义(P>0.05)。(2)ARID1a基因在子宫内膜腺上皮和间质细胞核中普遍表达,在不典型子宫内膜组织中表达丢失率为19.2%,与其余各组间比较,差异有统计学意义(P<0.05);增殖期内膜组、单纯性增生组、复杂性增生组间,差异无统计学意义(P>0.05)。(3)ARID1a基因的表达与ER、PR、AR之间无相关性。结论 雄激素及其受体与子宫内膜病变风险显著相关,ARID1a基因突变和表达缺失是子宫内膜增生恶变中的一个早期事件;对于雄激素受体阳性患者采用联合降低雄激素的治疗,将有可能成为子宫内膜增生症患者治疗的新思路。
子宫内膜增生;雌激素受体,孕激素受体;雄激素受体;ARID1a基因
子宫内膜不典型增生症是子宫内膜癌的癌前病变,23%~29%的未经治疗的子宫内膜不典型增生患者可发展为子宫内膜癌[1]。有研究表明,在子宫内膜癌细胞及组织中有雄激素受体(AR)的表达[2]。AT丰富结构结构域1a (AT rich interaction domain 1a,ARID1a)ARID1a基因是一个潜在的抑癌基因,在多种肿瘤中都存在不同程度的突变。在妇科癌症中突变率最高,卵巢透明细胞癌中达到46%~57%[3],子宫内膜癌中达到30%~41.9%[4]。
本研究采用免疫组化法检测ARID1a基因、雌激素受体(ER)、孕激素受体(PR)、雄激素受体(AR)在增殖期内膜、子宫膜增生症不同病变中的表达,探讨子宫内膜增生症的病因和发病机制,为子宫内膜增生症的防治提供新的思路。
1 资料与方法
1.1 一般资料
选取2011年1月~2016年6月山西省妇幼保健院妇科经宫腔镜检查和(或)诊刮后的子宫内膜石蜡切块标本160例,分为单纯性增生组40例,复杂性增生组40例、不典型增生组52例,增殖期内膜组织28例,全部标本经病理学证实,平均年龄(38.42±9.16)岁,所有患者均无乳腺癌、分泌雌激素的卵巢肿瘤病史,3个月内未用激素治疗。各组一般资料比较,差异无统计学意义(P>0.05)
1.2 实验方法
采用免疫组化SP法检测各组组织中ARID1a、AR、ER 及PR蛋白表达产物,一抗鼠抗人ER、PR、兔抗人AR单克隆抗体(工作浓度分别为1:80,1:200及1:200)和SP免疫组化染色试剂盒均购自北京中杉金桥生物技术有限公司,ARID1a单克隆抗体(工作浓度1:1000稀释)购自abcam公司。用已知乳腺癌、前列腺癌作阳性对照。
1.3 疗效判定标准
ER、PR、AR阳性染色为在胞核内出现黄色或棕黄色颗粒,染色结果根据细胞染色程度和阳性细胞百分率进行综合判定。阳性细胞数:无阳性细胞或<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分;着色程度计分:不着色0分,浅黄色1分,棕黄色2分,棕褐色3分,两者相乘为最后得分:3~4分为弱阳性(+),6~9分为阳性(++),12分为强阳性(+++),(+)~(+++)均为阳性表达。
ARID1a表达的判定:ARID1a阳性染色出现在胞核,细胞核内见棕黄色颗粒为阳性表达,细胞核内未见棕黄色颗粒为阴性表达[5]。
1.4 统计学方法
运用SPSS 21.0软件,计量资料以“x ±s”表示,率的比较采用Fisher确切概率法检验,相关性分析采用Spearman检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 不同子宫内膜增生病变组织中ER、PR、AR的比较
增殖期内膜组、单纯性增生组、复杂性增生组、不典型增生组的ER、PR的阳性表达率,差异无统计学意义(P>0.05);不典型增生组,AR表达率最低,与其余各组间比较,差异有统计学意义(P=0.018),增殖期内膜组,单纯性增生组、复杂性增生组,AR阳性表达率,差异无统计学意义(P>0.05),见表1。

表1 不同子宫内膜组中ER、PR、AR比较 [n(%)]
2.2 ARID1a基因表达水平的比较
随着子宫内膜增生病变的发展,ARID1a基因表达的丢失率逐渐增加,差异有统计学意义(P<0.05)。见表2,图1、2。
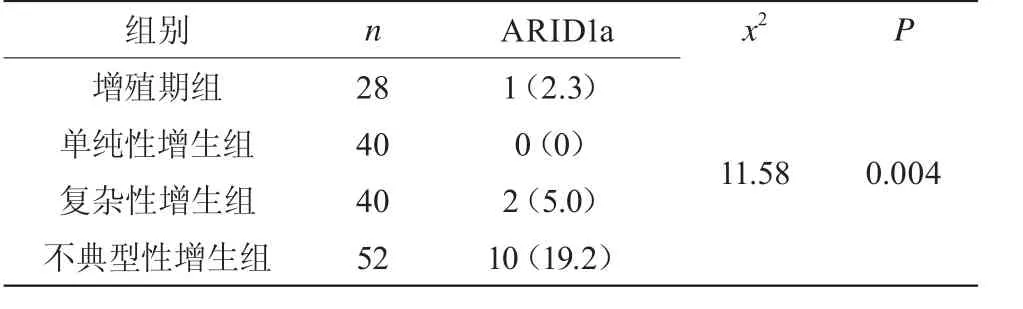
表2 ARID1a在各组中的表达
图1 ARID1a 阳性表达 SP×200

图2 ARID1a 阴性表达 SP×200
2.3 不典型增生组中,ARID1a与ER、PR、AR之间的相关性
在不典型增生组中,ARID1a与ER、PR、AR之间无明显的相关性。见表3。
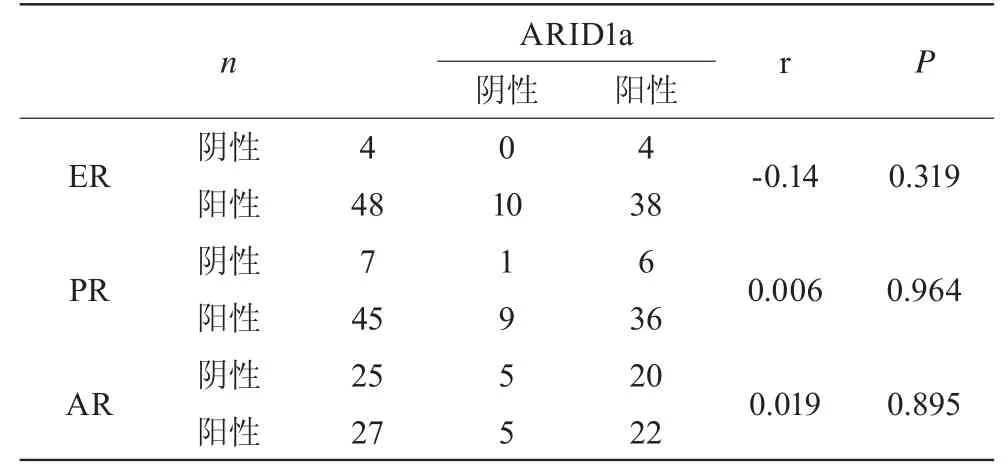
表3 子宫内膜病变组织中ARID1a与ER、PR、AR的相关性
3 讨 论
子宫内膜癌是最常见的一种女性盆腔恶性肿瘤,其发病率有逐年增加的趋势,在美国,每年有60050子宫内膜癌新发病例和10470死亡病例[6]。子宫内膜不典型增生是子宫内膜癌的癌前病变,无孕激素拮抗的雌激素的长期刺激是子宫内膜增生症乃至Ⅰ型子宫内膜癌的病因[7-8],但是,基础实验和临床研究均证实,子宫内膜异常增生的发生发展并不能仅用“无孕激素拮抗”这一理论来解释,围绝经期妇女是子宫内膜癌的高发人群,这些女性伴随雌激素产生紊乱和不足,并不是雌激素水平最高的阶段,约14%~16%子宫内膜增生症患者仅用孕激素治疗无反应(孕激素抵抗或不能逆转病变),约20%在治疗获得缓解后复发甚至加重[9]。因此,探讨子宫内膜增生的病因和发病机制,将成为临床预防及治疗子宫内膜癌的关键。
3.1 血清雄激素及其受体与子宫内膜增生症的相关性
欧洲癌症与营养前瞻性研究委员会,分析了223例子宫内膜癌(EC)及446例正常妇女后认为,游离睾酮水平升高与子宫内膜癌发病风险显著相关[2]。荟萃分析显示,多囊卵巢综合症(PCOS)患者与无PCOS相比,患子宫内膜癌的风险显著增加(OR:2.79),高的雄激素水平被认为是患子宫内膜癌的独立风险因素[2]。国内林金芳等学者采用口服达英-35联合二甲双胍治疗多囊卵巢综合症合并17例子宫内膜不典型增生症(EAH)及5例EC患者,结果显示,12例(9例EAH,3例EEC)曾采用高剂量孕激素治疗未能逆转的患者及10例(EAH8例,EEC2例)直接采用达英-35联合二甲双胍治疗的患者,于治疗3~6个月后均获得完全逆转(100%)[9-10]。达英-35所含雌激素成分炔雌醇及孕激素成分环丙孕酮,可明显降低血循环中及卵巢内雄激素水平,从而间接抑制子宫内膜细胞异常增生。基础实验和临床研究均证实,雄激素与子宫内膜增生症乃至子宫内膜癌的发生风险相关,降低雄激素治疗对于子宫内膜增生症病变逆转有一定的疗效,但仍需要临床大样本的研究。
有研究表明,AR第一外显子编码区存在着多态性及微卫星序列即重复的胞嘧啶-腺嘌呤-鸟嘌呤序列(CAG)n、单核苷酸多态性等基因的改变与子宫内膜癌风险显著相关。
Mertens等的研究显示,子宫内膜间质及平滑肌细胞中AR的免疫活性显著高于腺上皮细胞,增殖期子宫内膜组织中AR的表达显著高于分泌期[11]。Ito等在44例(100%)子宫内膜样癌的间质细胞及其中39例(89%)的癌细胞中检测到AR呈阳性表达,Tanaka等研究报道122例子宫内膜样癌中,其中92例(82%)检测到了AR受体的表达[11]。在我们的研究中,AR在增殖期组、单纯性增生组、复杂性增生组中呈高表达,而在不典型增生组中表达降低。子宫内膜组织中高表达的AR,可能是雄激素作为雌激素的前体转化为雌激素从而促进子宫内膜增生症的发生发展,也有学者认为,可能与雄激素的抗细胞增殖的作用有关,而Apparao等在体外子宫内膜癌细胞株实验中,也证实双氢睾酮和雌二醇均可上调AR的表达[6]。雄激素是否直接影响子宫内膜增生症的发生,目前仍不十分清楚。不典型增生内膜组织中AR表达下降,可能与局部持续增高的雌激素微环境,细胞应激状态下,AR构型改变,AR转录活性下降,最终导致雄激素受体信号的缺陷,但具体的调控机制尚不十分明确,仍有待于进一步研究。
3.2 ARID1a基因突变与表达缺失与子宫内膜增生症的相关性
染色质重塑,包括DNA的合成、转录及DNA损伤后的修复,在细胞核活动中起着非常重要的作用。ARIDla是ATP依赖的染色质重塑复合物的非催化亚基,ARIDla编码的蛋白为ARIDla蛋白,或者称为BAF250a蛋白,在肿瘤中频繁缺失,它的缺失与多种癌症(包括结肠癌、胃癌、子宫内膜癌等)的发生密切相关[12-13]。Werner Henrica MJ等研究表明:在不伴有非典型增生的子宫内膜病变组织中未发现ARID1a蛋白表达的缺失,16%非典型增生,19%子宫内膜肿瘤,28%转移病灶中发现了ARID1a表达的缺失[14]。因此,ARID1A的缺失似乎是在子宫内膜癌变过程中的早期事件。Ayhan等使用免疫组化检测与子宫内膜癌肿瘤抑制和增殖有关的两个基因PTEN和ARID1A基因,发现在所有PTEN基因损失的区域都观察到了ARID1a基因表达的缺失,并发ARID1A和PTEN损失的区域较只有PTEN损失的区域观察到显著的增殖活性[5]。这些研究结果表明,ARID1a基因是必不可少看门基因,防止PTEN基因的失活导致子宫上皮细胞过度增殖,进而由子宫内膜癌前病变过渡到子宫内膜癌的作用。在我们的研究中,不典型子宫内膜组织中,ARID1a基因表达缺失率为19.3%,这与Werner Henrica MJ等的研究结果一致。同时,我们在10例ARID1a表达缺失的组织中发现有5例AR呈阴性表达,其可能机制为子宫内膜组织局部持续高雌激素环境、炎症等因素,导致AR发生甲基化、单核苷酸多态性等基因改变,而ARID1a基因表达的缺失,导致AR损伤后的修复能力降低,最终导致在子宫内膜细胞的恶性转化。
雌激素在子宫内膜增生症的发生发生中起着至关重要的作用,但雄激素及其受体与子宫内膜增生症发生风险显著相关,临床上对于孕激素治疗不敏感的子宫内膜增生症患者,采用联合降低雄激素的治疗,有可能成为子宫内膜增生症治疗的一个新的思路;ARID1a基因表达的缺失,是子宫内膜恶变发生发展中的一个早期事件;有关子宫内膜增生症的病因和发病机制仍有待于进一步的研究。
[1] 周先荣.诊断子宫内膜增生过长的影响因素及其与子宫内膜癌的关系.实用妇产科杂志,2007.23卷(11期).
[2] 张红媛,胡元晶,曲芃芃.雄激素在子宫内膜癌发病中作用的研究进展.中华妇产科杂志,2015.50(11):p.875-877.
[3] Jones,S.,et al.,Frequent mutations of chromatin remodeling gene ARID1A in ovarian clear cell carcinoma.Science,2010.330(6001):p.228-31.
[4] Wiegand,K.C.,et al.,ARID1 Amutationsin endometriosis-associated ovarian carcinomas.N Engl J Med,2010.363(16):p.1532-43.
[5] Ayhan,A.,et al.,Increased proliferation in atypical hyperplasia/ endometrioid intraepithelial neoplasia of the endometrium with concurrent inactivation of ARID1A and PTEN tumour suppressors. J Pathol Clin Res,2015.1(3):p.186-93.
[6] Ito, K.,et al.,Insitu androgen and estrogen biosynthesis in endometrial cancer:focus on androgen actions and intratumoral production. Endocrine-Related Cancer,2016.23(7):p.R323-R335.
[7] 杨开选,王 超.子宫内膜增生症的病因及相关因素.实用妇产科杂志,2007(11):p.645-647.
[8] 《子宫内膜增生管理指南》第一版.2016,英国皇家妇产科医师学院(RC0G)英国妇科内镜学会(BSGE).
[9] 苏椿淋,李 昕,林金芳.子宫内膜不典型增生及早期子宫内膜样癌药物治疗的进展及前景.中华妇产科杂志,2015(9):p.715-717.
[10] 沈宗奇,林金芳.口服避孕药联合二甲双胍治疗多囊卵巢综合征患者子宫内膜不典型增生.中华妇产科杂志,2010.45(1):p.56-57.
[11] 孙丹丹.et al.,子宫内膜癌雄激素受体表达及临床意义.实用妇产科杂志,2012.28(2):p.131-134.
[12] 邓姝哲,邱慧磊.ARID1a基因在妇科肿瘤中的作用研究进展.中华病理学杂志,2014.43卷(12期).
[13] 吕昌帅,郎景和.ARIDlA基因突变在子宫内膜异位症及其相关卵巢肿瘤中的研究进展.2015.31卷(10期).
[14] LA Akslen.ARID1A loss is prevalent in endometrial hyperplasia with atypia and low-grade endometrioid carcinomas.Modern Pathology An Offi cial Journal of the Un,2013.
本文编辑:刘欣悦
Expressions of ARID1a and sex hormone receptor in Endometrial hyperplasia
YAO Xiu-e1,ZHAO Min2*
(1.The second clinical medical college,Shanxi Medical University,Shanxi Taiyuan 030001,China; 2.Maternal and child health care hospital of Shanxi province Taiyuan ,Shanxi Taiyuan 030013,China)
Objective To investigate the expression of ARID1a,in endometrial hyperplasia and its correlation wits sex hormone receptors.Methods Expressions of ARID1a,ER,PR and AR were detected with immunohistochemistry technic(streptavidin peroxidase-biotin,SP)in 160 cases including 28 of proliferative endometrium,40 of Simple endometrial hyperplasia,40 of Complex endometrial hyperplasia,52 of atypical proliferation.Results (1)The expression of ER,PR and AR receptors exist widely in the proliferative phase endometrium,atypical endometrial tissue,atypical endometrial hyperplasia.The positive expression rate of ER between these groups is not statistically significant;the positive expression rate of PR shows a tendency of decrease with the lowest expression rate appearing in atypical endometrial hyperplasia tissues;differences in the positive expression rate of AR in proliferative endometrium and all typical endometrial tissues had no significant statistical significance with the lowest expression rate existing in the group of atypical hyperplasia,the difference is statistically significant(P=0.018).(2)ARID1a gene has expression both in endometrial glandular epithelial and stromal cell nucleus,and the expression loss rate is 19.2% in atypical endometrial tissues.Compared with other groups, the atypical hyperplasia group has a significant statistical difference(P=0.004).(3)There is no correlation between ARID1a gene and ER,PR,AR.Conclusion Androgen and its receptor are significantly associated with the risk of endometrial hyperplasia.ARID1a gene mutation and expression of endometrial hyperplasia canceration in an early event;The treatment of androgen receptor positive patients with combined reduction of androgen will likely become a new idea for the treatment of endometrial hyperplasia.
Endometrial hyperplasia;Estrogen receptor;Progesterone receptor;Androgen receptor;ARID1a
R737.33
B
ISSN.2095-8803.2017.01.078.04
赵 敏,Email:minzhao22@163.com
