猪丹毒杆菌C43005株的制备及检定
2017-04-26王秀丽刘博张媛彭国瑞李建辛凌翔蒋玉文
王秀丽,刘博,张媛,彭国瑞,李建,辛凌翔,蒋玉文
(中国兽医药品监察所,北京 100081)
猪丹毒杆菌C43005株的制备及检定
王秀丽,刘博,张媛,彭国瑞,李建,辛凌翔,蒋玉文*
(中国兽医药品监察所,北京 100081)
为研究猪丹毒杆菌C43005株的菌种特性,制备了一批猪丹毒杆菌C43005株并对菌种的真空度、剩余水分、形态、培养特性、生化特性、血清学特性、毒力、免疫原性等参数进行检定,重点对该菌种的毒力进行重复试验并对影响毒力的因素进行分析。结果表明,菌种的真空度、剩余水分、形态、培养特性、生化特性、血清学特性、免疫原性均符合《中华人民共和国兽用生物制品规程》二〇〇〇版相关质量标准的规定,毒力试验结果明显受培养基质量和动物个体差异的影响。本研究可以为猪丹毒杆菌C43005株的制备和检定提供参考依据。
猪丹毒杆菌C43005株;毒力;免疫原性
目前我国的生产和检验用菌种作为标准物质进行管理,猪丹毒杆菌C43005株是王明俊先生在猪丹毒灭活疫苗(猪丹毒氢氧化铝菌苗)试验中经比较8株猪丹毒杆菌的免疫原性,筛选出的免疫原性最好的菌株,因此选择了C43005株为猪丹毒灭活疫苗的生产用菌种[1-2]。《中华人民共和国兽用生物制品规程》二〇〇〇年版规定,本菌种的保存期为2~8 ℃保存10年,在菌种过期前需要更换批次,新制备的菌种需要参照质量标准对所有参数进行检定,且由中国兽医药品监察所鉴定、保管和供应[3]。目前能追溯到的鉴定资料只有2006年的制备和检定报告,之前的制备和检定资料因未归档而无法查阅。本文详细报告C43005株猪丹毒杆菌的制备和检定方法及结果,以期为将来菌种的溯源和检定提供参考依据。
1 材料与方法
1.1 菌种 猪丹毒杆菌C43005株(1983年3月27日冻干),由中国兽医药品监察所菌种保藏中心提供。
1.2 培养基及试剂 马丁琼脂培养基、马丁肉汤培养基、肉肝胃膜消化汤培养基、硫盐(TG)、酪胨琼脂(GA)、葡萄糖蛋白胨汤(GP)、生理盐水、5%蔗糖脱脂牛奶购自北京中海生物技术有限公司;健康动物血清,购自Hyclone公司,批号:GWH0092,裂解血细胞全血、绵羊脱纤血由中国兽医药品监察所提供,API coryne棒状杆菌生化鉴定试纸条,购自biomerieux.sa公司,革兰氏染色液购自山东奥博星生物技术有限公司。
1.3 实验动物 小鼠(KM系),购自北京维通利华实验动物技术有限公司,健康易感猪,购自河北、山东、四川。
1.4 菌种复壮、冻干 开启1983年3月27日冻干的猪丹毒杆菌C43005株,经肉肝胃膜消化汤溶解后,用接种环取少量菌液划线接种含10%健康动物血清的马丁琼脂平板,37 ℃培养24 h后,挑取单菌落接种于20 mL含2%裂解血细胞全血的肉肝胃膜消化汤,37 ℃静置培养24 h后,取10mL静脉注射20 kg左右的健康易感猪,猪死亡后剖解,无菌取肝脏和心血,用接种环取少量心血、肝脏分别接种含10%健康动物血清的马丁琼脂平板各1 付,分别接种10 mL肉肝胃膜消化汤,37 ℃培养24 h。
若平板和肉肝胃消化汤中的细菌纯粹生长,挑取平板上的单菌落接种含10%健康动物血清的马丁琼脂斜面小管若干支,37 ℃培养24 h后,接种预培养24 h无菌生长的含10%健康动物血清的马丁琼脂斜面中管,37 ℃培养24 h。用含5%蔗糖的10%脱脂牛奶将菌体洗下,收集于含玻璃珠的灭菌分装瓶中,充分振荡混匀后,用长针头注射器分装至安瓿瓶中,按照特定的冻干曲线冻干后封口。
1.5 菌种的检定
1.5.1 真空度测定 按照《中国兽药典》[4]进行检验。
1.5.2 纯粹检验 用马丁琼脂培养基,按照《中国兽药典》[4]进行检验。
1.5.3 剩余水分测定 按照《中国兽药典》[4]进行检验。
1.5.4 培养特性 在含有10%健康动物血清或含4%健康动物血清和0.1%裂解血细胞全血的马丁琼脂平板上,37 ℃培养36~48 h,观察菌落形态。
1.5.5 血清学特性 沉淀反应抗原的制备:取在含10%绵羊脱纤血的血斜面上培养的C43005株接种于含0.5%乳糖的马丁肉汤培养基(加入10%的健康动物血清),37 ℃培养24 h,纯粹检验合格后加入0.5%的甲醛灭活24 h,3000 r/min离心30 min,收集菌体,用无菌PBS洗涤2 次,在沉淀物中加入适量蒸馏水(30倍浓缩),经121 ℃高压1 h,冷却后离心取上清即为沉淀反应抗原,加入0.01%的硫柳汞,置于2~8 ℃备用。琼脂双相扩散法检定血清型:在0.01 mol/L PBS中加入1%~1.2%的琼脂,融化后加入0.01%的硫柳汞,倾注平板,凝固后打孔,孔径与孔距均为4 mm,在酒精灯火焰上加热封底,在中心孔加入沉淀反应抗原,外周各孔加入定型血清,置于湿盘中37 ℃作用24 h,当中心孔与周围孔之间出现清晰的乳白色沉淀线,即为相应的血清型。
1.5.6 生化特性检查 参照试纸条的使用说明书进行检定。
1.5.7 毒力 以肉肝胃膜消化汤培养24 h的菌液1~5 mL(每1 mL不少于活菌30亿CFU),静脉注射断奶后1~3 个月体重20 kg以上的健康易感猪2 头,应于4 日内死亡;5~10 个活菌皮下注射18~22 g的小白鼠5 只,均应于7 日内死亡[3]。
1.5.8 免疫原性 开启新冻干菌种,用马丁肉汤溶解后划线接种含10%健康动物血清的马丁琼脂平板,37 ℃培养24 h,挑取中等大小的菌落接种于100 mL含2%裂解血细胞全血的肉肝胃膜消化汤中,37 ℃ 培养28 h,取菌液参照《中国兽药典》[4]进行纯粹检验。检验纯粹后按菌液总量的0.3%加入甲醛溶液,37 ℃灭活18~24 h,灭活期间振荡数次。灭活后参照《中国兽药典》二〇一〇版三部进行无菌检验;按照菌液与氢氧化铝胶5∶1的比例充分混匀,静置2~4 d后,弃去上清,浓缩至原体积的40%[3]。
用体重16~18 g的小白鼠10 只,分成2组,第1组皮下注射疫苗0.1 mL,第2 组皮下注射用40%氢氧化铝胶4倍稀释的疫苗0.2 mL,21 d后连同条件相同的对照小鼠6 只,其中3 只对照小鼠与免疫小鼠各皮下注射1000 MLD C43006和C43008的混合菌液,另3只小鼠皮下注射1 MLD C43006和C43008的混合菌液,观察10 d,注射1000 MLD的对照小鼠应全部死亡,注射1 MLD的对照小鼠应至少死亡2 只,免疫小鼠至少保护7 只为合格[3]。
2 结 果
2.1 真空度测定 对冻干的150 支菌种参照《中国兽药典》[4]进行检验,2/150无辉光,148/150呈现白色或粉色或紫色辉光,真空度良好。2 支无真空的菌种高压处理。
2.2 纯粹检验 随机抽取5 支真空度测定良好的菌种,按照《中国兽药典》[4]进行检验,5/5纯粹,符合规定。
2.3 剩余水分测定 按照《中国兽药典》[4]进行检验,结果为0.8%、0.4%、0.9%、0.7%,均小于4%,符合规定。
2.4 培养特性 在含4%健康动物血清和0.1%裂解血细胞全血的马丁琼脂平板上,37 ℃培养48 h,肉眼观察菌落表面圆整光滑,呈微蓝灰色露珠状,符合规定。
2.5 血清学特性 C43005株与2型猪丹毒血清出现明显沉淀线条,与1型血清无沉淀反应,说明C43005株为猪丹毒2型,符合规定。
2.6 生化特性 测试结果见表1,符合细菌分类学中猪丹毒杆菌的生物学特性。

表1 猪丹毒杆菌C43005生化检查结果
2.7 毒力 小鼠的毒力试验结果显示,20151222批肉肝胃膜消化汤培养的猪丹毒杆菌C43005株的最小致死剂量(MLD)大于10 CFU,20160126批肉肝胃膜消化汤培养的C43005株的MLD为4.3 CFU,初步证明肉肝胃膜消化汤对C43005的毒力有明显影响。用20160126批肉肝胃膜消化汤培养菌液对小鼠的毒力试验,结果符合标准中“5~10 个活菌皮下注射18~22 g的小白鼠5 只,均应于7 日内死亡”的规定,结果见表2;猪的毒力试验结果显示,用20160126批肉肝胃膜消化汤培养的菌液分别对山东、四川、河北地区的体重、日龄相近的猪进行毒力试验,结果显示对山东地区猪的MLD大于2.2×1010.0,对四川地区猪的MLD大于2.6×1010.0,对河北地区猪的MLD为1.6×1010.0,说明不同地区猪对C43005的耐受程度不同。20151222批和20160126批肉肝胃膜消化汤培养的菌液对河北地区猪的毒力试验结果差异也说明不同批次肉肝胃膜消化汤对C43005的毒力有明显影响。用20160126批次肉肝胃膜消化汤培养的菌液对河北猪进行试验,结果2/2死亡,符合规定,结果见表3。
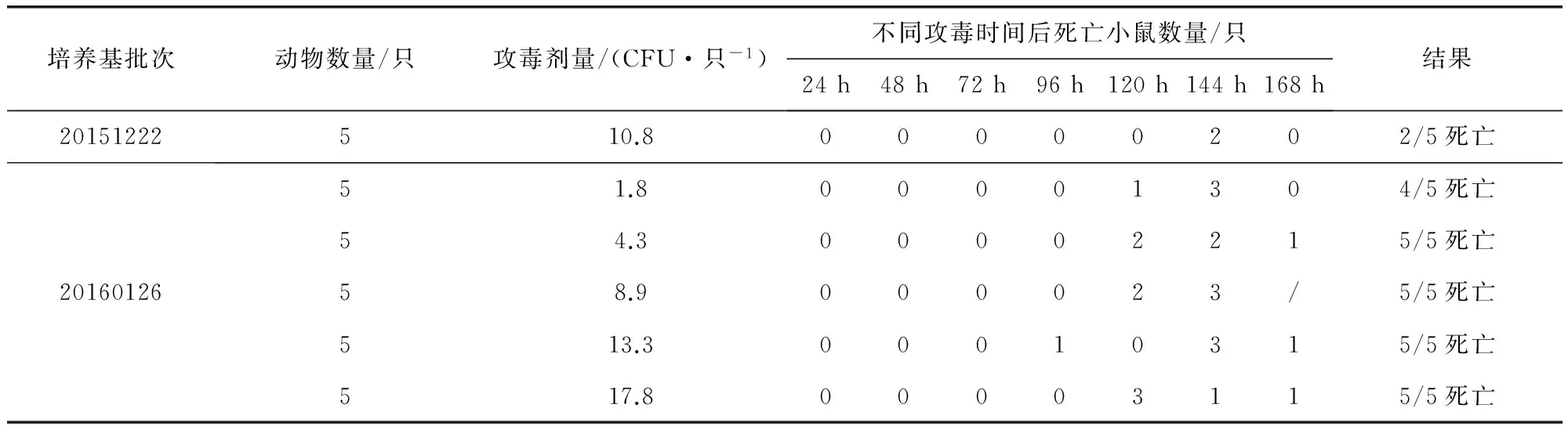
表2 猪丹毒C43005株对小鼠毒力试验结果
“/”表示小鼠全部死亡后无小鼠死亡记录
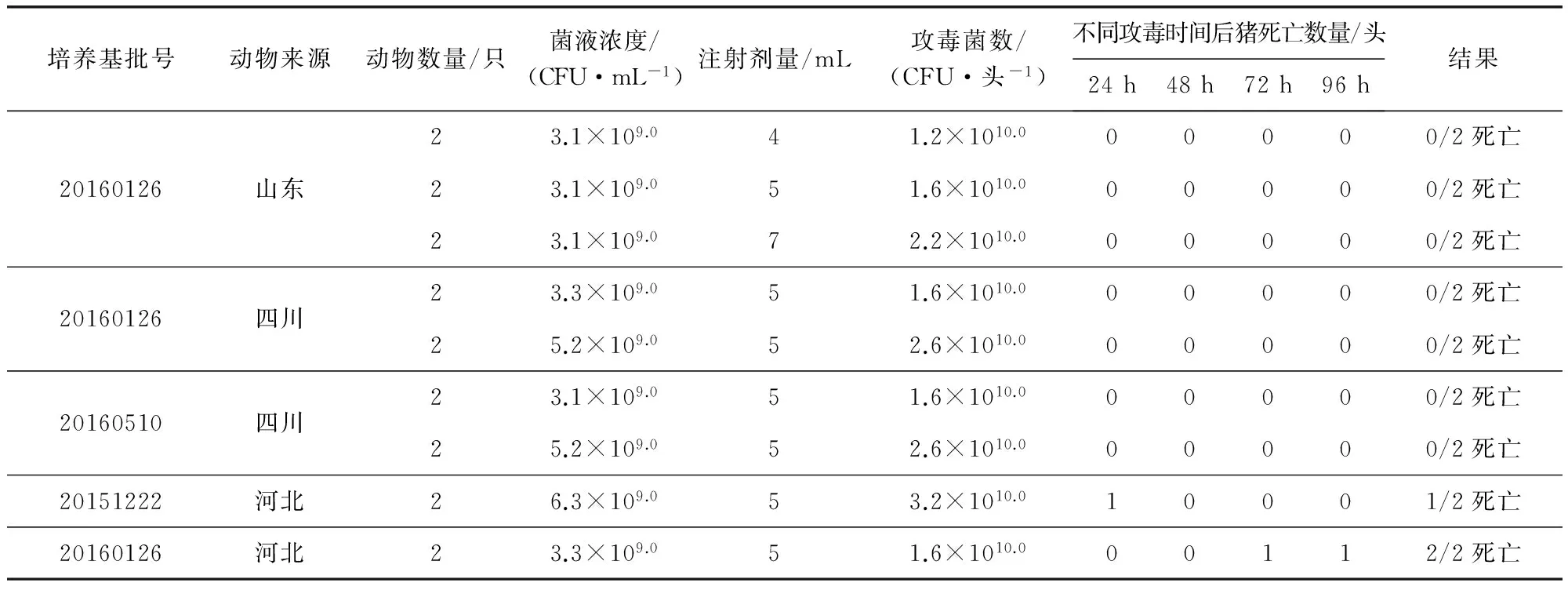
表3 猪丹毒C43005株对猪毒力试验结果
所有试验猪均为60~70 日龄,体重20~22 kg的健康易感猪
2.8 免疫原性试验 疫苗灭活前对菌液进行活菌计数,菌液浓度为3.7×109.0CFU/mL,免疫小鼠21 d后攻毒,免疫1组小鼠5/5保护,免疫2组小鼠4/5保护,对照1组和对照2组小鼠均3/3死亡,结果符合规定。C43006株和C43008株混合菌液毒力测定结果显示1MLD为4.3 CFU,见表4,攻毒保护结果见表5。
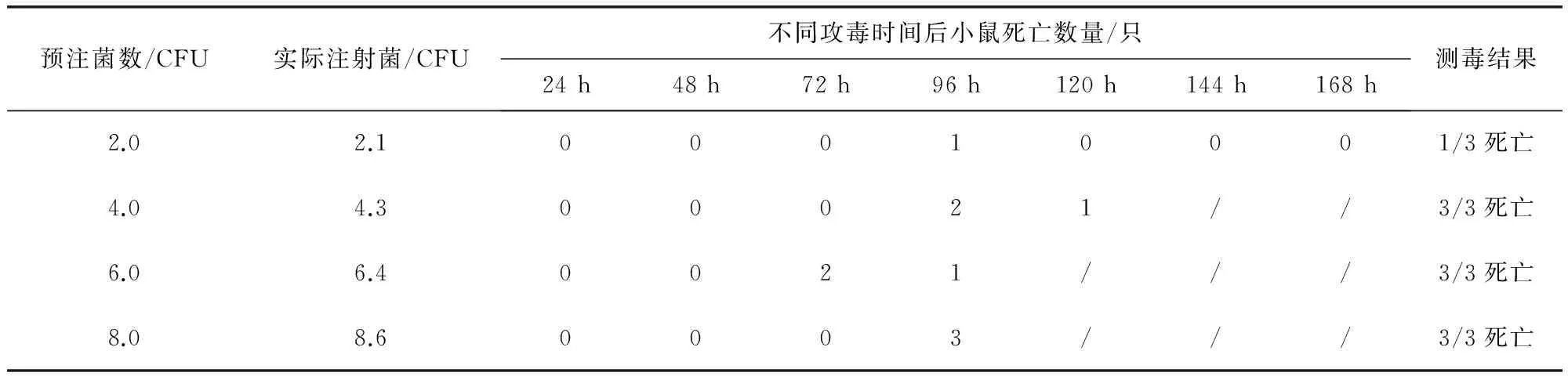
表4 C43006和C43008混合菌液毒力测定结果
“/”表示小鼠全部死亡后无小鼠死亡记录
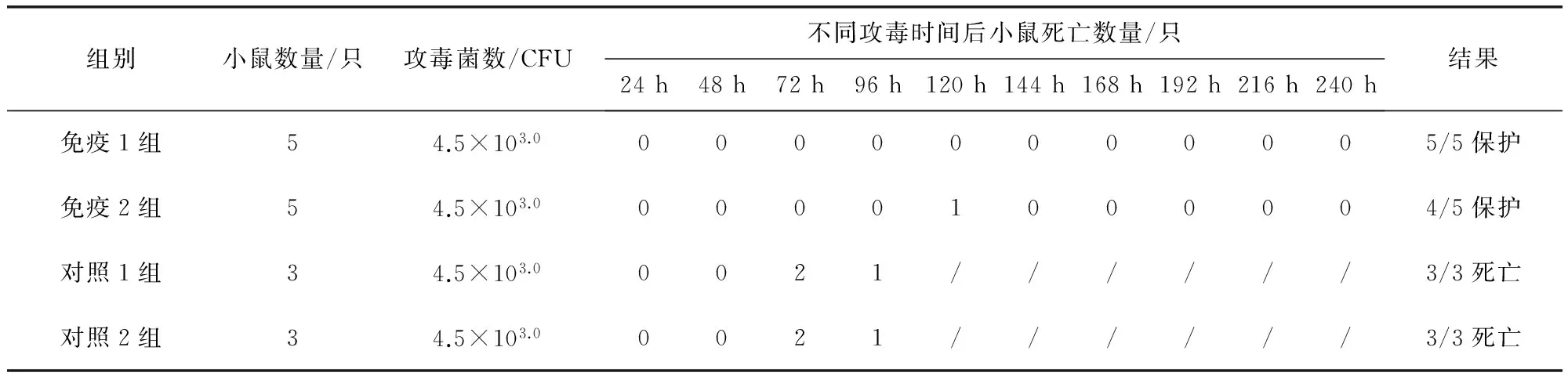
表5 攻毒保护试验结果
“/”表示小鼠全部死亡后无小鼠死亡记录;免疫1组表示小鼠免疫的疫苗原液,免疫2组表示小鼠免疫1 份疫苗与3 份40%的铝胶生理盐水的混合液;对照1组表示攻1000 MLD的对照组,对照2组表示攻1 MLD的对照组
3 讨论与小结
郑庆端在猪丹毒氢氧化铝胶甲醛灭活苗的研究报告中还比较了肉胃消化汤、胃蛋消化汤、牛肝胃酶消化汤、肉肝胃酶消化汤、胰酶消化汤1和胰酶消化汤2等培养基以及马丁肉汤加血清等培养基对猪丹毒促生长能力及制备疫苗的效力差异,结果显示猪丹毒杆菌在肉肝培养基中生长良好,制出的疫苗效力表现良好,猪丹毒杆菌在胰酶消化汤2和牛肝胃酶消化汤中生长甚差,猪丹毒在肉胃消化汤、胃蛋消化汤培养基中生长良好,但制备的疫苗免疫保护效力较差,说明疫苗的效力受培养基和菌数的共同影响[5]。本研究试验结果显示,猪丹毒杆菌C43005对小鼠和猪的毒力均受培养基的影响,新鲜肉肝胃膜消化汤的制备因受牛肉、牛肝、猪胃等原材料的新鲜程度及消化温度、时间、pH值、高压温度及时间等影响较大[3,5],因此在进行菌种检定时要先对培养基的促生长能力及培养菌的毒力进行预试验,筛选出合适的培养基进行菌种检定。
猪丹毒杆菌C43005对猪的毒力试验结果显示,不同地区的猪对C43005的耐受程度不同。在细菌类兽用生物制品效力检验中攻毒菌种毒力测定的结果也受实验动物品系、来源等的影响,这也是细菌类生物制品的效力检验即使是SPF小鼠、SPF鸡等有质量标准的动物攻毒前仍需预测毒力的原因,目前猪仅是一种实验用动物,没有相关的质量标准,地区差异、品系差异、养殖环境差异均影响试验结果。
《中华人民共和国兽用生物制品规程》中对C43005毒力的质量标准规定为“制造和检验用菌种,以肉肝胃消化汤培养24 h的菌液1~5 mL(每1 mL含活菌不少于30亿CFU)静脉注射断奶后1~3个月体重20 kg以上的健康易感猪2 头,应于4 日内死亡”[3],质量标准规定的攻毒菌液的浓度没有上限,此为质量标准中存在的一个漏洞,在C43006和C43008的毒力检定中和C43005存在同样的问题,2006年C43005菌种的检定中对健康易感仔猪的最小致死剂量为1.5×1010CFU/头(每头猪注射5 mL 3.0×109.0CFU/mL的菌液),因此建议修订C43005毒力试验的质量标准,控制攻毒菌液浓度的上限,且经过进一步的试验验证,将攻毒剂量进行适当调整。
此次猪丹毒对猪的毒力试验结果显示,以20160126批次的肉肝胃消化汤培养的C43005以3.3×109.0CFU/mL的菌液浓度对河北地区的猪攻毒,猪2/2在4日内死亡,符合质量标准,但受培养基质量的影响,或受不同地域猪的个体差异影响,试验结果差异显著,且多组实验结果均不符合质量标准的规定,菌种的毒力不能客观评价。因此建议对用于生产或检验用菌种检定的培养基、试剂、实验动物的品种品系等制定相关质量标准。
[1] 中国兽医药品监察所. 中国兽医微生物菌种保藏管理中心.中国兽医菌种目录[S].
[2] 王明俊, 李扬陇. 猪丹毒氢氧化铝菌苗试验报告[J]. 中国畜牧兽医杂志, 1956, (2):67-73.
[3] 农业部兽用生物制品规程委员会. 中华人民共和国兽用生物制品规程二〇〇〇年版[S].
[4] 中国兽药典委员会.中华人民共和国兽药典二〇一〇年版三部[S].
[5] 郑庆端, 马闻天, 王明俊. 猪丹毒氢氧化铝甲醛菌苗研究[J]. 畜牧兽医学报, 1957, (2):3-21.
(编辑:李文平)
The Preparation and Verification of Swine Erysipelas Bacillus C43005 Strain
WANG Xiu-li, LIU Bo, ZHANG Yuan, PENG Guo-rui, LI Jian, XIN Ling-xiang, JIANG Yu-wen*
(ChinaInstituteofVeterinaryDrugControl,Beijing100081,China)
In order to study the bacterial characteristics of swine erysipelas bacillus C43005 strain, a batch of swine erysipelas bacillus C43005 strain was prepared, and then the vacuum degree, residual moisture, morphology, culture characteristics, biochemical properties, serological characteristics, virulence, and immunogenicity were tested. The virulence experiment of C43005 was repeated and the influence factors were analyzed. The results showed that the vacuum degree, residual moisture, morphology, culture characteristics, biochemical properties, serological characteristics, immunogenicity conformed to the law of People′s Republic of China Veterinary Biological Products Regulation(2000 version), and the virulence test results were obviously affected by medium′s quality and experimental animals’ individual differences. This research could provide some reference data for the preparation of swine erysipelas bacillus C43005 strain.
swine erysipelas bacillus; C43005 strain; virulence; immunogenicity
王秀丽,助理研究员,从事兽用生物制品的检验及研究工作。
蒋玉文。E-mail:jiangyuwen@ivdc.org.cn
2016-11-09
A
1002-1280 (2017) 03-0021-06
S852.61
