赤霞珠葡萄生长发育过程中内源激素的变化及其与果实成熟的关系
2017-04-25高江曼王童孟刘美迎李汶冰惠竹梅张振文
高江曼,孟 莹,刘 庆,王童孟,刘美迎,李汶冰,惠竹梅,2,*,张振文,2,
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西葡萄工程研究中心,陕西 杨凌 712100)
赤霞珠葡萄生长发育过程中内源激素的变化及其与果实成熟的关系
高江曼1,孟 莹1,刘 庆1,王童孟1,刘美迎1,李汶冰1,惠竹梅1,2,*,张振文1,2,
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西葡萄工程研究中心,陕西 杨凌 712100)
为研究赤霞珠葡萄果实发育过程中不同组织(果皮、果肉和种子)内源激素的含量变化及其与果实成熟的关系,用高效液相色谱-质谱联用技术测定果实发育过程中果皮、果肉以及种子中脱落酸(abscisic acid,ABA)、生长素(indole acetic acid,IAA)、赤霉素(gibberellin A3,GA3)、茉莉酸(jasmonic acid,JA)和水杨酸(salicylic acid,SA)的含量。结果发现,在葡萄果实生长发育过程中,葡萄果皮和果皮中ABA含量呈双S型变化,花后20 d左右,ABA含量较高,随着果实膨大开始下降,随后开始上升,至转色中期达到最大值,随着果实的成熟缓慢下降;果皮、果肉和种子中GA3含量均是从果实膨大期开始上升,膨大后期下降,随后在转色初期又开始上升,随后下降;JA含量的变化与GA3类似;果皮和果肉中IAA含量首先略微下降,在果实快速生长期迅速上升,并达到峰值,随着果实进入转色期,含量逐渐下降并保持稳定,果实膨大期之前,种子中IAA含量较高,随着果实膨大降低,并维持在较低水平,SA含量的变化与IAA类似。结论:ABA、GA3、JA含量与赤霞珠果实成熟有关,IAA、GA3、SA、JA含量与赤霞珠果实生长有关。
植物激素;葡萄;调控;成熟;果皮;果肉;种子
近年来,由于葡萄和葡萄酒的保健功能,高质量的葡萄和葡萄酒的需求量越来越大。其中,葡萄中发挥保健作用的主要有酚类、有机酸、香气、维生素和氨基酸等物质。这些物质不仅给葡萄和葡萄酒提供了营养,而且还提供了口感和香气。其中,酚类物质为葡萄酒提供了颜色、口感上的收敛性[1]。酿酒葡萄中的香气物质为葡萄酒提供了香气基础这些物质主要是在葡萄的生长发育过程中合成其中,花色苷和糖的积累于成熟期开始,因此,花色苷和糖的开始合成可能是葡萄浆果开始成熟的标志。据研究葡萄的成熟过程不仅被环境因子调控[2],还被内源植物激素所调控[3-4]。
植物激素是一类不仅可以调节植物生长和代谢,又可以对生物逆境和非生物逆境进行调节的化合物[5]。植物激素是由植物体内的很多重要的代谢途径中衍生出来的,并且低浓度的植物激素便可以调节植物生长和发育以及提高植物体对生物或者非生物胁迫的抗性[5],是一类高效的生长调节物质。植物激素可以通过很多种水平来起作用,包括激素合成、代谢(失活)、转运、感受和转导[6]。
目前为止,已经有8 种植物激素被发现,分别是脱落酸(abscisic acid,ABA)、生长素(indole acetic acid,IAA)、赤霉素(gibberellic acid,GA)、茉莉酸(jasmonic acid,JA)、水杨酸(salicylic acid,SA)、油菜素内酯(brassinosteroid,BRs)、乙烯(ethylene)和细胞分裂素(cytokinin)。脱落酸在调控植物对逆境应答中起到重要作用[7]。并且外源ABA可以提高葡萄浆果中花色苷含量和抗氧化性[8]。除此之外,ABA还可以激发呼吸跃变型以及非跃变型果实的成熟[9-10]。IAA可通过促进细胞的垂直生长、原生质和细胞内含物的生成改善植物的生长。IAA还可促进植物根部生长和调控根系统结构[11]。不仅如此,IAA还能调节葡萄中激素的平衡并促进葡萄浆果的成熟[12]。报道称,GA对于葡萄的成熟具有重要作用,比如,诱导浆果生长、增大穗质量并引起更好的穗形[13-14],促进无核葡萄的生长[15],降低葡萄果皮和果肉中酚类物质的含量和抗氧化性[16]并提高无核葡萄波尔莱特的产量和质量[17]。茉莉酸甲酯(methyl jasmonate,MeJA)和JA是一种对植物细胞很重要的调控因子,可以调节植物生长的很多方面,例如缓解生物以及非生物胁迫、种子发芽和叶片衰老。MeJA不仅可以调控跃变型果实的成熟,还可以调控非跃变型果实的成熟[18]。MeJA可以通过短暂地增加可溶性糖与可滴定酸之间的比值,花色苷的积累和变软来促进草莓的成熟[18]。但是其他一些研究指出MeJA可能会降低或者抑制水果的成熟[19]。这些研究说明茉莉酸与果实的成熟有关,但是具体作用还存在争议。SA是一类对植物生长贡献很大的酚类物质,在调控植物生长发育中是一个很重要的角色。据报道,SA可以通过在特定路径中激活黄酮醇合成酶(f l avonol synthase,FLS)的活性调控葡萄中黄酮醇的合成[20],但是别的一些研究发现SA可能延迟果皮着色并且延迟成熟[21]。SA还可以提高弗雷无核葡萄的质量并延长其货架期[22]。并且这些激素不是独自作用,而是与一种甚至多种激素互作[5]。IAA可以促进GA3的合成[23],并且外源GA3也可以增加内源IAA的含量[24-25]。JA可以刺激ABA合成并与ABA和乙烯互作[9,26],并且ABA在调控跃变型果实成熟时与乙烯也有互作[27]。
基于这些激素对与植物的重要性,葡萄浆果中内源激素的变化趋势及其与浆果成熟的关系对浆果生长发育很重要。但目前对于葡萄组织中内源激素的变化趋势的研究较少,因此,本研究旨在探究赤霞珠葡萄浆果各组织中内源激素的变化趋势及其与果实成熟的关系。
1 材料与方法
1.1 材料和试剂
实验在山西省临汾市乡宁县戎子酒庄东廒产区(N 34°95’,E 110°85’)进行,平均海拔1 050~1 110 m,属温带大陆性季风气候区,该区四季分明,全年日照时数在2 500 h 左右,年均气温9.9 ℃,降水量570 mm,年均无霜期为212 d。供试品种为欧亚种(Vitis vinifera L.)酿酒葡萄品种赤霞珠(Cabernet Sauvignon),2007年定植,每亩266 株,株行距1.0 m×2.5 m,东西行向,倾斜式独龙干整形,常规管理。分别于2013年和2014年分别采样,2013年从花后29 d(2013-07-08)开始采样,每10 d采一次样,随机采样,每次采样兼顾阴阳面。2014年采样从花后28 d(2014-07-05)开始采样,采样方法和2013年相同。2013年和2014年的采样时间分别如表1所示。
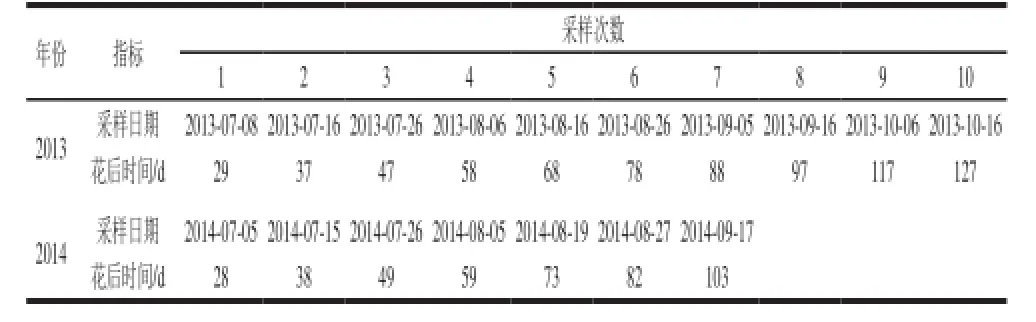
表1 2013年和2014年采样时间Table 1 Sampling time in 2013 and 2014
超纯水(电阻小于18 MΩ)、甲醇(色谱纯,纯度≥99%) 美国天地公司;GA3(63492)、IAA(I3750,纯度≥98%)、SA(S5922)、ABA(A1049,纯度≥99%)、JA(J2500) 美国圣路易斯西格玛化学试剂公司。
1.2 仪器与设备
-80 ℃超低温冰箱 青岛海尔特种电器有限公司、-40 ℃冰箱 沈阳北斗星制冷设备有限公司;AUW220D电子天平、LC-20AT高效液相色谱仪、Wondasil™ C18柱子(4.6 mm×150 mm,5 μm) 日本岛津公司;5804R低温冷冻离心机 德国Eppendorf公司;XB-70制冰机 美国格兰特公司;DHG-9145A型电热鼓风干燥箱 上海一恒科学仪器有限公司;R206旋转蒸发仪 上海申生公司;QYC-2102C全温摇床上海福玛公司;KQ-300DE型数控超声波 昆山市超声仪器有限公司;Milli-Q超纯水机 美国Millipore公司;API 2000™电喷雾串联质谱仪 美国密尔沃基艾伦-布拉得利公司。
1.3 方法
1.3.1 赤霞珠葡萄浆果理化指标的测定
随机取赤霞珠葡萄果实 150~200 粒,除去果皮表面水分和残留物,挤出汁液混匀,用斐林热滴定法测定还原糖含量,用国际葡萄和葡萄酒组织(OIV)方法测定可滴定酸含量。取100 粒葡萄果实,用电子天平测定葡萄果实的百粒质量。
1.3.2 植物激素的提取及测定
将赤霞珠葡萄浆果的果皮、种子和果肉分离,各组织用液氮速冻。并在液氮保护下进行研磨,研磨成粉之后,取0.4 g样品用4 mL 80%甲醇(含0.02% 2,6-二叔丁基-4-甲基苯酚和0.05%一水合柠檬酸)置于摇床中(100 r/min、4℃)提取18 h。提取完之后在低温离心机8 000 r/min离心15 min,分离上清液,4 mL 80%甲醇再提取两次,每次1 h。合并上清液,减压蒸发至5 mL,用1.5 倍石油醚萃取3 次,弃醚相。水相用一倍甲酸甲酯萃取3 次,收集酯相。旋蒸至干,用甲醇进行溶解,定容至1 mL,-40 ℃条件下保存备用,样品进样前用0.25 μm滤膜过滤,最后用高效液相色谱-质谱联用仪对葡萄果肉、种子、果皮中的ABA、IAA、GA3、JA、SA进行测定。流动相A是含体积分数0.1%甲酸的甲醇溶液,流动相B是超纯水。
1.4 数据处理
采用SPSS 20.0数据处理软件对实验数据的方差显著性以及相关性进行分析,显著水平为P<0.05。所有实验数据均为3 个重复,表示为±s。
2 结果与分析
2.1 赤霞珠葡萄浆果理化指标的变化
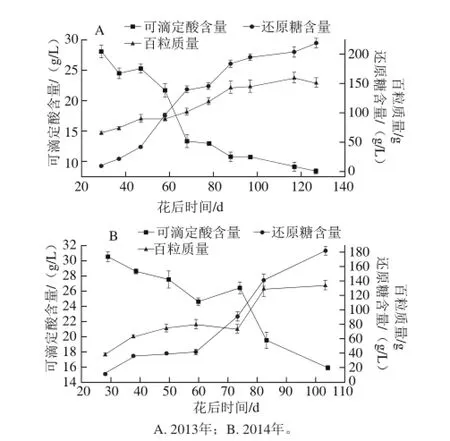
图1 赤霞珠葡萄还原糖含量、可滴定酸含量及百粒质量的变化Fig. 1 Changes in reducing sugar concentration, titrable acid concentration, and 100-berry weight
2013年和2014年赤霞珠葡萄浆果的还原糖含量、可滴定酸含量以及百粒质量见图1。从花后28 d开始,百粒质量便迅速上升,并在转色后期上升缓慢,于成熟期达到最大值(2013年159.5 g,2014年134.8 g),呈单S状上升。还原糖含量的变化趋势与百粒质量的变化趋势基本相同,于收获期达到最大值(2013年和2014年分别是218.7 g/L和181.5 g/L)。相反,可滴定酸含量随着浆果的生长下降,在成熟期达到其最低值(2013年和2014年分别是8.4 g/L和15.9 g/L)。
2.2 赤霞珠葡萄果肉、种子、果皮在生长发育过程中激素含量的变化
2.2.1 赤霞珠葡萄果肉、种子、果皮在生长发育过程中ABA水平的变化
2013年和2014年赤霞珠葡萄果肉、种子和果皮中ABA的水平见图2。果肉、种子和果皮中ABA含量均有一个峰值(2013年和2014年果肉中176 ng/g(68 d)和199 ng/g(84 d),种子中232 ng/g(28 d)和304 ng/g(38 d),果皮中296 ng/g(68 d)和476 ng/g(73 d))。种子中ABA的水平从坐果开始下降,此后到浆果成熟一直保持在低水平,果肉和果皮中ABA的水平也是从坐果期开始下降,直到转色期开始上升,至转色中期达到最高值,然后开始缓慢下降。

图2 2013年(A)和2014年(B)赤霞珠葡萄果肉、种子、果皮中ABA水平的变化趋势Fig. 2 Changes in ABA contents in Cabernet Sauvignon grape pulp, seeds and skin harvested in 2013 (A) and 2014 (B)
与本实验结果相同,转录组学研究发现,一些ABA合成关键基因的mRNA水平在授粉之后降低,同时ABA降解基因的表达量增加[27]。这可能就是ABA含量在果实发育的早期下降的原因。同时,ABA在果肉和果皮中的含量在坐果初期也很高,但是随着果实的生长发育减少,在转色期之前降低至最小值,这个结果和前人研究结果相同[28]。ABA是一种不仅能调控跃变型果实成熟[10],由于其对花色苷合成的重要作用[8],对非跃变型果实的成熟也很重要的一种激素。赤霞珠葡萄果皮中ABA只有一个峰值,这个唯一的峰值与赤霞珠葡萄的转色有密切关系,这与前人研究中发现的ABA含量在各组织中达到峰值的时间是转色中期是相同的。转色期前,外源ABA的应用加速了糖积累的开始[28-29]。结合图1和图2可以看出,ABA达到峰值的同时,糖含量也在快速增加,这暗示了ABA和蔗糖之间的互作[9,30]。并且ABA可以显著性地影响柑橘中葡萄糖、果糖和总糖含量[31]。这些发现可以解释ABA含量在转色期开始增加,在转色中期达到其最大值。ABA的积累也被认为在调控西红柿成熟和衰老[32],以及在非跃变型果实黄瓜的生长和成熟中起了重要的作用[31]。赤霞珠葡萄种子中ABA的含量从果实生长初期开始降低并一直保持低水平直到浆果成熟时上升了一点(图2)。Kondo等[33]的研究发现,果实中的植物激素都是来自于种子,并且种子中植物激素的含量会影响果肉和果皮中的激素含量。因此,在赤霞珠葡萄浆果转色期前,需要大量ABA来维持赤霞珠葡萄浆果的成熟,因此,种子中的大量ABA被转运至果肉和果皮中。转色期后,浆果果肉和果皮中ABA含量开始下降,这个与Davies等[28]的研究结果相同。ABA在赤霞珠葡萄种子的形成以及赤霞珠葡萄浆果的成熟中起重要作用。
2.2.2 赤霞珠葡萄果肉、种子、果皮在生长发育过程中GA3含量的变化
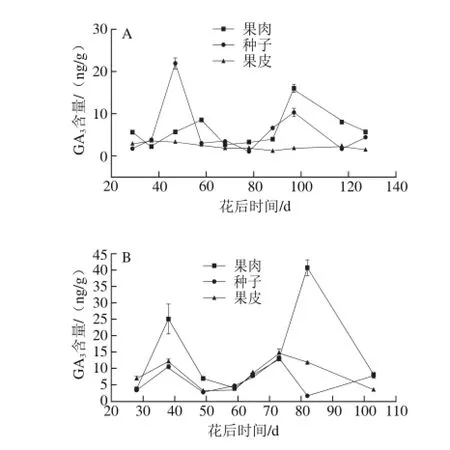
图3 2013年(A)和2014年(B)赤霞珠葡萄果肉、种子、果皮中量的变化趋势Fig. 3 Changes in GA3contents in Cabernet Sauvignon grape pulp, seeds and skin harvested in 2013 (A) and 2014 (B)
果肉和果皮中GA3的含量变化有两个峰值(图3)。特别是2013年GA3含量的第1个峰值出现在花后58 d,第2个峰值出现在花后97 d。同样的,2014年,两个峰值分别出现在花后38 d和82 d。两个峰值分别出现的时期为快速生长期和转色期,并且第1个峰值出现的时期与IAA的峰值出现的时期重合。
GA3促进葡萄浆果的生长,例如诱导浆果增大和穗质量增加[13-14,34]。根据Kong等[35]的研究结果可以看出,外源GA3的应用可以使形成层部位内源IAA含量增加,并且发现,GA3含量被发现是与IAA含量呈正相关(R=0.712,P<0.05)[36]。已经证明,IAA和GA3并不是单独作用,而是一起促进葡萄浆果的生长。这合理解释了GA3含量的第1个峰值与IAA峰值同时出现在果实快速生长期。另一方面,种子和果肉中GA3的含量在转色期增加,但是GA3并没有促进浆果的成熟的作用。根据Fuentes等[37]的研究结果,新合成的赤霉素会造成生长的抑制,这说明赤霉素可能是一个抑制生长的信号调控器。但是抑制生长的机制并不清楚,可能GA3通过降低IAA的含量抑制浆果的生长。因此,这可能是IAA含量在GA3含量开始上升的时候降低了的原因。GA3通过降低呼吸活性、延缓花色苷的合成和叶绿素的降解对草莓浆果的成熟发挥抑制作用[38]。因此,GA3不仅可以抑制成熟,还可以间接地促进成熟,GA3是一种可以调控浆果成熟的激素。
2.2.3 赤霞珠葡萄果肉、种子、果皮在生长发育过程中IAA含量的变化

图4 2013年(A)和2014年(B)赤霞珠葡萄果肉、种子、果皮中IAA含量的变化趋势Fig. 4 Changes in IAA contents in Cabernet Sauvignon grape pulp, seeds and skin harvested in 2013 (A) and 2014 (B)
2013年和2014年IAA的含量变化趋势见图4。果皮和果肉中IAA含量从果实生长期开始上升,并在果实快速生长期达到峰值,在转色初期开始下降。种子中IAA含量从浆果快速生长期开始下降,此后直到浆果成熟期一直保持低水平。
种子中IAA的含量随着浆果的生长一直在下降,这与种子中ABA含量变化趋势是相同的,并且变化的原因也是相同的,激素在种子中合成之后,会被转运到作用器官。本结果中赤霞珠葡萄浆果果肉和果皮中IAA的倒V字型变化趋势与之前的研究中赤霞珠葡萄浆果果肉和果皮中[3]以及栗子叶片中IAA的变化趋势[39]是相似的。IAA抑制葡萄果实的成熟[40-41],人工合成的生长素延迟草莓的成熟[42-43]。这很好地说明了果肉和果皮中IAA的含量在转色期开始下降的原因。种子中IAA的含量在花后20~40 d时高于果肉和果皮中的,但是之后开始下降。这可能因为种子只是生长素的合成器管,不是IAA的作用器官。生长素在种子中被合成,之后被转运到果肉和果皮中促进葡萄浆果的生长[44]。浆果果皮和果肉中IAA含量的峰值与GA3的第1个峰值同时出现,并不是巧合。从Li Xingjun等[25]的研究结果可以发现,外源GA3的使用可以使内源IAA的含量升高,并且有规律的GA合成需要IAA的存在[23],同时GA3参与IAA的信号转导以及转运[45]。很多生长素-GA互作的因子被找到,其中有一个是IAA应答因子(ARF)-SlARF7,这是受精后GA信号途径的一个激活剂,并且控制其表达[27]。IAA和GA在赤霞珠葡萄浆果快速生长期合作地调控浆果的生长。然而,GA3也抑制浆果的生长[27],同时IAA的含量激素下降。可以假设为GA3抑制IAA的合成或者通过与IAA互作调控浆果的成熟,同样的结果在McAtee等[27]的研究里面也可以看到。
2.2.4 赤霞珠葡萄果肉、种子、果皮在生长发育过程中JA含量的变化
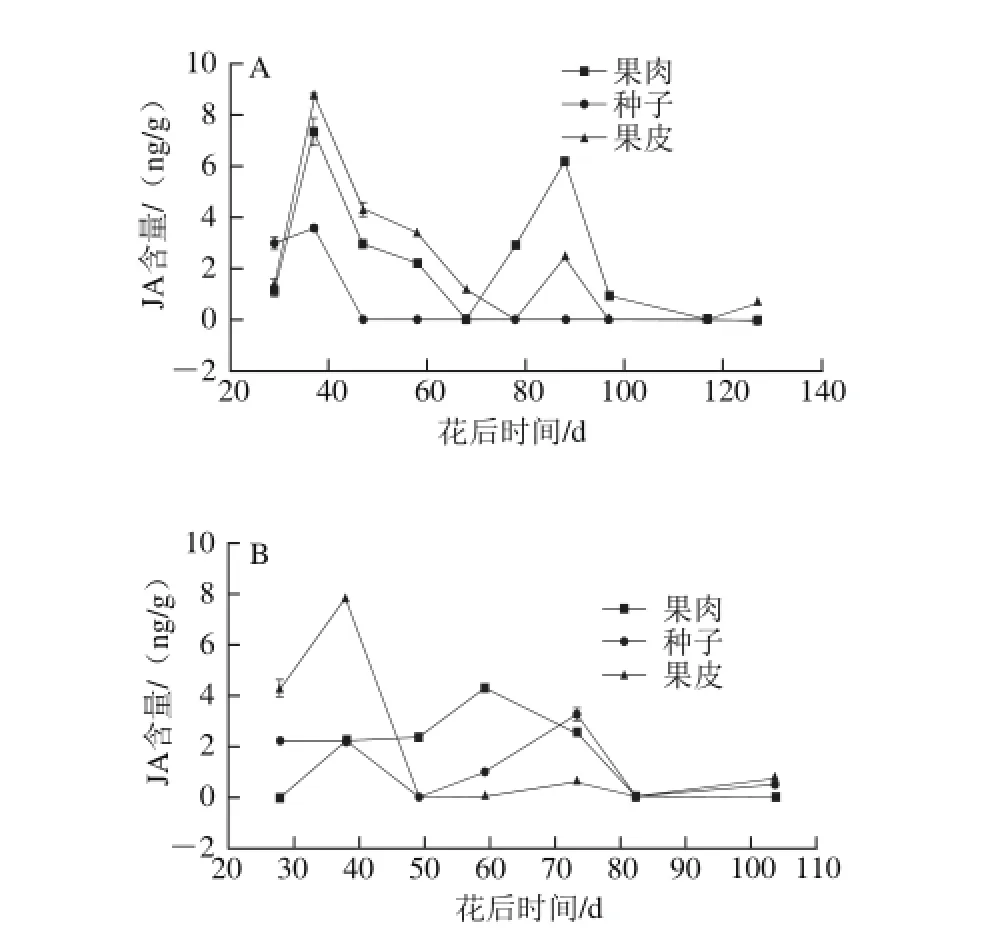
图5 2013年(A)和2014年(B)赤霞珠葡萄果肉、种子、果皮中JA含量的变化趋势Fig. 5 Changes in JA contents in Cabernet Sauvignon grape pulp, seeds and skin harvested in 2013 (A) and 2014 (B)
由图5可知,JA的含量有两个峰值,并且最高值出现在浆果的快速生长期,第2个峰值出现在转色初期。2013年种子中JA的含量从果实生长期开始下降至0,但是在2014年,种子中JA含量在转色期有一个峰值。
JA含量的第一个峰值出现的时间是浆果的快速生长期,这与Kondo等[46]的研究结果相似,其结果显示JA在快速生长期大量积累,这可能与细胞分裂有关。同时,之前的研究结果表明,低水平的JA可能影响细胞分裂[33]。赤霞珠葡萄浆果果皮和果肉中JA含量在浆果成熟开始时(也称为转色期)增长,这说明JA可能参与浆果的成熟。茉莉酸甲酯可能促进西红柿和苹果的成熟及其转色[26],此外,JA与光照结合可以提高葡萄悬浮细胞中花色苷的生物合成[47]。茉莉酸甲酯可以通过影响花色苷和成、细胞壁修饰和乙烯与JA的合成促进草莓的成熟[18]。然而,很多研究表明,茉莉酸甲酯可能延缓或者抑制草莓的成熟[19]。JA含量从转色期开始增加(图5),这说明,JA可能促进浆果成熟。同时,ABA也可以促进葡萄果皮上花色苷的积累[8]。Wang Shanshan等[36]的研究表明,JA的前体物质素馨酮可以激发ABA合成基因并提高内源ABA含量。并且茉莉酸甲酯含量的增加可以激活SDR基因的表达,最终导致高水平ABA积累[48]。这些充分说明,JA可以和ABA互作促进浆果的成熟,这与Zhang Yajian[9]的研究结果类似,即JA在柑橘果实的成熟过程中发挥重要作用,并且可能与ABA和蔗糖有互相作用。
2.2.5 赤霞珠葡萄果肉、种子、果皮在生长发育过程中SA含量的变化
2013年和2014年赤霞珠葡萄浆果果皮、果肉和种子中SA的含量见图6,3 个组织中的SA含量均在浆果第一个快速生长期开始上升,并于转色初期前开始下降,峰值出现在快速生长中期。

图6 2013年(A)和2014年(B)赤霞珠葡萄果肉、种子、果皮中SA含量的变化趋势Fig. 6 Changes in SA contents in Cabernet Sauvignon grape pulp, seeds and skin harvested in 2013 (A) and 2014 (B)
SA可以通过诱导抗氧化酶,例如过氧化物酶、过氧化氢酶以及超氧化物歧化酶,降低脂氧合酶活性延迟香蕉的成熟[49]。而SA处理可以抑制乙烯的产生、呼吸以及衰老。并且,转色2~3 周之前给西拉葡萄中注射SA可以延迟果皮颜色积累并且可能延迟葡萄浆果成熟[21]。同时,SA在特定生长期可以通过激活FLS活性调控黄酮醇的生物合成[44]。SA在赤霞珠葡萄浆果生长过程中的作用还存在争议,且SA在非跃变型果实的成熟过程中的作用不明确[28]。从图4和图6可以看出,两年中果肉和果皮中SA含量的变化趋势与IAA含量的变化趋势相似,但是种子中的两种激素变化是不同的。不同于IAA含量在增长期下降,种子中SA的含量和果皮和果肉中SA含量一样,有峰值。相同的变化趋势以及峰值时期说明,SA可能与IAA和GA3具有相似的作用。
2.3 赤霞珠葡萄浆果中激素与生化指标以及激素之间的相关性分析

表2 葡萄浆果中植物激素含量与理化指标之间的相关性分析Table 2 Correlation analysis between hormones and physiological properties in grape berries
由表2可知,2013年,果皮中GA3含量、种子中IAA含量、以及种子和果皮中JA含量都与浆果中还原糖含量显著负相关(P<0.05)。还原糖含量随着葡萄浆果的成熟而增加,并且,IAA可以抑制浆果的成熟,因此,IAA间接地抑制浆果中还原性糖的合成。GA3与IAA协同作用促进浆果的生长,其与IAA对赤霞珠葡萄浆果的生长具有类似的效果,因此,GA3也间接抑制浆果中糖的合成。果皮中GA3含量以及种子和果皮中IAA和JA含量与赤霞珠葡萄浆果中可滴定酸含量有显著的正相关性(P<0.05),可滴定酸含量随着浆果的成熟逐渐降低,和IAA峰值之后的变化趋势类似,类似的相关性在2014年也能看到。果皮中GA3的含量以及种子和果皮中IAA和JA含量与浆果百粒质量有显著的负相关性(P<0.05)。浆果百粒质量随着浆果的生长过程逐渐增加并且被类似IAA、GA3和SA之类的植物激素所诱导。2014年的浆果指标与激素之间以及激素之间的相关性不及2013年的相关性显著。
从表2可以看出,2013年果皮中GA3含量与还原糖含量以及果实百粒质量具有负相关性,但是与可滴定酸含量具有正相关性。并且2013年种子中IAA含量也是与还原糖含量以及百粒质量具有负相关性,与可滴定酸含量具有正相关性。JA恰巧与GA3和IAA相似。
植物激素在调控植物生长发育过程中有着极其复杂的互作,然而也是动态稳定的。2013年和2014年赤霞珠葡萄浆果果皮、果肉和种子中植物激素之间以及激素的比值之间的相关性系数分别见表3和表4。由表3可以看出,2013年赤霞珠葡萄种子中ABA含量与IAA含量及JA含量具有显著的正相关性(P<0.05,P<0.01),果肉中JA含量与GA3的含量具有显著的正相关性(P<0.01),种子中JA含量也与IAA含量具有显著的正相关性(P<0.05)。此外,种子中SA的含量与GA3含量具有极显著正相关性(P<0.01),果皮中SA的含量与IAA含量具有极显著的正相关性(P<0.01)。

表3 2013年植物激素及其比值之间的相关性系数Table 3 Correlation coeff i cient between plant hormones and hormone ratio in grape berries harvested in 2013
在赤霞珠葡萄浆果的生长发育过程中,浆果中植物激素是平衡的,成熟调控激素和生长调控激素之间的比值可以表示为成熟因子。从表4可以看出,这些比值与各组织中ABA含量具有显著性的正相关系数,但是表4中,2014年赤霞珠葡萄果肉和种子中ABA含量和ABA/GA3之间的相关性不显著。2013年JA作为一个成熟调控激素,其在种子中的含量与ABA/GA3、ABA/(IAA+GA3)和(ABA+ JA)/(IAA+GA3+SA)这些比值之间都存在极显著的正相关(P<0.01)。而2014年果皮中SA的含量也与ABA/IAA和ABA/(IAA+GA3+SA)这两个比值之间存在显著性的正相关性(P<0.05)。此外,果皮中GA3含量与ABA/IAA有显著的正相关性(P<0.05)。
从图2和图4可以看出,种子中ABA和IAA的含量从赤霞珠葡萄浆果的快速生长期开始下降,两者的变化趋势是一致的,因此,两者呈显著性正相关性。GA3与IAA可以合作地促进浆果生长[24-25],并且IAA可以诱导GA3合成[25]。另一方面,外源GA3可以增加内源IAA的含量[24]。表3结果表明2013年果皮中IAA含量与GA3含量具有显著的正相关性(P<0.05),这与前人的研究结果相同。JA及其衍生物不仅参与果实成熟的过程[9,26],例如花色苷积累和细胞壁修饰。这可能与其诱导ABA合成并与ABA和乙烯互作有关。同时另一方面,低水平的JA可以影响细胞分裂,这说明JA可能参与赤霞珠葡萄浆果中细胞的分裂[33]。目前为止,SA对于非跃变型果实的作用还存在争议。一方面,SA可以加速葡萄浆果成熟3~5 d,另一方面,SA可以抑制衰老,乙烯的生成和呼吸。尽管如此,从图6可以看出,SA在各组织中的含量在浆果快速生长期达到峰值,这说明SA可能调控葡萄浆果的生长。总的来说,可以将GA3、IAA和SA定义为生长调控激素,同时定义ABA和JA为成熟调控激素。2013年和2014年的激素比值之间都显著正相关,这说明激素之间是平衡的。

表4 2014年植物激素及其比值之间的相关性系数Table 4 Correlation coeff i cient between plant hormones and hormone ratio in grape berries harvested in 2014
3 结 论
本实验研究了赤霞珠葡萄浆果生长发育过程中组织里植物激素的变化趋势及其与赤霞珠葡萄成熟度的关系。阐明了赤霞珠葡萄果皮和果肉中IAA、GA3、SA和JA含量从第1个快速生长期开始上升,并在转色期前开始下降,说明这些激素促进赤霞珠葡萄浆果的生长。ABA、GA3和JA从转色期开始上升,并在转色中期开始缓慢下降,种子中ABA含量从坐果期开始下降,此后一直保持在低水平,这说明这些激素与赤霞珠葡萄浆果的转色以及成熟有关。此外,种子中IAA、ABA、GA3和JA含量均从第1次快速生长期开始下降,此后一直保持在最低水平,这可能因为激素的合成器官是种子,但是作用器官不是种子,因此,激素在种子中合成之后,被转运到其他作用器官中。
[1] ALI K, MALTESE F, CHOI Y H, et al. Metabolic constituents of grapevine and grape-derived products[J]. Phytochemistry Reviews: Proceedings of the Phytochemical Society of Europe, 2010, 9(3): 357-378. DOI:10.1007/s11101-009-9158.
[2] SALAZAR P C, AGUIRREOLEA J, SÁNCHEZ-DÍAZ M, et al. Effects of climate change scenarios on Tempranillo grapevine (Vitis vinifera L.) ripening: response to a combination of elevated CO2and temperature, and moderate drought[J]. Plant and Soil, 2010, 337(1/2): 179-191. DOI:10.1007/s11104-010-0514-z.
[3] GOUTHU S, DELUC L G. Timing of ripening initiation in grape berries and its relationship to seed content and pericarp auxin levels[J]. BMC Plant Biology, 2015, 15: 46. DOI:10.1186/s12870-015-0440-6.
[4] XU Fan, XI Zhumei, ZHANG Hui, et al. Brassinosteroids are involved in controlling sugar unloading in Vitis vinifera ‘Cabernet Sauvignon’berries during veraison[J]. Plant Physiology and Biochemistry, 2015, 94: 197-208. DOI:10.1016/j.plaphy.2015.06.005.
[5] SANTNER A, CALDERON-VILLALOBOS L I A, ESTELLE M. Plant hormones are versatile chemical regulators of plant growth[J]. National Chemistry Biology, 2009, 5(5): 301-307. DOI:10.1038/ nchembio.165.
[6] CHIBA Y, SHIMIZU T, MIYAKAWA S, et al. Identification of Arabidopsis thaliana NRT1/PTR FAMILY (NPF) proteins capable of transporting plant hormones[J]. Journal of Plant Research, 2015, 128(4): 679-686. DOI:10.1007/s10265-015-0710-2.
[7] YAMAGUCHI-SHINOZAKI K, SHINOZAKI K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annual Review of Plant Biology, 2006, 57: 781-803. DOI:10.1146/annurev.arplant.57.032905.105444.
[8] FERRARA G, MAZZEO A, MATARRESE A M S, et al. Application of abscisic acid (S-ABA) and sucrose to improve colour, anthocyanin content and antioxidant activity of cv. Crimson Seedless grape berries[J]. Australian Journal of Grape and Wine research, 2015, 21(1): 18-29. DOI:10.1111/ajgw.12112.
[9] ZHANG Yajian, WANG Xingjian, WU Juxun, et al. Comparative transcriptome analyses between a spontaneous late-ripening sweet orange mutant and its wild type suggest the functions of ABA, sucrose and JA during citrus fruit ripening[J]. PLoS ONE, 2014, 9(12): e116056. DOI:10.1371/journal.pone.0116056.
[10] SUN Yufei, CHEN Pei, DUAN Chaorui, et al. Transcriptional regulation of genes encoding key enzymes of abscisic acid metabolism during melon (Cucumis melo L.) fruit development and ripening[J]. Journal of Plant Growth Regulation, 2012, 32(2): 233-244. DOI:10.1007/s00344-012-9293-5.
[11] MARTINEZ-DE L C E, GARCIA-RAMIREZ E, VAZQUEZ-RAMOS J M, et al. Auxins differentially regulate root system architecture and cell cycle protein levels in maize seedlings[J]. Journal of Plant Physiology, 2015, 176: 147-156. DOI:10.1016/j.jplph.2014.11.012.
[12] BÖTTCHER C, HARVEY K E, BOSS P K, et al. Ripening of grape berries can be advanced or delayed by reagents that either reduce or increase ethylene levels[J]. Functional Plant Biology, 2013, 40(6): 566. DOI:10.1071/fp12347.
[13] CHAI L, LI Y, CHEN S, et al. RNA sequencing reveals high resolution expression change of major plant hormone pathway genes after young seedless grape berries treated with gibberellin[J]. Plant Science, 2014, 229: 215-224. DOI:10.1016/j.plantsci.2014.09.010.
[14] ÖZER C, YASASIN A S, ERGONUL O, et al. The effects of berry thinning and gibberellin on Recel Uzumu table grapes[J]. Pakistan Journal of Scientif i c Research, 2012, 49(2): 105-112.
[15] WANG Zeng, ZHAO Fengxia, ZHAO Xiao, et al. Proteomic analysis of berry-sizing effect of GA3on seedless Vitis vinifera L.[J]. Proteomics, 2012, 12(1): 86-94. DOI:10.1002/pmic.201000668.
[16] TIAN Shufen, WANG Yong, DU Gang, et al. Changes in contents and antioxidant activity of phenolic compounds during gibberellin-induced development in Vitis vinifera L. ‘Muscat’[J]. Acta Physiologiae Plantarum, 2011, 33(6): 2467-2475. DOI:10.1007/s11738-011-0791-z.
[17] USHA K, KASHYAP D, SINGH B. Inf l uence of gibberellic acid and N6-benzyladenine on the development of seed and shot berries in the seedless grape (Vitis vinifera L.) cv. Perlette[J]. Austrilia Journal of Agricultural Research, 2005, 56(9): 1009-1016. DOI:10.1071/ AR04202_CO.
[18] CONCHA C M, FIGUEROA N E, POBLETE L A, et al. Methyl jasmonate treatment induces changes in fruit ripening by modifying the expression of several ripening genes in Fragaria chiloensis fruit[J]. Plant Physiology Biochemistry, 2013, 70: 433-444. DOI:10.1016/ j.plaphy.2013.06.008.
[19] PREUSS A, AUGUSTIN C, FIGUEROA C R, et al. Expression of a functional jasmonic acid carboxyl methyltransferase is negatively correlated with strawberry fruit development[J]. Journal of Plant Physiology, 2014, 171(15): 1315-1324. DOI:10.1016/ j.jplph.2014.06.004.
[20] CHAN Z L, QIN G Z, XU X B, et al. Proteome approach to characterize proteins induced by antagonist yeast and salicylic acid in peach fruit[J]. Journal of Proteome Research, 2007, 6(5): 1677-1688. DOI:10.1021/pr060483r.
[21] KRAEVA E, ANDARY C, CARBONNEAU A, et al. Salicylic acid treatment of grape berries retards ripening[J]. Vitis, 1998, 37(3): 143-144.
[22] CHAMPA W A, GILL M I, MAHAJAN B V, et al. Preharvest salicylic acid treatments to improve quality and postharvest life of table grapes (Vitis vinifera L.) cv. Flame Seedless[J]. Journal of Food Science and Technology, 2015, 52(6): 3607-3616. DOI:10.1007/ s13197-014-1422-7.
[23] WOLBANG C M, CHANDLER P M, SMITH J J, et al. Auxin from the developing inflorescence is required for the biosynthesis of active gibberellins in barley stems[J]. Plant Physiology, 2004, 134(2): 769-776. DOI:10.1104/pp.103.030460.
[24] SATA S, GOKANI S, THAKER V. Influence of gibberellic acid on auxin biosynthesis and their effects on coleoptile elongation in garlic[J]. Acta Physiologiae Plant, 2002, 24(4): 393-398. DOI:10.1007/ s11738-002-0035-3.
[25] LI Xingjun, LI Sanyu, LIN Jinxing. Effect of GA3spraying on lignin and auxin contents and the correlated enzyme activities in bayberry (Myrica rubra Bieb.) during fl ower-bud induction[J]. Plant Science, 2003, 164(4): 549-556. DOI:10.1016/S0168-9452(03)00004-9.
[26] FAN Xuetong, MATTHEIS J P, FELLMAN J K. A role for jasmonates in climacteric fruit ripening[J]. Planta,1998, 204(4): 444-449. DOI:10.1007/s004250050278.
[27] MCATEE P, KARIM S, SCHAFFER R, et al. A dynamic interplay between phytohormones is required for fruit development, maturation, and ripening[J]. Frontiers in Plant Science, 2013, 4: 79.
[28] DAVIES C, BÖTTCHER C. Hormonal control of grape berry ripening[M]. Berlin: Springer Netherlands, 2009: 229-261.
[29] KUHN N, GUAN L, DAI Z, et al. Berry ripening: recently heard through the grapevine[J]. Journal of Experimental Botany, 2014, 65(16): 4543-4559. DOI:10.1093/jxb/ert395.
[30] FALCHI R, ZANON L, de MARCO F, et al. Tissue-specific and developmental expression pattern of abscisic acid biosynthetic genes in peach fruit: possible role of the hormone in the coordinated growth of seed and mesocarp[J]. Journal of Plant Growth Regulation, 2013, 32(3): 519-532. DOI:10.1007/s00344-013-9318-8.
[31] WANG Yanping, WANG Ya, JI Kai, et al. The role of abscisic acid in regulating cucumber fruit development and ripening and its transcriptional regulation[J]. Plant Physiology and Biochemistry, 2013, 64: 70-79. DOI:10.1016/j.plaphy.2012.12.015.
[32] ZHANG Mei, YUAN Bing, LENG Ping. The role of ABA in triggering ethylene biosynthesis and ripening of tomato fruit[J]. Journal of Experimental Botany, 2009, 60(6): 1579-1588. DOI:10.1093/jxb/ erp026.
[33] KONDO S, FUKUDA K. Changes of jasmonates in grape berries and their possible roles in fruit development[J]. Scientia Horticulturae, 2001, 91(3): 275-288. DOI:10.1016/S0304-4238(01)00271-0.
[34] MARZOUK H A, KASSEM H A. Improving yield, quality, and shelf life of Thompson seedless grapevine by preharvest foliar applications[J]. Scientia Horticulturae, 2011, 130(2): 425-430. DOI:10.1016/j.scienta.2011.07.013.
[35] KONG L S, ABRAMS S R, OWEN S J, et al. Phytohormones and their metabolites during long shoot development in Douglas-fir following cone induction by gibberellin injection[J]. Tree Physiol, 2008, 28(9): 1357-1364. DOI:10.1093/treephys/28.9.1357.
[36] WANG S S, TAKAHASHI H, SAITO T, et al. Jasmonate application influences endogenous abscisic acid, jasmonic acid and aroma volatiles in grapes infected by a pathogen (Glomerella cingulata)[J]. Scientia Horticulturae, 2015, 192: 166-172. DOI:10.1016/ j.scienta.2015.06.001.
[37] FUENTES S, LJUNG K, SOREFAN K, et al. Fruit growth in Arabidopsis occurs via DELLA-dependent and DELLA-independent gibberellin responses[J]. The Plant Cell, 2012, 24(10): 3982-3996. DOI:10.1105/tpc.112.103192.
[38] MARTINEZ G, CHAVES A, ANON M. Effect of gibberellic acid on ripening of strawberry fruits (Fragaria annanassa Duch.)[J]. Journal of Plant Growth Regulation, 1994, 13(2): 87-91. DOI:10.1007/ BF00210952.
[39] LIU Tao, HU Yunqian, LI Xiaoxian. Comparison of dynamic changes in endogenous hormones and sugars between abnormal and normal Castanea mollissima[J]. Progress in Natural Science, 2008, 18(6): 685-690. DOI:10.1016/j.pnsc.2008.03.001.
[40] DAVIES C, NICHOLSON E L, BOTTCHER C, et al. Shiraz wines made from grape berries (Vitis vinifera) delayed in ripening by plant growth regulator treatment have elevated rotundone concentrations and “pepper” fl avor and aroma[J]. Journal of Agricultural and Food Chemistry, 2015, 63(8): 2137-2144. DOI:10.1021/jf505491d.
[41] SYMONS G M, CHUA Y J, ROSS J J, et al. Hormonal changes during non-climacteric ripening in strawberry[J]. Journal of Experimental Botany, 2012, 63(13): 4741-4750. DOI:10.1093/jxb/ers147.
[42] MANNING K. Changes in gene-expression during strawberry fruit ripening and their regulation by auxin[J]. Planta, 1994, 194(1): 62-68.
[43] GIVEN N K, VENIS M A, GIERSON D. Hormonal regulation of ripening in the strawberry, a non-climacteric fruit[J]. Planta, 1988, 174(3): 402-406. DOI:10.1007/BF00959527.
[44] DEKKERS B J W, BENTSINK L. Regulation of seed dormancy by abscisic acid and DELAY OF GE RMINATION 1[J]. Seed Science Research, 2015, 25(2): 82-98. DOI:10.1017/S0960258514000415.
[45] LI G, ZHU C, GAN L, et al. GA(3) enhances root responsiveness to exogenous IAA by modulating auxin transport and signalling in Arabidopsis[J]. Plant Cell Reports, 2015, 34(3): 483-494. DOI:10.1007/s00299-014-1728-y.
[46] KONDO S, MOTOYAMA M, MICHIYAMA H, et al. Roles of jasmonic acid in the development of sweet cherries as measured from fruit or disc samples[J]. Plant Growth Regulation, 2002, 37(1): 37-44. DOI:10.1023/A:1020362926829.
[47] ZHANG W, CURTIN C, KIKUCHI M, et al. Integration of jasmonic acid and light irradiation for enhancement of anthocyanin biosynthesis in Vitis vinifera suspension cultures[J]. Plant Science, 2002, 162(3): 459-468. DOI:10.1016/S0168-9452(01)00586-6.
[48] LIU Z, ZHANG S, SUN N, et al. Functional diversity of jasmonates in rice[J]. Rice, 2015, 8(1): 42. DOI:10.1186/s12284-015-0042-9.
[49] SRIVASTAVA M K, DWIVEDI U N.Delayed ripening of banana fruit by salicylic acid[J]. Plant Science, 2000, 158(1/2): 87-96. DOI:10.1016/S0168-9452(00)00304-6.
Changes in Endogenous Hormones during the Development of Vitis vinifera L. cv. Cabernet Sauvignon and Their Relationship with Berry Ripening
GAO Jiangman1, MENG Ying1, LIU Qing1, WANG Tongmeng1, LIU Meiying1, LI Wenbing1, XI Zhumei1,2,*, ZHANG Zhenwen1,2
(1. College of Enology, Northwest A&F University, Yangling 712100, China; 2. Shaanxi Engineering Research Center for Viti-Viniculture, Yangling 712100, China)
To investigate the changes in endogenous hormone contents of various berry tissues during the development of Vitis vinifera L. cv. Cabernet Sauvignon and further to examine their relationship with berry ripening, abscisic acid (ABA), indole acetic acid (IAA), gibberellin A3(GA3), jasmonic acid (JA) and salicylic acid (SA) in grape seeds, skin and pulp were determined by high-performance liquid chromatography-tandem mass spectrometry (HPLC-MS/MS). The results indicated that the variation of ABA in grape pulp and skin showed a double S-shaped trend during the development of grape berries. At 20 days after anthesis (20 DAA), the ABA level was relatively high, and the ABA levels in pulp and skin decreased before veraison, and then increased until the middle of veraison, followed by a slow decrease until ripening. GA3and JA were changed in a similar pattern. Both of them fi rst increased rapidly followed by a decrease at the fruit expansion stage and then showed a bell-shaped trend during veraison. IAA contents in grape pulp and skin fi rst decreased slightly followed by a rapid increase until reaching a peak during the rapid developmental stage of grape berries, and then gradually decreased and remained stable during the subsequent veraison. IAA contents in grape seeds were high before the beginning of the fruit expansion stage, and then declined and remained at a low level after entering the fruit expansion stage. Similar changes were observed for SA. Conclusion: ABA, GA3and JA were related to the ripening of Cabernet Sauvignon, while IAA, GA3, SA and JA were related to the development of Cabernet Sauvignon.
hormones; grape; regulation; ripening; skin; pulp; seed
10.7506/spkx1002-6630-201707027
TS255.2
A
1002-6630(2017)07-0167-09
2016-05-09
国家现代农业(葡萄)产业技术体系建设专项(CARS-30-zp-9);陕西省自然科学基金项目(2011JM3004)
高江曼(1989—),女,硕士研究生,研究方向为葡萄生理。E-mail:gjm269869490@163.com
*通信作者:惠竹梅(1969—),女,教授,博士,研究方向为葡萄学。E-mail:xizhumei@nwsuaf.edu.cn
高江曼, 孟莹, 刘庆, 等. 赤霞珠葡萄生长发育过程中内源激素的变化及其与果实成熟的关系[J]. 食品科学, 2017, 38(7): 167-175. DOI:10.7506/spkx1002-6630-201707027. http://www.spkx.net.cn
GAO Jiangman, MENG Ying, LIU Qing, et al. Changes in endogenous hormones during the development of Vitis vinifera L. cv. Cabernet Sauvignon and their relationship with berry ripening[J]. Food Science, 2017, 38(7): 167-175. (in Chinese with English abstract)
10.7506/spkx1002-6630-201707027. http://www.spkx.net.cn
