症状性颈动脉狭窄患者延长双联抗血小板治疗临床观察
2017-04-25刘昌云陈龙飞陈枝挺熊文婷林汉斌黄华品
刘昌云, 陈龙飞, 陈枝挺, 熊文婷, 林汉斌, 黄华品
症状性颈动脉狭窄患者延长双联抗血小板治疗临床观察
刘昌云1, 陈龙飞2, 陈枝挺1, 熊文婷1, 林汉斌1, 黄华品1
目的 探讨双联抗血小板时间对症状性颈动脉狭窄患者缺血性卒中复发和动脉斑块活动性的影响。 方法 症状性颈动脉狭窄患者95例,根据发病后双联抗血小板的持续时间,分为短期双联抗血小板(SD)组(疗程<1月)67例及延长双联抗血小板(PD)组(疗程>3月)28例,2组患者的临床资料、MES、血清MMP-7和hs-CRP水平等基线数据的差别无统计学意义。分析并比较2组患者经双联抗血小板治疗后,脑卒中复发、出血并发症、经颅多普勒超声检测微栓子(MES)、血清基质金属蛋白酶-7(MMP-7)和超敏C反应蛋白(hs-CRP)水平的差别。 结果 (1)随访6月后,SD组的MES阳性率及血清MMP-7、hs-CRP水平分别为(38.8%,26/67),(17.35±0.95)μg/L和(13.74±1.41)mg/L,均低于入院时水平(P<0.05);PD组的MES阳性率及血清MMP-7、hs-CRP水平分别为(17.9%,5/28),(16.94±0.62)μg/L和(13.05±1.03)mg/L,均低于入院时水平(P<0.05),且均低于SD组(P<0.05)。(2)随访1年后,2组的脑梗死或短暂性脑缺血发作复发和出血并发症的差别无统计学意义(P>0.05)。 结论 PD治疗可减少症状性颈动脉狭窄患者的MES,可能有利于降低缺血性卒中的复发率。
颈动脉狭窄; 卒中; 栓子清除术; 超声检查,多普勒,经颅; 生物学标记; 血小板聚集抑制剂
颈动脉狭窄是缺血性卒中的主要病因之一,其发病机制为斑块脱落形成栓子,引起远端动脉栓塞或严重狭窄,造成低灌注,导致缺血性卒中的发生。因此,各国指南均推荐,狭窄程度>50%的症状性颈动脉狭窄(symptomatic carotid stenosis, SCS)的患者可以行颈动脉内膜剥脱术或颈动脉成形支架术[1-2]。但部分患者由于颈动脉病变特殊不适合手术、存在手术治疗禁忌证或担心手术风险等原因,拒绝手术治疗。强化药物治疗成为这部分患者预防缺血性卒中的重要措施。但对于此类患者应给予多久的强化抗血小板治疗才能获得最大收益尚有待进一步研究。
动脉粥样硬化斑块的稳定性是影响缺血性卒中复发的重要因素。临床常通过影像随访和炎症标记物监测等方法进行评估。经颅多普勒超声(transcranial doppler, TCD)检查是一项无创性、可床旁进行的脑血流检测技术,是目前检测血流中血小板或血栓碎片的唯一方法[3]。微栓子(microembolic signals, MES)检测技术简便易行且花费少,便于观察MES的数量变化。多项研究均提示,MES的阳性率可有效地预测SCS患者缺血性事件再发的风险[4-5]。此外,多种炎症因子参与动脉粥样硬化的形成过程,包括超敏C反应蛋白(hypersensitive C-reactive protein, hs-CRP)、基质金属蛋白酶(matrix metalloproteinase, MMP)、白细胞介素和选择素等[6]。临床上判断动脉粥样硬化性病变活动性的常用方法是监测炎症因子。本研究对SCS患者进行横断面研究,探讨强化抗血小板治疗时间对缺血性卒中复发、出血性并发症、MES阳性率和血清炎症因子水平的影响,报道如下。
1 对象与方法
1.1 对象 收集2009年10月-2014年1月在福建医科大学附属协和医院和附属第一医院神经内科住院的伴颈动脉狭窄的新发脑梗死或短暂性脑缺血发作(transient ischemic attack, TIA)患者95例,男性62例,女性33例,年龄(65.1±4.7)岁(57~74岁)。入组标准:年龄>18岁,颈动脉狭窄>50%且新发脑梗死或TIA与颈动脉狭窄相关,无法或拒绝行动脉内膜剥脱术或颈动脉成形支架术治疗。排除标准:CT检查发现脑梗死出血转化、梗死体积超过大脑中动脉分布区的1/3、NIHSS评分>12分、TCD检测时颞窗不能探测、对阿司匹林或氯吡格雷过敏或禁忌、心房颤动或心脏瓣膜病变、合并恶性肿瘤、自身免疫性疾病、血液系统疾病、严重肝肾功能损害、严重消化道出血病史。
1.2 方法
1.2.1 分组 患者发病后均给予抗血小板和他汀类药物强化降脂维持治疗。根据患者发病后双联抗血小板治疗的持续时间,将95例患者分为短期双联抗血小板(short term dual antiplatelet therapy, SD)组(阿司匹林联合氯吡格雷抗血小板时间<1月)和延长双联抗血小板(prolonged dual antiplatelet therapy, PD)组(阿司匹林联合氯吡格雷抗血小板时间>3月),2组患者入组时的各项临床资料比较,差别无统计学意义(表1)。
表1 SD组和PD组患者基本临床资料比较
Tab 1 Comparison of basic clinical data in the SD group and the PD group
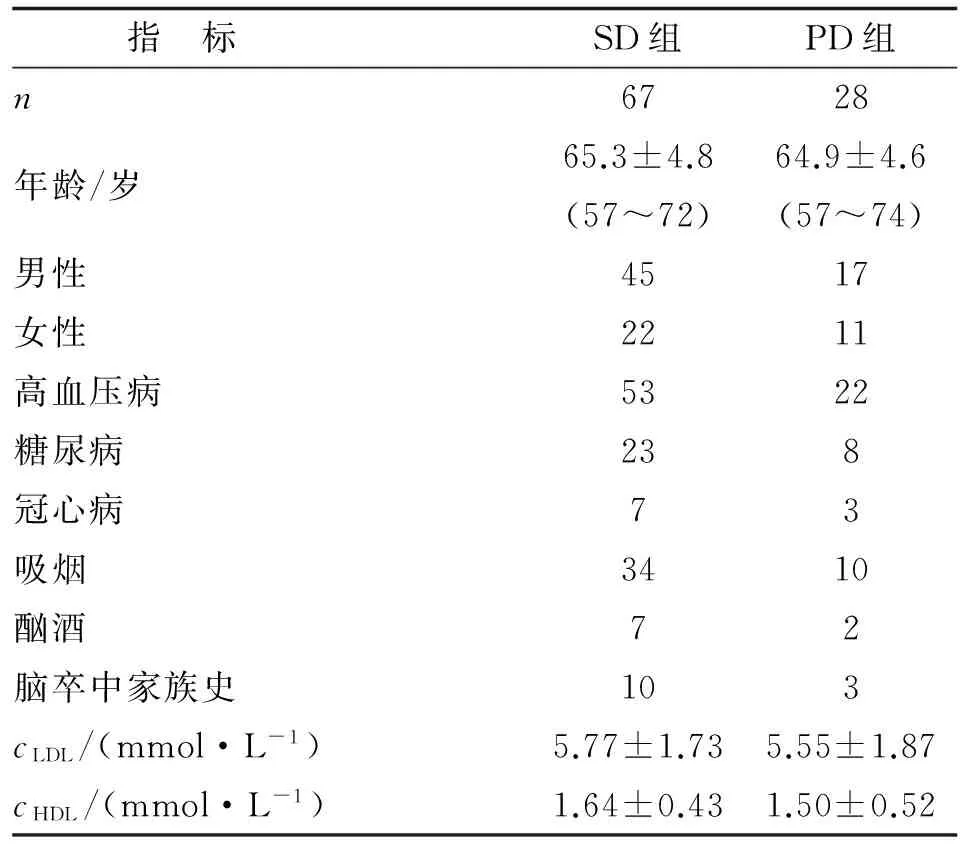
指 标SD组PD组n6728年龄/岁65.3±4.8(57~72)64.9±4.6(57~74)男性4517女性2211高血压病5322糖尿病238冠心病73吸烟3410酗酒72脑卒中家族史103cLDL/(mmol·L-1)5.77±1.735.55±1.87cHDL/(mmol·L-1)1.64±0.431.50±0.52
表中除年龄、LDL和HDL外,余为n. SD:短期双联抗血小板组;PD:延长双联抗血小板组; LDL:低密度脂蛋白胆固醇; HDL:高密度脂蛋白胆固醇.
1.2.2 收集一般资料 包括年龄、性别、吸烟、酗酒、高血压病、糖尿病、冠状动脉粥样硬化性心脏病、TIA或脑卒中家族史及血脂水平等。记录随访期间患者再发脑梗死或TIA、脑出血以及消化道出血情况。
1.2.3 检测MES SD组和PD组分别于患者入组后3 d内和6月时进行MES检测。采用TCD检测仪(德国DWL公司),以头架固定2 MHz脉冲探头于颞窗,调整探测方向及深度,以获得双侧大脑中动脉最佳血流信号,探测深度为45~65 mm,调节发射功率和增益至最清晰多普勒频谱,在狭窄颈动脉侧的大脑中动脉处检测30 min。双深度探头取样容积为10 mm,深度差≤12 mm,探测阈值10~30 dB。由2名有经验的TCD医师随机监测实时检测过程,并记录栓子信号。MES诊断标准参照2016年的《中国脑血管超声临床应用指南》[3]:(1)短时程,持续时间取决于MES通过TCD取样容积的时间,通常短于300 ms。(2)高强度,信号强度通常高出背景血流信号3 dB或以上,取决于单个MES的特性。(3)单方向,与血流方向一致出现于血流频谱中。(4)MES伴有尖锐“鸟鸣”、“哨音”或“呻吟”的高音频信号,取决于仪器和MES的速度。
1.2.4 血清MMP-7及hs-CRP检测 SD组和PD组分别于患者入组后3 d内和6月时清晨抽取肘静脉血4 mL,3 000 r/min离心10 min,离心半径6 cm,分离血清后置冰箱备用。检测血清MMP-7和hs-CRP水平,采用ELISA试剂盒(美国USCN LIFE公司),检测过程严格按照试剂盒说明规范操作。
1.2.5 随访情况 采取门诊复诊或电话随访的方式进行随访追踪,以发病后1年为随访结束时间。

2 结 果
2.1 MES阳性率 入院时,SD组与PD组的MES阳性率比较差别无统计学意义。发病6月后,2组患者的MES阳性率均低于入院时水平(P<0.05),且PD组低于SD组(P<0.05),具体见表2。
2.2 MMP-7和hs-CRP 入院时,SD组与PD组的血清MMP-7和hs-CRP水平比较差别均无统计学意义。发病6月后,2组患者的血清MMP-7和hs-CRP水平均低于入院时水平(P<0.05),且PD组均低于SD组(P<0.05),具体见表2。
2.3 并发症 随访1年后,2组患者在脑梗死或TIA复发、脑出血和消化道出血方面的比较,差别无统计学意义(表2)。
3 讨 论
手术治疗、积极的药物治疗和危险因素控制是预防SCS相关缺血事件的主要手段[7]。在临床工作中,对于不能进行颈动脉支架治疗或内膜剥脱手术的SCS患者,积极的药物治疗就显得尤为重要。由于长期抗血小板治疗存在潜在的消化道出血和颅内出血等风险,因此采用何种治疗方案才能获得最大的获益/风险比,一直是各国学者关注的重点。
双联抗血小板治疗比单一抗血小板治疗可更加有效地降低SCS再发缺血性卒中的风险。Bhatt等对15 603例存在心脑血管病变或多发危险因素的患者进行SCS亚组分析发现,双联抗血小板治疗对比单用阿司匹林能够更有效预防再发心脑血管缺血事件,可以获得更高的获益/风险比[8]。Markus等将107例SCS患者随机分为双联抗血小板组和单用抗血小板组,观察2组患者在卒中后第1周的缺血事件发生率,发现56例单用抗血小板的患者中,发生了4例脑梗死以及7例TIA,而51例双联抗血小板的患者中,仅发生了2例TIA[9]。然而,长期应用双联抗血小板治疗也同时增加了出血并发症的风险,从而抵消了其所带来的获益。Valgimigli等将2 013例接受冠状动脉支架治疗的患者随机分为双联抗血小板6月组和24月组,结果发现接受双联抗血小板24月的患者发生明显出血事件的几率显著高于双联抗血小板6月组(4.0%vs1.5%,P=0.001 6)[10]。对于不能进行手术治疗的SCS患者,需要维持多长时间的双联抗血小板治疗才能得到最大的获益目前尚无相关报道。本研究结果显示,与SD组比较,PD组未增加出血事件的风险,这说明适当延长双联抗血小板治疗时间对于SCS患者是相对安全的。PD是否比SD能更有效预防缺血性卒中再发,有必要通过增加样本量、延长随访时间或者采用磁共振检查进行随访更有利于发现隐性卒中等方法以进一步研究证实。
表2 SD组和PD组患者随访结局、MES和血清标记物比较
Tab 2 Comparison of follow-up outcome, MES and serum markers the SD group and the PD group
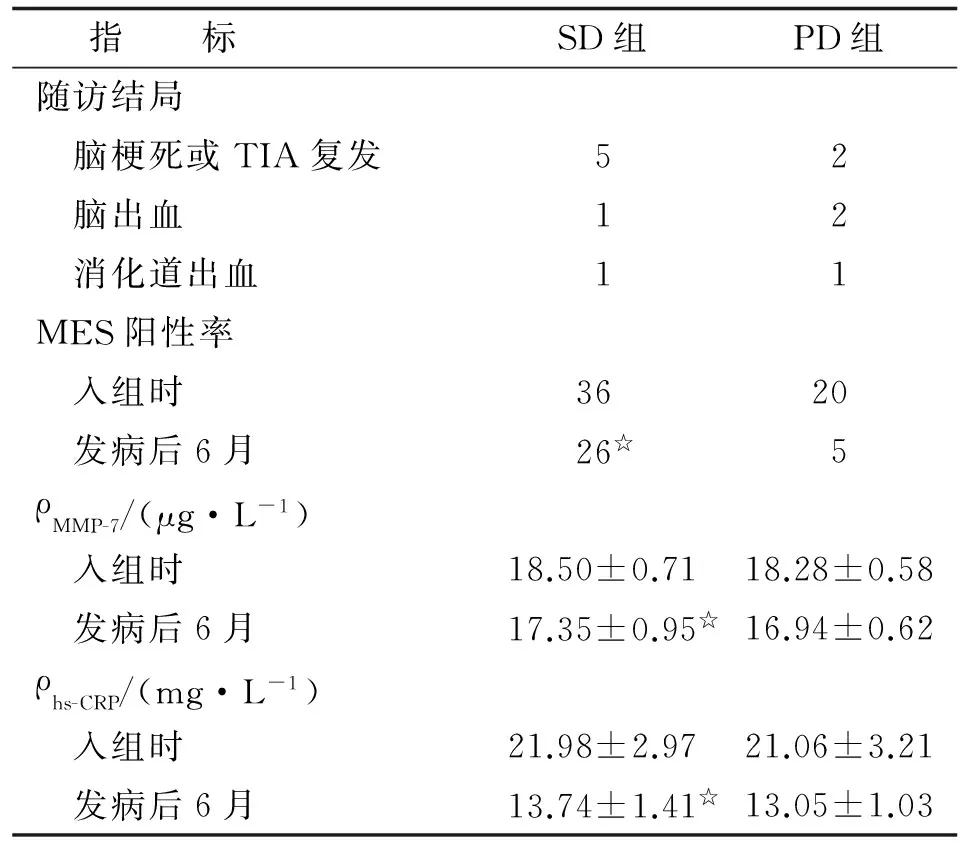
指 标SD组PD组随访结局 脑梗死或TIA复发52 脑出血12 消化道出血11MES阳性率 入组时3620 发病后6月26☆5ρMMP⁃7/(μg·L-1) 入组时18.50±0.7118.28±0.58 发病后6月17.35±0.95☆16.94±0.62ρhs⁃CRP/(mg·L-1) 入组时21.98±2.9721.06±3.21 发病后6月13.74±1.41☆13.05±1.03
表中除MMP-7和hs-CRP外,余为n. SD:短期双联抗血小板组;PD:延长双联抗血小板组;TIA:短暂性脑缺血发作;MES:微栓子;hs-CRP:超敏C反应蛋白;MMP:基质金属蛋白酶. 与PD组比较,☆:P<0.05.
颈动脉狭窄所致分水岭区脑梗死或TIA与MES相关[11]。MES是预测缺血性脑卒中复发的重要参考指标[12]。Markus等纳入了230例SCS患者,对其中107例TCD发现MES的患者分别进行双联抗血小板和单用阿司匹林治疗,结果提示7 d的双联抗血小板治疗就能显著降低患者的MES阳性率(43.8%),而单用阿司匹林治疗患者的MES阳性率仍高达72.7%;研究人员进一步对脑梗死急性期复发缺血性卒中的患者进行TCD检测发现,这些患者的MES阳性率高达90%[9]。Wong等也采用了类似的研究方法,同样发现联合抗血小板治疗7 d就可以将MES相对风险降低42.4%[13]。国内王遐等的研究也提示,在脑梗死急性期给予强化药物治疗能够明显降低MES数量,但是因纳入研究的患者较少,未发现强化治疗能明显降低脑梗死急性期复发的风险[14]。本研究结果提示,无论是SD还是PD均能明显降低MES的阳性率,但PD的效果优于SD,说明PD治疗有可能通过减少MES从而降低缺血性卒中复发的风险。
炎症因子的异常表达常常提示动脉粥样硬化斑块发展和不稳定状态[15]。hs-CRP是炎症反应时产生的一种非特异性急相反应蛋白,由动脉硬化病变区域的巨噬细胞和平滑肌细胞内合成后直接参与动脉硬化的发生和发展,特别是在活动性动脉粥样斑块的发展中起到重要作用,是心脑血管疾病的独立危险因素[16]。MMP家族是一种锌离子依赖的蛋白水解酶家族,可以通过降解和重塑细胞外基质造成动脉粥样硬化斑块的形成和不稳定。炎性细胞浸润和炎症因子激活诱导了内皮细胞释放MMP,降解基底膜,并且加快低密度脂蛋白的氧化和渗入,加快了单核细胞浸润并向泡沫细胞转化,最终形成粥样硬化斑块[17]。MMP-7是MMP家族中蛋白水解活性最强的蛋白,常常表达于易损斑块处,能够通过清除钙粘蛋白诱导血管平滑肌细胞凋亡和降解Ⅳ型胶原纤维等方式使斑块易于破裂[18]。本研究结果显示,经双联抗血小板治疗后,发病急性期高表达的血清MMP-7和hs-CRP均明显下降,原因可能是MES明显降低的机制且PD组降低得更为明显。这说明PD能够更有效地降低SCS患者动脉硬化斑块炎症的活动性。炎症标记物的显著降低也提示,PD有可能进一步降低SCS相关缺血性卒中再发的风险。
本研究提示,MES可以作为监测缺血性卒中复发的重要工具,双联抗血小板治疗可能通过降低动脉硬化斑块的炎症活动,减少MES,从而发挥更强的二级预防的作用。但因本研究的病例有限,尚有待扩大样本量和延长随访时间以进一步验证。
[1] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国缺血性卒中和短暂性脑缺血发作二级预防指南[J].中华神经科杂志, 2014, 48(4):258-273.
[2] Kernan W N, Ovbiagele B, Black H R,etal. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: A guideline for healthcare professionals from the american heart association/american stroke association[J].Stroke, 2014,45:2160-2236.
[3] 中华医学会神经病学分会, 中华医学会神经病学分会神经影像学协作组. 中国脑血管超声临床应用指南[J]. 中华神经科杂志, 2016,49(7):507-517.
[4] Markus H S, King A, Shipley M,etal, Asymptomatic embolisation for prediction of stroke in the Asymptomatic Carotid Emboli Study (ACES): a prospective observational study[J].LancetNeurol, 2010,9(7):663-671.
[5] Ritter M A, Dittrich R, Thoenissen N,etal. Prevalence and prognostic impact of microembolic signals in arterial sources of embolism. A systematic review of the literature[J].JNeurol, 2008,255(7):953-961.
[6] Hermus L, Lefrandt J D, Tio R A,etal. Carotid plaque formation and serum biomarkers [J].Atherosclerosis, 2010,213(1):21-29.
[7] Gokaldas R, Singh M, Lal S,etal. Carotid stenosis: from diagnosis to management, where do we stand [J]?CurrAtherosclerRep, 2015,17(2):480.
[8] Bhatt D L, Fox K A, Hacke W,etal. Clopidogrel and aspirin versus aspirin alone for the prevention of atherothrombotic events[J].NEnglJMed, 2006,354(16):1706-1717.
[9] Markus H S, Droste D W, Kaps M,etal. Dual antiplatelet therapy with clopidogrel and aspirin in symptomatic carotid stenosis evaluated using doppler embolic signal detection: the Clopidogrel and Aspirin for Reduction of Emboli in Symptomatic Carotid Stenosis (CARESS) trial[J].Circulation, 2005,111(17):2233-2240.
[10] Valgimigli M, Campo G, Monti M,etal. Short- versus long-term duration of dual-antiplatelet therapy after coronary stenting: a randomized multicenter trial[J].Circulation, 2012,125(16):2015-2026.
[11] Moustafa R R, Izquierdo-Garcia D, Jones P S,etal. Watershed infarcts in transient ischemic attack/minor stroke with > or = 50% carotid stenosis: hemodynamic or embolic[J]?Stroke, 2010,41(7):1410-1416.
[12] Poppert H, Sadikovic S, Sander K,etal. Embolic signals in unselected stroke patients: prevalence and diagnostic benefit[J].Stroke, 2006,37(8):2039-2043.
[13] Wong K S, Chen C, Fu J, Chang H M,etal. Clopidogrel plus aspirin versus aspirin alone for reducing embolisation in patients with acute symptomatic cerebral or carotid artery stenosis (CLAIR study): a randomised, open-label, blinded-endpoint trial[J].LancetNeurol, 2010,9(5):489-497.
[14] 王 遐, 潘旭东, 马爱军, 等. 微栓子信号在评价抗血小板药治疗中的作用初步探讨[J]. 国际脑血管病杂志, 2011,19(3):204-208.
[15] Sorci-Thomas M G, Thomas M J. Microdomains, inflammation and atherosclerosis[J].CircRes, 2016,118(4):679-691.
[16] Koenig W. High-sensitivity C-reactive protein and atherosclerotic disease: from improved risk prediction to risk-guided therapy[J].IntJCardiol, 2013,168(6):5126-5134.
[17] Vacek T P, Rehman S, Neamtu D,etal. Matrix metalloproteinases in atherosclerosis: role of nitric oxide, hydrogen sulfide, homocysteine, and polymorphisms[J].VascHealthRiskManag, 2015,11:173-183.
[18] Williams H, Johason J L, Jackson C L,etal. MMP-7 mediates cleavage of N-cadherin and promotes smooth muscle cell apoptosis[J].CardiovascRes, 2010,87:137-146.
(编辑:何佳凤)
Clinical Observation Study of Prolonged Dual Antiplatelet Therapy in Patients with Symptomatic Carotid Stenosis
LIU Changyun1, CHEN Longfei2, CHEN Zhiting1, XIONG Wenting1, LIN Hanbin1, HUANG Huapin1
1. Department of Neurology, Fujian Medical University Union Hospital, Fuzhou 350001, China; 2. Department of Neurology, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350005, China
Objective To analyze the effects of the duration of dual antiplatelet therapy on ischemic stroke recurrence and artery plaque activity in patients with symptomatic carotid stenosis. Methods Subjects were 95 patients with symptomatic carotid stenosis who were admitted to department of Neurology, Fujian Medical University Union Hospital and The Affiliated First Hospital of Fujian Medical University. Clinical data, microembolic signals (MES) detected by transcranial Doppler, and serum level of MMP-7 and hs-CRP were investigated. 67 patients were recruited in short-term dual antiplatelet therapy (SD) group (duration <1 month) while 28 patients were recruited in prolonged dual antiplatelet therapy (PD) group (duration >3 months), which were two different durations of dual antiplatelet therapy. The differences in ischemic stroke recurrence rate, hemorrhage complications, MES positive rate, and level of MMP-7 and hs-CRP were analyzed. Results There were no differences between the two groups in baseline data, MES, and the level of serum markers. After 1 year of follow-up, there were no significant differences between the two groups in ischemic stroke recurrence and hemorrhage complications. After 6 months of follow-up, in the SD group, MES positive rate(38.8%,26/67)were lower than that (53.7%,36/67)detected at admission, the serum levels of MMP-7 [(17.35±0.95)μg/L]were lower than that [(18.50±0.71)μg/L] detected at admission, and the serum levels of hs-CRP[(13.74±1.41)mg/L]were lower than that [(21.98±2.97)mg/L] detected at admission(allP<0.05). And, in the PD group, MES positive rate(17.9%,5/28)were lower than that (71.4%,20/28) detected at admission, the serum levels of MMP-7 [(16.94±0.62)μg/L]were lower than that [(18.28±0.58)μg/L]detected at admission, and the serum levels of hs-CRP[(13.05±1.03)mg/L])were lower than that [(21.06±3.21)mg/L] detected at admission(allP<0.05). MES positive rate and the serum levels of MMP-7 and hs-CRP in the PD group were both lower than that in the SD group (P<0.05). Conclusions Prolonged dual antiplatelet treatment may reduce the risk of ischemic stroke recurrence in symptomatic carotid stenosis by stabilizing artherosclerotic plaque. Further study in this area is needed.
carotid stenosis; stroke; embolectomy; ultrasonography, doppler, transcranial; biological markers; platelet aggregation inhibitors

2016-09-14
福建省科技厅重点项目(2013Y0042)
福建医科大学 1. 附属协和医院 神经内科,福州 350001;2. 附属第一医院 神经内科,福州 350005
刘昌云,男,医学硕士,主任医师,副教授
黄华品. Email: hh-p@163.com
R322.121; R619.2; R743.3; R973
A
1672-4194(2017)01-0035-05
