肝硬化患者的人工髋关节置换
2017-04-25李文波张文明白国昌黄子达张超凡张泽宇
李文波, 张文明, 白国昌, 黄子达, 张超凡, 张泽宇
肝硬化患者的人工髋关节置换
李文波1, 张文明1, 白国昌1, 黄子达1, 张超凡1, 张泽宇2
目的 探讨肝硬化患者行人工髋关节置换围术期的治疗方法。 方法 收集因不同原因导致肝硬化并行人工髋关节置换手术的患者16例(肝硬化组)和非肝硬化患者32例(对照组),2组均为同期因股骨颈骨折和股骨头坏死行人工髋关节置换的病例。观察2组的并发症,术前、术后行Harris评分及功能评价,并至少随访1年,保留假体清创术的病例至少随访2年。 结果 肝硬化组术后Child-Pugh分级A级7例,B级8例,C级1例;术后伤口渗出6例;伤口浅表感染3例,给予清创换药、使用抗生素治疗,伤口愈合;伤口周围血肿4例;急性人工关节假体周围感染5例,其中表皮葡萄球菌感染4例,保留假体清创随访2年以上无复发,假体无松动,另一例为金黄色葡萄球菌感染,保留假体清创失败。对照组术后伤口渗出2例,未出现浅表伤口感染、周围血肿、关节感染等。2组在住院时间、手术时间、总费用等方面比较,差别具有统计学意义(P<0.05)。 结论 肝硬化患者行人工髋关节置换手术风险较大,术后并发症多,特别是感染和出血,术前需做详细准备。
人工关节; 髋关节; 关节成形术,置换,髋; 肝硬化
人工关节置换手术对于关节疾病的治疗日趋成熟,且疗效确切,临床上相关病例逐年增加,但对于有特殊合并症的患者,在行人工关节置换时仍存在许多棘手的问题。肝硬化是各种慢性肝病的终末期改变[1],因肝脏功能存在不同程度的损伤,患者存在凝血功能异常、免疫功能低下,术后易出现较多并发症。对于一些肝硬化合并髋部疾病,如股骨颈骨折、股骨头坏死等需关节置换手术治疗的患者,围术期应如何处理,对临床医师提出了更高的要求。如何提高肝硬化患者的人工关节置换手术的成功率,目前尚无成熟的经验[2-4]。现收集2008年6月-2014年12月于笔者科室行人工髋关节置换手术的肝硬化患者16例,并和同期行人工髋关节置换的非肝硬化患者32例进行对比研究,探讨肝硬化患者行人工髋关节置换手术围术期的治疗方法,报道如下。
1 对象与方法
1.1 对象 16例中,男性14例,女性2例,年龄(55.4±9.1)岁(46.3~64.5岁),体质量指数(body mass index, BMI)为(25.8±1.6)kg/m2(24.2~27.4 kg/m2)。股骨头坏死12例,股骨颈骨折4例;酒精性肝硬化14例,乙型肝炎病毒致肝硬化2例;使用改良肝硬化Child-Pugh分级[5]:A级11例,B级4例,C级1例。16例均符合肝硬化诊断标准[6]:(1)病毒性肝炎、长期饮酒导致肝硬化病史;(2)肝功能减退和门静脉高压的临床表现;(3)肝功能试验显示,血清白蛋白下降、血清胆红素升高及凝血酶原时间延长;(4)B超或CT提示肝硬化,内镜发现食管胃底静脉曲张。患者术前给予保护肝脏的药物,输注血清白蛋白,使其水平≥35 g/L,有腹水者给予利尿剂,纠正水、电解质紊乱,避免使用损害肝脏的药物。
按照1∶2的比例收集同期行人工髋关节置换术的非肝硬化患者32例,男性28例,女性4例,年龄(57.4±10.2)岁(47.2~67.6岁),BMI(25.2±5.6))kg/m2(19.6~30.8 kg/m2),其中股骨颈骨折8例,股骨头坏死24例。抽取原则:按照性别、身高、BMI及伴随疾病进行配对,随访时间>1年。2组在年龄、BMI方面差别无统计学意义(P>0.05);2组术前总胆红素、凝血功能及白蛋白水平差别均有统计学意义(P<0.05,表1)。
1.2 方法
1.2.1 手术方法 肝硬化组16例中,凝血酶原时间(prothrombin time, PT)延长3 s者,术前输注新鲜冰冻血浆1 000 mL。采用气管内麻醉或硬膜外麻醉,90°侧卧位,切皮前30 min静脉注射头孢唑啉钠2.0 g,如手术超过3 h,则再次静脉注射2.0 g。手术均为单侧,均采用髋关节后外侧切口,清理磨锉
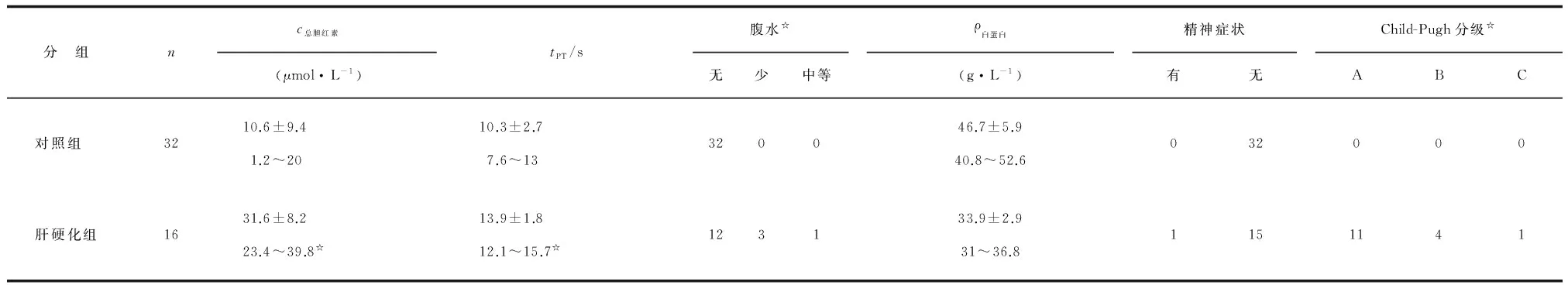
表1 对照组与肝硬化组患者术前一般资料比较
PT:凝血酶原时间. 与对照组比较,☆:P<0.05.
后植入人工髋关节假体。确认髋关节的稳定性,检查无活动性出血,冲洗伤口,伤口局部使用混合药物注射镇痛(2%罗哌卡因20 mL+盐酸肾上腺素0.05 mg+吗啡10 mg+生理盐水40 mL),放置引流管,肝硬化患者同时放置皮下引流管9例。关闭切口,伤口包扎,T形枕固定搬运。2组的手术操作均由同一组医师进行,均使用非骨水泥生物骨长入型假体(美国强生公司)。
1.2.2 术后处理
1.2.2.1 常规处理 肝硬化组患者因具有出血倾向,术后未进行抗凝治疗。髋关节腔内放置引流管但皮下未置引流管的患者,待无新出血后拔除;放置皮下引流管的患者,于术后24~48 h拔除髋关节引流管,术后5~7 d拔除皮下引流管。术后输注新鲜冰冻血浆、凝血酶原复合物,必要时补充血小板。对照组术后常规放置引流管,并于24 h内拔除。术后12 h开始使用常规半量低分子肝素皮下注射抗凝,24 h后改为常规剂量。拔除引流管后扶助行器下地行走。出院前检查关节功能评分。
1.2.2.2 观察指标 包括围术期的白细胞总数、血红蛋白水平、血小板计数、血沉(erythrocyte sedimentation rate, ESR)、C-反应蛋白(C-reaction protein, CRP)、胆红素水平、白蛋白水平及凝血功能等,还应监测患者的体温、饮食情况、伤口是否渗液、髋关节周围肿胀、是否出现精神症状、腹胀情况、是否有消化道出血等。观察患者的腹水情况:超声检查下,<1 000 mL为少量,1 000~3 000 mL为中等,>3 000 mL为大量,评估肝功能分级。术后7 d或出院前常规行下肢静脉超声检查,观察是否有血栓发生。
1.2.2.3 并发症处理 术后第1天检查血常规、凝血功能及肝功能,引流量>500 mL/24 h者予输注新鲜冰冻血浆或凝血酶原复合物。术后72 h伤口纱布有渗液算渗出。髋部肿胀者行CT扫描,查看是否有血肿,检查血红蛋白<70 g/L者给予输注悬浮红细胞。术后出现伤口肿胀、疼痛,CRP>90 mg/L,排除其他部位感染,应考虑急性人工关节感染,应给予保留假体清创,并留取深部多部位组织行微生物培养,清创后静脉使用头孢唑啉钠2.0 g,每8 h 1次,根据药物敏感试验调整抗生素,2周后改为口服,共使用3月。不同时间检测ESR、CRP均正常时,停止抗生素治疗。脱位患者行手法或手术复位。
出血量计算:采用Gross提出的围手术期出血量计算方法[7]。如患者接受输血,则一个单位的浓缩红细胞等于200 mL的标准红细胞容量。2组均未使用血液回输技术。
失血量=PVB(血容量)×(术前HCT-术后HCT)+输血量
PVB=k1×身高(m)+k2×体质量(kg)+k3(男性:k1=0.3669,k2=0.03219,k3=0.6041;女性:k1=0.3561,k2=0.03308,k3=0.1833)
1.2.2.4 随访 出院前及出院后3,6月均进行随访,此后为1年1次。随访时均摄双髋正位片及患髋侧位片,检测ESR及CRP,并行髋关节的Harris功能评分。2组病例均随访1年以上,其中假体周围感染者至少随访2年,无失访病例。
1.3 统计学处理 连续变量表示为平均率标准偏差。比较采用Wilcoxon秩和检验或Kruskal-Wallis检验进行。分类变量表示为总计数,并采用Fisher精确检验。因样本量太小,未进行多因素分析,仅行单变量T配对分析。P<0.05为差别有统计学意义。
2 结 果
肝硬化组术后Child-Pugh分级:A级7例,B级8例,C级1例;术后伤口渗出6例;伤口浅表感染3例,给予清创换药、使用抗生素治疗,伤口愈合;伤口周围血肿4例;急性人工关节假体周围感染5例,其中表皮葡萄球菌感染4例,保留假体清创随访2年以上无复发,假体无松动,另一例金黄色葡萄球菌感染,保留假体清创失败。对照组术后伤口渗出2例,未出现浅表伤口感染、周围血肿、关节感染等。2组在住院时间、手术时间、总费用等方面比较差别具有统计学意义(P<0.05);在人工关节脱位和术后静脉血栓形成方面比较,2组差别则无统计学意义(P>0.05),具体见表2。术前、术后髋关节功能评分无明显差异。
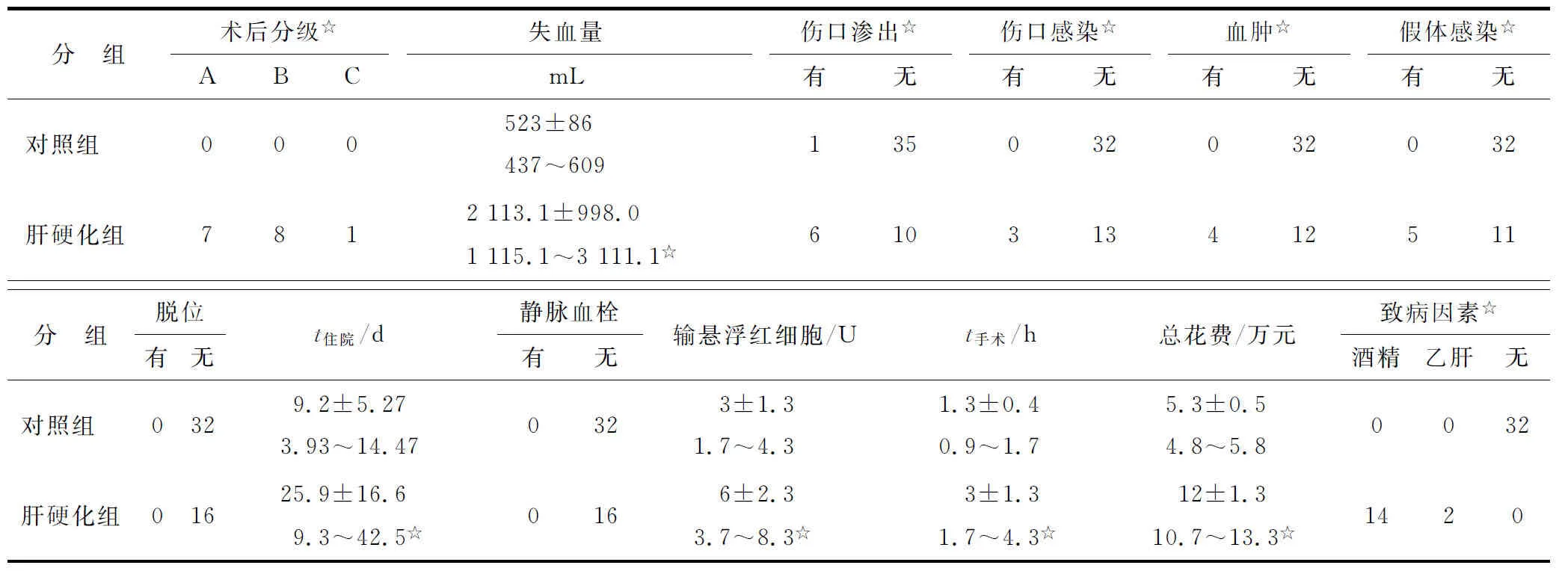
表2 对照组与肝硬化组的术后合并症
与对照组比较,☆:P<0.05.
3 讨 论
肝硬化患者行手术治疗有较高的风险和死亡率[8-10]。目前,有关肝硬化患者行人工关节置换术的文献报道仍较少[11]。本研究结果显示,肝硬化组围术期的输血量及输血率、术中出血量、手术时间、平均住院时间及费用、术后并发症均明显高于对照组,与文献报道一致[12]。围术期并发症发生率高主要与肝硬化后凝血因子、白蛋白等合成障碍有关,而低浓度的白蛋白又使肝硬化患者更易发生伤口渗液。但因病例数较少,本组并未出现死亡病例,且因置换术后的远期并发症及假体生存时间仍需较长的随访时间进行观察,期待能获得良好的远期疗效。
对于此类患者,围术期做好充分的准备,可大大降低发生合并症的风险和死亡率。临床上,对于长期饮酒或嗜酒、乙肝抗原阳性、既往有消化道出血或肝脏疾病治疗史的患者,除常规检查外,还需行腹部肝脏超声或CT扫描,观察肝脏的形态、是否有腹水等,并使用改良肝硬化Child-Pugh分级对肝脏功能进行分级;给予保护肝脏的药物,维持水、电解质稳定,输注白蛋白,利尿,减轻心脏负担,避免使用损害肝脏的药物,均可提高手术的成功率。输注新鲜冰冻血浆是一种比较低廉且疗效较好的方法。新鲜冰冻血浆所含的丰富的白蛋白和活性凝血因子也是肝硬化失代偿期患者所急需的,配合使用利尿剂,可快速提高患者的凝血因子浓度,减少出血量,降低发生严重出血的风险,同时可提高血管内胶体渗透压,吸收组织间隙内水分,快速消肿。笔者的经验是,对于此类患者,术前输注1 000~1 500 mL血浆,使术中因凝血因子缺乏而导致创面广泛渗血的风险明显下降,术后继续补充新鲜冰冻血浆,使用量为引流量的2~3倍。尽管不能使PT恢复至正常值,但基本能控制术腔内血肿形成。
凝血酶原复合物也可快速补充凝血因子,不增加血容量,但无补充白蛋白的功效,且价格较贵,目前临床上已较少使用。而对于非肝硬化且凝血功能正常的患者,围术期使用氨甲环酸也可做到基本不输血[13]。目前,氨甲环酸已广泛应用于关节外科的手术中[14]。在补足凝血因子的情况下,术前后均可根据经验使用氨甲环酸以减少出血。主要原理是,氨甲环酸可通过和纤溶酶竞争性吸附纤维蛋白原,减少纤维酶原活性,保护纤维蛋白不被纤溶酶所降解和溶解,且能直接抑制纤溶酶的活力,达到止血的效果[15]。本研究中,肝硬化组术前常规使用氨甲环酸20 mg/kg,术后则根据出血量酌情使用,如术后6 h引流量>500 mL,再追加1次10 mg/kg,术后24 h引流量达800 mL,在补足凝血因子的情况下,再次使用10 mg/kg;而对照组只在术前0.5~1 h使用10~15 mg/kg,术后未再使用。
对于行髋关节置换手术的肝硬化患者,术后监测凝血时间、白蛋白及引流量对围手术期并发症的管控较为重要,监测血小板总数的意义也非常重大。血小板由骨髓产生,在脾脏内被吞噬。此类患者因出血以及脾脏功能血小板总数较低,如血小板>50×109L-1,可基本满足凝血功能需要[16]。本组1例术后出现血小板总数进行性下降,但血红蛋白浓度不降,伤口内严重血肿,考虑因出血后血液浓缩、血小板消耗所致,给予输注大量的血浆和血小板浓缩液,才控制住出血。
文献报道,非肝硬化患者应避免因长时间放置引流管导致的逆行感染[17-18]。本研究显示,肝硬化组感染发生率明显高于非肝硬化组。由于肝硬化患者存在免疫功能下降、细菌移位、补体功能缺陷、白细胞及网状内皮组织系统功能紊乱等[19],再加上出血和创伤,容易导致感染。其中股骨颈骨折的患者,因骨折疼痛、术前调整时间较少,加上卧床以及止痛药物的使用,难以补充充足的营养,且因出血消耗了凝血因子,导致患者的假体感染风险更高。在本研究中,笔者对肝硬化患者使用双引流管,髋关节深部放置1条引流管,紧密缝合阔筋膜后,在阔筋膜表面再放置1条,深部引流管24~48 h内拔除,7~10 d伤口愈合后再拔除皮下引流管。经双引流管技术处理的患者,后期发生伤口并发症的病例有减少的趋势。肝硬化患者具有明显的出血倾向,因此术后不建议使用抗凝剂预防下肢深静脉血栓,建议使用物理方法如气压治疗、踝泵等进行预防。
本研究尚存在一定的局限性:(1)为回顾性研究,不如前瞻性研究说服力强;(2)病例数较少,加上治疗者对治疗方法的偏好及伦理问题,对患者进行分组区别治疗,已探讨各治疗方法孰优孰劣,只能通过术后并发症的发生率、死亡率及Harris评分的优良率来证明本方法的可行性。
[1] 许 杰, 黄 晶, 马若凡, 等. 人工髋关节置换肝硬化患者围置换期的处理[J]. 中国组织工程研究, 2013,17(52):8967-8973.
[2] Khokhar N. Perioperative management of cirrhosis[J].JCollPhysiciansSurgPak, 2011,21(10):581-583.
[3] Liao J C, Chen W J, Chen L H,etal. Complications associated with instrumented lumbar surgery in patients with liver cirrhosis: a matched cohort analysis[J].Spine, 2013,13(8):908-913.
[4] Pandey C K, Karna S T, Pandey V K,etal. Perioperative risk factors in patients with liver disease undergoing non-hepatic surgery[J].WorldJGastrointestSurg, 2012,4(12):267-274.
[5] 中华医学会肝病学分会重型肝病与人工肝学组. 肝衰竭诊疗指南[J]. 中华肝脏病杂志, 2012,21(3):177-183.
[6] Tsochatzis E A, Bosch J, Burroughs A K,etal. Liver cirrhosis [J].Lancet, 2014,383(9930):1749-1761.
[7] Good L, Pcterson E, Lisander B. Tranexamic acid decreases external blood loss but not hidden blood loss in total knee replacement[J].BrJAnaesth, 2003,90:596-599.
[8] Sugimura Y, Toyama M, Katoh M,etal. Analysis of open heart surgery in patients with liver cirrhosis.AsianCardiovascThoracAnn, 2012,20(3):263-268.
[9] Nicoll A. Surgical risk in patients with cirrhosis[J].JGastroenterolHepatol, 2012,27(10):1569-1575.
[10] Jeffrey D, Mosko, Geoffrey C,etal. Increased perioperative mortality following bariatric surgery among patients with cirrhosis[J].ClinGastroenterolHepatol, 2011,9(10):897-901.
[11] 王雲蛟, 路星辰, 熊 雁, 等. 合并慢性肝衰竭老年髋部骨折的救治与围术期管理[J]. 中国矫形外科杂志, 2015,16:1476-1481.
[12] Cohen S M, Te H S, Levitsky J,etal. Operative risk of total hip and knee arthroplasty in cirrhotic patients[J].Arthroplasty, 2005,20(4):460-466.
[13] Sun X, Dong Q, Zhang Y G,etal. Intravenous versus topical tranexamic acid in primary total hip replacement: A systemic review and meta-analysis[J].IntJSurg,2016,32:10-18.
[14] Whiting D R, Duncan C M, Sierra R J,etal. Tranexamic acid benefits total joint arthroplasty patients regardless of preoperative hemoglobin value[J].JArthroplasty, 2015,30(12):2098-2101.
[15] Jiménez J J, Iribarren J L, Brouard M,etal. Safety and effectiveness of two treatment regimes with tranexamic acid to minimize inflammatory response in elective cardiopulmonary bypass patients: a randomized double-blind, dose-dependent, phase Ⅳ clinical trial[J].JCardiothoracSurg, 2011,6:138-148.
[16] El Bokl M A, Shawky A, Riad G S,etal. Pro-coagulant versus anticoagulant factors in cirrhotic patients[J].ArabJGastroenterol, 2014,15:123-129.
[17] Liu X H, Fu P L, Wang S Y,etal. The effect of drainage tube on bleeding and prognosis after total knee arthroplasty: a prospective cohort study[J].JOrthopSurgRes, 2014,129:27.
[18] Richards J, Inacio M C, Beckett M,etal. Patient and procedure-specific risk factors for deep infection after primary shoulder arthroplasty[J].ClinOrthopRelatRes, 2014,472:2809-2815.
[19] Tiberi J V, Hansen V, El-Abbadi N,etal. Increased complication rates after hip and knee arthroplasty in patients with cirrhosis of the liver[J].ClinOrthopRelatRes, 2014,472:2774-2778.
(编辑:何佳凤)
Total Hip Arthroplasty in Patients with Liver Cirrhosis
LI Wenbo1, ZHANG Wenming1, BAI Guochang1, HUANG Zida1, ZHANG Chaofan1, ZHANG Zeyu2
1.Department of Orthopedics, The First Affiliated Hospital of Fujian Medical University, Fuzhou 350001, China; 2.Postgraduate School of Fujian Medical University, Fuzhou 350122, China
Objective To investigate the perioperative treatment method of artificial hip replacement for cirrhotic patients. Methods From June 2008 to December 2014, 16 patients with cirrhosis parallel caused by various reasons underwent hip replacement surgery, including 14 males and 2 females, aged (55.4±9.1) years ( range from 41 to 64.5 years). There were 12 cases of femoral head necrosis, 4 cases of femoral neck fracture; 14 cases of alcoholic cirrhosis. Two cases of cirrhosis of the liver were caused by hepatitis B virus; 11 cases were classified as Child-Pugh class A, 4 case were classified as grade B, 1 case was classified as grade C, all were unilateral. Paired by gender, height, weight, disease and 1∶2 ratio, 32 cases were collected in the control group for the same period, with femoral neck fracture and femoral head necrosis undergoing artificial hip replacement , including 28 male patient and 4 female patients, of age (57.4±10.2) years (range from 47.2 to 67.6 years). Femoral head necrosis were presented in 24 cases, femoral neck fracture in 8 cases. Both groups were observed for complications, preoperative and postoperative Harris score and functional evaluation and follow-up for at least one year, while retaining debridement prosthesis patients were followed for at least 2 years. Results In the cirrhosis group (group A) there were 7 cases of postoperative Child-Pugh class A, 8 cases of grade B, 1 case of grade C; in the control group (group B), no cirrhosis occurred. There were six cases of postoperative wound exudate in Group A, while there was no superficial wound infection, peripheral hematoma, or postoperative joint infections in Group B. The patients with superficial wound infection were given clear Chong dressing and antibiotics and thewound healed. Four patients were with hematoma Five with acute peripheral prosthesis infection, including Staphylococcus epidermidis infection in 4 cases, underwent debridement and retention of prosthesis then were followed up for 2 years without recurrence, no prosthesis loose. Staphylococcus aureus infection occurred in 1 case, for whom debridement and retention of prosthesis failed. Group A in hospital stay, operative time, and the total cost outperformed group B significantly (P<0.05). Conclusion Detailed preoperative preparation is needed for the artificial joint replacement in patients with cirrhosis, since risk is higher for more postoperative complications,especially infections and bleeding than patients without cirrhosis.
oint prosthesis; hip joint; arthroplasty, replacement, hip; liver cirrhosis
2016-07-21
福建省临床重点专科建设项目;福建省卫生系统中青年骨干人才培养项目(2014-ZQN-JC-19);福建省卫生计生委医学创新课题(2014-CX-23);福建省卫生厅青年科研课题(2013-2-41)
福建医科大学 1.附属第一医院 关节外科,福州 350005;2.研究生院,福州 350122
李文波,男,副主任医师,医学硕士
张文明. Email:zhangwm0591@163.com
R318.17; R575.2; R687.42
A
1672-4194(2017)01-0044-05
