羟乙基籼米淀粉的制备及结构特征
2017-04-25刘忠义乔丽娟王永强湘潭大学化工学院湘潭411105
陈 婷 刘忠义 乔丽娟 王永强 杨 菊(湘潭大学化工学院,湘潭 411105)
羟乙基籼米淀粉的制备及结构特征
陈 婷 刘忠义 乔丽娟 王永强 杨 菊
(湘潭大学化工学院,湘潭 411105)
使用籼米淀粉作为原材料,采用溶媒法结合超声波处理原淀粉以氯乙醇作为醚化剂制备羟乙基籼米淀粉。通过单因素实验优化合成条件,并用FTIR、XRD、SEM和TG-DSC对产品进行结构特征分析。结果表明,在籼米淀粉10.0 g,蒸馏水30 mL时,优化合成的条件如下:温度50℃,氢氧化钠2.4 g,无水乙醇50 mL,氯乙醇4 g,反应时间8 h。X射线衍射和扫描电镜分析表明籼米淀粉的醚化反应主要发生在非结晶区,醚化作用没有改变淀粉结晶区的晶型;籼米淀粉经过超声波处理和醚化后,其晶型结构与颗粒形貌均受到破坏。对比原淀粉和羟乙基籼米淀粉的红外光谱说明籼米淀粉确实发生了羟乙基化。热稳定性分析证明籼米淀粉经过羟乙基化后,其水分蒸发温度和融熔温度均降低。超声波处理有助于羟乙基淀粉的合成及破坏原淀粉的晶型结构。
籼米淀粉 羟乙基籼米淀粉 结构特征 取代度(MS)
羟乙基淀粉是一种半合成的水溶性多糖,它可由淀粉在碱性条件下经羟乙基化而成或者在酸性条件下水解成一定分子量的糊精再在碱性条件下经羟乙基化而成,淀粉链上葡萄糖基2位、3位(少量6位)上部分羟基被羟乙基取代,经取代的淀粉的α-1,4糖苷链在体内不易被淀粉酶水解[1],其醚键的稳定性高,几乎不受电解质和pH的影响,能在较宽的pH条件下使用[2],因此被广泛应用于食品、医药、纺织、造纸、石油开采等众多工业中,尤其是作为代血浆广泛用于临床。
籼米是我国的主要粮食之一[3],在加工过程中会产生大量碎米。相比完整颗粒的籼米,碎米价格很低,但是营养物质和籼米几乎相同[4]。碎米以前主要用于加工生产米粉、传统米制食品,后来用于生产各种淀粉糖浆,但在糖浆生产过程中碎米中蛋白质进入米渣中丢弃,现在则有新技术以碎米为原材料同时制取籼米淀粉和籼米蛋白水解物并已经工业化[5],促进了籼米淀粉的应用研究。
目前,国内外主要采用玉米、马铃薯及木薯淀粉生产变性淀粉,用籼米淀粉作原料的研究在国内外报道相对较少[6]。提取蛋白质后生产的籼米淀粉具有颗粒小、易消化、低敏性、不含蛋白质等特点[7],基于这些特性,籼米淀粉在食品和医药中的应用有较强的潜在优势。然而,由于籼米淀粉颗粒微细,容易产生聚并,导致籼米淀粉的表观粒径偏大,由于需要将聚并的颗粒分散,因此,用籼米淀粉制备变性淀粉时,可能需要比其他淀粉更为苛刻的条件或者使用其他手段。
目前对羟乙基淀粉的研究,大部分羟乙基化时使用的醚化剂是环氧乙烷,但是该物质易燃易爆,本试验采用的醚化剂为氯乙醇可避免环氧乙烷易爆易燃的缺陷,使得操作的安全性大大增加[8]。试验通过单因素分析考查了不同反应条件对羟乙基籼米淀粉取代度的影响,并对籼米淀粉及其羟乙基淀粉的结构特征进行了比较。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
籼米淀粉,一级品:云南普洱永吉生物技术有限责任公司。
1.1.2 仪器与设备
Agilent7890A气相色谱仪:安捷伦科技公司;NICOLET380傅里叶红外光谱:美国热电集团;D/MAX-2500/PC X射线多晶粉末衍射仪:日本理学公司;TGA/DSC1/1600HT同步热分析仪:瑞士梅特勒公司;JSM-5900型扫描电子显微镜:日本电子公司。
1.2 试验方法
1.2.1 羟乙基淀粉的制备
将10.0 g籼米淀粉和30 mL水置于250 mL三口瓶中,超声波处理15 min,将三口瓶置于电热恒温水浴锅中,装上回流冷凝管及电动搅拌器,开启搅拌器充分搅拌均匀,制成淀粉乳液,再加入2 mL(0.25 mol/L)盐酸,在65℃下反应大约1.5 h(品氏黏度计在25℃下恒温测定运动黏度为18.3~20.0 mm2/s),降温到50℃,加入NaOH中和,接着加入无水乙醇,搅拌30 min稳定后,然后加入氯乙醇,加热反应一段时间。反应完毕后,对反应液进行抽滤并用无水乙醇洗涤干净,滤饼粉碎后在50℃下干燥6 h。
1.2.2 取代度(MS)的测定
采用气相色谱法[9],精密称取样品0.050 g和己二酸0.100 g置于密闭容器中,精密加入内标溶液(精密量取甲苯1 mL,在250 mL容量瓶中用邻二甲苯稀释至刻度)1 mL,加入氢碘酸(≥55%)2 mL,立即封口,放入135℃烘箱中保温15 h,取出冷却,以3 000 r/min离心10 min,取上清液测定。
MS定义为碘乙烷摩尔分数与淀粉中葡萄糖单元之比。其值由式(1)与式(2)计算得出。

1.2.3 结构特征测定方法
1.2.3.1 红外光谱测定
通过红外光谱仪测定其红外光谱图,范围为400~4 000 cm-1,样品测量前需要掺混KBr粉末并压成片剂[10]。
1.2.3.2 X射线衍射测定
参照Zhang等[11]的测定方法,测试条件为:Cu-Ka,40 mA管流,40 kV管压,10°/min扫描速率,测量范围10°~90°扫描范围。
1.2.3.3 扫描电镜测定
将样品过筛干燥进行喷金处理,通过扫描电镜分析淀粉颗粒[10]。
1.2.4 数据分析
数据使用Excel进行处理,采用Origin7.5软件作图。
2 结果与讨论
2.1 不同因素对羟乙基淀粉MS的影响
溶媒法是指淀粉在有机溶剂介质中进行醚化反应。常用的有机溶剂有甲醇、乙醇和异丙醇。在温度为50℃、氢氧化钠2.4 g、氯乙醇4 g、羟乙基反应时间为8 h的条件下,考察了不同溶剂对MS的影响。在有机溶剂为甲醇的条件下,MS为0.21;在有机溶剂为异丙醇的条件下,反应体系产生絮凝物,反应无法进行;在有机溶剂为乙醇的条件下,反应均匀,MS能达到理想的0.4。所以反应溶剂确定为无水乙醇。
无水乙醇为50 mL,氢氧化钠2.4 g,氯乙醇4 g,羟乙基反应时间为8 h,不同反应温度对MS的影响见图1,随着温度的升高取代度不断的增加,但温度达到53℃以上时,反应体系产生絮凝物,反应产物聚集,反应无法进行。50℃时产物达到了理想的取代度0.4,所以反应温度确定为50℃。
温度为50℃,无水乙醇50 mL,氯乙醇4 g,羟乙基反应时间为8 h,不同氢氧化钠用量对MS的影响见图1。由图1可知随着氢氧化钠反应量的增加,产品的取代度不断提高,这主要是因为氢氧化钠能与淀粉分子链上的羟基键合,形成反应的活性中心。当氢氧化钠的用量在2.0~2.4 g范围内增加时,碱处理淀粉所生成的活性中心会不断增多,因而使淀粉与氯乙醇的反应效率大大增加,取代度也随之提高。但当氢氧化钠用量继续增加到2.5 g以上时,反应体系产生絮凝物,可能此时pH过大导致淀粉糊化,致使反应无法正常进行[12]。
温度为50℃,氢氧化钠2.4 g,氯乙醇4 g,羟乙基反应时间为8 h,不同无水乙醇用量对MS的影响见图1。随着无水乙醇的增加,羟乙基淀粉的取代度MS先增加后减小,这是因为加入不同量的无水乙醇,将改变水与无水乙醇所占的质量分数,随着水质量分数的减少,亲核体氯乙醇的水合程度减小,反应活性增加,适当质量分数的水使淀粉适当溶胀,氯乙醇可以扩散到淀粉晶体中,加快反应的传质速率,当无水乙醇量为50~60 mL时,取代度达到最大,趋于平衡,此后处于下降趋势,可能因为水质量分数较少时淀粉易糊化或反应不稳定[13]。
温度为50℃,无水乙醇50 mL,氢氧化钠2.4 g,羟乙基反应时间为8 h,不同氯乙醇的用量对MS的影响见图1,随着氯乙醇的用量增加,氯乙醇扩散到淀粉内部的数量增加,从而氯乙醇与活性基团的碰撞概率增加,取代度随之提高,随着氯乙醇使用量继续增加后,扩散到淀粉内部的氯乙醇达到饱和,因为空间位阻的关系,反应试剂与活性基团的碰撞概率反而下降;同时因为氯乙醇的过剩,副反应加剧,在此反应中氢氧根离子既是强碱又是亲核试剂,因为邻基效应的关系,氯乙醇分子之间会发生亲核取代生成环氧乙烷和乙二醇,环氧乙烷还能与羟乙基淀粉继续反应生成副反应产物。因此会出现羟乙基摩尔取代度随着氯乙醇用量的增加先增大而后降低的趋势。在佘艳[12]的研究中也报道过类似的情况。
温度为50℃,无水乙醇50 mL,氢氧化钠2.4 g,氯乙醇4 g,不同反应时间对MS的影响见图1,随着羟乙基化反应时间的延长,羟乙基取代度发生了直线上升,当羟乙基化8 h后,反应的延长羟乙基的取代度没有发生明显变化。反应时间确定为8 h较为合适。

图1 不同因素对羟乙基取代度的影响
2.2 羟乙基淀粉X-射线衍射分析
X-射线衍射峰的强度及半峰宽的变化反映了颗粒结晶度的大小,无定形化程度和晶格畸变等情况,且根据X-射线衍射图谱,可将淀粉分为A、B、C 和V几种类型[14]。图2表示的是原淀粉和羟乙基淀粉的X-射线衍射图。原淀粉在15°、17°、18°和23°处出现衍射峰,其晶体类型是特征A型[15]。当籼米淀粉只经过超声波处理时,特征衍射峰基本没有变化,说明超声波处理对籼米淀粉颗粒只起到了一个疏散聚并颗粒的作用;籼米淀粉经羟乙基化后,衍射峰减弱明显,但仍保留了A型特征峰,说明反应主要发生在非结晶区,醚化作用对淀粉结晶区的破坏仍不足以使其晶型发生改变;籼米淀粉经过超声波处理再进行醚化后,其晶型结构受到破坏,A型特征衍射峰消失,在21°处出现了新的特征峰,其晶体类型变为典型V型结构,结晶度降低。

图2 籼米淀粉和羟乙基籼米淀粉的X-射线衍射图谱
2.3 扫描电镜分析
图3籼米淀粉和羟乙基淀粉的扫描电子显微镜图像。由图3a可知籼米淀粉颗粒为不规则的多边形结果,表面较为平滑。图3b为没有经过超声波处理的羟乙基淀粉,可以看到经过羟乙基化后,一些淀粉被粘连在一起,淀粉颗粒表面出现了明显的腐蚀现象。图3c经过超声波处理后的羟乙基淀粉,淀粉出现融合,在聚集的颗粒上看不到原有的淀粉颗粒的形状,破坏严重,边缘被严重磨损。由图可以知道羟乙基化只发生在淀粉颗粒表面,但是超声波的处理和醚化的双重作用对其内部结构造成了影响。这与XRD的结果相一致。

图3 籼米淀粉和羟乙基淀粉的扫描电镜图
2.4 羟乙基淀粉红外分析
用傅里叶红外光谱仪对原淀粉和羟乙基淀粉进行的红外表征见图4,与原淀粉相比羟乙基淀粉在波长3 000~4 000 cm-1上,波峰突然变狭长,3 410 cm-1为—OH的伸缩振动吸收峰相对增强,2 930 cm-1为C—H的伸缩振动吸收特征峰[16],在859、762、575 cm-1处有-CH2-摇摆振动吸收峰变得更加明显[10],说明发生了羟乙基化反应。

图4 籼米淀粉和羟乙基籼米淀粉的红外图谱
注:A为原淀粉,B为羟乙基籼米淀粉。
2.5 热稳定性分析
淀粉在热重分析仪中随着温度变化质量的变化过程被分为3个阶段:第1阶段质量损失是由于易挥发物质的蒸发所致,主要是水分的蒸发,第2阶段是淀粉在非氧化过程中的解聚和降解阶段,这1阶段可以放出CO2、CO、水、乙醛、呋喃、2-甲基呋喃。除了复杂的气体和水分释放之外,解聚产物的主要成分是左旋葡萄糖。第3阶段的质量损失是由于发生了碳化,中间产物在高温下的总降解[17]。由籼米淀粉的TG曲线图可知,籼米淀粉的热分解反应起始温度在270℃,热分解反应终止温度320℃,由羟乙基淀粉的TG曲线图可知羟乙基淀粉热分解反应起始温度在220℃,热分解反应终止温度340℃。从图5a可以看出籼米淀粉的DSC曲线在113℃和280℃出现了吸热峰,分别是由于淀粉中的水分及淀粉融熔引起的[18],而在图5b中羟乙基淀粉的DSC曲线,2个峰的位置温度都有所降低(分别是100℃和248℃),综上所述,羟乙基淀粉与原淀粉相比,水分蒸发温度降低,融熔温度降低。即原淀粉经过羟乙基化后热稳定性降低。
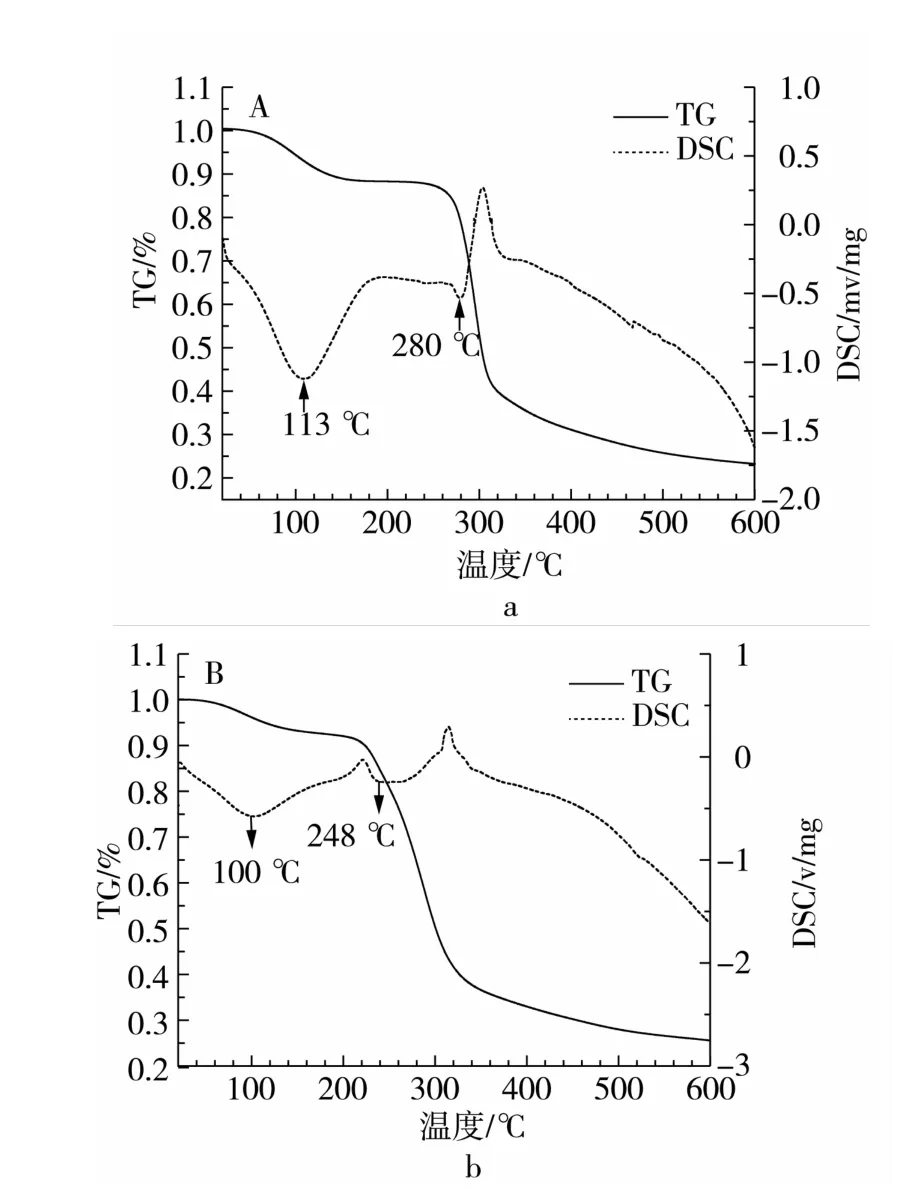
图5 籼米淀粉与羟乙基籼米淀粉的TG-DSC图
3 结论
通过考察温度、无水乙醇、氯乙醇、氢氧化钠、反应时间5个因素对工艺进行了优化,在籼米淀粉10.0 g,蒸馏水为30 mL条件下,得到的合成羟乙基籼米淀粉的优化条件为:温度为50℃,无水乙醇50 mL,氯乙醇4 g,氢氧化钠2.4 g,反应时间为8 h。由XRD和SEM的结果可知,醚化作用主要发生在非结晶区并没有使晶型发生改变;通过超声波处理后,羟乙基籼米淀粉的晶体结构由A型变为V型,超声波的作用破坏晶型结构与颗粒形貌,颗粒发生团聚,粒度增大,结晶度降低;通过原淀粉及羟乙基籼米淀粉的FTIR图谱可知,淀粉在3 410 cm-1为—OH的伸缩振动吸收峰增强,在859、762、575 cm-1处的—CH2— 摇摆振动吸收峰更加明显,表明淀粉发生了羟乙基化;由TG-DSC图表明,羟乙基籼米淀粉与原淀粉相比,水分蒸发温度降低,融熔温度降低,热稳定性降低。
[1]Guangxu Zhang,Yan She,Yanqing You,et al.The application of an advanced visualized method in synthesis process optimization of carboxymethyl hydroxyethyl starch[J].Carbohydrate Polymers,2010,79:673-676
[2]陈蔚江,范慧红,徐康森.气相色谱法测定羟乙基淀粉摩尔取代级[J].药物分析杂志,2003,23(2):97-99 Chen Weijiang,Fan Huihong,Xu Kang-sen.GC determination of molar substitution of hydroxyethyl starch[J].Journal of Pharmaceutical Analysis,2003,23(2):97-99
[3]Song X Y,Chen Q H,Ruan H,et al.Synthesis and paste properties of octenyl succinic anhydride modified early indica rice starch[J].Journal of Zhejiang University Science B,2006,7(10):800-805
[4]刘忠义,彭丽,包浩,等.羧甲基籼米淀粉的理化性质及其在冰淇淋中的应用[J].现代食品科技,2015,31(3):184-189 Liu Zhongyi,Peng Li,Bao Hao,et al.Physical and chemical properties of carboxymethyl indica starch and in ice cream [J].Modern Food Science and Technology,2015,31(3):184-189
[5]陈正行,王韧,王莉,等.稻米及其副产品深加工技术研究进展[J].食品与生物技术学报,2012,31(4):355-364 Chen Zhengxing,Wang Ren,Wang Li,et al.Development in deep processing technology of rice and by-products[J].Journal of Food Science and Biotechnology,2012,31(4):355-364
[6]Chowdary K P R,Enturi V,Sandhya Rani A.Preparation and evaluation of starch phosphate-a new modified starch as a disintegrant in tablet formulations[J].International Journal of Chemical Sciences,2011,9(2):889-899
[7]田丹青,沈希宏,舒小丽,等.稻米淀粉的理化特性及其应用现状和进展[J].核农学报,2010,24(1):93-97 Tian Danqing,Shen Xihong,Shu Xiaoli,et al.Physicochemical properties and utilization of rice starch[J].Journal of Nuclear Agricultral Sciences,2010,24(1):93-97
[8]郑桂富.可用作代血浆的羟乙基淀粉200/0.5及其制备方法:中国,103087206[A].2013-05-08 Zheng Guifu.Hydroxyethyl starch 200/0.5 of used as plasma substitute preparation method:China,103087206[A].2013 -05-08
[9]Mourits,J Merkus,H de Galan L.Gas chromatographic determination of hydroxyethyl derivatives of glucose[J].Analytical Chemistry,1976,48(11):1557-1562
[10]彭丽,刘忠义,包浩,等.羧甲基化反应对大米淀粉性质影响的研究[J].食品工业科技,2015,26(6):138-142 Peng Li,Liu Zhongyi,Bao Hao,et al.Study on the effect of carboxymethylation on properties of rice starch[J].Science and Technology of Food Industry,2015,26(6):138-142
[11]Zhang L,Xie W,Zhao X,et al.Study on the morphology,crystalline stucture and thermal properties of yellow ginger starch acetates with different degrees of substitution[J]. Thermochimica,2009,495(1):57-62
[12]佘艳.羧甲基-羟乙基多元复合变性淀粉合成工艺的研究[D].武汉:武汉理工大学,2008 She Yan.The research of carboxymethyl-hydroxyethyl compound modified starch synthesis process[D].Wuhan:Wuhan University of Technology,2008
[13]张光旭,胡张雁,尤燕青,等.相转移催化合成羧甲基-羟乙基淀粉及工艺优化[J].中国粮油学报,2011,26 (12):34-38 Zhang Guangxu,Hu Zhangyan,You Yanqing,et al.Phase transfer catalytic synthesis of carboxymethyl hydroxyethyl starch and process optimization[J].Journal of the Chinese Cereals and Oils Association.2011,26(12):34-38
[14]谢涛,杨春丰,亢灵涛,等.超微粉碎锥栗淀粉的理化性质变化[J].现代食品科技,2014,30(6):121-125 Xie Tao,Yang Chunfeng,Kang Lingtao,et al.Changes of physicochemical properties of superfin grinding starch from castanea henryi[J].Modern Food Science and Technology,2014,30(6):121-125
[15]Han Fei,Gao Chunmei,Liu Mingzhu,et al.Synthesis,optimization and characterization of acetylated corn starch with the high degree of substitution[J].International Journal of Biological Macromolecules,2013,59:372-376
[16]Zhou Gang,Luo Zhigang,Fu Xiong.Preparation and characterization of starch nanoparticles in ionic liquid-in-oil microemulsions system[J].Industrial Crops and Products,2014,52:105-110
[17]田斌强,邓乾春,谢笔钧.发芽燕麦淀粉的热特性[J].现代食品科技,2014,30(5):98-103 Tian Bingqiang,Deng Qianchun,Xie Bijun.Thermal properties of the starch from germinated oat[J].Modern Food Science and Technology,2014,30(5):98-103
[18]Qianqian Li,Fu Liu,Li Zhang,et al.In situ construction of potato starch based carbon nanofiber/activated carbon hybrid structure for high-performance electrical double layer capacitor[J].Journal of Power Sources,2012,207:199-204.
Preparation and Structure Features of
Hydroxyethyl Indica Rice Starch
Chen Ting Liu Zhongyi Qiao Lijuan Wang Yongqiang Yang Ju
(Collage of Chemical Engineering,Xiangtan University,Xiangtan 411105)
Using indica rice starch as raw material,hydroxyethyl indica rice starch was prepared by chloroethanol as etherifying agent through solvent method combined with ultrasonic treatment of starch.Through thesingle factor experiment,synthesis conditions of hydroxyethyl indica rice starch were optimized.And structure features of hydroxyethyl indica rice starch were analyzed by FTIR,XRD,SEM and TG-DSC,respectively.The results showed that under the basic conditions of the milled starch 10.0 g and distilled water 30 mL,the optimun conditions include temperature of 50℃,sodium hydroxide of 2.4 g,chloride anhydrous ethanol of 50 mL,ethanol of 4 g and reaction time of 8 h.X-ray diffraction and scanning electron microscope analysis indicated that the etherification reaction of indica rice starch mainly occurs in the amorphous region,and the etherification reaction fails to change the crystal shape of crystallization area of starch.After ultrasonic treatment and etherificating,the crystal structure and morphology of the particles of indica rice starch were destroyed.Comparison on the infrared spectrum of original starch and hydroxyethyl indica rice starch,hydroxyethylation occurs in the indica rice starch molecules.The thermal stability analysis proved that water evaporation temperature and melting temperature of indica rice starch were decreased after hydroxyethylation.Ultrasonic treatment contributes to the synthesis of hydroxyethyl starch and destruction of the original starch crystal structure.
indica rice starch,hydroxyethyl indica rice starch,structure feature,degree of substitution(MS )
TS235.1
A
1003-0174(2017)03-0030-06
国家农转资金(2013GB2D200332),湖南省科技厅农业支撑计划重点项目(2015NK3034),粮食发酵深加工工艺与技术(江南大学)国家工程实验室科技项目(KH02010)
2015-07-22
陈婷,女,1991年出生,硕士,食品、生物与制药工程
刘忠义,男,1964年出生,教授,食品加工
