吴茱萸总碱对大鼠原代心肌细胞肥大的抑制作用
2017-04-25林淑娴张婧怡李利生孙安盛
林淑娴, 张婧怡, 李利生, 吴 芹, 孙安盛
(1. 遵义医学院 药理学教研室暨贵州省基础药理重点实验室, 贵州 遵义 563099; 2. 贵州省肿瘤医院 药剂科, 贵州 贵阳 550001; 3. 山东省潍坊市人民医院 药剂科, 山东 潍坊 261041)
基础医学研究
吴茱萸总碱对大鼠原代心肌细胞肥大的抑制作用
林淑娴1,2, 张婧怡1,3, 李利生1, 吴 芹1, 孙安盛1
(1. 遵义医学院 药理学教研室暨贵州省基础药理重点实验室, 贵州 遵义 563099; 2. 贵州省肿瘤医院 药剂科, 贵州 贵阳 550001; 3. 山东省潍坊市人民医院 药剂科, 山东 潍坊 261041)
目的 研究吴茱萸总碱对血管紧张素Ⅱ(AngⅡ)诱导大鼠心肌细胞肥大的抑制作用, 探讨其可能的作用机制。方法 应用胰酶和Ⅱ型胶原酶混合消化法制备新生大鼠原代心肌细胞。实验随机分为正常对照组, 模型组(AngⅡ0.1 μmol/L), Eta 1、10、100 mg/L组和Eta 100 mg/L+L-NAME(1.5×10-2mol/L)组。心肌细胞加入不同浓度Eta 30 min后再加入AngⅡ 0.1 μmol/L作用24 h。采用Image-Pro Plus 6.0图像分析系统测量心肌细胞的表面积, BCA 法测定总蛋白含量, 比色法测定细胞培养上清液中一氧化氮(NO)含量和一氧化氮合酶(NOS)活性, RT-PCR 检测心房利钠肽(ANP)、丝裂素活化蛋白激酶磷酸酶-1(MKP-1)和内皮型一氧化氮合酶(eNOS)基因的表达。结果 与正常对照组比较, AngⅡ 0.1 μmol/L明显诱导心肌细胞肥大, 增加心肌细胞表面积、细胞蛋白质含量和ANP mRNA的表达; 降低NOS活性、NO含量和eNOS mRNA表达。与模型组比较, Eta 10和100 mg/L明显抑制AngⅡ诱导的心肌细胞肥大, 心肌细胞表面积、蛋白质含量及ANP mRNA的增加; 明显增加eNOS和MKP-1 mRNA表达、NOS活性和NO的产生。L-NAME能取消Eta抗心肌细胞肥大效应。结论 Eta可抑制AngⅡ诱导的心肌细胞肥大, 作用机制可能与Eta增加心肌细胞NO的生成,促进MKP-1表达,增加MAPK去磷酸化有关。
吴茱萸总碱; 心肌细胞肥大; 血管紧张素Ⅱ; 一氧化氮
心室肥厚是心血管疾病独立的危险因子, 能明显增加心血管恶性事件的发生率和死亡率[1]。心肌细胞肥大是心室肥厚的细胞学特征, 主要表现为细胞体积增大、表面积增加和细胞蛋白质合成增多。探讨心肌细胞肥大的调控机制对防治心血管疾病具有重要意义。吴茱萸是我国传统中药,中医药用其未成熟果实, 其药性热味苦辛, 具有降逆止呕、散寒止痛等功效。现代药理学研究证实, 吴茱萸所含生物碱具有广泛的心血管生物活性, 如抗血管平滑肌细胞增殖[2]、抗动脉粥样硬化[3]、维护心血管功能等作用[4-5]。近来研究表明, 吴茱萸提取物或总碱对大鼠心室肥厚具有防治作用[6-8]。该实验旨在明确吴茱萸总碱(evodia total alkaloids, Eta)对AngⅡ诱导心肌细胞肥大的抑制作用, 并探讨可能的作用机制。
1 材料与方法
1.1 试药与试剂 吴茱萸总碱(南京泽朗医药科技有限公司, 纯度98%, 生产批号: ZL130608269); N-硝基-L-精氨酸甲酯(L-NAME)、AngⅡ、5′-BrdU (Sigma公司); 胎牛血清(FBS)、BCA蛋白检测试剂盒、抗α-actin抗体试剂盒(南京建成生物工程研究所); RIPA裂解液、一氧化氮(nitric oxide, NO)和一氧化氮合酶(nitric oxide synthase, NOS)试剂盒(碧云天生物技术研究所); 逆转录试剂盒、β-actin、心房利钠肽(atrial natriuretic peptide, ANP)、丝裂素活化蛋白激酶磷酸酶-1 (mitogen-activated protein kinase phosphatase-1, MKP-1)和内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)引物(美国Gene ray公司),引物序列(见表1)。
表1 RT-PCR的引物对
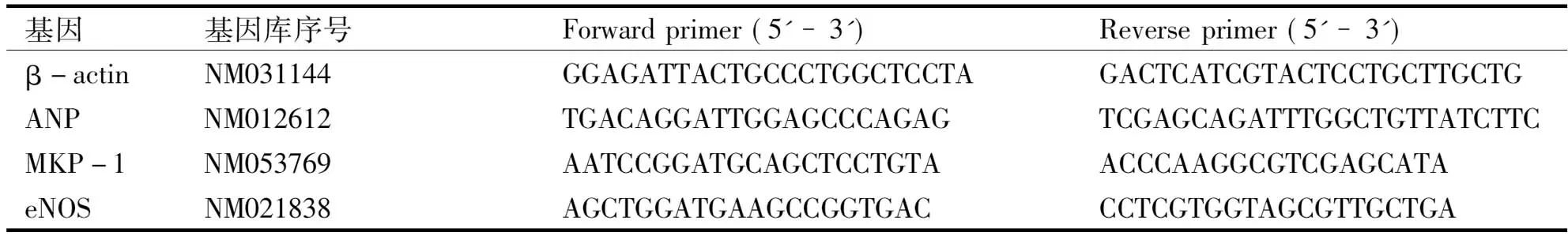
基因基因库序号Forwardprimer(5'-3')Reverseprimer(5'-3')β-actinNM031144GGAGATTACTGCCCTGGCTCCTAGACTCATCGTACTCCTGCTT-GCTGANPNM012612TGACAGGATTGGAGCCCAGAGTCGAGCAGATTTGGCTGT-TATCTTCMKP-1NM053769AATCCGGATGCAGCTCCTGTAACCCAAGGCGTCGAGCATAeNOSNM021838AGCTGGATGAAGCCGGTGACCCTCGTGGTAGCGTTGCTGA
1.2 仪器 CO2培养箱、NanoDrop2000超微量分光光度计(美国Thermo公司); 超净工作台(苏州净化设备厂); DMEM(美国Gibco 公司); Real-Time RT-PCR扩增仪、酶标仪、Mini Trans-Bloe电泳仪(美国BIO-RAD公司); 逆转录仪(德国Eppendorf公司); Leica光学显微镜(德国Leica公司); TMS-1015倒置显微镜(日本OLYMPUS公司)。
1.3 动物 清洁级SD大鼠雌鼠20只, 雄鼠10只, 体重180~200 g, 购于第三军医大学大坪医院实验动物中心, 许可证号: SCXK(渝)2012-0005。饲养于贵州省基础药理重点实验室SPF级动物房。取1~3 d新生乳鼠心脏, 用于原代心肌细胞培养。
1.4 大鼠心肌细胞培养、分组及给药 大鼠原代心肌细胞的培养参照文献[9], 简言之, 无菌条件下迅速取出乳鼠心尖部组织,在预冷的PBS液中清洗后剪为1~3 mm3组织块, 经胰蛋白酶和Ⅱ型胶原酶混合消化, 用20%胎牛血清的DMEM培养液悬浮, 置CO2孵箱中差速贴壁60 min。取上清, 细胞培养前5′-BrdU抑制非心肌细胞增殖, 然后改为无胎牛血清的 DMEM 同步化24 h。实验分为正常对照组(不含血清DMEM培养基), 模型组(AngⅡ 0.1 μmol/L), Eta低(Eta 1 mg/L)、中(Eta 10 mg/L)、高(Eta 100 mg/L)浓度组和Eta-H+L-NAME组(Eta 100 mg/L+L-NAME 1.5×10-2mol/L)组。Eta各试药组加入Eta 30 min后再加入AngⅡ0.1 μmol/L, 作用24 h后检测各项指标。
1.5 心肌细胞鉴定 将载有心肌细胞生长的玻片, 经PBS漂洗, 4%多聚甲醛固定, 加一抗(抗大鼠α-actin), 4 ℃湿盒过夜, 生物素化二抗, DAB显色, 再经苏木素复染胞核后梯度酒精浓度脱水, 中性树脂封片。相差显微镜下观察, 胞质染为棕黄色为心肌细胞。
1.6 检测量心肌细胞表面积 细胞密度1×106个/mL, 接种于含盖玻片的6孔板中, 每组5孔,各组给药后培养24 h, 相差法拍摄细胞, 使用Image-Pro Plus 6.0图像分析系统测量单个细胞的表面积, 每组随机拍摄5张图片, 每个图片随机检测10个细胞, 取平均值。
1.7 测量心肌细胞蛋白含量 心肌细胞总蛋白质含量的测定, 心肌细胞5×105个/mL密度接种于24孔板中(每组5孔), 各组加入不同试药24 h后吸弃培养基, 经RIPA裂解30 min, 收集细胞, 冰浴下超声破碎细胞, 4 ℃, 12 000 ×g离心30 min, 吸取上清液按BCA蛋白浓度检测试剂盒说明书操作。酶标仪波长562 nm, 检测每孔细胞的蛋白含量, 进而计算出每组单个细胞的蛋白含量。
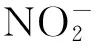
1.9 检测基因的表达 细胞密度2.0×106个/mL接种于12.5 mL培养瓶, 培养48 h后Trizol一步法提取细胞总RNA, 紫外分光光度计波长260和280 nm检测吸光度值(A), 两者比值1.8~2.0, 纯度良好。两步法逆转录cDNA:反应条件为37 ℃ 15 min,85 ℃ 5 s,反应终止。Real-time PCR扩增:反应条件95 ℃ 10 min预变性,95 ℃ 15 s变性,60 ℃ 1 min退火,循环40 次。采用相对定量法分析PCR结果,以β-actin基因为内参照,使用2-ΔΔCt法计算ANP、MKP-1和NOS基因的相对表达水平。
2 结果
2.1 心肌细胞形态观察及鉴定 显微镜下观察结果(见图1)显示, 培养的心肌细胞3 h后见其贴壁生长, 培养1 d可见多数心肌细胞自发搏动, 初期心肌细胞呈圆形, 3~4 d后为梭形并逐渐伸出伪足, 形成不规则的星形, 交织成网, 细胞核1~2个。培养的心肌细胞经α-肌动蛋白免疫组化染色, 胞质染为棕黄色被视为心肌细胞, 心肌细胞阳性率达 95%以上, 符合实验要求。

图1 α-肌动蛋白免疫组化染色鉴定心肌细胞(×400)
2.2 Eta对AngⅡ诱导心肌细胞肥大的抑制作用 表2结果表明, 与正常对照组比较, 模型(Ang II)组显著增加心肌细胞的表面积和心肌细胞的蛋白含量, 分别增加了2倍和1.6倍。RT-PCR结果显示, 正常心肌细胞ANP mRNA表达低, 模型组与正常对照组比较, ANP mRNA的表达增加了近1倍。Eta 1、10 和100 mg/L抑制心肌细胞肥大作用呈现一定的浓度-效应关系, 对心肌细胞表面积的抑制率分别是9%、35.2%和57.2%; 蛋白含量的抑制率分别为5.8%、25.2%和44.7%; 下调AngⅡ诱导的ANP mRNA表达增加, 分别下调14.7%、21.8%和 38.1%。
为了排除Eta给药浓度过大产生的毒性作用, 影响对心肌细胞指标的观察, 实验设有所用Eta最大给药浓度(100 mg/L)对照组, 结果表明该浓度对各观察指标没有明显影响(P>0.05)。
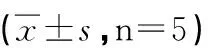
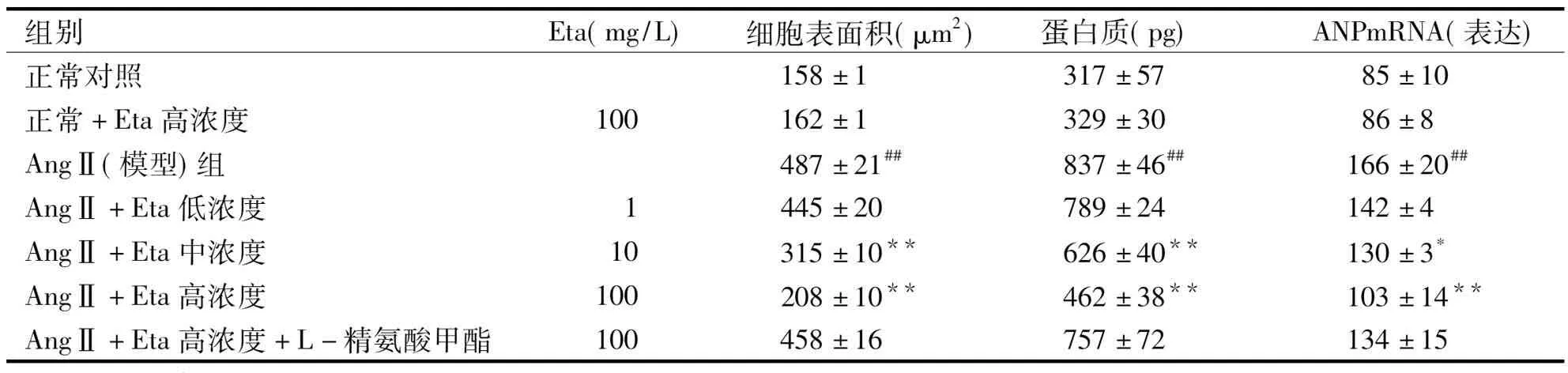
组别Eta(mg/L)细胞表面积(μm2)蛋白质(pg) ANPmRNA(表达)正常对照158±1317±5785±10正常+Eta高浓度100162±1329±3086±8AngⅡ(模型)组487±21##837±46##166±20##AngⅡ+Eta低浓度1445±20789±24142±4AngⅡ+Eta中浓度10315±10**626±40**130±3*AngⅡ+Eta高浓度100208±10**462±38**103±14**AngⅡ+Eta高浓度+L-精氨酸甲酯100458±16757±72134±15
##:与正常对照比,P<0.01;*:与模型组比,P<0.05;**:与模型组比,P<0.01。
2.3 Eta对AngⅡ诱导所致肥大心肌细胞NO含量和NOS活性的影响 表3结果表明,与正常对照组相比,模型组培养基中NO含量和NOS活性显著降低(P<0.01)。与模型组相比,Eta中、高浓度组培养基中NO含量和NOS活性明显升高(P<0.01);Eta低浓度组NO含量和NOS活性有增加趋势,但增加不明显(P>0.05);Eta高浓度+L-精氨酸甲酯组NO含量和NOS活性与模型组比较无明显变化(P>0.05),表明Eta促进NO生成和增强NOS活性的作用被L-精氨酸甲酯取消。
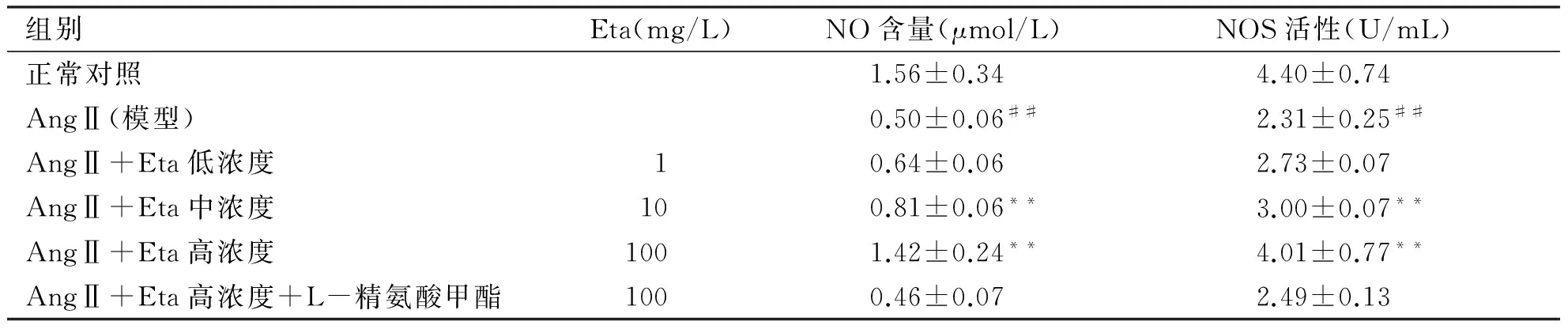
组别Eta(mg/L)NO含量(μmol/L) NOS活性(U/mL) 正常对照1.56±0.344.40±0.74AngⅡ(模型)0.50±0.06##2.31±0.25##AngⅡ+Eta低浓度10.64±0.062.73±0.07AngⅡ+Eta中浓度100.81±0.06**3.00±0.07**AngⅡ+Eta高浓度1001.42±0.24**4.01±0.77**AngⅡ+Eta高浓度+L-精氨酸甲酯1000.46±0.072.49±0.13
##:与正常对照比,P<0.01;**:与模型组比,P<0.01。
2.4 Eta对AngⅡ所致肥大心肌细胞MKP-1和eNOS mRNA表达的影响 RT-PCR检测结果(见表4)显示,与正常对照组相比,模型组MKP-1和eNOS mRNA的表达显著下调,分别下降了49%(P<0.01)和75.2%(P<0.01)。与模型组比较,Eta中、高浓度组显著增加MKP-1和eNOS mRNA的表达;低浓度Eta的影响不明显(P>0.05)。
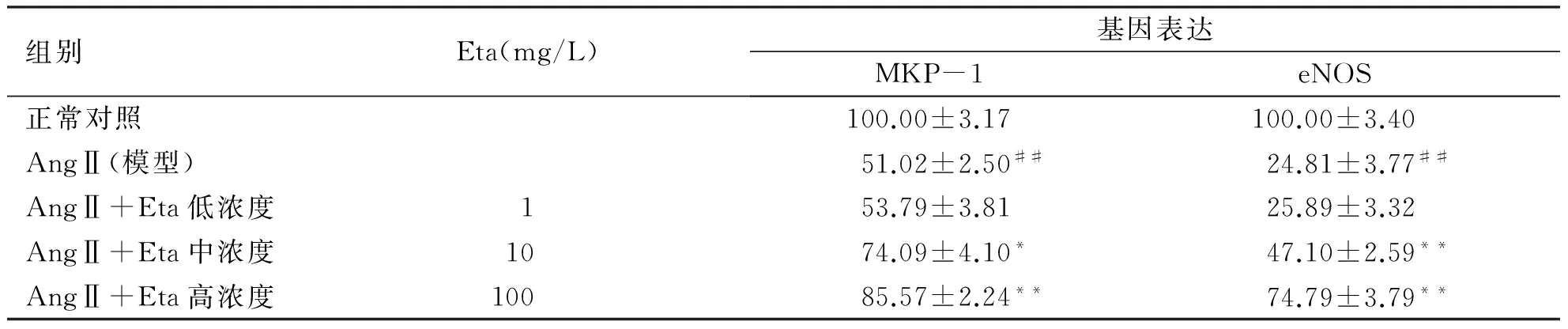
组别Eta(mg/L)基因表达MKP-1eNOS正常对照100.00±3.17100.00±3.40AngⅡ(模型)51.02±2.50##24.81±3.77##AngⅡ+Eta低浓度153.79±3.8125.89±3.32AngⅡ+Eta中浓度1074.09±4.10*47.10±2.59**AngⅡ+Eta高浓度10085.57±2.24**74.79±3.79**
##:与正常对照组比,P<0.01;*:与模型组比,P<0.05;**:与模型组比,P<0.01。
3 讨论
目前体外原代心肌细胞培养技术已广泛用于心血管疾病及药物的研究中。为了避免胰酶消化液反复多次使用对心肌细胞的损伤[10],实验采用胰酶和Ⅱ型胶原酶混合消化液,分离、提取心肌细胞,同时加入5-溴脱氧尿苷抑制成纤维样细胞的生长,从而可以获得高纯度的心肌细胞。提取、纯化的心肌细胞,通过特征性抗原标记物α-actin免疫组织化学鉴定,心肌细胞纯度大于95%。
AngⅡ是体内重要活性物质,其与AT1受体结合可活化多条信号通路,其中PLC、PKC、SRE在AngⅡ诱导的肥大反应中可能起关键作用;AngⅡ也可以直接活化丝裂原活化蛋白激酶(MAPK),MAPK在多种致肥大因子介导的心肌肥大反应中起关键作用,活化的MAPK通过转位方式进入细胞核,激活其下游底物,调控细胞生长反应。故AngⅡ现已成为诱导心肌细胞肥大常用的工具药。
我们近期的研究证实吴茱萸提取物和Eta对大鼠心室肥厚具有明显的抑制作用[6-7],该实验旨在明确Eta对心肌细胞的直接影响。实验结果表明,Eta 10和100 mg/L明显降低肥大心肌细胞表面积和蛋白含量,同时下调心肌肥大标志性基因ANP的表达,表明Eta对AngⅡ诱导心肌细胞肥大具有抑制作用。为排除高浓度Eta的毒性作用,实验还设立了Eta最大给药浓度(100 mg/L)空白对照组,结果表明这一剂量对心肌细胞的生长无明显影响。
NO是体内重要的活性物质,eNOS具有合成NO的能力,eNOS主要表达于血管内皮细胞和心肌细胞中。已有大量研究证实NO具有抗心肌肥大的作用[11-14],有报道指出给予合成NO的前体物质L-精氨酸后能诱导肥厚心肌组织中eNOS和MAPK磷酸酶-1(MKP-1)的表达,MKP-1使p-MAPK去磷酸化而使后者失活,产生抗心肌细胞肥大作用[14],这一作用可被NOS抑制剂L-NAME阻断。本实验结果表明Eta中、高剂量组在抑制AngⅡ诱导心肌细胞肥大的同时能上调eNOS和MKP-1 mRNA的表达,增加NOS的活性和NO的含量。NOS抑制剂L-NAME与Eta合用,能抑制后者增加NO产生的同时,取消了Eta抗心肌细胞肥大作用,进一步提示Eta的抗心肌细胞肥大作用与上调eNOSmRNA的表达,增加NO的生成,促进MKP-1的表达,增加了MAPK去磷酸化实现的。
[1] 潘建红,王佩显.高血压左室肥厚机制的研究进展[J].重庆医学, 2015, 44(30): 4292-4294.
[2] Li Y J, Zhang F, Gong Q H, et al. Rutaecarpine inhibits angiotensin II-induced proliferation in rat vascular smooth muscle cells[J]. Chin J Integr Med, 2014, 20(9): 682-687.
[3] Wei J, Ching L C, Zhao J F, et al. Essential role of transient receptor potential vanilloid type 1 in evodiamine-mediated protection against atherosclerosis[J]. Acta Physiol (Oxf), 2013, 207(2): 299-307.
[4] Jia S, Hu C. Pharmacological effects of rutaecarpine as a cardiovascular protective agent[J]. Molecules, 2010, 15(3): 1873-1881.
[5] Li J Z, Peng J, Xiao L, et al. Reversal of isoprenaline induced cardiac remodeling by rutaecarpine via stimulation of calcitonin gene related peptide production[J]. Can J Physiol Pharmacol, 2010, 88(10): 949-959.
[6] 张婧怡, 林淑娴, 侯化化, 等. 吴茱萸总碱抑制大鼠左室肥厚及对钙调神经磷酸酶信号通路的影响[J]. 遵义医学院学报, 2014, 37(2): 151-155.
[7] 高永双, 孙安盛, 何娜, 等. 吴茱萸提取物对大鼠右室肥大细胞外信号调节激酶-mRNA表达的抑制作用[J]. 时珍国医国药, 2011, 22(5): 1122-1123.
[8] 高永双, 孙安盛, 何娜, 等. 吴茱萸提取物对大鼠右室肥大及钙调神经磷酸酶的抑制作用研究[J]. 中国药房, 2011, 22(27): 2508-2510.
[9] 何娜, 孙安盛, 吴芹, 等. 钩藤碱对血管紧张素Ⅱ诱导的心肌细胞肥大的抑制作用[J]. 中国药理学与毒理学杂志, 2010, 24(4): 255-260.
[10] 许家林. 大鼠心肌细胞培养方法的改良及PE诱导心肌肥大[J].中国药理通讯, 2009, 26(2): 76-77.
[11] Saraiva R M, Hare J M. Nitric oxide signaling in the cardiovascular system: implications for heart failure[J]. Curr Opin Cardiol, 2006, 21(3): 221-228.
[12] Buys E S, Raher M J, Blake S L, et al. Cardiomyocyte-restricted restoration of nitric oxide synthase 3 attenuates left ventricular remodeling after chronic pressure overload[J]. Am J Physiol Heart Circ Physiol, 2007, 293(1): 620-627.
[13] Lin Y, Liu J C, Zhang X J, et al. Downregulation of the ornithine decarboxylase/polyamine system inhibits angiotensin-induced hypertrophy of cardiomyocytes through the NO/cGMP-dependent protein kinase type-I pathway[J]. Cell Physiol Biochem, 2010, 25(4/5): 443-450.
[14] 刘培庆, 鲁伟, 潘敬运. 一氧化氮抑制AngⅡ介导的心肌肥大反应的信号机制[J]. 生理学报, 2002, 54(3): 213-218.
[收稿2016-11-10;修回2016-12-28]
(编辑:王静)
Evodia total alkaloids protect against rat cardiomyocyte hypertrophy in vitro
LinShuxian1, 2,ZhangJingyi1, 3,LiLisheng1,WuQin1,SunAnsheng1
(1. Department of Pharmacology and The Key Laboratory of Basic Pharmacology of Guizhou Province, Zunyi Medical University, Zunyi Guizhou 563099, China; 2.Department of Pharmacy, Guizhou Cancer Hospital, Guiyang Guizhou 550001, China; 3. Department of Pharmacy, Weifang People’s Hospital, Weifang Shandong 261041, China)
Objective This study was designed to investigate the inhibition of evodia total alkaloids (Eta) on rat cardiomyocyte hypertrophy induced by angiotensinⅡ(Ang II) in vitro and to explore the underlying mechanisms. Methods The primary cardiomyocytes were isolated from neonatal Sprague Dawley rats by using trypsin and type Ⅱ collagenase, and stained with anti-α-smooth-muscle-actin antibody by an immunohistochemistry method for identification. The cultured cardiomyocytes were randomly divided into 6 groups and marked as normal control group, model (AngⅡ0.1 μmol/l) group, Eta (1, 10, 100 mg/l) group, and Eta (100 g/l) + L-NAME (1.5×10-2mol/l) group. The cardiomyocytes were pretreated with Eta for 30 min and subsequently stimulated with Ang II 0.1 μmol/l. The cardiomyocyte surface area was measured with Image-Pro Plus 6.0 imaging analytic system, and the content of cell protein was determined by BCA assay. The activity of nitric oxide synthetase (NOS) and the content of nitric oxide (NO) were detected, respectively. The mRNA levels of atrial natriuretic peptide (ANP), mitogen-activated protein kinase phosphatase-1 (MKP-1) and endothelial nitric oxide synthase (eNOS) in the cardiomyocytes were analyzed by RT-PCR.Results Compared with the normal control group, Ang II (0.1 μmol/l) significantly induced cardiomyocytes hypertrophy which includes larger cell surface area, higher protein content, as well as the re-expression of ANP. The results further revealed that Eta (10, 100 mg/l) could obviously protect against Ang II-induced cardiomyocyte hypertrophy, which was associated with enhancing the activity of NOS and the content of NO, and up regulating the gene expressions of eNOS and MKP-1. The data also demonstrated that L-NAME could abolish the effect of Eta on anti-cardiomyocyte hypertrophy.Conclusion The present study suggests that Eta (10, 100 mg/l) could attenuate Ang II-induced cardiomyocyte hypertrophy by increasing the production of NO, promoting the gene expression of MKP-1, and improving the phosphorylation of MAPK.
evodia total alkaloids; cardiomyocyte hypertrophy; Ang II; nitric oxide
国家自然科学基金资助项目(NO: 81160528)。
孙安盛, 男, 教授, 硕士生导师, 研究方向: 心血管药理学, E-mail:sunansheng1945@163.com。
R285
A
1000-2715(2017)01-0017-05
