BMP和IL-6信号分子在类风湿关节炎中研究进展①
2017-04-24邹任玲张冬青
徐 鹏 邹任玲 张冬青
(上海理工大学医疗器械与食品学院,上海200093)
·专题综述·
BMP和IL-6信号分子在类风湿关节炎中研究进展①
徐 鹏 邹任玲 张冬青②
(上海理工大学医疗器械与食品学院,上海200093)
类风湿关节炎(Rheumatoid arthritis,RA)是一类以关节滑膜炎为主的慢性自身免疫性疾病,在疾病早期阶段,关节损伤通过影像学观察并不明显,但不断的全身性及关节性炎症将导致骨和软骨的侵蚀破坏,造成关节畸形,导致严重残疾,甚至死亡。目前的治疗策略及药物还是以临床缓解和低疾病活动度为主[1,2]。正常生理条件下,由成骨细胞介导的骨形成和破骨细胞介导的骨吸收是紧密联系并能保持平衡的作用,这两者主要发生在骨表面的更新被称为骨重建(Bone remodeling)。骨重建为维护骨质量和强度以及矿物质平衡起重要作用,而骨重建的失衡往往与各种骨疾病有关,打破破骨细胞与成骨细胞在骨微环境的平衡[3]。无法及时骨重建造成关节骨丢失正是慢性类风湿关节炎的重要特征。RA患者体内促炎细胞因子表达在炎症滑膜组织诱导破骨细胞生成,并抑制成骨细胞分化,结果造成关节病灶的骨侵蚀[4]。因而本文主要综述与骨重建密切相关的两个指标:BMP和IL-6,以及他们两者之间联系,为解决RA患者临床缓解骨侵蚀提供新的思路以及新的认识。
1 BMP与RA
1.1 成骨细胞 成骨细胞来源于间充质前体细胞,是表达骨生成的特征,转录因子Runx2和Osterix是成骨细胞分化所必须。成骨细胞能够产生和矿化骨基质,最初表达碱性磷酸酶和Ⅰ型胶原,其次是骨钙素(Osteocalcin)、骨桥蛋白(Osteopontin)等,且一些成骨细胞最终镶嵌在骨基质成为骨细胞,并充当感受器,再发送信号至破骨细胞促进骨吸收,或至成骨细胞促进骨形成[4]。其中BMP信号是成骨细胞分化的关键信号通路,此外Wnt信号及miRNAs和细胞因子也有调节成骨细胞分化功能。
1.2 BMP分类及作用 1965年首次报道,Urist成功应用牛脱钙骨基质植入肌肉内诱导间充质细胞分化成新的软骨和骨,并发现脱钙骨基质中含有一种特殊蛋白质称骨形态发生蛋白(Bone Morphogenetic Protein,BMP)[5]。骨形态发生蛋白属于转化生长因子(TGF-β)超家族成员,已知发现超过20多种,属于具有类似结构的高度保守功能蛋白,可在体内诱导骨,软骨,甚至肌腱组织形成与修复[6]。在间充质细胞转化,成骨细胞分化起关键作用,BMP信号中断可造成骨质量失调。BMPs主要分泌细胞有成骨细胞,软骨细胞和内皮细胞,主要配体包括BMP-2、BMP-4、BMP-6和BMP-7等。同时并非所有BMP配体都是成骨的,独特的家族成员BMP-3可抑制BMP信号,作为成骨的负调节因子。此外BMP配体抑制剂包括细胞外的Noggin和Chordin可直接竞争性结合配体,细胞内抑制型受体(Smad-6和Smad-7),可阻止BMP受体结合和信号传导[7,8]。BMP信号由 Ⅰ 型和 Ⅱ 型丝氨酸/苏氨酸激酶跨膜受体(BMPRIA、BMPRIB和BMPRⅡ)介导。这些受体在不同的组织中表达在不同的水平,这些BMPs与相应膜结合型BMP受体结合,导致SMADs 1/5/8磷酸化,再异质寡聚化Smad 4,其复合物转移至细胞核,激活BMP应答基因转录[6]。通过靠上调Runx2和Osterix的表达,促进成骨细胞分化。对于BMP对骨重建影响, 通过研究大鼠骨折模型,已证实BMP-2和BMP-6均能对其骨折愈合产生积极影响[9,10]。而在BMP家族众多成员中,BMP-2是研究最多的生长因子,并已临床应用于诱导骨形成,2007年FDA批准了应用BMP-2与可吸收胶原海绵载体的临床使用[11]。 BMPs除了确定为成骨细胞的生长和分化因子,现在也被认为是多功能性蛋白,参与几乎所有的器官的发展和不同的组织更新和维护[6]。异常的BMP信号可以导致多种发育缺陷和不同的人类疾病,包括癌症,慢性肾脏疾病、内分泌改变、血管疾病、关节和肌肉骨骼疾病等[12]。
1.3 BMP与RA RA是最常见的慢性炎症性关节炎,其特征是持续性的滑膜炎症、关节损伤和免疫反应改变[1]。几个BMP配体,包括BMP2、BMP6和BMP7,已被证实在RA患者的滑膜组织以及肿瘤坏死因子-α(Tumor necrosis factor,TNF-α)转基因小鼠关节炎模型和胶原诱导的关节炎模型中均有上调[13,14]。高水平的BMP7也已经在RA患者的滑液中得到证实,并且水平与疾病的严重程度相关[15]。相比之下,BMP4和BMP5配体在RA滑膜中下调[16]。在胶原诱导的关节炎,一个动态的BMP信号通路被激活,呈现出随时间的增加而上升的磷酸化的BR-Smad和Smad 1/5/8阳性细胞数[13]。此外,来自RA患者的成纤维细胞样滑膜细胞已经被证明表达BMP受体,并且在用促炎细胞因子例如TNF-α,IL-1β和IL-17刺激后上调BMP-2和BMP-6的表达[14]。近期通过构建RA小鼠模型,发现BMP信号的拮抗剂BMP3在关节炎病程中后期高表达,可能是骨侵蚀过程的重要因素[17]。另也有研究表明TGF-β1和BMP-2能通过ALK5和ALK1 通路抑制RA患者滑膜成纤维细胞的IL-34表达,从而可能有助于对抗炎症和RA骨侵蚀[18]。Alberto等[19]研究显示在滑膜细胞功能活动存在BMP信号通路。人RA滑膜细胞表达三种Ⅰ型BMP受体:BMPRIA,BMPRIB和ACTRIA,以及BMP-特异性Ⅱ型受体BMPR Ⅱ。RA滑膜细胞也表达BR-Smads以及共同配偶体Smad-4。并发现所有这些组分在信号转导方面是有效的,因为滑膜细胞响应于外源性BMP刺激而调节一些BMP靶基因(包括一些Runx因子和Id蛋白家族的成员)的表达的能力。此外,RA滑膜细胞表达BMP配体,这与上述论述一致[14],由此表明,滑膜细胞的一些功能活性可以通过BMP以自分泌方式调节。然而,RA滑膜细胞的刺激不仅诱导BMP配体的表达,而且还诱导BMP拮抗剂的表达,主要在单独用TNF-α或与IL-17组合处理后。 Smad-7和BAMBI是主要上调的BMP拮抗剂,分别作用于细胞内和细胞膜水平,表明BMP信号抑制必须发生在滑膜细胞本身中。这一发现表明,在RA的晚期,BMP信号通路可能不再能够控制和维持低水平的促炎因子,其将升高并持续在长期高水平促成RA发病机制,见图1。
在稳定条件下,自分泌BMP产生可下调促炎细胞因子和趋化因子以及基质金属蛋白酶的表达,并有助于在滑膜细胞使它们保持处于较低水平。随着TNF-α和IL-17的水平增加,滑膜细胞变得活化并增强BMP的产生,然而,BMP因为同时上调了BMP信号转导抑制剂的表达,不再能够控制促炎细胞因子和趋化因子以及基质金属蛋白酶的水平。然后,增加的BMP水平可能参与免疫细胞的募集和活化,反而增加促炎细胞因子,趋化因子和金属蛋白酶水平,从而加重类风湿性关节炎。
2 IL-6与RA
2.1 破骨细胞 破骨细胞来源于单核/巨噬细胞系,是表达骨侵蚀的特征,单核前体细胞分化并融合成多核破骨细胞,这些细胞表达抗酒石酸磷酸酶(Tartrate resisitant acid phosphatase,TRAP)。破骨细胞利用质子泵酸化环境,深化皱褶缘,溶解骨矿物质,并分泌组织蛋白酶K和基质金属蛋白酶(Matrix metallo proteinase,MMPs)降解骨有机基质。核因子κB受体活化配体(Receptor activator for nuclear factor-κB ligand,RANKL)是破骨细胞分化重要因子,其结合破骨前体细胞的RANK受体,有诱导破骨细胞分化的功能,促进关节骨吸收。由成骨细胞和其他细胞分泌的骨保护素(Osteoprotegerin,OPG)作为诱捕RANKL受体可抑制破骨细胞分化,因此破骨细胞产生也很大程度取决于RANKL和OPG的平衡[4]。
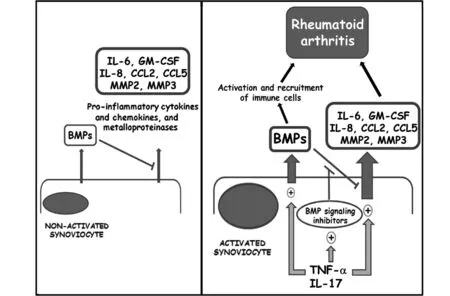
图1 BMP参与类风湿性关节炎发病机理的示意图Fig.1 Schematic representation of BMP involvement in rheumatoid arthritis pathogenesis
2.2 IL-6和IL-6受体 IL-6表达通过多因素调解,诸如NF-κb、Lin28、IL-6阳性反馈环等,gp130是IL-6家族成员(包括IL-6、IL-11、IL-27等)共有的信号转导受体[20]。IL-6主要通过两种途径传导信号,一种是传统的信号转导途径,即IL-6与膜连接的IL-6Rα结合,随后与膜连接的gp130结合;另一种是反式信号转导途径,即IL-6与sIL-6Rα结合,进而与gp130连接。之后gp130同源二聚化,二聚化的gp130使Jak家族的非受体酪氨酸激酶磷酸化并激活,Jak使gp130胞浆侧6个酪氨酸残基磷酸化,C端的4个酪氨酸残基磷酸化后招募stat3并使其磷酸化,磷酸化的stat3转位进入细胞核,激活基因的转录[21]。通过多种实验模型和研究表明,IL-6也是一种高度多效性的细胞因子,其作为一个典型的促炎性细胞因子,可由多种细胞产生,参与炎症疾病的发病机制。gp130也可触发YAP和Notch激活,转录调节,控制组织的生长和再生。独立的gp130效应STAT3,可刺激细胞增殖、分化和抵抗糜烂,促进愈合和维持屏障功能[22]。IL-6也可作为一种抗炎细胞因子介导抑制肿瘤坏死因子和IL-1作用,并激活IL-1受体拮抗剂和IL-10。在过去的十年里,大量的研究已经证明只有IL-6信号通过可溶性受体反式信号(sIL-6R)属于IL-6的有害影响,而经典的IL-6信号通过膜结合受体是IL-6参与组织再生和抗菌作用的关键[23]。
2.3 IL-6/IL-6R与RA IL-6及其受体对促B细胞增殖,下调T细胞提高免疫效率,起到一定保护作用。但细胞因子的大量产生也可使自身免疫疾病发病概率增加,如RA患者血清及关节滑液中IL-6/IL-6R升高,且浓度升高与患者临床表现轻重相关[21,24]。托珠单抗(Tocilizumab)是第一类批准上市直接以IL-6R为靶向,抑制IL-6信号通路的抗风湿类药物[25]。IL-6对骨的多效性作用是其参与RA的发病机制的关键,尽管IL-6上调RANKL表达,但它也抑制破骨细胞前体细胞分化为成熟的破骨细胞,通过扰乱RANKL信号通路,阻断IL-6亦能降低在TNF-α转基因小鼠的破骨细胞数,减少小鼠关节炎的关节损伤。亦有证明RA患者关节周围骨丢失与局部IL-6过量表达有关,但与TNF-α及IL-1表达过量无关[24,25]。IL-6参与Th17细胞的产生,由此提高IL-17的表达水平。而IL-17亦是RA炎症和骨破坏的关键,通过上调RANKL表达及诱导PGE2分泌,增加破骨细胞数量[26]。但也有研究表明IL-17和IL-6和协同效应显著促进MC3T3-E1小鼠成骨细胞矿化和分化[27]。
IL-6和可能的IL-11,通过gp130在破骨细胞中起作用,以限制破骨细胞在骨表面上的扩散。此外,IL-11作用于松质骨的破骨细胞,促进了一种或多种作用于间充质干细胞(Mesenchymal stem cell,MSC)或成骨细胞的祖细胞由破骨细胞衍生的偶联因子,以使成骨细胞分化的释放。 IL-6还在破骨细胞中发出信号,以使骨传递素(Osteotransmitters)的释放,使骨膜表面上的骨形成。这些信号从骨膜内空间到骨膜表面的传输可通过骨细胞网络发生,因为在骨形成发生的骨膜表面附近没有发现破骨细胞。在Ctsk.gp130f/f小鼠中,因减少这种偶联因子和骨传递素释放的刺激导致松质骨和骨膜表面的骨形成受损[28],见图2。
3 BMP与IL-6/IL-6R及炎症关联
破骨细胞介导的局灶性关节骨侵蚀是类风湿性关节炎的一个标志,是炎症性骨丢失的一种疾病。骨微环境中的炎症促进破骨细胞分化导致骨侵蚀。同时,炎症也抑制成骨细胞介导的骨形成,进一步促进骨的净损失。对炎症介质诱导骨形成相关BMP2评价作为一种手段,炎症也可正向调节成骨细胞功能。破骨细胞两种功能:限定功能是其吸收骨的能力,但也同时刺激骨生成成骨细胞。
长期以来,IL-6/IL-6R对BMP作用尚存在一定争议,至今没有阐明BMP信号与IL-6信号之间的调节环路。有研究表明应用IL-6R抗体能明显抑制RA滑膜成纤维细胞的活性,IL-6R抗体阻断IL-6能升高BMP-2的表达[29]。而通过BMP-2/ACS诱导异-6/sIL-6R能促进BMPRIA的细胞表面迁移,并导致放大BMP/Smad信号和增强成骨细胞分化[30]。反之用DMH1阻断BMP信号传导可显著增强IL-6、IL-8、MMPs等[19]。因此猜测BMP信号传导可以在健康滑膜细胞中以及可能还在RA的早期阶段中控制和维持低水平的促炎因子具有抗炎作用。在这方面,也提出过BMPs可以发挥作为联合保护因子的疾病控制作用,因为BMP2除了诱导成骨细胞促进骨生成,还被描述为可促进滑膜细胞凋亡[31]。BMPs可能能够抑制由RA患者的滑液所诱导的滑膜细胞的改变。同样猜测IL-6也有类似作用,但可能由于IL-6过度表达,反式信号系统过度活化介导下游JAK/STAT3信号途径异常,促自身反应性B淋巴细胞增殖分化而产生自身抗体及定向Ig类别转换,诱导原始CD4 T向Th17细胞分化,并抑制Treg细胞生成,导致Th17/Treg细胞失衡[24],从而诱发多种自身免疫性疾病,包括RA。

图2 IL-6及gp130在松质骨和皮质骨的破骨细胞的关键作用Fig.2 Key roles of IL-6 and gp130 in osteoclasts in trabecular and cortical bone
4 展望
综上所述,细胞因子是炎症诱导骨丢失发病机制的关键,导致成骨细胞介导骨生成和破骨细胞介导骨吸收不平衡,由此扰乱正常骨重建,造成RA患者的关节骨侵蚀。其中BMPs及IL-6作为成骨细胞与破骨细胞的重要参与细胞因子,通过正向促进与反向抑制,同时对其他细胞因子的调节作用,在通过各自独有的信号通路,对类风湿关节炎的发病机制起到了关键作用,本课题组在国家自然科学基金和上海市科委重点项目的资助下,积累和揭示了BMPs和IL-6通过各自信号通路及其互相串话,以及正反双向调节在解析RA的免疫病理学发病机制和研制抗IL-6R的治疗性抗体已初见成果,深入研究发现介导RA发病的新靶点进一步阐明BMPs及IL-6在调控患者骨代谢与免疫重建将为临床医生诊断和治疗患者提供了一新的思路和手段。
[1] Daniel A,Tuhina N,Alan J,etal.Rheumatoid arthritis classification criteria:An American college of rheumatology/european league against rheumatism collaborative initiative[J].Arthritis Rheumatism,2010,69(9):1580-1588.
[2] Smolen JS,Breedveld FC,Burmester GR,etal.Treating rheumatoid arthritis to target:2014 update of the recommendations of an international task force[J].Annals Rheumatic Dis,2015,26(3):355.
[3] Nakashima T.Bone and calcium research update regulation of bone remodeling by osteocytes[J].Clin Calcium,2015,25(1):21-28.
[4] Shaw AT,Gravallese EM.Mediators of inflammation and bone remodeling in rheumatic disease[J].Semin Cell Developmental Biology,2015,49:2-10.
[5] Urist MR.Bone:formation by autoinduction[J].Science,1965,150(3698):893-899.
[6] Miyazono K,Kamiya Y,Morikawa M.Bone morphogenetic protein receptors and signal transduction[J].J Biochemis,2010,147:35-51.
[7] Rosen V.BMP and BMP inhibitors in bone[J].Annals N Y Acad Sci,2006,1068(1):19-25.
[8] Kloen P,Lauzier D,Hamdy RC.Co-expression of BMPs and BMP-inhibitors in human fractures and non-unions[J].Bone,2012,51(1):59-68.
[9] Schwabe P,Greiner S,Ganzert R,etal.Effect of a novel nonviral gene delivery of BMP-2 on bone healing[J].Sci World J,2012,2012:560142.
[10] Fischerauer EE,Manninger M,Seles M,etal.BMP-6 and BMPR-la are up-regulated in the growth plate of the fractured tibia[J].J Orthop Res,2013,31(3):357-363.
[11] Razzouk S,Sarkis R.BMP-2:biological challenges to its clinical use[J].N Y State Dental J,2012,78(5):37-39.
[12] Bandyopadhyay A,Yadav PS,Prashar P.BMP signaling in development and diseases:a pharmacological perspective[J].Biochemical Pharmacol,2013,85:857-864.
[13] Daans M,Lories RJ,Luyten FP.Dynamic activation of bone morphogenetic protein signaling in collagen-induced arthritis supports their role in joint homeostasis and disease[J].Arthritis Res Therapy,2008,10:R115.
[14] Lories RJ,Derese I,Ceuppens JL,etal.Bone morphogenetic proteins 2 and 6,expressed in arthritic synovium,are regulated by proinflammatory cytokines and differentially modulate fibroblast-like synoviocyte apoptosis[J].Arthritis Rheumatol,2003,48:2807-2818.
[15] Chubinskaya S,Frank BS,Michalska M,etal.Osteogenic protein 1 in synovial fluid from patients with rheumatoid arthritis or osteoarthritis:relationship with disease and levels of hyaluronan and antigenic keratan sulfate[J].Arthritis Res Ther,2006,8(3):R73.
[16] Bramlage CP,Thomas H,Christian K,etal.Decrease in expression of bone morphogenetic proteins 4 and 5 in synovial tissue of patients with osteoarthritis and rheumatoid arthritis[J].Arthritis Res Ther,2006,8(3):1-10.
[17] Matzelle MM,Shaw AT,Baum R,etal.Inflammation in arthritis induces expression of BMP3,an inhibitor of bone formation[J].Scand J Rheumatol,2016,45(5):379-383.
[18] Mary MC,Legoff B,Maugars Y,etal.BMP-2 and TGF-β inhibit IL-34 expression in rheumatoid arthritis synovial fibroblasts[J].Am J Pathol,2017,187(1):156-162.
[19] Alberto V.Blockade of bone morphogenetic protein signaling potentiates the pro-inflammatory phenotype induced by interleukin-17 and tumor necrosis factor-α combination in rheumatoid synoviocytes[J].Arthritis Res Ther,2015,17(1):1-10.
[20] Chang Q,Daly L,Bromberg J.The IL-6 feed-forward loop:a driver of tumorigenesis[J].Semin Immunol,2014,26(1):48-53.
[21] 苗 平,陆梅生,张冬青.IL-6/IL-6受体与类风湿关节炎关联性研究新进展[J].免疫学杂志,2011,271(4):355-360.
[22] Taniguchi K,Wu LW,Grivennikov SI,etal.A gp130-Src-YAP module links inflammation to epithelial regeneration[J].Nature,2015,519(7541):57-62.
[23] Garbers C,Aparicio-Siegmund S,Rose-John S.The IL-6/gp130/STAT3 signaling axis:recent advances towards specific inhibition[J].Current Opinion Immunol,2015,34:75-82.
[24] 张冬青.干扰素-β/抗白细胞介素-6受体单抗干预类风湿关节炎机制的新认识[J].诊断学理论与实践,2015,14(2):99-104.
[25] Smolen JS,Avila JC,Aletaha D.Tocilizumab inhibits progression of joint damage in rheumatoid arthritis irrespective of its anti-inflammatory effects:disassociation of the link between inflammation and destruction[J].Annals Rheumatic Dis,2011,71(5):687-693.
[26] Bettelli E,Carrier Y,Gao W,etal.Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J].Nature,2006,441(7090):235-238.
[27] Sritharan S,Kannan TP,Norazmi MN,etal.Interleukin 6 and/or interleukin 17A modulate the OPG/RANKL system of MC3T3-E1 murine osteoblast cell line[J].International J Peptide Res Therapeutics,2016:1-10.
[28] Johnson RW,Mcgregor NE,Brennan HJ.Glycoprotein130 (Gp130)/Interleukin-6 (IL-6) signalling in osteoclasts promotes bone formation in periosteal and trabecular bone[J].Bone,2015,81:343-351.
[29] 蔡月明, 陶 可, 曾 晖,等.类风湿性关节炎滑膜成纤维细胞骨保护素和骨形态发生蛋白-2的表达及干预[J].国际免疫学杂志,2014,37(4):356-360,362.
[30] Huang RL,Chen G,Wang W,etal.Synergy between IL-6 and soluble IL-6 receptor enhances bone morphogenetic protein-2/absorbable collagen sponge-induced bone regeneration via regulation of BMPRIA distribution and degradation[J].Biomaterials,2015,67:308-322.
[31] Lories RJ,Luyten FP.Bone morphogenetic proteins in destructive and remodeling arthritis[J].Arthritis Res Ther,2007,9(2):1-7.
[收稿2016-12-22]
(编辑 许四平)
10.3969/j.issn.1000-484X.2017.04.028
①本文为国家自然科学基金面上项目(31270963、31570903)、上海市科委生物医药处科技支撑重点项目(14431903700)和上海市科学技术委员会科研计划项目(14441905100)。
徐 鹏(1983年-),男,在读硕士,主要从事生物医学工程及免疫学研究,E-mail:paynexu@sina.com。
及指导教师:邹任玲(1971年-),女,博士,教授,硕士生导师,主要从事生物医学工程研究,E-mail:zourenling@163.com。 张冬青(1955年-),男,硕士,教授,硕士生导师,主要从事医学免疫学研究,就职于上海交通大学医学院,上海市免疫学研究所,E-mail:dqzhang1333@163.com。
R392
A
1000-484X(2017)04-0611-05
②上海交通大学医学院,上海市免疫学研究所,上海200025。
