Ⅰ型干扰素通路IRF5基因多态性与系统性红斑狼疮的关联性研究①
2017-04-24李红梅刘水和叶震璇
李红梅 刘水和 叶震璇 张 华
(贵州省人民医院检验科,贵阳550002)
Ⅰ型干扰素通路IRF5基因多态性与系统性红斑狼疮的关联性研究①
李红梅 刘水和②叶震璇 张 华
(贵州省人民医院检验科,贵阳550002)
目的:研究Ⅰ型干扰素通路IRF5基因rs2004640、 rs10954213、rs4728142位点的单核苷酸多态性与系统性红斑狼疮易感性之间的关联。方法:运用Taqman荧光定量PCR检测218例SLE患者及200例健康对照者IRF5基因 rs10954213、rs4728142、rs2004640位点基因型,计算等位基因频率,分析其与SLE的关系;用IIF法和LIA法测定218例SLE患者血浆中抗核抗体、抗双链DNA抗体和特异性抗体,并分析其与IRF5 rs2004640、rs10954213位点基因频率的关系。结果:IRF5 rs2004640位点等位基因T频率分布SLE组高于对照组,差异有统计学意义(χ2=6.809,P=0.009),基因型GG/TT分布在两组差异有统计学意义(χ2=5.111,P=0.024,);IRF5 rs10954213位点等位基因G频率分布在SLE组高于对照组,差异有统计学意义(χ2=4.332,P=0.037);基因型GG在两组的分布差异有统计学意义(χ2=5.805,P=0.016);IRF5 rs4728142位点等位基因频率及基因型,两组比较差异无统计学意义。SLE组IRF5 rs2004640位点等位基因T和抗Sm抗体、抗Rib-P抗体相关(χ2=8.512、4.057;P=0.005、0.048)。218例SLE患者中活动期患者特异性抗体主要以Anti-NUC、Anti-His、Anti-Rib-P为主,两组比较差异有统计学意义(P<0.05)。结论:IRF5基因rs2004640、rs10954213基因位点单核苷酸多态性与SLE 易感性相关,rs4728142基因位点单核苷酸多态与SLE易感性不相关;IRF5 rs2004640 T等位基因和抗Sm抗体、Anti-Rib-P抗体相关,SLE活动期患者特异性抗体主要以抗ds-DNA抗体、抗NUC抗体、抗His抗体、抗Rib-P抗体为主。
SLE;Ⅰ型干扰素通路;干扰素调节因子;基因多态性;抗核抗体
系统性红斑狼疮(Systemic lupus erythemato-sus,SLE)是一种自身免疫性疾病,以体内大量自身抗体产生和免疫复合物形成为特点,发病机制不明。近年来的研究发现 SLE 患者血清中含有大量的IFN-α,体内多种免疫细胞,如T 细胞、B细胞和粒细胞,均高表达IFN诱导基因[1,2]。IFN-α 能够通过多种不同的机制调控树突状细胞及 T 细胞等免疫细胞的生存、活化及功能,进而促进 SLE 的发生发展[3]。IFN-α 的表达或者相关信号通路的活化失衡,导致自身免疫耐受被打破、机体的免疫系统异常活化,从而引起SLE的发生。干扰素调节因子(Interferon regulator factor,IRF)是一类多功能的转录因子,目前已发现10个IRFs成员:IRF1-IRF9和病毒IRF(V-IRF)。IRF可诱导干扰素的产生及调控相关基因的表达,在SLE的发病中起作用。目前已知 IRF5 不仅可以诱导干扰素的产生,并且通过 Toll 样受体通路激活干扰素下游靶基因,在SLE发病中起重要的作用[4]。IRF5作为欧洲人群SLE的易感基因[5],目前在国内已有关于中国汉族人群的研究报道,但在贵州地区少见相关报道,且贵州是多民族地区,单核甘酸多态性(Single nucleotide polymorphisms,SNPs)的等位基因频率存在种族和地区差异。因此本研究拟对贵州地区人群SLE患者与健康人群IRF5基因rs2004640、rs10954213、rs4728142位点进行联合检测,以探讨IRF5基因多态性与SLE易感性之间的关系及其等位基因对抗核抗体、特异性抗体的影响,为SLE的诊治提供新的思路。
1 资料与方法
1.1 临床资料
1.1.1 SLE组 获取知情同意后、收集2010年10月至2014年12月在贵州省人民医院门诊及住院患者218例,其中女195例、男23例,平均年龄(36.51±12.41)岁。全部病例符合1997年美国风湿病学会(American College of Rheumatology,ACR)关于SLE的分类修订标准[2]。疾病分期标准:根据病人主诉及实验室检查,结合系统性红斑狼疮疾病活动性指数(Systemic lupus erythematosus disease activity index,SLEDAI )评分[3]。
1.1.2 对照组 获取知情同意后收集2014年11月至2014年12月在贵州省人民医院门诊健康体检人员200例,其中女168例、男32例,平均年龄(38.20±9.91)岁。对照组组成的选择满足以下条件:①不满足SLE诊断标准;②无其他自身免疫性疾病及家族史;③无过敏史;④无慢性疾病史及家族史。
1.1.3 主要试剂与仪器 血液基因组DNA提取系统(非离心柱法) 、Taqman master mix扩增预混试剂、单核苷酸多态性基因分型试剂,均购于美国ABI公司;抗核抗体IgG检测试剂盒(IIF)、抗双链DNA抗体IgG检测试剂盒(IIF)、抗核抗体谱IgG检测试剂盒(LIA)均购于德国欧蒙医学诊断有限公司;7500 FAST荧光定量PCR仪购于美国ABI公司;EUROBLotMaster-44免疫印迹自动操作仪、IF Sprinter荧光自动操作仪、EUROStar 荧光显微镜均购于德国欧蒙医学诊断有限公司;ASP-2680微量核酸检测分光光度计购于美国 ACTGene公司。
1.2 方法
1.2.1 DNA提取和定量 采集受检者静脉血2.0 ml于EDTA-K2抗凝管内,根据血液基因组DNA提取系统(非离心柱法)操作步骤,提取DNA。在核酸定量仪进行测定,当OD260/OD280=1.6~1.8时为合格,要求DNA定量终浓度为10 ng/μl。
1.2.2 引物设计与合成 由美国ABI公司设计合成,在特异性杂交荧光探针的5′端结合报告基团(FAM),在3′端结合淬灭荧光基团(VIC)。产品目录号:rs4728142(IRF5),C_2691222_10;rs2004640(IRF5),C_9491614_10;rs10954213(IRF5),C_31283335_10。
1.2.3 Taqman-PCR扩增 PCR反应体系总体积25 μl。PCR反应循环参数:50℃ 2 min;95℃ 10 min;95℃ 15 s,60℃ 1 min,共40个循环。荧光收集设置在60℃。
1.2.4 等位基因分型 ABI 7500 FAST 通过检测荧光强度来确定基因型,并利用终点法对等位基因进行定性,SDS软件检测和分析处理PCR扩增后的FAM和VIC荧光信号。
1.3 统计学处理 采用SPSS17.0软件对研究数据进行统计分析。样本的群体代表性采用Hardy-weinberg平衡检验检测。等位基因频率=(2×纯合子+杂合子)/(2×受检人数)。基因型及等位基因频率组间,抗核抗体和特异性抗体谱组间计数资料比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SLE组与患者组一般资料的分析 本次研究共收集SLE病例组218例,平均年龄(36.51±12.41)岁,其中女195例,占89.45%,男23例,占10.55%;对照组200例,平均年龄(38.20±9.91)岁,其中女168例,占84.0%,男32例,占16.0%。两组比较,年龄与性别差异均无统计学意义,见表1。
2.2 活动期与缓解期SLE患者抗核抗体与特异性抗体检测结果的比较 218例SLE患者经SLEDAI评分分为活动期和缓解期,其中活动期125例(55.96%),缓解期93例(44.04%)。在SLE活动期,荧光模型以核均质型为主,而在缓解期组则以核颗粒型为主,两组比较差异有统计学意义。在特异性抗体谱的检测中,活动期组主要以Anti-NUC(71.32%)、Anti-His(72.07%)、Anti-Rib P(62.63%)为主,而缓解期组则以Anti-nRNP(48.76%)、Anti-Sm(48.28)、PCNA(71.43%)为主,见表2。
表1 SLE组与对照组一般资料分析
Tab.1 Basic characteristics of SLE group and control group

GenderSLEgroup[n(%)]Controlgroup[n(%)]Male23(10 60)32(16 00)Female195(89 40)168(84 00)Age(x±s)36 51±12 4138 20±9 91
表2 SLE活动期组与缓解期抗核抗体谱结果的比较
Tab.2 Comparison of autoantibodies spectrum of results in SLE remission patients and activity patients

Fluorescenremodel/specificityantibodiesTotal(%)Activitypatients(%)Remissionpatients(%)ANA⁃IIF212(97 25)123(58 02)89(41 98)ds⁃DNA⁃IIF125(57 33)125(100 0)0(0 00)FluorescencemodelNuclearhomogeneous93(42 66)71(76 34)2)22(23 66)Nuclearparticles126(57 80)61(48 41)1)65(51 59)Cytoplasmparticles89(40 83)58(65 17)31(34 83)Other16(7 34)8(50 00)8(50 00)SpecificityantibodiesAnti⁃nRNP121(55 50)62(51 24)1)59(48 76)Anti⁃Sm87(39 91)45(51 72)42(48 28)Anti⁃SSA141(64 68)80(56 74)61(43 26)Anti⁃SSB27(12 39)16(59 26)11(40 74)PCNA14(6 42)4(28 57)1)10(71 43)Anti⁃NUC136(62 39)97(71 32)2)39(28 68)Anti⁃His111(50 92)80(72 07)2)31(27 93)Anti⁃Rib⁃P99(45 41)62(62 63)37(37 37)AMA⁃M216(7 34)6(37 50)10(62 50)
Note:1)P<0.05,2)P<0.01,compared with SLE remission patients.
2.3 IRF5基因rs2004640、rs10954213、rs4728142基因型、等位基因频率分布比较
2.3.1 IRF5基因rs2004640位点基因型、等位基因
表3 IRF5 rs2004640位点基因型和等位基因在SLE组和对照组间的频率分布比较
Tab.3 Allele and genotype frequencies of IRF5 rs2004640 in SLE cases and controls
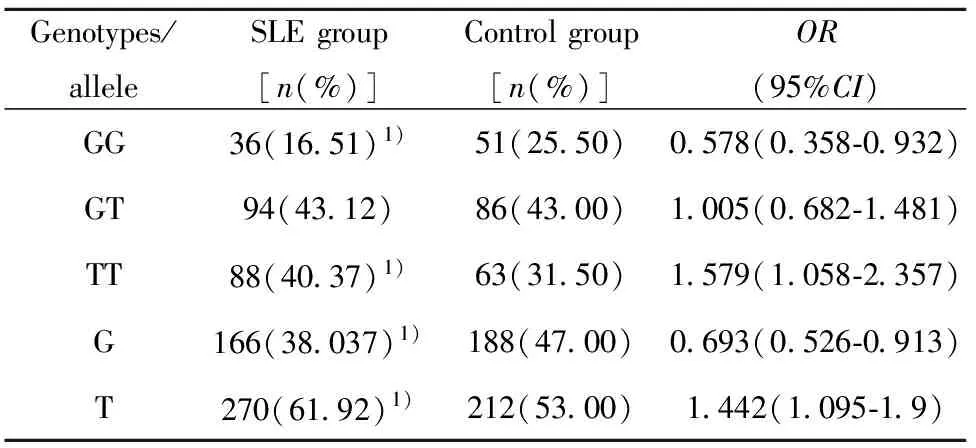
Genotypes/alleleSLEgroup[n(%)]Controlgroup[n(%)]OR(95%CI)GG36(16 51)1)51(25 50)0 578(0 358⁃0 932)GT94(43 12)86(43 00)1 005(0 682⁃1 481)TT88(40 37)1)63(31 50)1 579(1 058⁃2 357)G166(38 037)1)188(47 00)0 693(0 526⁃0 913)T270(61 92)1)212(53 00)1 442(1 095⁃1 9)
Note:1)P<0.05,compared with controls group.
表4 IRF5 rs10954213位点基因型和等位基因在SLE组和对照组间的频率分布比较
Tab.4 Allele and genotype frequencies of IRF5 rs10954213 in SLE cases and controls

Genotypes/alleleSLEgroup[n(%)]Controlgroup[n(%)]OR(95%CI)GG83(38 07)1)54(27 5)1 662(1 098⁃2 517)AG93(42 66)101(50 5)0 729(0 496⁃1 073)AA42(19 27)45(22 5)0 822(0 512⁃1 319)G259(59 40)1)209(52 25)1 337(1 017⁃1 759)A177(40 60)1)191(47 75)0 748(0 569⁃0 983)
Note:1)P<0.05,compared with controls group.
表5 IRF5 rs4728142位点基因型和等位基因在SLE组和对照组间的频率分布比较
Tab.5 Allele and genotype frequencies of IRF5 rs4728142 in SLE cases and controls

Genotypes/alleleSLEgroup[n(%)]Controlgroup[n(%)]OR(95%CI)AA5(2 29)1(0 5)4 671(0 541-40 333)AG52(23 85)40(20 00)1 253(0 786-1 997)GG161(73 85)159(79 5)0 728(0 461-1 151)A62(14 22)42(10 50)1 413(0 931-2 146)G374(85 78)358(89 50)0 708(0 466-1 075)
表6 SLE组特异性抗体与rs2004640、rs10954213等位基因的相关性分析
Tab.6 Correlation analysis of specificity antibodies and rs2004640,rs10954213 SNPs in SLE cases

Specificityantibodiesrs2004640(n)TGOR(95%CI)rs10954213(n)GAOR(95%CI)ANA(+)2651591 6672531711 480ANA(-)66(0 528-5 256)66(0 469-4 664)dsDNA(+)153970 930156941 401dsDNA(-)11769(0 629-1 376)10383(0 799-2 455)Anti⁃nRNP(+)156861 273145971 049Anti⁃nRNP(-)11480(0 863-1 877)11480(0 714-1 541)Anti⁃Sm(+)122521 807102720 947Anti⁃Sm(-)148114(1 204-2 713)157105(0 642-1 399)PCNA(+)16120 80814140 665PCNA(-)254154(0 373-1 754)245163(0 309-1 432)Anti⁃NUC(+)1661060 9031641081 103Anti⁃NUC(-)10460(0 605-1 348)9569(0 744-1 635)Anti⁃Rib⁃P(+)135601)1 847120781 096Anti⁃Rib⁃P(-)142106(1 242-2 746)13999(0 746-1 609)
Note:1)P<0.05,compared with controls group.
频率分布比较 SLE患者IRF5 rs2004640位点GG/GT/TT基因型分布频率分别为16.51%、43.12%、40.37%,基因型GG、TT在两组中的分布差异有统计学意义。等位基因T频率分布在SLE组(61.92%)高于对照组(53.00%),在两组中的分布差异有统计学意义。见表3。
2.3.2 IRF5基因rs10954213位点基因型、等位基因频率分布比较 SLE患者IRF5 rs10954321位点GG/AG/AA基因型分布频率分别为38.07%、42.66%、19.27%。基因型GG在两组人群中的分布差异有统计学意义。等位基因A/G在两组人群中的分布差异有统计学意义,其中等位基因G的频率分布SLE组(59.40%)高于对照组(52.25%)。见表4。
2.3.3 IRF5 rs4728142位点基因型、等位基因频率分布比较 SLE患者IRF5 rs4728142基因型AA/AG/GG分布频率分别为2.29%、23.85%、73.85%,两组间的基因型频率和等位基因A/G频率分布差异均无统计学意义,如表5。
2.4 SLE组IRF5基因rs2004640、rs10954213位点等位基因与特异性抗体的相关性分析 通过病例-病例分析[(比如抗Sm抗体(+)的SLE患者与抗Sm抗体(-)的SLE患者之间rs2004640、rs10954213等位基因频率的差异], rs2004640位点等位基因 T 和抗Sm抗体、抗Rib-P抗体相关,与其余抗体差异无统计学意义。等位基因T可能是抗Sm抗体、抗Rib-P抗体的危险因素(OR=1.972,1.530;95%CI=[1.236-3.003],[1.010-2.317])。rs10954213位点与各特异性抗体之间差异无统计学意义。见表6。
3 讨论
系统性红斑狼疮是一种以产生多种自身抗体、激活补体、免疫复合物沉积,导致组织和器官的损伤为特征的自身免疫性疾病[6]。可累及多系统、多脏器、临床表现复杂多样。迄今为止,其发病机制尚未完全阐明,但多数学者认为遗传因素、环境因素及激素水平在本病的发生发展中起着重要的作用。近年来许多学者认为Ⅰ型干扰素参与 SLE的病理生理学机制,研究表明Ⅰ型干扰素(IFN)通路是SLE发病中重要的功能通路之一[7],SLE 患者血清中含有大量的IFN-α,其能够通过调控多种免疫细胞的分化、 活化及功能影响免疫系统的活化,促进 SLE 的发生发展[8,9]。IRF5为IFN通路的重要调控因子,IRF5与TLRs形成通路来诱导表达炎性因子[10]。因此,对SLE相关易感基因的研究,除可发现SLE易感基因外,还可从基因组水平认识SLE的发病机制。在本次研究中,SLE活动期患者的荧光模型主要以核均质型为主,而缓解组则以核颗粒型为主,可能是由于多数活动期病人都伴有抗dsDNA抗体,该抗体的荧光模型多表现为核均质型,有可能会掩盖其他的荧光模型,而随着病情的缓解,抗dsDNA抗体的滴度下降,SLE其他特异性抗体的荧光模型随之表现出来。在对抗核抗体谱的研究中,发现活动组患者的靶抗原以dsDNA、NUC、His、Rib P为主,这几种靶抗原在以往的文献报道中均与疾病的活动性相关[11]。所以联合检测ANA与特异性抗体谱,可以对SLE进行早期诊断,利于病情和疗效的观察,并对临床用药有一定的指导作用。
IRFs是一类转录因子,主要参与调节Ⅰ型IFN和干扰素刺激性应答基因的表达和转录,参与Th细胞的分化调节,调节免疫细胞发育和抑制肿瘤细胞生长。
IRF5基因主要在B细胞和树突细胞内表达,诱导IL-6、IL-12等炎性细胞因子表达;反之,IFN-α信号也会进一步活化IRF5,从而促使IRF5在Ⅰ型IFN产生中发挥重要作用,形成一个正反馈环,相互作用,可能是SLE疾病发生、发展的机制之一。许多研究显示欧洲人此基因的多个多态性位点与SLE相关,对亚洲人SLE的相关研究也证实IRF5是亚洲人的易感基因。不同研究结果显示致病性rs2004640 T 等位基因频率中国人群的分布频率为31.6%,本次研究检测的频率较其他地区的高,可能与样本量不够大及贵州是多民族地区,种族差异较大有关。此次研究对IRF5 rs2004640 T的多态性进行检测并分析,发现基因型TT和等位基因T在两组人群中的分布差异有统计学意义,提示该基因型可能是SLE的相关易感因子,携带等位基因T增加了SLE的患病风险。
rs10954213位于IRF5基因的非编码区,在欧洲人的研究中已证实了 rs10954213与SLE的关系,并发现该位点使IRF5基因产生更稳定的mRNA,从而增强其生物学作用[12]。本次研究显示IRF5 rs10954213位点基因型GG、等位基因G在SLE组与对照组人群中的分布差异有统计学意义,其中等位基因G在SLE组的频率分布显著高于对照组,这与宋卫青等[13]对中国山东汉族人群的研究结果相同。结合国内外的研究结果,我们认为等位基因G可能与IRF5基因的高表达有关,影响干扰素的表达,增加SLE患者的患病风险。
rs4728142位于IFR5基因的基因间隔区,国内学者张鹏等[14]有研究表明该位点的多态性SLE易感性相关。但在本研究中,其基因型及等位基因在SLE组与对照组间的频率总体分布差异无统计学意义。本研究结果跟以上研究结果不符,可能是由于地区差异不同造成的。
通过病例-病例分析表明不同的特异性抗体如抗Sm抗体、抗Rib-P抗体的产生可能和IRF5 rs2004640 T相关。IRF5 作为IRF家族成员之一,可诱导产生Ⅰ型IFN。Ⅰ型IFN诱导DC分化成熟,递呈自身抗原,活化T细胞并逃避中枢清除,促进活化T细胞刺激自身反应性B细胞产生针对DNA、RNA及凋亡细胞成分的自身抗体,形成免疫复合物,该复合物作为内源性的IFN诱导物进一步促进浆细胞样DC产生更多的Ⅰ型IFN,更多的IFN又进一步促进自身抗体的产生,免疫复合物的形成及pDC活化,形成恶性循环。从而导致SLE患者对自身抗原丧失免疫耐受,自身免疫反应不断加剧。本次研究结果间接提示等位基因可能在一定程度上影响SLE患者体内自身抗体的产生,这可能对评估SLE的遗传学发病机制有一定的提示作用,但由于样本量较小,其具体的作用机制还有待进一步的研究。
我们采用群体相关研究策略,运用TaqMan-PCR技术发现IRF5基因SNP rs2004640、rs10954213 与SLE易感性相关联,IRF5基因SNP rs4728142与SLE易感性无关。SLE作为复杂的多因素疾病,受到众多危险因素的影响。同时由于受到样本大小、人种的选择、地区差异等的影响,都可能导致研究结果差异。因此在本研究的基础上,选择其他人群进行重复试验并扩大样本量,将有利于对SLE发病相关机制的深入研究;同时对携带易感基因人群的早期发现,利于对其进行早发现、早诊断、早治疗,提高患者的生活质量和延长生命。
[1] Crow MK.Type Ⅰ interferon in the pathogenesis of lupus[J].J Immunol,2014,192(12):5459-5468.
[2] Fan H,Liu F,Dong G,etal.Activation-induced necroptosis contributes to B-cell lymphopenia in active systemic lupus erythematosus[J].Cell Death Dis,2014,5:e1416.
[3] Bezalel S,Guri KM,Elbirt D,etal.TypeⅠinterferon signature in systemic lupus erythematosus [J].Isr Med Assoc J,2014,16(4):246-249.
[4] Graham RR,Kyogoku C,Sigurdsson S,etal.Three functional variants of IFN regulatory factor 5(IRF5)define risk and protective haplotypes for human lupus[J].PNAS,2007,104:6758-6763.
[5] Radtke MA,Augustin M.Economic considerations in psoriasis management [J].Clin Dermatol,2008,26(5):424-431.
[6] Crispin JC,Liossis SN,Kis-Toth K,etal.Pamogenesis of human systmic lupus erythematosus:recent advances[J].Trends Molecular Med,2010,16(2):47-57.
[7] Balasubramanian S,Ecker RL.Keratinocyte proliferation,differe-ntiation,and apoptosis-differential mechanisms of regulation by curcumin,EGCG and apigenin [J].Toxicol Appl Pharma Col,2007,224(3):214-219.
[8] Mavragani CP,Niewold TB,Chatzigeorgiou A,etal.Increased serum typeⅠinterferon activity in organ-specific autoimmune disorders:clinical,imaging,and serological associations[J].Front Immunol,2013,4:238.
[9] Bezalel S,Guri KM,Elbirt D,etal.TypeⅠinterferon signature in systemic lupus erythematosus[J].Isr Med Assoc J,2014,16(4):246-249.
[10] Artavanis-Tsakonas S,Rand MD,Lake RJ.Notch signaling:cell fate control and signal integrationb in development[J].Science,1999,284(5415):770-776.
[11] Riboldi P,Gerosa M,Moroni G,etal.Anti-DNA antibodies:a diagnostic agnostic and prognostic tool for systemic lupus erythematosus [J].Autoimmunity,2005,38(1):39.
[12] 沈金花,吕 印,刘庆华.干扰素调节影子的研究进展[J].中南民族大学学报(自然科学版),2014,33(2):41-44.
[13] 宋卫青,李化会,陈华波,等.IRF5 rs10954213基因多态性与系统性红斑狼疮的相关性研究[J].中国实验诊断学,2009,13(8):1082-1084.
[14] 张 鹏,陈日新,李存涛,等.IRF5基因多态性与中国汉族人系统性红斑狼疮表型的相关性[J].中国皮肤性病学杂志,2011,25(7):497-500.
[收稿2016-07-20 修回2016-10-17]
(编辑 许四平)
Study on associations between type Ⅰ interferon pathway IRF5 gene polymorp-hisms and SLE
LIHong-Mei,LIUShui-He,YEZhen-Xuan,ZHANGHua.
ClinicalLaboratory,GuizhouProvincePeople′sHospital,Guiyang550002,China
Objective:To investigate the IRF5 rs2004640,rs10954213,rs4728142 loci gene polymorphisms in the progress of Systemic lupus erythematosus(SLE),and explore the influence of the IRF5 gene polymorphisms to the SLE.Methods:218 patients with SLE and 200 health controls were analyzed by using TaqMan-PCR.And all allele frequencies were calculated.The risk factors were compared between cases and controls.At the same time,antinuclear antibodies and double-stranded DNA antibody of 218 SLE cases were analysed with indirect immunefluorescence method,specific autoantibodies in plasma spectrometry were determined using linear immunoassay in plasma.Results:T allele frequency of IRF5 rs2004640 loci in SLE was higher than the controls,allele frequency of the G/T distribution differences in two groups were statistically significant(χ2=6.809,P=0.009).The GG/TT genotype frequencies between the control and the SLE were statistically significant(χ2=5.111,5.035;P=0.024,0.025).Compared control group with SLE group,G allele frequency of IRF5 rs10954213 loci in SLE group was higher than the controls,the difference was statistically significant(χ2=4.332,P=0.037).And GG genotype distribution had significant difference in the two groups(χ2=5.805,P=0.016).SLE group AA/AG/GG genotype distribution of IRF5 rs4728142 loci,compared with control group,there were no statistically difference(χ2=1.273,0.902,1.853;P=0.259,0.342,0.173).And allele frequency A/G also were not statistically differences in two groups(χ2=2.651,P=0.104).The T allele frequency of IRF5 rs2004640 and autoantibodies(anti-Sm,anti-Rib-P)significant associations were found with SLE patient.There were no statistically significant difference between IRF5 rs10954213 with autoantibodies.Compared with SLE remission patients,ANA,ds-DNA increased obviously.Anti-NUC,anti-His,anti-Rib-P were higher,there were statistically significant differences betwen two groups.Conclusion:The GG/GT/TT polymorphism of IRF5 rs2004640,GG/GA/AA polymorphism of rs10954213 were related to SLE.But the GG/GA/AA polymorphism of IRF5 rs4728142 were not significant difference.IRF5 rs2004640 T comtributed to the anti-Sm,anti-Rib-P.In active SLE patients,anti-ds-DNA,anti-NUC,anti-His,anti-Rib-P were higher than the other group.
SLE;Ⅰtype interferon pathway;IRF;Gene polymorphism;ANA
10.3969/j.issn.1000-484X.2017.04.020
李红梅(1981年-),女,硕士,主管技师,主要从事自身免疫性疾病致病机制的研究。
及指导教师:张 华(1970年-),女,博士,主任技师,主要从事自身免疫病发病机制方面的研究。
R593.241 R394.112
A
1000-484X(2017)04-0574-06
①本文为贵州省科技厅国际合作项目(黔科合外G字[2012]7046号)。
②贵州省人民医院中心实验室,贵阳550002。
