基于PI3K/AKT/mTOR通路、HIF-1α、ES观察新风胶囊对佐剂关节炎大鼠滑膜血管新生的影响①
2017-04-24张晓军黄传兵
张晓军 刘 健 万 磊 黄传兵
(安徽中医药大学,合肥230038)
·中医中药与免疫·
基于PI3K/AKT/mTOR通路、HIF-1α、ES观察新风胶囊对佐剂关节炎大鼠滑膜血管新生的影响①
张晓军 刘 健②万 磊②黄传兵②
(安徽中医药大学,合肥230038)
目的:观察新风胶囊(XFC)对佐剂关节炎(AA)大鼠滑膜PI3K/AKT/mTOR通路的影响。方法:将大鼠随机分成正常对照组、模型对照组、甲氨蝶呤组、雷公藤多苷组、XFC组。采用免疫组化法检测滑膜微血管密度(MVD)表达,酶联免疫吸附法检测白介素(IL)-6、IL-10、HIF-1α、VEGF-A表达,免疫印迹法检测PI3K、AKT1、p-AKT1、mTOR、ES蛋白在滑膜血管中表达。结果:模型对照组滑膜组织MVD计数升高,血清IL-6、VEGF、HIF-1α和滑膜PI3K、AKT1、p-AKT1、mTOR、ES表达显著升高,血清IL-10表达量降低;治疗后,XFC组MVD呈高计数量,HIF-1α、 IL-6、VEGF-A表达降低,滑膜PI3K、p-AKT1、mTOR、ES蛋白表达降低,血清IL-10升高。结论:XFC通过调节PI3K/AKT/mTOR信号通路、HIF-1α、ES表达改善AA滑膜血管新生。
佐剂关节炎;血管新生;PI3K/AKT/mTOR通路;新风胶囊
类风湿关节炎(Rheurnatoid arthritis,RA)基本病理变化是滑膜炎[1]。RA长期慢性炎症和病理变化逐渐导致关节腔出现低氧环境,导致滑膜血管新生形成,从而加重滑膜炎症的发生。研究发现,磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)通路在RA滑膜血管新生中起重要作用[2]。PI3K/AKT通路可以激活哺乳动物雷帕霉素靶向蛋白(mTOR)表达,而 mTOR可进一步增加缺氧诱导因子1-α(HIF-1α)升高,导致血管内皮生长因子(VEGF-Α)、微血管密度(MVD)及ES表达增强,VEGT-A,ES可以对内皮细胞的直接作用,并增加在滑膜新生血管形成[3-5]。某些细胞因子如白细胞介素1(IL-)-6可上调VEGF的表达;而IL-10等则能抑制VEGF的表达。既往研究发现,中药新风胶囊能明显降低RA患者关节肿痛等症状,还能改善滑膜血管新生的表达[6-8]。为进一步观察新风胶囊的作用机制,笔者通过弗氏完全佐剂(FCA)复制AA大鼠模型,通过新风胶囊对AA大鼠滑膜新生血管的疗效观察,并研究对滑膜血管PI3K/AKT/mTOR通路、IL-6、IL-10、HIF-1α、VEGF-Α、ES的影响,分析PI3K/AKT/mTOR信号通路、HIF-1α、VEGF-Α、ES、IL-6、IL-10与滑膜血管新生的关系,探讨新风胶囊改善滑膜血管新生的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 50只SD大鼠,由安徽省实验动物中心提供。实验动物经安徽中医学院第一附属医院和基础研究伦理委员会批准审核通过,清洁级标准饲养。
1.1.2 试剂与药品 FCA:Sigma,USA,批号:116K8706; VEGF-A试剂盒:圣塔克鲁兹公司,USA,批号:sc-1045; MVD试剂盒:圣塔克鲁兹公司,USA,批号:sc-376975;IL-6、IL-10试剂盒: RD公司,USA,批号:2013012205、2012100204;HIF-1α试剂盒:Bioworld公司,USA,批号:22061046-1;羊抗PI3K、鼠抗AKT1、兔抗p-AKT1、兔抗mTOR抗体:圣塔克鲁兹公司,USA,批号: sc-48637、sc-5298、sc-135650、sc-8319;兔抗内皮抑素(Endostatin,ES):Abcam公司,USA,批号:ab01387;新风胶囊:安徽省中医院制剂中心提供,批号2015021504;甲氨蝶呤:上海信谊生产,批号2015110527;雷公藤多苷片:10 mg/片,上海红旗制药厂生产,批号2014100114。
1.1.3 仪器与设备 病理切片机:LEICA,德国,型号:2235;显微摄像系统:OLYMPUS,日本,型号:BX51T-32000-2;高速冷冻离心机:Sigma,德国,型号:2-16PK。
1.2 方法
1.2.1 模型制备、分组与给药 将大鼠均分为正常对照组、模型对照组、新风胶囊组、甲氨蝶呤组、雷公藤多苷片组。大鼠右足跖皮内注射 0.1 ml FCA制成 AA模型(除正常对照组外)[9]。注射第12天开始给药,按照实验动物与人体体表面积比等效剂量换算比例(相当于临床成人等效剂量8倍)。新风胶囊组0.24 g/100 g,雷公藤多苷片组1 mg/100 g,每天1次;甲氨蝶呤组0.3 mg/100 g,每周1次;正常对照组、模型对照组予生理盐水灌胃,0.1 g/100 g,每天1次。各组连续用药30 d。
1.2.2 血清细胞因子HIF-1α、VEGF-A、IL-6、IL-10测定 采用ELISA测定血清HIF-1α、VEGF-A、IL-6、IL-10的表达。具体步骤依照试剂盒操作。
1.2.3 滑膜MVD测定 将各组大鼠无菌取双膝关节滑膜,常规制备石蜡包埋切片,行SABC法染色。采用山羊抗鼠MVD多克隆抗体标记血管内皮细胞(一抗浓度稀释比例1∶200),结果在显微镜下观察各组血管新生情况[10]。
1.2.4 滑膜PI3K、AKT、p-AKT、mTOR、ES检测 制备组织蛋白样品,蛋白电泳、转膜,PI3K、AKT、p-AKT、mTOR、ES一抗(1∶ 800稀释)孵育 2 h,分别采用抗羊、小鼠、兔二抗(1∶ 5 000)孵育1 h。用增强化学发光法显色,条带用扫描仪对结果摄像;以条带与各组内参β-actin灰度值的比值作为滑膜PI3K、AKT、p-AKT、mTOR、ES蛋白的相对表达量。
2 结果
2.1 血清HIF-1α、VEGF-A、IL-6、IL-10变化 与正常对照组比较,模型对照组大鼠血清IL-10降低,HIF-1α、VEGF-A、IL-6升高 (P<0.01或P<0.05);与模型对照组比较,新风胶囊组IL-10升高,HIF-1α、VEGF-A、IL-6降低 (P<0.01或P<0.05);新风胶囊组VEGF-A表达低于雷公藤多苷片组 (P<0.05)。见表1。
2.2 大鼠滑膜血管MVD计数比较 模型对照组大鼠血管MVD计数明显高表达(P<0.01)。治疗后,与模型对照组相比,各治疗组MVD计数量明显减少;各治疗组间比较, 新风胶囊组MVD计数量低于甲氨蝶呤组(P<0.05)。见图1。

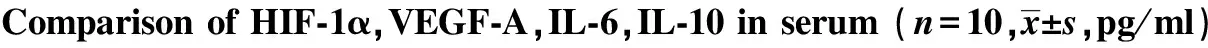

GroupsHIF⁃1αVEGF⁃AIL⁃6IL⁃10Normalcontrol32 45±5 38 51 26±9 9744 48±7 1493 47±16 86Modelcontrol82 28±10 982) 93 43±16 492)81 69±10 652) 80 36±12 231)Methotrexate 65 73±11 671)4)5) 66 34±12 341)4)57 17±8 471)4)82 62±12 171)3)5)Tripterygiumglycosides53 65±9 551)4) 74 51±19 941)3)5)53 03±7 311)4)90 75±11 673)XinfengCapsule52 17±7 751)4) 63 60±12 371)4)54 85±6 281)3)95 49±10 433)
Note:Compared with normal control group,1)P<0.05,2)P<0.01;compared with the model control group,3)P<0.05,4)P<0.01;compared with the Xinfeng Capsule group,5)P<0.05.

图1 滑膜血管MVD计数比较Fig.1 Comparison of MVD in synovial blood vesselsNote:A.Normal control group;B.Model control group;C.Methotrexate group;D.Tripterygium glycosides group;E.Xinfeng Capsule group;F.Expression of MVD in each group.Compared with the normal control group,▲.P<0.05,▲▲.P<0.01;compared with the model group,*.P<0.05,**.P<0.01;compared with the Xinfeng Capsule group,△.P<0.05.
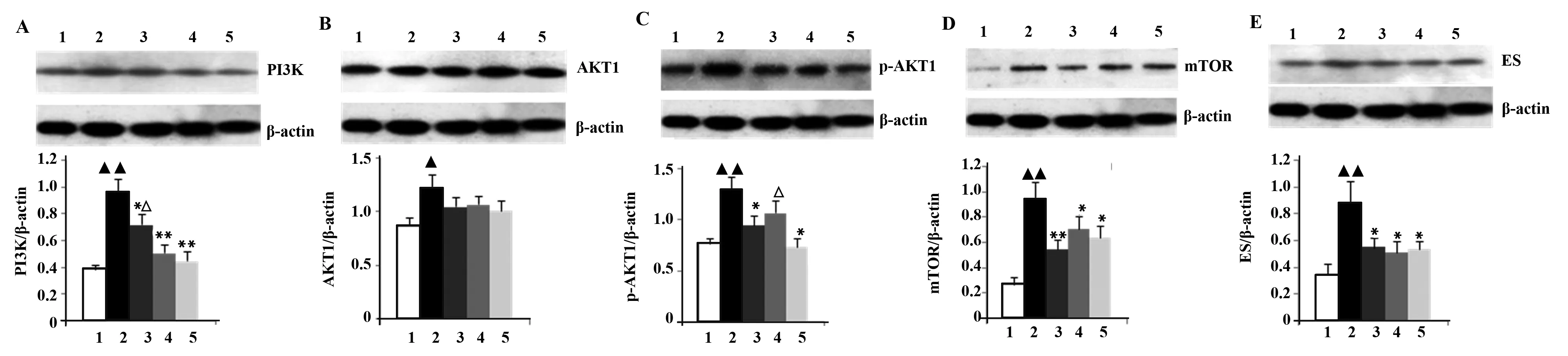
图2 滑膜血管PI3K、AKT、p-AKT、mTOR、ES蛋白表达Fig.2 Expression of PI3K,AKT p-AKT,mTOR,ES protein in synovial vascularNote:1.Normal control group;2.Model control group;3.Methotrexate;4.Tripterygium glycosides group;5.Xinfeng Capsule group;A-E is PI3K,AKT,p-AKT,mTOR,ES.
2.3 大鼠滑膜组织PI3K、AKT、p-AKT、mTOR、ES蛋白表达 与正常对照组比较,mTOR、PI3K、p-AKT、ES在模型对照组明显增加(P<0.01或P<0.05)。药物干预后,mTOR、PI3K、p-AKT、ES表达在新风胶囊组降低(P<0.01或P<0.05);与新风胶囊组比较,甲氨蝶呤组PI3K表达升高;雷公藤多苷片组p-AKT表达升高(P<0.05)。见图2。
3 讨论
PI3K/Akt/mTOR信号通路的激活和HIF-1和VEGF蛋白α、ES表达失衡在滑膜血管生成中发挥重要作用[11-13]。PI3K/Akt通路通过调节HIF-1表达并诱导VEGF、ES产生。PI3K/AKT通路激活可导致低氧环境诱导的滑膜血管的分化、生长,介导细胞生长、发育和血管调节作用。PI3K/AKT通路激活mTOR表达调节细胞增殖,诱发血管形成和血管通透性增加[14,15]。
mTOR上调可引起mTOR通路的激活,从而进一步导致HIF-1α、VEGF-Α、ES表达升高,加重滑膜炎症和滑膜血管新生的形成。因此,PI3K/AKT通路过度激活也会促使HIF-1α、ES表达增加。PI3K/AKT/mTOR通路激活后首先直接使HIF-1α升高[16,17]。VEGF-Α、ES上调后会诱导RA滑膜血管新生。当组织损伤发生炎症时,VEGF会被异常表达,而且这种表达会被其他因素所影响。VEGF促血管新生受细胞因子IL-6、IL-10调节,细胞因子IL-6、IL-10对VEGF产生直接或间接的影响,在RA的发病过程中共同促进滑膜血管翳的形成。细胞因子IL-6在RA中呈高表达状态,IL-10呈低表达。IL-6上调和IL-10下调,可作用于VEGF-A、ES,导致RA血管新生形成。既往研究发现,AA大鼠滑膜PI3K、AKT、mTOR升高,且PI3K、p-AKT、mTOR分别与HIF-1α、VEGF-A、ES呈正相关[18]。说明PI3K/AKT/mTOR通路的过度激活和HIF-1α表达上调可能是促进滑膜血管新生形成原因之一。此结果与Agani等[19]研究结论相似。因此,PI3K/AKT/mTOR通路异常激活后可以提高HIF-1α蛋白合成,进而导致VEGF-A、ES升高,从而通过促进滑膜新生血管生长,参与滑膜炎症的过程和血管病变[20,21]。
根据以上研究结果,针对RA滑膜血管新生的特点,可以采用抑制滑膜PI3K/AKT/mTOR通路过度激活,降低滑膜血管炎症反应。本研究结果发现,新风胶囊可降低AA大鼠足趾肿胀度和关节炎指数,滑膜PI3K、p-AKT、mTOR、ES表达降低,血清HIF-1α、VEGF-A、IL-6水平下降,而IL-10表达升高。说明新风胶囊可能是通过降低PI3K/AKT 通路蛋白表达,从而阻止mTOR异常激活,抑制血管内皮细胞增殖,改善滑膜血管新生。新风胶囊由黄芪、薏仁、雷公藤、蜈蚣等药物组成。黄芪具有益气、消肿、健脾、除痹之功,薏苡仁具有化湿、除痹之效。黄芪有效成分黄芪皂甙、黄芪多糖具有免疫调节作用,黄芪皂甙能降低关节肿胀、减少关节液和血清炎性细胞因子,黄芪多糖可抑制血管生成作用[22,23]。研究发现,黄芪甲苷可以抑制PI3K/AKT 通路的激活,减低mTOR蛋白表达,降低HIF-1α mRNA表达水平,从而降低VEGF表达[24,25]。薏苡仁含薏苡素,薏苡素具有抗炎、抑制炎性分子分泌作用,薏苡仁有效成分能降低HIF-1α、VEGF的表达[26]。蜈蚣具有抗炎镇痛作用,蜈蚣多糖蛋白复合物具有可降低VEGF的表达,蜈蚣多糖具有抗血管生成活性。雷公藤含有雷公藤碱等,雷公藤有降低毛细血管通透性、抑制炎性细胞因子IL-6渗出、抗栓塞以及降低HIF-1α、VEGF表达的作用。研究发现,雷公藤甲素能明显抑制PI3K/AKT 通路激活,还能明显下调HIF-1α基因和蛋白表达,抑制HIF-1α的转录活性[27-30]。
总之,新风胶囊改善滑膜血管新生机制可能是通过下调PI3K、p-AKT、mTOR表达,抑制PI3K/AKT/mTOR通路过度激活,从而降低HIF-1α的转录,减少VEGF释放,从而进一步减少MVD表达,降低滑膜血管新生。
[1] Collison J.Rheumatoid arthritis:Features of synovium in RA remission revealed[J].Nat Rev Rheumatol,2016,12(6):316.
[2] Gao J,Zhou XL,Kong RN,etal.microRNA-126 targeting PIK3R2 promotes rheumatoid arthritis synovial fibro-blasts proliferation and resistance to apoptosis by regulating PI3K/AKT pathway [J].Exp Mol Pathol,2016,100(1):192-198.
[3] Zhang Y,Zhang B.Trichostatin A,an inhibitor of histone deacetylase,inhibits the viability and invasiveness of hypoxic rheumatoid arthritis fibroblast-like synoviocytes via PI3K/Akt signaling [J].J Biochem Mol Toxicol,2016,30(4):163-169.
[4] Lv Q,Zhu XY,Xia YF,etal.Tetrandrine inhibits migration and invasion of rheumatoid arthritis fibroblast-like synoviocytes through down-regulating the expressions of Rac1,Cdc42,and RhoA GTPases and activation of the PI3K/Akt and JNK signaling pathways [J].Chin J Nat Med,2015,13(11):831-841.
[5] Hua S,Dias TH.Hypoxia-Inducible factor (HIF) as a target for novel therapies in rheumatoid arthritis [J].Front Pharmacol,2016,7:184.
[6] Liu J,Chen RL.The potential role of chinese medicine in ameliorating extra-articular manifestations of rheumatoid arthritis[J].Chin J Integr Med,2011,17(10):735-737.
[7] 万 磊,刘 健.新风胶囊对佐剂关节炎大鼠肺功能、Th细胞及调节性T细胞的影响[J].中华中医药杂志,2013,28(5):1366-1371.
[8] Wan L,Liu J,Huang C,etal.Effects of xinfeng capsule on pulmonary function based on treg-mediated notch pathway in a rat model of adjuvant arthritis[J].J Tradit Chin Med,2012,32(3):430-436.
[9] 徐叔云,卞如濂,陈 修.药理实验方法学[M].第3版.北京:人民卫生出版社,2002:919-921.
[10] 张 育,周 玮,顾 健,等.沙利度胺及氨甲蝶吟抗CIA大鼠滑膜血管新生及其作用机制的研究[J].实用临床医药杂志,2008,12(5):23-27.
[11] Han W,Xiong Y,Li Y,etal.Anti-arthritic effects of clematichinenoside (AR-6) on PI3K/Akt signaling pathway and TNF-α associated with collagen-induced arthritis[J].Pharm Biol,2013,51(1):13-22.
[12] Cury V,Moretti AI,Assis L,etal.Low level laser therapy increases angiogenesis in a model of ischemic skin flap in rats mediated by VEGF,HIF-1α and MMP-2[J].J Photochem Photobiol B,2013,125:164-170.
[13] Bhattacharya D,Singh MK,Chaudhuri S,etal.T11TS impedes glioma angiogenesis by inhibiting VEGF signaling and pro-survival PI3K/Akt/eNOS pathway with concomitant upregulation of PTEN in brain endothelial cells[J].J Neurooncol,2013,113(1):13-25.
[14] Kishore T KK,Ganugula R,Gade DR,etal.Gedunin abrogates aldose reductase,PI3K/Akt/mToR,and NF-κB signaling pathways to inhibit angiogenesis in a hamster model of oral carcinogenesis [J].Tumour Biol,2016,37(2):2083-2093.
[15] Fujii M,Amanso A,Abrahão TB,etal.Polymerase delta-interacting protein 2 regulates collagen accumulation via activation of the Akt/mTOR pathway in vascular smooth muscle cells [J].J Mol Cell Cardiol,2016,92:21-29.
[16] Park JH,Lee JY,Shin DH,etal.Loss of Mel-18 induces tumor angiogenesis through enhancing the activity and expression of HIF-1α mediated by the PTEN/PI3K/Akt pathway[J].Oncogene,2011,30(45):4578-4589.
[17] Westra J,Brouwer E,Bos R,etal.Regulation of cytokine-induced HIF-1alpha expression in rheumatoid synovial fibroblasts[J].Ann N Y Acad Sci,2007,1108:340-348.
[18] 张晓军,刘 健,万 磊,等.佐剂关节炎大鼠滑膜血管新生与PTEN/PI3K/AKT信号传导通路的关系[J].中国骨伤,2015,28(1):71-74.
[19] Agani F,Jiang BH.Oxygen-independent regulation of HIF-1:novel involvement of PI3K/AKT/mTOR pathway in cancer[J].Curr Cancer Drug Targets,2013,13(3):245-251.
[20] Sun P,Wei S,Wei X,etal.Anger emotional stress influences VEGF/VEGFR2 and its induced PI3K/AKT/mTOR signaling pathway [J].Neural Plast,2016,2016:4129015.
[21] Yang Y,Cong H,Han C,etal.12-Deoxyphorbol 13-palmitate inhibits the expression of VEGF and HIF-1α in MCF-7 cells by blocking the PI3K/Akt/mTOR signaling pathway [J].Oncol Rep,2015,34(4):1755-1760.
[22] Shin JM,Jeong YJ,Cho HJ,etal.Melittin suppresses HIF-1α/VEGF expression through inhibition of ERK and mTOR/p70S6K pathway in human cervical carcinoma cells[J].PLoS One,2013,8(7):e69380.
[23] Wang D,Zhuang Y,Tian Y,etal.Study of the effects of total flavonoids of Astragalus on atherosclerosis formation and potential mechanisms[J].Oxid Med Cell Longev,2012,2012:282383.
[24] Qu ZH,Yang ZC,Chen L,etal.Inhibition airway remodeling and transforming growth factor-β1/Smad signaling pathway by astragalus extract in asthmatic mice[J].Int J Mol Med,2012,29(4):564-568.
[25] Auyeung KK,Mok NL,Wong CM,etal.Astragalus saponins modulate mTOR and ERK signaling to promote apoptosis through the extrinsic pathway in HT-29 colon cancer cells[J].Int J Mol Med,2010,26(3):341-349.
[26] Zhang L,Liu Q,Lu L,etal.Astragaloside IV stimulates angiogenesis and increases hypoxia-inducible factor-1α accumulation via phosphatidylinositol 3-kinase/Akt pathway[J].J Pharmacol Exp Ther,2011,338(2):485-491.
[27] Wang L,Sun J,Yi Q,etal.Protective effect of polyphenols extract of adlay (Coix lachryma-jobi L.var.ma-yuen Stapf) on hypercholesterolemia-induced oxidative stress in rats[J].Molecules,2012,17(8):8886-8897.
[28] Lu N,Liu J,Liu J,etal.Antagonist effect of triptolide on AKT activation by truncated retinoid X receptor-alpha[J].PLoS One,2012,7(4):e35722.
[29] Chen F,Liu Y,Wang S,etal.Triptolide,a Chinese herbal extract,enhances drug sensitivity of resistant myeloid leukemia cell lines through downregulation of HIF-1α and Nrf2[J].Pharmacogenomics,2013,14(11):1305-1317.
[30] Zhou ZL,Luo ZG,Yu B,etal.Increased accumulation of hypoxia-inducible factor-1α with reduced transcriptional activity mediates the antitumor effect of triptolide[J].Mol Cancer,2010,9:268.
[收稿2016-08-07 修回2016-10-25]
(编辑 张晓舟)
Effects of Xinfeng Capsule on synovial angiogenesis based PI3K/AKT/mTOR pathway,HIF-1α,ES in rats model of adjuvant arthritis
ZHANGXiao-Jun,LIUJian,WANLei,HUANGChuan-Bing.
AnhuiUniversityofChineseMedicine,Hefei230038,China
Objective:To observe the effect of Xinfeng Capsule (XFC) on synovial membrane PI3K/AKT/mTOR pathway in adjuvant arthritis (AA) rats.Methods:Rats were randomly divided into normal control group,model control group,methotrexate group,tripterygium glycoside group and XFC group.The expressions of IL-6,IL-10,HIF-1α and VEGF-A were detected by immunohistochemical method,and the expressions of PI3K,AKT1 and p-AKT1 were detected by immunoblotting.Results:Expression of AKT1,mTOR and ES proteins in synovial blood vessels.The expression of IL-6,VEGF,HIF-1α and synovial membrane PI3K,AKT1,p-AKT1,mTOR,ES in the model group were significantly higher than those in the control group The expression of PI3K,p-AKT1,mTOR,ES in synovial membrane decreased,and IL-10 in serum increased in XFC group,and the expression of HIF-1α,IL-6 and VEGF-A were decreased.Conclusion:XFC can improve angiogenesis in AA synovium by regulating PI3K/AKT/mTOR signaling pathway,HIF-1α and ES expression.
Adjuvant arthritis;Angiogenesis;PI3K/AKT/mTOR pathway;Xinfeng Capsule
10.3969/j.issn.1000-484X.2017.04.011
①本文为安徽省科技厅项目(1604f0804030)、国家自然科学基金青年项目(81403388)、安徽省自然基金项目(1508085QH159)、安徽省重点实验室:现代中医内科应用基础与开发研究(1606c08238)和安徽中医药大学校级基金(2014qn025)资助项目。
张晓军(1976年-),男,博士,副教授,主要从事中医药防治风湿、类风湿疾病研究,E-mail:zhecho223@sohu.com。
及指导教师:刘 健(1964年-),男,教授,博士生导师,主要从事中医药防治风湿病研究,E-mail:liujianahzy@126.com。
R593.2
A
1000-484X(2017)04-0533-05
②安徽中医药大学第一附属医院,合肥230038。
