IFN-α通过IFI16抑制人脑血管外膜成纤维细胞增殖并促进细胞凋亡①
2017-04-24龙向淑田茂波
黄 晶 宋 方 龙向淑 田茂波 吴 强
(贵州省人民医院心内科,贵阳550002)
IFN-α通过IFI16抑制人脑血管外膜成纤维细胞增殖并促进细胞凋亡①
黄 晶 宋 方 龙向淑 田茂波 吴 强
(贵州省人民医院心内科,贵阳550002)
目的:探讨干扰素-α(IFN-α)是否通过诱导干扰素诱导蛋白16(IFI16)表达抑制人脑血管外膜成纤维细胞(HBVAFs)增殖与促进细胞凋亡。方法:应用转染针对IFI16基因的小干扰RNA(siRNA)和/或IFN-α瞬时干预体外培养的HBVAFs。通过蛋白免疫印迹(Western blot)法和Real-time PCR法测定细胞中IFI16、P53、P21蛋白和mRNA表达水平的变化。用MTT法检测细胞活力,流式细胞术测定细胞周期及凋亡。结果:与未干预组比较,IFN-α(2 000~5 000 kU/L)干预HBVAFs后,IFI16蛋白表达水平明显上调,但不同浓度IFN-α组之间无统计学差异。使用2 000 kU/L IFN-α可诱导HBVAFs中P53及P21蛋白和mRNA表达水平上调,同时抑制细胞增殖与促进细胞凋亡。但在转染了IFI16 siRNA的HBVAFs中IFN-α的上述作用受到了抑制。结论:IFN-α抑制HBVAFs增殖与促进其凋亡的作用可能部分与其诱导IFI16表达有关。
干扰素诱导蛋白;干扰素-α;血管外膜成纤维细胞;增殖;凋亡
作为动脉管壁外膜最重要的细胞成分血管外膜成纤维细胞(Vascular adventital fibroblasts,VAFs),其增殖、参与血管内膜和中膜的形成、分泌胞外基质及迁移等作用,参与了血管增殖性疾病(如高血压、动脉粥样硬化、冠状动脉搭桥术后及支架植入术后再狭窄等)主要的病理生理过程[1-3]。干扰素(Interferon,IFN)通过表达多种IFN诱导蛋白发挥抑制增殖、促进凋亡、干预细胞分化等作用[4]。前期研究发现IFN-α能抑制VAFs及血管内皮细胞、血管平滑肌细胞的增殖,促进VAFs凋亡[5-7];IFN-β不但能抑制细胞增殖还能抑制动脉粥样硬化的进程[8]。干扰素诱导蛋白16(Interferon-inducible protein 16,IFI16)是IFN诱导蛋白p200家族的人源蛋白成员之一,研究发现IFI16参与了细胞增殖、凋亡的调控[9]。前期研究发现IFN-α可通过诱导该蛋白家族成员p204(该蛋白结构与IFI16相似)表达抑制大鼠主动脉外膜VAFs增殖,促进大鼠血管平滑肌细胞凋亡[10,11]。但IFN-α对VAFs增殖与凋亡的影响是否与其诱导IFI16表达有关尚未见文献报道。本研究拟观察IFN-α对VAFs增殖与凋亡的影响及IFI16表达变化,为研究IFN及其诱导蛋白运用于防治血管增殖性疾病提供更多理论及实验依据。
1 材料与方法
1.1 材料 人脑血管外膜成纤维细胞(Human brain vascular adventitial fibroblasts,HBVAFs)细胞株(ScienCell公司)。DMEM高糖培养基和胎牛血清(HyClone公司)。IFN-α(北京三元基因工程有限公司)。噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒、SDS-PAGE凝胶试剂盒、细胞周期与凋亡检测试剂盒(碧云天公司)。Real-time PCR荧光染料试剂(TaKaRa公司)。人β-actin引物上游:TGGCACCACACCTTCTACAATG,下游:TCATCTTCTCGCGGTT-GGC;人IFI16引物上游:GAAGTGCCAGCGTAAC-TCCTA,下游:TACCTCAAACACCCCATTCAC;人p53引物上游:CTCCTCAGCATCTTATCCGAG,下游:GCTGTTCCGTCCCAGTAGATTA,人p21引物上游ATGTGGACCTGTCACTGTCTTG,下游ATTAGGGCT-CCTCTTGGAGAA(上海生工生物公司)。逆转录试剂(Fermentas公司)。P53抗体、P21抗体(EPITOMICS公司)。IFI16 siRNA(h)、Control siRN-A-A、siRNA transfection medium、siRNA transfection reagent、IFI16抗体、β-actin抗体(Santa Cruz公司)。
1.2 方法
1.2.1 HBVAFs的培养 从液氮罐中取出HBVAFs细胞冻存管经37℃水浴,再经10倍体积DEME培养液(含10%胎牛血清)漂洗。1 000 r/min离心5 min后弃上清液,加入1 ml上述培养液吹打重悬细胞,加培养液至4 ml后,置于37℃含5%CO2培养箱内。24 h后更换新培养液。采用复苏后第3代生长状态良好的细胞用于实验。
1.2.2 分组 实验分为7组,正常培养为Negative组;用终浓度2 000~5 000 kU/L IFN-α分别干预24 h 后,即获2 000、3 000、4 000、5 000 kU/L IFN-α组。在Negative组中转染质控siRNA和针对IFI16基因的siRNA 48 h后,用2 000 kU/L IFN-α处理24 h 后分别为Control siRNA组和IFI16 siRNA组。每实验组均设3个复孔,实验重复 3 次。
1.2.3 Real-time PCR检测mRNA表达 按Trizol法提取总RNA后,42℃ 60 min,70℃ 5 min合成cDNA。Real-time PCR采用95℃ 30 s预变性,95℃ 5 s,60℃ 34 s,重复循环40次。95℃ 15 s,60℃ 1 min,95℃ 15 s进行熔解曲线。计算各组IFI16、P53、P21 mRNA的相对表达量。
1.2.4 Western blot检测蛋白表达 通过细胞裂解液(RIPA)提取细胞蛋白。蛋白定量后加入SDS-PAGE上样缓冲液,沸水5 min变性。湿法转膜转移蛋白条带至NC膜。常温下5%脱脂奶粉封闭1 h;TBST洗膜;加入一抗工作液4℃过夜孵育(IFI16抗体稀释度1∶500;P53、P21抗体稀释度1∶1 000;β-actin抗体稀释度1∶5 000);TBST洗膜;37℃孵育二抗1 h;TBST洗膜;ECL化学发光;X光胶片显影、定影后对胶片进行扫描。BandScan 4.3软件计算IFI16、P53、P21与β-actin吸光度比值。
1.2.5 MTT 检测细胞增殖活力 收集对数增殖期细胞,按细胞数4×103个/孔接种于96孔板,各组细胞继续培养48 h后按噻唑蓝(MTT)细胞增殖及细胞毒性检测试剂盒说明书测定细胞增殖活性。
1.2.6 流式细胞仪检测细胞周期 按细胞周期与凋亡检测试剂盒说明书测定DNA含量分析与凋亡。
2 结果
2.1 干预后对IFI16、P53和P21表达的影响 与Negative组比较,2 000、3 000、4 000、5 000 kU/L IFN-α组中IFI16蛋白及mRNA表达水平升高(P<0.05);与2 000 kU/L,3 000、4 000、5 000 kU/L IFN-α组间IFI16蛋白及mRNA表达无统计学意义。与2 000 kU/L IFN-α组比较,IFI16 siRNA组中IFI16、P53、P21蛋白及mRNA表达水平下降(P<0.05)。2 000 kU/L IFN-α组与Control siRNA组间差异无统计学意义(图1、2)。

图1 干预后IFI16蛋白和mRNA水平在HBVAFs中的表达情况Fig.1 Effect of intervention factors on expression of IFI16 protein and mRNA in HBVAFsNote:1.Negative;2.2 000 kU/L IFN-α;3.3 000 kU/L IFN-α;4.4 000 kU/L IFN-α;5.5 000 kU/L IFN-α.*.P<0.05 vs negative.
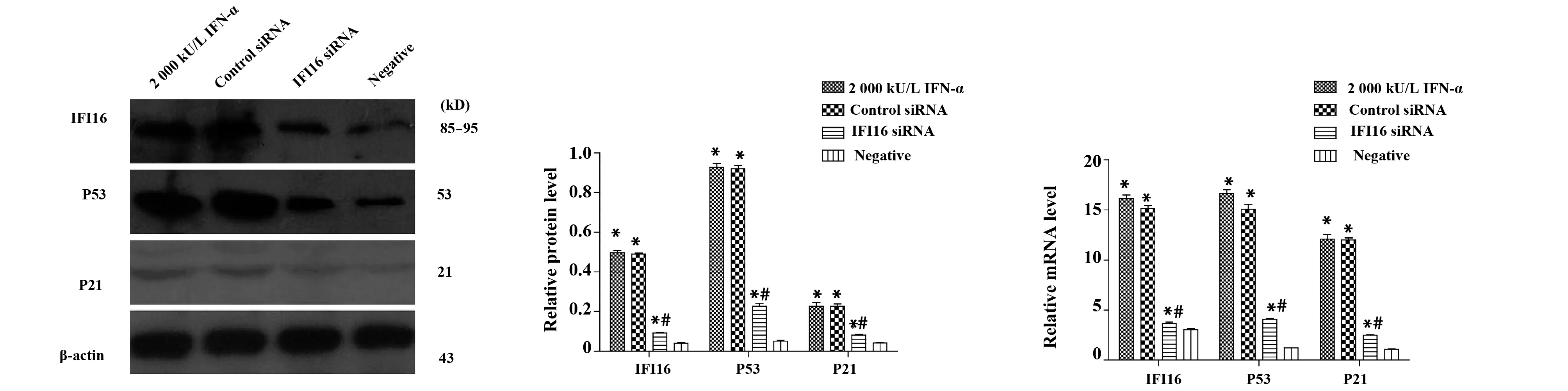
图2 干预后IFI16、P53、P21蛋白和mRNA水平在HBVAFs中的表达情况Fig.2 Effect of intervention factors on the expression of IFI16,P53,P21 protein and mRNA in HBVAFsNote:*.P<0.05 vs negative;#.P<0.05 vs 2 000 kU/L IFN-α.
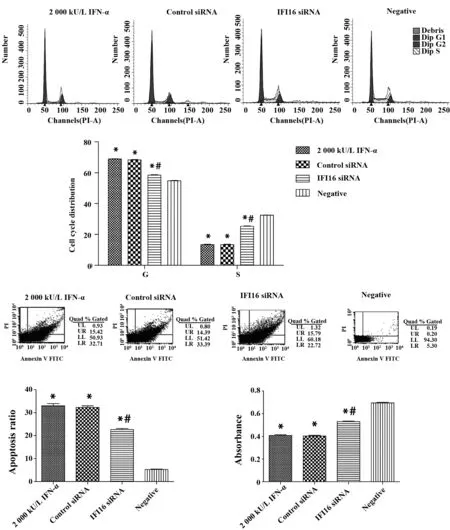
图3 干预后对HBVAFs细胞增殖与凋亡影响Fig.3 Effect of intervention factors on cell proliferation and apoptosis of HBVAFsNote:*.P<0.05 vs negative,#.P<0.05 vs 2 000 kU/L IFN-α.
2.2 IFN-α对细胞增殖、凋亡的影响 与Negative组比较,2 000 kU/L IFN-α组MTT吸光度A值减低(P<0.05),G0/G1期细胞与凋亡细胞数增多,S期细胞数减少 (P<0.05)。与2 000 kU/L IFN-α组比较,IFI16 siRNA组MTT吸光度A值增加(P<0.05),G0/G1期细胞与凋亡细胞数减少,S期细胞数增多 (P<0.05)。2 000 kU/L IFN-α组与Control siRNA组间差异无统计学意义(图3)。
3 讨论
血管壁内、中、外膜主要由血管内皮细胞、血管平滑肌细胞与VAFs组成。长期以来均将前两者视为血管增殖性疾病病理改变的关键作用靶点,VAFs仅作为“旁观者”起着营养与支持的作用[1]。然而随着研究的深入,发现在血管损伤后血管重构过程中,VAFs增殖活性、合成细胞外基质以及转化为肌成纤维细胞能力明显增强[12,13]。因此VAFs在血管增殖性疾病的发生、发展过程并非旁观者而是像“哨兵”一样起着关键的作用[3],故促进VAFs增殖及其凋亡是防治上述疾病的措施之一。
IFN分为Ⅰ型(IFN-α、β、τ等)、Ⅱ型(IFN-γ)与Ⅲ型(IFN-λ),是一组具有多种生物学效应(如抗增殖、调节免疫应答、抗病毒等)的活性细胞因子家族。体外实验证实IFN-α能抑制血管壁细胞增殖[5-7]。动物实验发现动脉球囊损伤后通过在损伤局部转染过表达IFN-β或肠外给予IFN-γ能抑制新生内膜的形成与血管平滑肌细胞增殖[14,15],提示在血管增殖性疾病的治疗过程中运用IFN是可行的。本研究结果也同样显示IFN-α能抑制HBVAFs增殖与促进其凋亡。
IFI16蛋白作为IFN诱导蛋白p200家族成员在上皮细胞、成纤维细胞、内皮细胞、单核/巨噬细胞、淋巴细胞、部分肿瘤细胞等胞核与胞质中存在表达[16,17],并能被IFN-α、β、γ等诱导表达[17]。IFI16蛋白氨基端有参与蛋白与蛋白相互作用的PYD构域与核定位序列(Nuclear localization sequences,NLS),二者通过与凋亡、炎性反应信号通路相关蛋白之间的相互结合参与细胞增殖、凋亡、分化及炎症反应调控等过程[16]。本研究通过Westem blot表明,IFI16蛋白在HBVAFs中存在基础表达,并且IFN-α干预HBVAFs 24h后能诱导IFI16蛋白表达,但在2 000~5 000 kU/L浓度范围内诱导IFI16表达未呈现剂量依赖性。因此推测在HBVAFs中IFI16可能是发挥IFN-α多种生物学功能的重要下游蛋白之一。抑癌基因p53能够通过下游基因p21抑制细胞周期进程促进细胞凋亡与老化[18]。有研究发现,IFI16蛋白通过p53、p21通路抑制脐静脉内皮细胞增殖,但在感染人乳头状瘤病毒而永生化的HUVEC 中,由于致癌基因E6和E7抑制p53的活性,导致IFI16抑制增殖的作用受到明显限制[19]。亦有研究发现,在人胚胎肾细胞293中转染IFI16基因后,IFI16蛋白200A结构域中的MFHATVATIF基序与p53羟基端结合,增加p53的表达,从而抑制细胞增殖[20]。而在乳腺癌细胞中上调IFI16蛋白表达能通过活化p53的bax启动子激活p53的表达,并增加其下游目的基因p21表达,从而激活p53介导的细胞凋亡与增殖抑制[21]。大量的研究说明IFI16在调控细胞增殖与凋亡过程中与p53/p21等细胞周期调控蛋白存在密切关系。本研究结果显示,在2 000 kU/L IFN-α干预HBVAFs后更多的细胞停滞在G0/G1期,凋亡细胞数亦有所增加。IFN-α在诱导IFI16表达增加的同时P53与P21的表达也上调了。然后沉默IFI16基因后IFN-α诱导的上述作用受到了限制。无论诱导IFI16过表达还是抑制IFI16表达,P53与P21蛋白及mRNA表达水平均与其呈一致性变化趋势,这表明IFI16在抑制VAFs增殖与促进凋亡过程中可能与诱导P53和P21表达有关。提示IFN-α抑制HBVAFs增殖,促进其凋亡过程中,P53/P21可能作为IFI16的下游蛋白而发挥其作用。
综上所述,IFN-α能促进IFI16、P53、P21表达,抑制VAFs增殖,诱导其凋亡,推测IFI16可能参与了IFN-α对VAFs增殖、凋亡的调控,P53/P21途径可能参与该生物学效应的下游调控。从而为IFN及其诱导蛋白应用于血管增殖性疾病提供更多的理论依据。
[1] Chiang HY,Korshunov VA,Serour A,etal.Fibronectin is an important regulator of flow-induced vascular remodeling[J].Arterioscler Thromb Vase Biol,2009,29(7):1074-1079.
[2] Tieu BC,Ju X,Lee C,etal.Aortic adventitial flbroblasts participate in angiotensin-induced vascular wall inflammation and remodeling [J].J Vase Res,2011,48(3):261-272.
[3] 王 洋,雷 燕.血管外膜成纤维细胞及其还原型烟酰胺腺嘌呤二核苷酸磷酸氧化酶激活在血管损伤中的作用[J].中国循环杂志,2015,30(4):404-407.
[4] Motylewska E,Lawnicka H,Kowalewicz-Kulbat M,etal.Interferon alpha and rapamycin inhibit the growth of carcinoid and medullary thyroid cancer in vitro[J].Pharmacol Rep,2014,66(4):624-629.
[5] 黄 晶,宋 方,龙向淑,等.α干扰素对人脑血管成纤维细胞增殖、凋亡与迁移的影响[J].临床心血管病杂志,2013,12(29):952-955.
[6] 龙向淑,吴 强,宋 方.干扰素诱导蛋白16对血管内皮细胞增殖的影响[J].中华高血压杂志,2013,21(1):29-33.
[7] 龙向淑,吴 强,宋 方,等.Ras信号途径参与干扰素-α抑制大鼠平滑肌细胞增殖 [J].基础医学与临床,2014,34(7):882-885.
[8] Bekisz J,Baron S,Balinsky C,etal.Antiproliferative properties of typeⅠ and type Ⅱ interferon [J].Phamaceuticals,2010,3(4):994-1015.
[9] Zhao H,Gonzalezgugel E,Cheng L,etal.The roles of interferon-inducible p200 family members IFI16 and p204 in innate immune responses,cell differentiation and proliferation[J].Genes Diseases,2015,2(1):46-56.
[10] 宋 方,吴 强,潭洪文,等.IFN-α通过p204抑制大鼠主动脉外膜成纤维细胞增殖[J].基础医学与临床,2012,32(12):1431-1436.
[11] 龙向淑,宋 方,吴 强,等.干扰素α通过P204和P21诱导大鼠原代血管平滑肌细胞凋亡[J].基础医学与临床,2014,34(12):1635-1639.
[12] Sartore S,Chiavegato A,Faggin E,etal.Contribution of adventitial fibroblasts to neointima formation and vascular remodeling:from innocent bystander to active participant[J].Circ Res,2001,89(2):1111-1121.
[13] Stenmark KR,Davie N,Frid M,etal.Role of the adventitia in pulmonary Vascular remodeling[J].Physiology (Bethesda),2006,21(1):134-145.
[14] Castronuovo JJ Jr,Guss SB,Mysh D,etal.Cytokine therapy for arterial restenosis:inhibition of neo-intimal hyperplasia by gamma-interferon[J].Cardiovasc Surg,1995,3(5):463-468.
[15] Stephan D,San H,Yang ZY,etal.Inhibition of vascular smooth muscle cell proliferation and intimal hyperplasia by gene transfer of beta-interferon[J].Mol Med,1997,3(9):593-599.
[16] Veeranki S,Choubey D.Interferon-inducible p200-family protein IFI16,an innate immune sensor for cytosolic and nuclear double-stranded DNA:Regulation of subcellular localization[J].Mol Immunol,2012,49(4):567-571.
[17] Gariglio M,Mondini M,DeAndrea M,etal.The multifaceted interferon-inducible p200 family proteins:from cell biology to human pathology[J].J Interferon Cytokine Res,2011,31 (1):159-172.
[18] Vousden KH,Prives C.Blinded by the light:The growing complexity of p53[J].Cell,2009,137(3):413-431.
[19] Raffaella R,Gioia D,De Andrea M,etal.The interferon-inducible IFI16 gene inhibits tube morphogenesis and proliferation of primary,but not HPV16 E6/E7-immortalized human endothelial cells[J].Exp Cell Res,2004,293(2):331-345.
[20] Johnstone RW,Wei W,Greenway A,etal.Functional interaction between p53 and the interferon-inducible nucleoprotein IFI16[J].Oncogene,2000,19 (52):6033-6042.
[21] Fujiuchi N,Aglipay JA,Ohtsuka T,etal.Requirement of IFI16 for the maximal activation of p53 induced by ionizing radiation[J].Biol Chem,2004,279(19):20339-20344.
[收稿2016-05-16 修回2016-06-24]
(编辑 许四平)
Interferon alpha suppresses proliferation and induces apoptosis of human brain vascular adventitial fibroblasts via IFI16
HUANGJing,SONGFang,LONGXiang-Shu,TIANMao-Bo,WUQiang.
DepartmentofCardiology,GuiyangProvincePeople′sHospital,Guiyang550002,China
Objective:To study interferon alpha (IFN-α) inhibition of proliferation and apoptosis induction of human brain vascular adventitial fibroblasts(HBVAFs)via IFI16.Methods:Cultured HBVAFs were treated with transfection IFI16 siRNA and/or IFN-α in vitro instantaneously.The protein and mRNA levels of IFI16,P53,P21 were measured by Western blot and Real-time PCR.MTT was used to detect the cell proliferation of the HBVAFs.Cell cycle and apoptosis were analyzed by flow cytometry.Results:IFN-α with terminal concentration of 2 000-5 000 kU/L induce significantly expression of IFI16 in HBVAFs,without any significant difference.Stimulated with 2 000 kU/L IFN-α up-regulated the expression of P53,P21 at protein and mRNA levels,and inhibited the cell proliferation and promote cells apoptosis in HBVAFs.Such effect was restrained by transfection with IFI16 siRNA into HBVAFs.Conclusion:IFN-α inhibits HBVAFs proliferation and induces apoptosis may partly relate to the increased IFI16 expression.
Interferon-inducible protein;IFN-α;Vascular adventitial fibroblasts;Proliferation;Apoptosis
10.3969/j.issn.1000-484X.2017.04.003
①本文为国家自然科学基金项目(No. 81260030)。
黄 晶(1988年-),男,硕士,主治医师,主要从事冠心病基础与临床方面的研究,E-mail:herenwushui@sohu.com。
及指导教师:吴 强(1969年-),男,博士,主任医师,主要从事冠心病基础与临床方面的研究,E-mail:gzgywq@126.com。
R363
A
1000-484X(2017)04-0494-04
