CD8+ T细胞活化与分化的分子机制
2017-04-24王红艳
刘 畅 王红艳
(中科院上海生物化学与细胞生物学研究所系统生物学重点实验室/中科院分子细胞卓越中心,上海200000)
·专家述评·
CD8+T细胞活化与分化的分子机制
刘 畅 王红艳
(中科院上海生物化学与细胞生物学研究所系统生物学重点实验室/中科院分子细胞卓越中心,上海200000)
CD8+T细胞识别由MHCⅠ分子递呈的抗原肽,由于大多数有核细胞都表达MHCⅠ分子,因此CD8+T细胞在清除被病毒、胞内菌、寄生虫等感染的细胞或突变的肿瘤细胞中发挥着重要作用。识别病原微生物等抗原后,CD8+T细胞活化并分化形成多种类型的效应和记忆细胞,不仅能及时清除被感染的细胞,也能形成长期保护。各亚群CD8+T细胞的表面分子、功能和定位不同,细胞存活的时间、再次感染时的增殖能力和效应功能也有所差别。本文主要讨论CD8+T细胞如何受到多条信号通路和转录因子调控,活化和分化成不同类型的效应和记忆细胞,并对临床应用T细胞抵御肿瘤和病原微生物的进展作一简单概述。
细胞毒性T细胞;活化;分化;记忆T细胞;效应T细胞

刘 畅(1991年-),2012年毕业于云南大学生命科学与技术基地班,同年推荐免试进入中国科学院生物化学与细胞生物学研究所,师从王红艳研究员,攻读博士学位,主要研究巨噬细胞和CD8+T细胞的功能。2016年作为共同第一作者在Cell Reports上发表TET3通过非DNA去甲基化方式负性调控 Ⅰ 型干扰素产生的论文,目前正在进行CD8+T细胞杀伤功能研究。

王红艳(1975年-),任中科院上海生化与细胞所研究员。2007年1月获英国伦敦帝国理工学院博士,2007~2010年在英国剑桥大学任Research Fellow,2010年3月起任中科院上海生化与细胞所研究员,课题组长。研究领域为“免疫细胞介导的炎症相关疾病”,发表SCI论文31篇。其中,以通讯作者或第一作者(共同)发表论文20篇,累计影响因子为172。自2010年独立建实验室以来,以通讯或共同通讯作者发表10篇论文,包括Immunity、J Clin Invest、J Exp Med、EMBO Mol Med、Cell Research、PLoS Pathogens、Cell Reports等,获得或申请发明专利3项。此外,发表受邀综述4篇。任JBC、Frontiers in Immunology、Immunology等编委;任中国免疫学会基础免疫分会委员。主持国家自然科学基金“优秀青年基金”和面上项目3项(2项已结题),任中科院分子细胞卓越中心成员先导B课题组长和两项科技部重大科学研究项目的课题组长(1项已结题)等资助;2011年获中科院百人计划、上海浦江人才计划。2015年获中科院优秀研究生指导教师奖。
CD8+T细胞来源于骨髓造血干细胞,在胸腺中经过基因V(D)J重排和阳选/阴选发育成熟,迁出胸腺后在血液和淋巴器官间循环[1]。识别特定抗原的静息态CD8+T细胞仅有10~1 000个,这保证了体内有限数量的CD8+T细胞能够识别众多抗原[2]。CD8+T细胞通过其表面的TCR识别由MHCⅠ分子递呈的抗原肽而被活化,活化后的CD8+T细胞会经历扩增、收缩和记忆形成三个阶段。扩增阶段产生大量的抗原特异性CD8+T细胞,经过大于13次的分裂,最多可产生约10 000个子细胞,但是其中的90%~95%都会在收缩阶段凋亡,防止机体产生自身免疫疾病。而剩余的5%~10%细胞则会进一步分化,形成记忆细胞长期存活,当再次感染时能够迅速响应清除病原[2,3]。
1 抗原递呈与CD8+ T细胞的活化
抗原递呈细胞(Antigen presenting cell,APCs)通过抗原肽-Ⅰ型主要组织相容性复合体(Pathogen-derived peptides-major histocompatibility complex class Ⅰ,pMHC-Ⅰ)与CD8+T细胞表面的TCR结合,协同黏附分子淋巴细胞功能相关分子/细胞间黏附分子1(LFA-1/ICAM-1)形成免疫突触,从而活化CD8+T细胞[4]。抗原肽通常有8~10个氨基酸[5],是APCs将抗原吞入后经过蛋白酶体的消化、降解,被抗原处理相关转运蛋白(Transporter associated with antigen processing,TAP)转运到内质网中进一步加工,然后被装载到MHCⅠ分子,并被运送到细胞膜表面。此外,凋亡细胞等产生的胞外蛋白与MHCⅠ分子结合,通过另外一种称为交叉递呈的作用,也能促进CD8+T细胞的活化。比如CD8α+DCs特异性表达趋化因子受体XCR1,能够与CD8+T细胞表面的XCR1配体——XCL1结合,完成交叉递呈[6]。
CD8+T细胞的活化和分化需要三种信号形成的分子网络:T细胞受体/抗原肽-Ⅰ型主要组织相容性复合体(信号1)、共刺激信号(信号2,如CD28-CD80/CD86、CD40-CD40L、OX40-OX40L等)和炎症因子(信号3,如type Ⅰ IFNs、IFN-γ、IL-2、IL-12、IL-27等)[7-10]。信号1决定了CD8+T细胞具有抗原特异性,也影响CD8+T细胞增殖;信号2能够增强信号1即TCR信号,信号3会影响细胞的存活、增殖和分化方向。抗原类型、抗原存在时间及炎症信号的强弱等任何条件的变化都会影响CD8+T细胞的效应功能和分化水平以及二次免疫应答反应。比如,L.monocytogenes感染后24 h使用抗生素处理,并不影响CD8+T细胞的增殖,但是若是感染后12 h使用抗生素处理,则严重影响细胞增殖[2]。此外,若是缺少IFN-γ和IL-12信号,CD8+T细胞会向IL-7Rαhi的记忆前体细胞方向分化[11]。在LCMV及VSV感染时,如果CD8+T细胞缺失IFN-α/β受体或者IL-27的受体也会出现TCM增多的现象。相反,如果炎症水平和TCR信号很强,记忆细胞的数目会显著减少[12,13]。
活化的CD8+T细胞又称为细胞毒性T细胞(Cytotoxic T cell,CTL),主要通过三种途径发挥效应功能:①产生细胞因子TNF-α和IFN-γ:TNF-α与靶细胞表面的TNFR结合,启动胞内Caspase途径,诱导靶细胞凋亡。IFN-γ一方面促进靶细胞表面MHC分子的表达从而增强抗原递呈,另一方面能促进巨噬细胞、树突状细胞的吞噬能力;②CD8+T细胞表面的CD95L与靶细胞表面的CD95结合,启动靶细胞内凋亡信号; ③CD8+T细胞通过释放穿孔素、颗粒酶等细胞毒性分子裂解靶细胞[14]。CD8+T细胞清除不同病原所用的杀伤方式有所不同,如对LCMV的清除主要依赖于穿孔素,而非Fas途径,但是在清除流感病毒时穿孔素和Fas途径都是需要的[5]。此外,流感病毒感染时,肺部的效应CD8+T细胞在产生IFN-γ的同时,还能够产生IL-10,及TGF-β诱导产生的CD103+CD8+T细胞都能减少对肺部的损伤[15,16]。
2 CD8+ T细胞的分化和定位
感染后CD8+T细胞会经历扩增、收缩和记忆形成三个阶段,各阶段CD8+T细胞的表面分子、效应功能和定位有所不同。活化后的CD8+T细胞可以分为短活效应细胞(Short-lived effector cells,SLECs)和记忆前体效应细胞(Memory precursor effector cells,MPECs)两大类,常使用KLRG1和CD127(Interleukin-7 receptor subunit alpha,IL-7Rα)这两个表面分子来表征CD8+T细胞的活化状态。MPECs细胞为KLRG1lowCD127hi,在清除病原后进一步分化形成记忆细胞,而SLECs为KLRG1hiCD127low,能产生大量的细胞毒性分子和细胞因子,大部分在收缩阶段凋亡。但这种分类方法并不是绝对的,也有CD127hi的细胞在清除病原后凋亡或者是KLRG1hiCD127low的细胞存活下来[17]。依据细胞表面分子和定位,可以将记忆细胞进一步分为中枢性记忆T细胞(Central memory T cells,TCM),效应性记忆T细胞(Effector memory T cells,TEM)和组织特异性T 细胞(Tissue resident memory T cells,TRM)三种类型[18,19],见表1。不同活化状态的CD8+T细胞表达的与细胞迁移相关的分子不同,包括选择素/选择素配体、趋化因子受体和整合素。CD62L(L-selectin,also known as CD62L)和CCR7能分别与高内皮小静脉(High endothelial venule,HEV)上的外周淋巴结地址素(Peripheral node addressins,PNAd)和CCL19/CCL21结合,介导CD8+T细胞迁入淋巴结,主要在静息态CD8+T细胞和记忆细胞上表达[20]。CD8+T细胞表达的整合素和趋化因子受体决定了细胞的最终定位。比如,CCR9和α4β7有利于CD8+T细胞迁移至肠道,而CCR10和皮肤淋巴细胞抗原(Cutaneous lymphocyte antigen,CLA)对于CD8+T细胞迁移到皮肤很重要。CD8+T细胞有较强的可塑性,当外界环境变化时,CD8+T细胞的功能、表面分子和细胞定位也会发生改变[21]。当病原反复刺激时,记忆CD8+T细胞表型更像效应细胞,且TEM的比例也会增多[22,23]。
表1 记忆细胞亚群
Tab.1 Memory T cell subsets
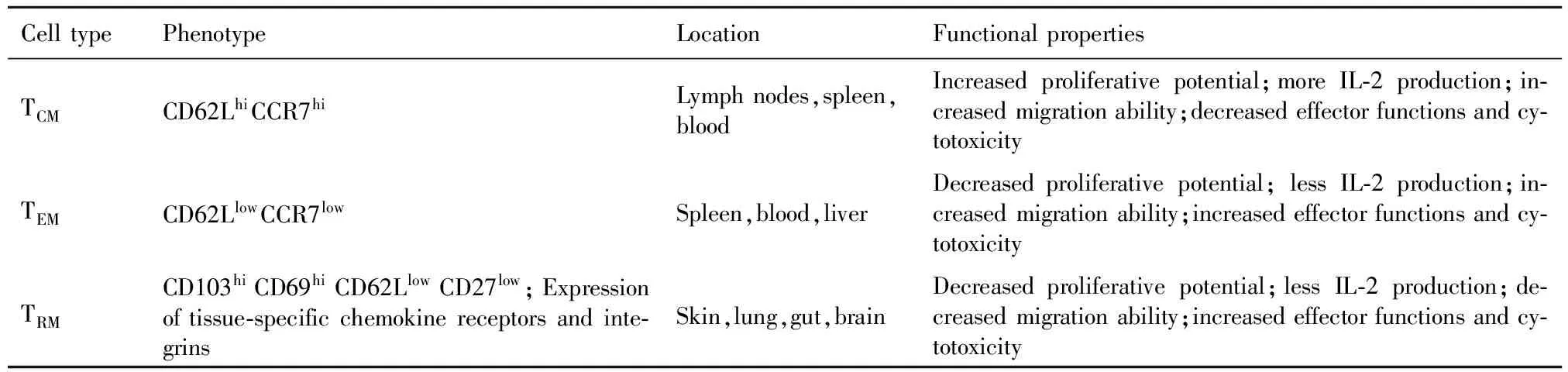
CelltypePhenotypeLocationFunctionalpropertiesTCMCD62LhiCCR7hiLymphnodes,spleen,bloodIncreasedproliferativepotential;moreIL⁃2production;in⁃creasedmigrationability;decreasedeffectorfunctionsandcy⁃totoxicityTEMCD62LlowCCR7lowSpleen,blood,liverDecreasedproliferativepotential;lessIL⁃2production;in⁃creasedmigrationability;increasedeffectorfunctionsandcy⁃totoxicityTRMCD103hiCD69hiCD62LlowCD27low;Expressionoftissue⁃specificchemokinereceptorsandinte⁃grinsSkin,lung,gut,brainDecreasedproliferativepotential;lessIL⁃2production;de⁃creasedmigrationability;increasedeffectorfunctionsandcy⁃totoxicity
目前有4种模型解释CD8+T细胞存在多种分化状态的原因[19]:一是单独前体模型(Separate-precursor model)提出CD8+T细胞在胸腺中发育成熟的过程中已经决定了其可能成为的细胞类型,但是支持证据较少;二是直线式发展模型(Linear progression model又称Decreasing-potential model),即在整个感染过程的不同阶段,各种信号的累积效应影响细胞分化状态;三是信号强度模型(Signal-strength model),在T细胞活化阶段,3种信号的整体强度影响细胞分化;四是不对称分裂模型(Asymmetric cell fate model),即靠近APCs侧的细胞会成为SLECs,而另外一侧形成MPECs。
此外,在慢性病毒感染如HIV、HBV及HCV感染的病人和肿瘤中,抗原和炎症的持续存在可以导致CD8+T细胞处于耗竭状态(Exhausted T cells,TEX), 不能有效地清除病毒和肿瘤[24,25]。这群抗原特异的CD8+TEX细胞产生较低水平的IL-2、TNF-α和IFN-γ等效应分子,增殖能力受损,杀伤功能减弱;依赖抗原维持细胞存活和增殖,而不是像正常的记忆细胞那样依赖IL-7、IL-15[10];CD8+TEX细胞表面高水平表达PD-1、LAG3、CD244、CD160等抑制性分子;表观遗传学特征与正常的记忆细胞不同[24,26]。近期的研究发现,TEX的定位对其表型也有影响,如LCMV-Cl13感染时,位于B细胞滤泡中的CXCR5+CD8+T细胞的效应功能强于CXCR5-细胞群[27]。
3 CD8+ T细胞分化的转录水平调控
CD8+T细胞表面的TCR与pMHCⅠ结合后,Src家族的激酶LCK/FYN对CD3胞内段的ITAM进行磷酸化,招募并活化ZAP-70,ZAP-70随后磷酸化LAT和SLP-76,促进与PLCγ1、VAV1、GRB2/SOS、ITK等形成信号小体,进一步促进下游的Ca2+、NFAT、NF-κB等信号通路,启动与增殖、效应功能等相关的基因的转录[28,29]。CD8+T细胞膜上高水平的游离胆固醇也有利于TCR成簇化及活化信号增强,更快形成成熟的免疫突触,如当抑制胆固醇酯化酶ACAT1后能增强CTL的杀伤能力[30]。共刺激分子(如CD80、CD86)和共抑制分子(如PD-1、CTLA-4、Tim-3)的表达水平也影响着CD8+T细胞效应功能[31-33]。此外,CD8+T细胞表面的细胞因子受体,如IL-2R、IL-12R、IFN-γR等与配体结合能够促进或抑制基因的转录,且配体浓度会影响到下游信号强度和细胞的分化方向。高浓度的IL-2促进blimp1的转录和效应CD8+T细胞的形成,低浓度的IL-2有利于诱导EOMES转录和记忆细胞的形成。IL-12则能够诱导T-bet的转录,促进效应CD8+T细胞形成。两种细胞因子还可以促进ID2的转录[27]。另外,CD8+T细胞中也存在着TLR信号通路,如在牛痘病毒感染时会活化TLR2-MyD88通路,促进细胞的增殖和存活[34]。
T-bet和EOMES是调控CD8+T细胞效应功能和分化的重要转录因子,都有T-box结构域[35]。在CD8+T细胞中,T-bet由TCR和IL-12信号诱导表达,EOMES由RUNX3途径上调表达。T-bet的表达在CD8+T细胞记忆形成的过程中逐渐降低,相反,EOMES的表达水平逐渐升高,该过程受到Type Ⅰ IFNs、IL-12、IL-4、IL-10等细胞因子及WNT信号通路调控,由TCF1启动转录[36]。T-bet和EOMES在CD8+T细胞活化的早期,共同促进CTLs产生IFN-γ、颗粒酶B、穿孔素、CXCR3和CXCR4等[37]。在LCMV感染时,这两个转录因子都缺失的CD8+T细胞没有正常的杀伤功能并产生IL-17,引起大量中性粒细胞浸润和严重的炎症反应并引起死亡[38]。T-bet和EOMES还可调控记忆细胞的形成。T-bet促进CD8+T细胞形成SLECs,CD8+T细胞缺失T-bet后不能正常形成KLRG1hiCD127low的效应细胞,当过表达T-bet时表型回复[39]。EOMES促进TCM的形成,EOMES缺失的CD8+T细胞虽然能够有效地形成KLRG1lowCD127hi的记忆前体细胞,但是不能正常分化表达CD122、CD62L、CXCR3和CXCR4等与归巢、稳态相关的分子[40]。
BLIMP1和BCL-6在调节CD8+T细胞过程中也起着相反的作用。在效应细胞和记忆细胞中,BCL-6的表达也与BLIMP1成负相关。在LCMV感染时,CD127hi的记忆前体细胞中BCL-6的表达水平略微高于KLRG1hiCD127low的效应细胞,而且随着记忆细胞的成熟,BCL-6的表达水平升高,BLIMP1的表达水平降低。急性感染过程中,IL-10和IL-21可能会通过STAT3维持并促进记忆细胞中BCL-6的表达。在CD8+T细胞中过表达BCL-6能够增加记忆细胞,尤其是TCM的数量。BLIMP1能抑制记忆细胞相关基因的表达,当LCMV感染BLIMP1缺失的小鼠时,CD62LhiCD127hi的记忆细胞数显著增多[41]。 此外,BLIMP1促进KLRG1hiCD127low的效应细胞形成,增强CTL迁移、产生IFN-γ和颗粒酶B[41]。缺失BLIMP1的抗原特异性CD8+T细胞不能有效地迁移到肺部对流感病毒进行清除[42]。
ID2和ID3(Inhibitor of DNA binding 2/3,ID2/3),是另外一对调节CD8+T细胞形成效应细胞或者记忆细胞的转录因子,两个基因在不同的分化阶段发挥作用。ID2促进从静息态向效应细胞分化阶段中效应CD8+T细胞的存活,促进KLRG1hiCD127low的效应细胞形成,而ID3则是在随后的效应细胞向记忆细胞形成阶段中发挥作用,促进记忆细胞的形成[43,44]。
JAK-STAT信号通路也参与CD8+T细胞的分化过程。在记忆细胞形成的阶段,STAT3能够维持SOCS3、BCL-6、EOMES、CD127和CD62L等基因的表达[45]。L.monocytogenes感染时,在IL-12和I型干扰素的影响下,CD8+T细胞中STAT4的表达水平逐渐升高,并伴随着T-bet转录水平的升高和KLRG1hiCD127low的效应细胞的形成[46]。STAT5A和STAT5B在LCMV感染过程中可以形成四聚体,维持CD8+T细胞中多个基因的正常表达[47]。体外用IL-2/IL-12刺激CD8+T细胞,发现STAT4/STAT5能够结合到blimp1的3号内含子上[48]。
调控CD8+T细胞分化和记忆形成的转录组中各种基因彼此关联、相互影响,相对表达水平决定了细胞的最终状态。感染过程中,如果T-bet、BLIMP1、ID2和STAT4等的表达水平高于某一阈值,CD8+T细胞会更倾向于向SLECs分化,增殖能力降低、存活时间缩短。相反地,另外一组转录因子,EOMES、BCL-6、ID3、TCF1和STAT3等的高表达则会促进细胞向MPECs分化,增殖能力强、存活时间长[49]。除了上面提到的转录因子,还有很多其他基因或信号通路参与CD8+T细胞的分化调控过程[37],如c-fos/PD-1、ADAP-SKAP55-NFATc1-PD-1和GSK-3-T-bet-PD-1通路[50-52]。此外,一些大规模测序的结果,根据基因的功能进行分类,具体信息可参考相应的文献[53]。
4 CD8+ T细胞分化的代谢水平调控
CD8+T细胞的代谢是目前重要研究领域之一,文献提示不同状态的CD8+T细胞的代谢方式不同。静息态和记忆CD8+T细胞主要利用氧化脂肪酸和线粒体氧化磷酸化产生ATP。在CD8+T细胞活化后,开始利用有氧糖酵解和脂类合成,提供快速增殖所需的能量和物质。当抗原清除后,CD8+T细胞对糖酵解的依赖减弱,又逐步恢复到静息态细胞的代谢状态[54]。条件性敲除Vhl后发现,氧化磷酸化不是记忆细胞形成的必要条件,CD8+T细胞即使在活化之后的整个过程使用糖酵解途径依然能够形成记忆细胞,只是会更倾向于形成TEM[55]。而提高外界L-arginine的水平可以促进代谢从糖酵解向氧化磷酸化切换,促进TCM的形成[56]。
现阶段研究发现,代谢方式的转变主要受到PI3K-AKT-mTOR/AMPK信号通路的调控,调节细胞快速增殖过程中所需的营养摄取、蛋白翻译和脂类合成[57,58]。AKT位于mTORC2和PI3K下游,被磷酸化后促进mTORC1和S6K活性,抑制真核翻译启动子(Eukaryotic translation initiation factor 4E-binding protein,eIF4E-binding protein,4EBP),从而促进合成代谢,加速糖酵解、蛋白翻译、脂类合成、细胞增殖,并促进T-bet的转录,形成效应细胞。当ATP减少和某些细胞因子的作用下,磷酸腺苷酸活化的蛋白激酶(AMP-activated protein kinase,AMPK)被激活,抑制mTOR信号,促进分解代谢,发生脂肪酸氧化、自噬、线粒体氧化磷酸化,升高EOMES的转录水平,形成记忆细胞。另外,IL-12-STAT4信号能够促进PI3K-AKT-mTOR通路,通过抑制FOXO1,促进T-bet/抑制EOMES表达,形成效应细胞。FOXO1还能够调控其他与CD8+T细胞迁移和存活相关的基因表达,如CD127、CCR7、CD62L、BCL-2、KLF2和IFN-γ等[59]。在LCMV感染时,使用雷帕霉素(Rapamycin)抑制mTOR的活性能够促进CD8+T细胞形成记忆前体细胞。在L.monocytogenes感染时,使用二甲双胍(Metformin,AMPK激活剂)处理或者过表达线粒体氧化脂肪酸(Carnitine palmitoyltransferase 1A)能够增强记忆CD8+T细胞形成[44]。
5 CD8+ T细胞与抗肿瘤或抗感染治疗
利用免疫系统治疗肿瘤的概念已经出现了一个世纪之久,其中提高CD8+T细胞对肿瘤的杀伤是一个热门领域。肿瘤的成分很复杂,包括肿瘤细胞(大约占30%)、基质细胞(能够为肿瘤的存活提供营养)和浸润的免疫细胞(成分和功能均较为复杂,有提高也有降低免疫监视能力的各种类型细胞)。有很多因素不利于CD8+T细胞发挥作用,在肿瘤微环境的影响下逐渐丧失效应功能,比如肿瘤细胞能够产生降解色氨酸和精氨酸的酶,并与免疫细胞竞争营养和氧气,同时还会产生高浓度的乳酸盐[60]。此外,肿瘤内还有很多具有免疫抑制性的固有免疫细胞,如髓系来源的抑制性细胞(Myeloid-derived suppressor cells,MDSCs)、肿瘤相关巨噬细胞(Tumor associated macrophages,TAMs)及CD4+FoxP3+调节性T细胞等降低CD8+T细胞的杀伤功能[61,62]。因此,在一些实体瘤的治疗时,肿瘤中浸润的CD8+T细胞数或者CD8/FoxP3高比值还常作为良好预后的指标[60,63]。
在实验和临床中尝试过多种提高T细胞免疫监视功能的治疗方法,如向乳腺癌细胞形成的肿瘤内注射IL-12和GM-CSF,诱导TEM活化产生IFN-γ和穿孔素,促进引流淋巴结中效应细胞的增殖和迁入到肿瘤中发挥功能[64]。或者,利用过继性转移T细胞(Adoptive T cell therapy,ACT)的治疗方案,如Yee等将黑色素瘤抗原MelanA或gp100特异的T细胞在体外培养,然后输到肿瘤携带者体内并伴随使用低剂量的IL-2; Rosenberg等从黑色素瘤中分离出肿瘤浸润的淋巴细胞(Tumor-infiltrating lymphocytes,TILs),在体外扩增,然后回输到病人体内[65]。近期开发的T细胞嵌合抗原受体(Chimeric antigen receptors on T cells,CAR-T)也可以归属于ACT治疗方案,在治疗淋巴瘤或白血病中获得显著的功效。CARs是由单克隆抗体的结合位点与TCR/CD3或CD28等共刺激分子的胞内段组成,能够直接对高表达特定靶分子的肿瘤细胞进行杀伤,如表达CD19的B淋巴瘤[66]。更重要的肿瘤免疫治疗方案是近年来阻断免疫检查点的方案。免疫检查点疗法是通过阻断T细胞的抑制性通路来增强其效应功能[67]。2011年FDA批准了anti-CTLA-4的单抗Ipilimumab用于治疗黑色素瘤[68]。随后又推出了anti-PD-1和anti-PD-L1单克隆抗体,病人的应答率可达10%~40%,将anti-CTLA-4和anti-PD-1联合使用后应答率可以提高到约60%,也正是因为如此,检查点阻断法成为治疗黑色素瘤的一线疗法。而且,鉴于anti-PD-1和anti-PD-L1单克隆抗体在治疗膀胱癌、错配修复基因缺失引起的结肠癌、部分淋巴瘤、非小细胞肺癌等中也发挥了较好疗效[69],免疫疗法被Science评为2013年十大科学突破之首[67]。针对过继性转移效应T细胞或CAR-T通常高表达PD-1的现象,最近的研究提出ACT联合anti-PD-1单克隆抗体的治疗策略[69]。
另外,CD8+T细胞在清除病毒感染中发挥不可替代的作用。例如,流感病毒造成呼吸道感染,在家禽、人类中引发大规模的流行,甚至会导致死亡。目前主要采用注射疫苗诱导体液免疫产生抗体的方式进行预防和治疗。但是,鉴于抗体主要识别病毒外壳HA/NA蛋白,而流感病毒的基因组很容易发生突变,产生新的不能被抗体识别的病毒外壳,因此需要经常更新疫苗,具有较大的限制性。由于CD8+T细胞能够识别不同毒株之间有一定保守性的病毒蛋白,能产生一定的交叉保护性和广谱性,因而发展出研制CTL疫苗的方法。如利用胞内体逃逸机制或者利用L.monocytogenes裂解细胞的原理,促进抗原的交叉递呈[70-74],增强免疫应答。
6 展望
综上所述,CD8+T细胞作为适应性免疫的重要组成部分,在清除各种病原微生物和肿瘤细胞中发挥关键的作用。CD8+T细胞受到抗原刺激后能够迅速地活化、增殖,在清除抗原后,效应CD8+T细胞大量消亡,仅小部分形成具有抗原特异性的记忆CD8+T细胞。CD8+T细胞应答过程的各个时期都受到多种因素协同精密调控,外界三类信号的变化会影响到细胞的最终状态和功能的发挥。免疫学家正是利用了CD8+T细胞的这些特征,优化免疫/刺激的条件以达到获取较多的效应细胞或者记忆细胞的目的,或者阻断抑制性信号(如针对PD-1、CTLA-4的单抗)逆转CD8+T细胞不应等的状态,回复其杀伤功能,也可以直接对CD8+T细胞进行改造,让其识别特异的抗原。随着高通量测序、CAS9等技术的发展,对各种病原感染、肿瘤细胞和免疫系统相互作用的分子机制的深入研究,将可能分时期、有针对性地调控CD8+T细胞的数量、功能等状态,用于疾病的预防和治疗。
[1] Gascoigne NR,Rybakin V,Acuto O,etal.TCR signal strength and T cell development[J].Annual Rev Cell Developmental Biol,2016,32:327-348.
[2] Khan SH,Badovinac VP.Listeria monocytogenes:a model pathogen to study antigen-specific memory CD8 T cell responses[J].Semin Immunopathol,2015,37(3):301-310.
[3] Harty JT,Badovinac VP.Shaping and reshaping CD8+T-cell memory[J].Nat Rev Immunol,2008,8(2):107-119.
[4] Li D,Molldrem JJ,Ma Q.LFA-1 regulates CD8+T cell activation via T cell receptor-mediated and LFA-1-mediated Erk1/2 signal pathways[J].J Biological Chemist,2009,284(31):21001-21010.
[5] Harty JT,Tvinnereim AR,White DW.CD8(+) T cell effector mechanisms in resistance to infection[J].Annual Rev Immunol,2000,18:275-308.
[6] Zhang N,Bevan MJ.CD8(+) T cells:foot soldiers of the immune system[J].Immunity,2011,35(2):161-168.
[7] Song A,Song J,Tang X,etal.Cooperation between CD4 and CD8 T cells for anti-tumor activity is enhanced by OX40 signals[J].Europ J Immunol,2007,37(5):1224-1232.
[8] Cho JH,Kim HO,Kim KS,etal.Unique features of naive CD8+T cell activation by IL-2[J].J Immunol,2013,191(11):5559-5573.
[9] Bourgeois C,Rocha B,Tanchot C.A role for CD40 expression on CD8(+) T cells in the generation of CD8(+) T cell memory[J].Science,2002,297(5589):2060-2063.
[10] Schluns KS,Lefranois L.Cytokine control of memory T-cell development and survival[J].Nat Rev Immunol,2003,3(4):269-279.
[11] Cui W,Joshi NS,Jiang AM,etal.Effects of signal 3 during CD8 T cell priming:Bystander production of IL-12 enhances effector T cell expansion but promotes terminal differentiation[J].Vaccine,2009,27(15):2177-2187.
[12] Wiesel M,Crouse J,Bedenikovic G,etal.Type-I IFN drives the differentiation of short-lived effector CD8(+) T cells in vivo[J].Europ J Immunol,2012,42(2):320-329.
[13] Obar JJ,Jellison ER,Sheridan BS,etal.Pathogen-induced inflammatory environment controls effector and memory CD8(+) T cell differentiation[J].J Immunol,2011,187(10):4967-4978.
[14] Andersen MH,Schrama D,Straten PT,etal.Cytotoxic T cells[J].J Invest Dermatol,2006,126(1):32-41.
[15] Duan S,Thomas PG.Balancing immune protection and immune pathology by CD8(+) T-cell responses to influenza infection[J].Frontiers Immunol,2016,7:25.
[16] Li CY,Jiao SZ,Wang GJ,etal.The immune adaptor ADAP regulates reciprocal TGF-beta 1-integrin crosstalk to protect from influenza virus infection[J].PLoS Pathog,2015,11(4):e1004824.
[17] Chang JT,Wherry EJ,Goldrath AW.Molecular regulation of effector and memory T cell differentiation[J].Nat Immunol,2014,15(12):1104-1115.
[18] Slifka MK,Whitton JL.Activated and memory CD8+T cells can be distinguished by their cytokine profiles and phenotypic markers[J].J Immunol,2000,164(1):208-216.
[19] Kaech SM,Cui W.Transcriptional control of effector and memory CD8+T cell differentiation[J].Nat Rev Immunol,2012,12(11):749-761.
[20] Nolz JC,Starbeck-Miller GR,Harty JT.Naive,effector and memory CD8 T-cell trafficking:parallels and distinctions[J].Immuno Therapy,2011,3(10):1223-1233.
[21] Schenkel JM,Masopust D.Tissue-resident memory T cells[J].Immunity,2014,41(6):886-897.
[22] Nolz JC,Harty JT.Protective capacity of memory CD8(+) T cells is dictated by antigen exposure history and nature of the infection[J].Immunity,2011,34(5):781-793.
[23] Wirth TC,Xue HH,Rai D,etal.Repetitive antigen stimulation induces stepwise transcriptome diversification but preserves a core signature of memory CD8(+) T cell differentiation[J].Immunity,2010,33(1):128-140.
[24] Wherry EJ,Kurachi M.Molecular and cellular insights into T cell exhaustion[J].Nat Rev Immunol,2015,15(8):486-499.
[25] Benci JL,Xu B,Qiu Y,etal.Tumor interferon signaling regulates a multigenic resistance program to immune checkpoint blockade[J].Cell,2016,167(6):1540-1554.e12.
[26] Reiser J,Banerjee A.Effector,memory,and dysfunctional CD8+T cell fates in the antitumor immune response[J].J Immunol Res,2016,2016:1-14.
[27] He R,Hou S,Liu C,etal.Follicular CXCR5-expressing CD8+T cells curtail chronic viral infection[J].Nature,2016,537(7620):412-428.
[28] Andreotti AH,Schwartzberg PL,Joseph RE,etal.T-cell signaling regulated by the Tec family kinase,Itk[J].Cold Spring Harbor Perspectives Biology,2010,2(7):a002287.
[29] Wiede F,Shields BJ,Chew SH,etal.T cell protein tyrosine phosphatase attenuates T cell signaling to maintain tolerance in mice[J].J Clin Invest,2011,121(12):4758-4774.
[30] Yang W,Bai YB,Xiong Y,etal.Potentiating the antitumour response of CD8(+) T cells by modulating cholesterol metabolism[J].Nature,2016,531(7596):651-655.
[31] Pennock ND,White JT,Cross EW,etal.T cell responses:naive to memory and everything in between[J].AJP Education,2013,37(4):273-283.
[32] Ahmadzadeh M,Johnson L,Heemskerk B,etal.Tumor antigen-specific CD8+T cells infiltrating the tumor express high levels of PD-1 and are functionally impaired[J].Blood,2009,114(8):1537-1544.
[33] Fourcade J,Sun ZJ,Pagliano O,etal.PD-1 and Tim-3 regulate the expansion of tumor antigen-specific CD8(+) T cells induced by melanoma vaccines[J].Cancer Res,2014,74(4):1045-1055.
[34] Quigley M,Martinez J,Huang X,etal.A critical role for direct TLR2-MyD88 signaling in CD8 T-cell clonal expansion and memory formation following vaccinia viral infection[J].Blood,2009,113(10):2256-2264.
[35] Lazarevic V,Glimcher LH,Lord GM.T-bet:a bridge between innate and adaptive immunity[J].Nat Rev Immunol,2013,13(11):777-789.
[36] Zhou XY,Yu SY,Zhao DM,etal.Differentiation and persistence of memory CD8(+) T cells depend on T cell factor 1[J].Immunity,2010,33(2):229-240.
[37] Glimcher LH,Townsend MJ,Sullivan BM,etal.Recent developments in the transcriptional regulation of cytolytic effector cells[J].Nat Rev Immunol,2004,4(11):900-911.
[38] Intlekofer AM,Banerjee A,Takemoto N,etal.Anomalous type 17 response to viral infection by CD8+T cells lacking T-bet and eomesodermin[J].Science,2008,321(5887):408-411.
[39] Joshi NS,Cui W,Chandele A,etal.Inflammation directs memory precursor and short-lived effector CD8+T cell fates via the graded expression of T-bet transcription factor[J].Immunity,2007,27(2):281-295.
[40] Banerjee A,Gordon SM,Intlekofer AM,etal.Cutting edge:the transcription factor eomesodermin enables CD8(+) T cells to compete for the memory cell niche[J].J Immunol,2010,185(9):4988-4992.
[41] Rutishauser RL,Martins GA,Kalachikov S,etal.Transcriptional repressor blimp-1 promotes CD8(+) T cell terminal differentiation and represses the acquisition of central memory T cell properties[J].Immunity,2009,31(2):296-308.
[42] Kallies A,Xin A,Belz GT,etal.Blimp-1 transcription factor is required for the differentiation of effector CD8(+) T cells and memory responses[J].Immunity,2009,31(2):283-295.
[43] Yang CY,Best JA,Knell J,etal.The transcriptional regulators Id2 and Id3 control the formation of distinct memory CD8(+) T cell subsets[J].Nat Immunol,2011,12(12):1221-1229.
[44] Kaech SM,Cui W.Transcriptional control of effector and memory CD8+T cell differentiation[J].Nat Rev Immunol,2012,12(11):749-761.
[45] Cui WG,Liu Y,Weinstein JS,etal.An Interleukin-21-interleukin-10-STAT3 pathway is critical for functional maturation of memory CD8(+) T cells[J].Immunity,2011,35(5):792-805.
[46] Xiao ZG,Casey KA,Jameson SC,etal.Programming for CD8 T cell memory development requires IL-12 or type I IFN[J].J Immunol,2009,182(5):2786-2794.
[47] Lin JX,Li P,Liu DL,etal.Critical role of STAT5 transcription factor tetramerization for cytokine responses and normal immune function[J].Immunity,2012,36(4):586-599.
[48] Xin A,Masson F,Liao Y,etal.A molecular threshold for effector CD8+T cell differentiation controlled by transcription factors Blimp-1 and T-bet[J].Nat Immunol,2016,17(4):422-432.
[49] Chang JT,Wherry EJ,Goldrath AW.Molecular regulation of effector and memory T cell differentiation[J].Nat Immunol,2014,15(12):1104-1115.
[50] Xiao G,Deng AQ,Liu HF,etal.Activator protein 1 suppresses antitumor T-cell function via the induction of programmed death 1[J].Natl Acad Sci U S A,2012,109(38):15419-15424.
[51] Li CY,Li WY,Xiao J,etal.ADAP and SKAP55 deficiency suppresses PD-1 expression in CD8(+) cytotoxic T lymphocytes for enhanced anti-tumor immunotherapy[J].Embo Mol Med,2015,7(6):754-769.
[52] Taylor A,Harker JA,Chanthong K,etal.Glycogen synthase kinase 3 inactivation drives T-bet-mediated downregulation of Co-receptor PD-1 to enhance CD8(+) cytolytic T cell responses[J].Immunity,2016,44(2):274-286.
[53] Best JA,Blair DA,Knell J,etal.Transcriptional insights into the CD8+T cell response to infection and memory T cell formation[J].Nat Immunol,2013,14(4):404-412.
[54] Finlay D,Cantrell DA.Metabolism,migration and memory in cytotoxic T cells[J].Nat Rev Immunol,2011,11(2):109-117.
[55] Phan AT,Doedens AL,Palazon A,etal.Constitutive glycolytic metabolism supports CD8(+) T cell effector memory differentiation during viral infection[J].Immunity,2016,45(5):1024-1037.
[56] Geiger R,Rieckmann JC,Wolf T,etal.L-Arginine modulates t cell metabolism and enhances survival and anti-tumor activity[J].Cell,2016,167(3):829-842.
[57] Rao RR,Li QS,Odunsi K,etal.The mTOR kinase determines effector versus memory CD8(+) T cell fate by regulating the expression of transcription factors T-bet and eomesodermin[J].Immunity,2010,32(1):67-78.
[58] Kim EH,Suresh M.Role of PI3K/Akt signaling in memory CD8 T cell differentiation[J].Front Immunol,2013,4:20.
[59] Kerdiles YM,Stone EL,Beisner DL,etal.Foxo transcription factors control regulatory T cell development and function[J].Immunity,2010,33(6):890-904.
[60] Hadrup S,Donia M,thor Straten P.Effector CD4 and CD8 T cells and their role in the tumor microenvironment[J].Cancer Micro-Environ,2013,6(2):123-133.
[61] Kennedy BC,Shimato S,Anderson RCE,etal.Defining the mechanisms of CD8 T-cell tumor tolerance[J].Immuno Therapy,2011,3(1):23-26.
[62] Speiser DE,Ho PC,Verdeil G.Regulatory circuits of T cell function in cancer[J].Nat Rev Immunol,2016,16(10):599-611.
[63] Mahmoud SMA,Paish EC,Powe DG,etal.Tumor-infiltrating CD8(+) lymphocytes predict clinical outcome in breast cancer[J].J Clin Oncol,2011,29(15):1949-1955.
[64] Kilinc MO,Gu T,Harden JL,etal.Central role of tumor-associated CD8+T effector/memory cells in restoring systemic antitumor immunity[J].J Immunol,2009,182(7):4217-4225.
[65] Pardoll D.T cells take aim at cancer[J].Proceed National Acad Sci,2002,99(25):15840-15842.
[66] Ramos CA,Heslop HE,Brenner MK.CAR-T cell therapy for lymphoma[J].Annual Rev Med,2016,67(1):165-183.
[67] Sharma P,Allison JP.The future of immune checkpoint therapy[J].Science,2015,348(6230):56-61.
[68] Gao J,Shi Lewis Z,Zhao H,etal.Loss of IFN-γ pathway genes in tumor cells as a mechanism of resistance to Anti-CTLA-4 therapy[J].Cell,2016,167(2):397-404.e9.
[69] Zou W,Wolchok JD,Chen L.PD-L1 (B7-H1) and PD-1 pathway blockade for cancer therapy:Mechanisms,response biomarkers,and combinations[J].Sci Transl Med,2016,8(328):328rv4.
[70] Thomas PG,Keating R,Hulse-Post DJ,etal.Cell-mediated protection in influenza infection[J].Emerg Infect Dis,2006,12(1):48-54.
[71] Schotsaert M,Ibaez LI,Fiers W,etal.Controlling influenza by cytotoxic T-cells:calling for help from destroyers[J].J Biomed Biotechnol,2010,2010:1-13.
[72] Olson MR,Russ BE,Doherty PC,etal.Influenza A virus-specific CD8(+) T-cell responses:from induction to function[J].Future Virol,2010,5(2):175-183.
[73] Hemann EA,Kang SM,Legge KL.Protective CD8 T cell-mediated immunity against influenza A virus infection following influenza virus-like particle vaccination[J].J Immunol,2013,191(5):2486-2494.
[74] Duan S,Thomas PG.Balancing immune protection and immune pathology by CD8+T-cell responses to influenza infection[J].Front Immunol,2016,7:25.
[收稿2017-01-09]
(编辑 许四平)
Molecular mechanism of CD8+T cell activation and differentiation
LIUChang,WANGHong-Yan.
InstituteofBiochemistryandCellBiology,KeyLaboratoryofSystemsBiology,InnovationCenterforCellSignalingNetwork,Shanghai200000,China
CD8+T cells play an essential role in defending against viruses,intracellular bacteria,protozoal infections and clearance of tumors since almost all the nucleated cells express MHCⅠ molecule.Following antigen recognition,CD8+T cells are activated and differentiated to different subsets of effector or memory cells,which could clear the pathogen and form long-term protection.Phenotypic markers,functional properties and anatomical locations are different among these CD8+T cell subsets.They also show variation in surviving time,proliferation and effector functions when re-challenged with the pathogen or tumor.Multiple signaling pathways and transcriptional factors are involved in CD8+T cells activation and differentiation,and will be discussed in this review.We will also briefly summary the clinical applications of T cells against tumor or pathogens.
Cytotoxic T cell/CTL;Activation;Differentiation;Memory T cell;Effector T cell
10.3969/j.issn.1000-484X.2017.04.001
R392.12
A
1000-484X(2017)04-0481-07
