TRPC6在IL-1β诱导类风湿关节炎成纤维细胞样滑膜细胞增殖中的作用*
2017-04-24刘贵旺徐大为张玮琼许锦煌郑沛中李建华黄建荣
刘贵旺, 徐大为, 张玮琼, 许锦煌, 郑沛中, 叶 培, 李建华, 黄建荣△
(1中山大学孙逸仙纪念医院骨科, 广东 广州 510235; 2广州医科大学生理教研室, 广东 广州 511436; 3广州市增城区人民医院骨科, 广东 广州 511300; 4佛山市南海区人民医院骨科, 广东 佛山 528200)
TRPC6在IL-1β诱导类风湿关节炎成纤维细胞样滑膜细胞增殖中的作用*
刘贵旺1, 徐大为1, 张玮琼3, 许锦煌3, 郑沛中3, 叶 培4, 李建华2△, 黄建荣1△
(1中山大学孙逸仙纪念医院骨科, 广东 广州 510235;2广州医科大学生理教研室, 广东 广州 511436;3广州市增城区人民医院骨科, 广东 广州 511300;4佛山市南海区人民医院骨科, 广东 佛山 528200)
目的: 应用RNA干扰技术研究瞬时受体电位通道6(TRPC6)对IL-1β诱导的类风湿关节炎(RA)成纤维细胞样滑膜细胞(RA-FLS)增殖的影响。方法: RT-qPCR法检测RA和骨关节炎(OA)患者滑膜组织中TRPC6 mRNA的表达水平。组织块联合酶消化法培养RA-FLS。流式细胞术鉴定RA-FLS。将不同浓度(0、0.25、0.5、1、2、4、8、16 μg/L)的重组人 IL-1β与 RA-FLS共培养36 h,CCK-8法检测细胞活力的改变;16 μg/L的IL-1β作用RA-FLS不同时间(12、24、36、48、60、72 h),CCK-8法检测细胞活力的改变。特异性TRPC6-siRNA转染RA-FLS后,采用RT-qPCR和Western blotting 检测沉默效率。在IL-1β存在和不存在的条件下,CCK-8法、EdU标记法和流式细胞术检测TRPC6干扰组与对照组的细胞活力、EdU阳性细胞比率和(G2/M+S)期比率的差异。结果: RA患者滑膜组织中TRPC6的mRNA表达水平相对于OA患者明显增加(P<0.05)。TRPC6-siRNA能显著降低RA-FLS中TRPC6 mRNA和蛋白的表达(P<0.05)。IL-1β能诱导RA-FLS增殖(P<0.05)。沉默TRPC6后,在IL-1β的诱导环境下,特异性干扰组RA-FLS 的活力、EdU阳性细胞比率和(G2/M+S)期比率与空白组和对照组相比均明显降低(P<0.05),而在不含IL-1β的条件下,干扰组与空白组和对照组相比差异均无统计学显著性。结论: TRPC6参与IL-1β诱导的RA-FLS增殖过程,沉默TRPC6能降低IL-1β诱导的RA-FLS增殖水平。
瞬时受体电位通道6; 类风湿关节炎; 滑膜细胞; 细胞增殖
类风湿性关节炎(rheumatoid arthritis,RA)是一种以慢性多关节滑膜炎、骨及软骨破坏为主要特征的全身性自身免疫性疾病[1]。比较公认的基本病理机制为滑膜细胞的激活,分泌大量炎症因子、趋化因子,导致炎症细胞激活并募集于滑膜衬下间质。而炎症细胞所分泌的炎症因子又能反馈促进滑膜细胞的激活。如此级联反应,使得滑膜细胞快速活化,爆发增殖,形成血管翳,侵入并破坏毗邻软骨及骨骼。因此研究成纤维样滑膜细胞的增殖作用及机制十分必要。
钙离子(Ca2+)是细胞信号转导过程中重要的第二信使,参与细胞内信息传递并调控递质释放、细胞增殖、基因转录和细胞死亡等一系列生命过程[2]。瞬时受体电位通道6(transient receptor potential channel 6, TRPC6)作为参与调控细胞内钙离子浓度媒介。TRPC6基因突变或过表达能引起胞内钙离子信号通路异常,影响细胞内钙浓度,进而使细胞的多种病理生理过程发生变化[3]。一项关于RA的全基因组关联分析(genome- wide association study,GWAS)发现RA病人中TRPC6基因存在突变,并且与RA疾病进展具有相关性[4]。IL-1β是一种重要的促炎因子,参与多种慢性炎症性疾病的病理过程。它能加重RA患者滑膜炎症的进展,并在RA病理机制中发挥重要作用。有文献报道,IL-1β能促进类风湿关节炎成纤维细胞样滑膜细胞(rheumatoid arthritis fibroblast-like synoviocytes,RA-FLS)的DNA合成,加快其增殖[5]。结合本课题组前期的实验结果显示TRPC6在RA-FLS中的表达量较骨性关节炎(osteoarthritis,OA)成纤维细胞样滑膜细胞中的表达量增加。是否TRPC6在RA-FLS增殖行为中起重要作用呢?本文拟通过RNAi技术,在IL-1β诱导下对该问题进行了初步探讨,以期阐明TRPC6 在IL-1β诱导RA-FLS增殖中的作用。
材 料 和 方 法
1 主要试剂及仪器
DMEM 高糖培养基、胎牛血清(fetal bovine serum,FBS)、DPBS磷酸盐缓冲液、含EDTA的0.25%胰酶溶液和Opti-MEM培养基购自于Gibco;抗CD90-PE和CD68-APC抗体购自于BD;IL-1β购自于Peprotech;Lipofectamine RNAiMAX 购自于Invitrogen;CCK-8试剂盒购于Dojindo;Cell-Light EdU Apollo 567 DNA试剂盒购于广州锐博。碘化丙啶、RNA酶和II型胶原酶购于Sigma。TRPC6兔抗多克隆抗体购于Alomone;GAPDH鼠抗单克隆抗体和辣根过氧化物酶标记的山羊抗兔及山羊抗小鼠Ⅱ抗购于Bioworld;PrimeScriptTMRT Master Mix (Perfect Real Time) 试剂盒和SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒购于TaKaRa。其它化合物均为分析级,购于广州化学试剂厂。所用引物由Invitrogen根据设计合成,见表1。所用siRNA由苏州吉玛公司根据设计合成,见表2。
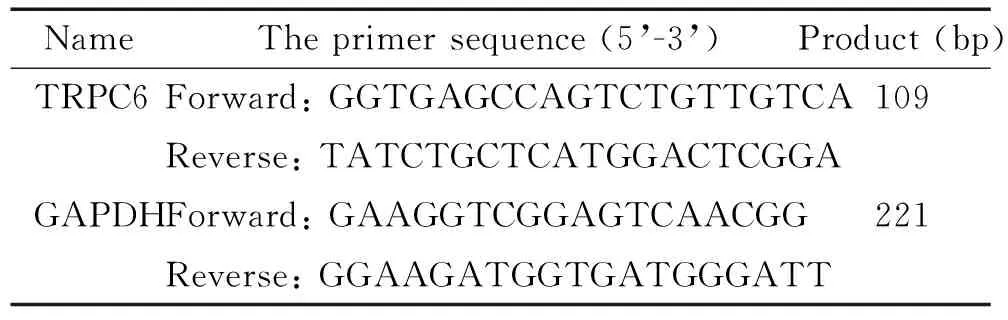
表1 引物序列

表2 siRNA序列
多功能酶标仪、StepOnePlusTM实时荧光定量PCR仪和EVOS FL荧光显微镜(Thermo Fisher); 化学发光成像仪(Bio-Rad);流式细胞仪(BD FACS Calibur)。
2 主要方法
2.1 RT-qPCR检测RA和OA滑膜组织TRPC6 mRNA表达水平 滑膜组织来自中山大学孙逸仙纪念医院行膝关节置换术或关节镜下滑膜清理术的RA和OA患者。该项目通过了中山大学孙逸仙纪念医院伦理委员会审查。所有RA及OA患者的诊断分别符合美国风湿病学会类风湿关节炎和骨性关节炎诊断标准。TRIzol法提取2组滑膜组织总RNA,按照PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒说明书合成cDNA。然后按照SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒说明书,在Thermo Fisher的StepOnePlusTM实时定量PCR仪上进行PCR扩增反应。以GAPDH为内参照,2-ΔΔCt法计算RA组与OA组滑膜组织TRPC6 mRNA的相对表达量。
2.2 原代细胞培养与鉴定 取出滑膜组织后,充分剪碎,加入2 g/L的II型胶原酶溶液,于37 ℃培养箱中消化4 h,滤过未消化组织,离心2 000 r/min、5 min,PBS重悬后离心2 000 r/min、5 min,重复2次;加入适量含15% FBS的完全培养基,培养箱中培养4 d后,换液除去未贴壁细胞,随后每2~3 d换液。原代培养第3代后通过2种方法进行细胞鉴定:光学相差显微镜下观察细胞形态以及通过流式细胞术检测培养细胞的CD68和CD90抗原阳性率。
2.3 siRNA沉默RA-FLS细胞TRPC6基因 取经过鉴定的第3~6代RA-FLS用于实验,将RA-FLS以1×107cells/L的密度接种于6 孔板,每孔加入2 mL 含15% FBS完全培养基,当细胞融合度达到60%~80%时,采用Lipofectamine RNAiMAX介导TRPC6-siRNA转染细胞。设置RA-FLS TRPC6-siRNA转染组(TRPC6-siRNA组)、RA-FLS阴性对照(negative control, NC)siRNA转染组(NC-siRNA组)和RA-FLS对照组(control组)。在转染8 h后,先用DPBS洗涤细胞3 次,洗脱残留在培养基及细胞表面的携带FAM基团的siRNA,以降低荧光背景。荧光显微镜观察,初步估计转染效率。
2.4 RT-qPCR检测TRPC6的mRNA表达 TRIzol法提取各组细胞总RNA,按照PrimeScriptTMRT Master Mix(Perfect Real Time)试剂盒说明书合成cDNA。然后按照SYBR® Premix Ex TaqTMⅡ(Tli RNaseH Plus)试剂盒说明书,在Thermo Fisher的StepOnePlusTM实时定量PCR仪上进行PCR扩增反应。以GAPDH为内参照,2-ΔΔCt法计算TRPC6-siRNA组与两对照组TRPC6的mRNA相对表达量。
2.5 Western blotting 检测TRPC6蛋白的表达 转染72 h后收集各组细胞、提取总蛋白,采用BCA 法蛋白定量后,各组取80 μg蛋白上样。经SDS-PAGE分离后转膜,BSA封闭液室温孵育2 h,孵育后TBST洗膜,然后将膜分别放入抗TRPC6和GAPDH的 I 抗稀释缓冲液中,4 ℃平缓摇动过夜。再次TBST洗膜3次,每次5 min;放入牛奶稀释过的辣根过氧化物酶标记的 II 抗,室温摇床孵育1 h; TBST洗膜3次,每次5 min,最后于化学发光成像仪曝光,用ImageJ软件进行分析,比较各组蛋白的相对表达量。
2.6 CCK-8法检测细胞活力 (1)将RA-FLS接种于96孔板中,细胞密度为1×107cells/L。当细胞生长融合至60%时,给予不同浓度(0、0.25、0.5、1、2、4、8、16 μg/L) IL-1β处理36 h或一定浓度IL-1β处理不同时间(12、24、36、48、60、72 h),在处理结束后,弃去板内的培养基,用DPBS清洗1 次后,每孔加入1∶10稀释过的CCK-8溶液100 μL,37 ℃孵育3 h,酶标仪读取各孔在450 nm 波长处的吸光度(A)值,取其平均值。(2)将TRPC6-siRNA 组、NC-siRNA 组和control组的RA-FLS分别接种于96孔板中,又分别将其分为IL-β处理和不处理亚组。60 h后,弃去板内的培养基,用DPBS清洗1 次后,每孔加入1∶10稀释过的CCK-8溶液100 μL,37 ℃孵育3 h,酶标仪读取各孔在450 nm 波长处的吸光度(A)值,取其平均值。
2.7 EdU标记法检测细胞DNA合成 将TRPC6-siRNA 组、NC-siRNA 组和control组的RA-FLS分别接种于96孔板中,又分别将其分为IL-1β处理和不处理亚组。36 h处理或不处理后,按照Cell-Light EdU Apollo 567 DNA试剂盒说明书进行操作。于荧光显微镜拍摄获得图片。EdU阳性细胞率通过10个随机视野下计数获得。
2.8 流式细胞术检测细胞周期的变化 将TRPC6-siRNA 组、NC-siRNA 组和control组的RA-FLS分别接种于25 cm2培养瓶中,又将其分为IL-1β处理和不处理亚组。60 h后,胰酶消化,离心去除培养基。用DPBS重悬后,1 000 r/min 离心5 min,取不少于3×105~5×105个细胞,用0.2 mL DPBS重悬,然后用70%冰乙醇2 mL固定细胞,混匀后,封口4 ℃过夜。取固定过夜的细胞,1 000 r/min 离心5 min ,弃固定液,2 mL DPBS重悬细胞,1 000 r/min离心5 min ,再次弃上清。细胞沉淀加50 μL RNA酶和450 μL碘化丙啶,避光孵育30 min后,行流式细胞仪检测。检测结果使用相关分析软件分析。细胞增殖活性用增殖指数(proliferation index,PI)进行量化,PI 值越大,细胞处于增殖期的越多,增殖越明显。PI=100%×(G2/M+S)期细胞数/(G2/M+S+G0+G1)期细胞数。
4 统计学处理
采用SPSS 22.0 统计软件进行统计学分析, 数据以均数±标准误(mean±SEM)表示。 两组间比较采用独立样本资料t检验。双因素多组间资料用双因素方差分析, 多重比较用Bonferroni法检验。单因素多组间资料用单因素方差分析,多重比较用Bonferroni法检验。以P<0.05为差异有统计学意义。
结 果
1 RA和OA患者滑膜组织中TRPC6 mRNA表达水平
RT-qPCR结果显示,RA患者滑膜组织中TRPC6的mRNA表达水平相对于OA患者明显增加(P<0.05),见图1。
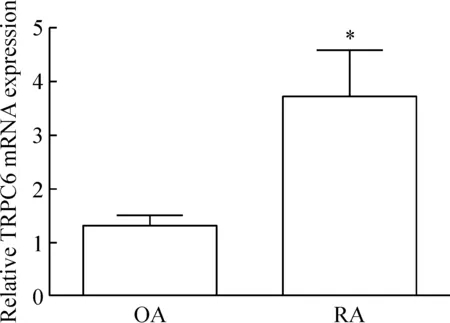
Figure 1.Expression of TRPC6 mRNA in synovial tissues from OA patients and RA patients. Mean±SEM.n=4.*P<0.05vsOA group.
图1 RA和OA患者滑膜组织中TRPC6 mRNA表达水平
2 RA-FLS的培养及鉴定
用组织块联合酶消化法培养细胞,培养第4天即可见少量细胞,第10天可见细胞融合。胰酶消化进行传代。光学显微镜下原代细胞呈细长纺锤形,与成纤维细胞形态相符,见图2A。流式细胞术检测第3代细胞表面CD90和CD68阳性表达率,分别为93.55%和0.53%,提示大多数细胞为RA-FLS,见图2B。
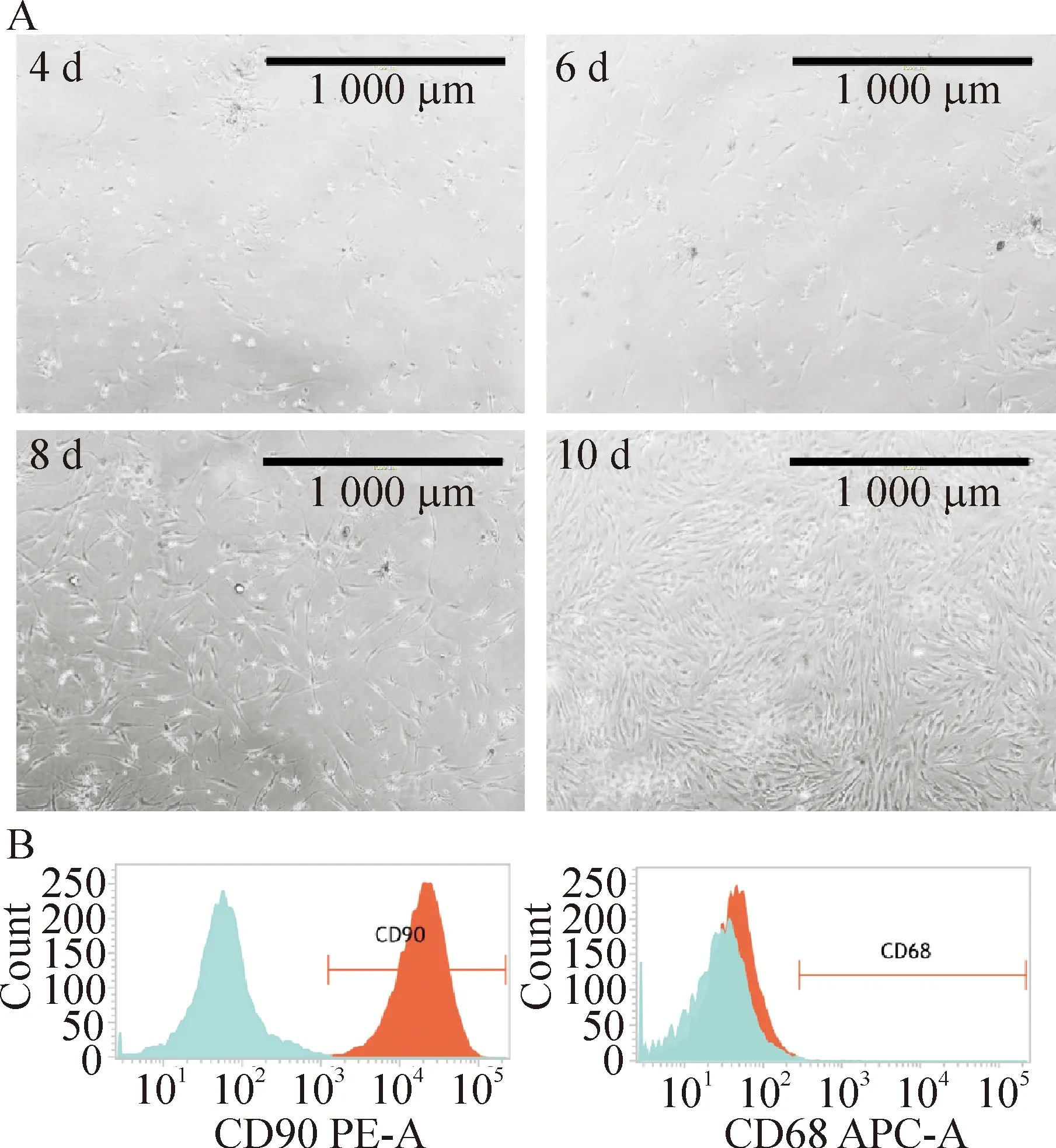
Figure 2.Identification of primarily cultured RA-FLS. A: RA-FLS under light microscope at 4 d, 6 d, 8 d and 10 d; B: the expression of CD90 and CD68 in the RA-FLS at passage 3 detected by flow cytometry.
图2 RA-FLS的培养与鉴定
3 IL-1β诱导RA-FLS增殖
不同浓度IL-1β作用36 h 后,8 μg/L 和16 μg/L组RA-FLS的A值与对照组相比显著升高(P<0.05),见图3A; 16 μg/L IL-1β作用不同时间后,36~72 h组RA-FLS的A值与相应对照组相比均显著升高(P<0.05),见图3B。

Figure 3.The viability of RA-FLS induced by IL-1β. A: the cells were treated with 0.25~16 μg/L IL-1β for 36 h; B: the cells were treated with 16 μg/L IL-1β for 12 h~72 h. The cell viability was measured by CCK-8 assay. Mean±SEM.n=4.*P<0.05,**P<0.01vscontrol group.
图3 IL-1β诱导RA-FLS细胞活力增强
4 转染TRPC6-siRNA对RA-FLS 中 TRPC6 mRNA和蛋白表达的影响
RT-qPCR结果显示,TRPC6-siRNA转染RA-FLS后,TRPC6的mRNA表达相对于空白对照组及阴性对照组均明显降低(P<0.05),而空白对照组与阴性对照组相比mRNA的表达无明显差异,见图4A。Western blotting检测结果显示TRPC6-siRNA转染组的TRPC6 蛋白表达相对于空白对照组及阴性对照组明显降低(P<0.05),而空白对照组与阴性对照组相比蛋白表达未见明显差异,见图4B。

Figure 4.The interference efficiency of TRPC6-siRNA. A: the mRNA expression of TRPC6 at 24 h after transfection detected by RT-qPCR; B: the protein expression of TRPC6 at 72 h after transfection detected by Western blotting. Mean±SEM.n=4.*P<0.05vscontrol;#P<0.05vsNC-siRNA.
图4 RA-FLS中TRPC6-siRNA沉默效率
5 沉默TRPC6对IL-1β诱导的RA-FLS增殖作用的影响
TRPC6-siRNA转染RA-FLS后,在IL-1β诱导和不诱导的条件下,采用 CCK-8法检测细胞活力,结果发现在IL-1β诱导的环境下,TRPC6-siRNA干扰组与空白对照组和阴性对照组相比细胞活力水平明显降低(P<0.05);而在IL-1β不进行诱导的条件下,TRPC6-siRNA干扰组与空白对照组和阴性对照组相比活力水平差异不显著,见图5。EdU实验结果表明,沉默TRPC6后,在IL-1β诱导的环境下,TRPC6-siRNA干扰组与空白对照组和阴性对照组相比DNA合成水平明显降低(P<0.05);而在IL-1β不进行诱导的条件下,TRPC6-siRNA干扰组与空白对照组和阴性对照组相比DNA合成水平差异不显著,见图6。
6 沉默TRPC6对IL-1β诱导的RA-FLS细胞周期的影响
应用流式细胞术分析沉默TRPC6对IL-1β诱导的RA-FLS细胞周期的变化。结果显示在IL-1β诱导的环境下,TRPC6-siRNA干扰组与空白对照组和阴性对照组相比S期和G2/M期的细胞比例减少,G0/G1期增加(P<0.05);而在IL-1β不进行诱导的条件下,TRPC6-siRNA干扰组与空白对照组和阴性对照组相比S期和G2/M期以及G0/G1期的细胞比例变化不明显,见图7。
讨 论
RA是一种以慢性多关节滑膜炎、骨及软骨破坏为主要特征的全身性自身免疫性疾病,可发生于任何年龄,持续性反复发作,致残率极高。在欧美发达国家中,RA的患病率约为0.5%~1.0%[1]。我国的流行病学调查显示RA的患病率为0.41%,男女比约为1∶6[6]。RA的主要病理特征为滑膜衬里细胞增生,间质内炎性细胞大量浸润,微血管增生,血管翳形成,软骨和骨组织破坏,关节功能障碍。然而,RA的发病机制依然不全明了。比较公认的基本病理机制为滑膜细胞的激活,然后炎症细胞激活并募集于滑膜组织,形成血管翳,侵入并破坏毗邻软骨及骨骼[1]。特别是RA-FLS功能异常在RA患者关节炎症和组织破坏过程中发挥关键作用。因此,研究RA-FLS的生物学功能,探寻RA发病机制中新的干预靶点,成为RA相关研究的热点。
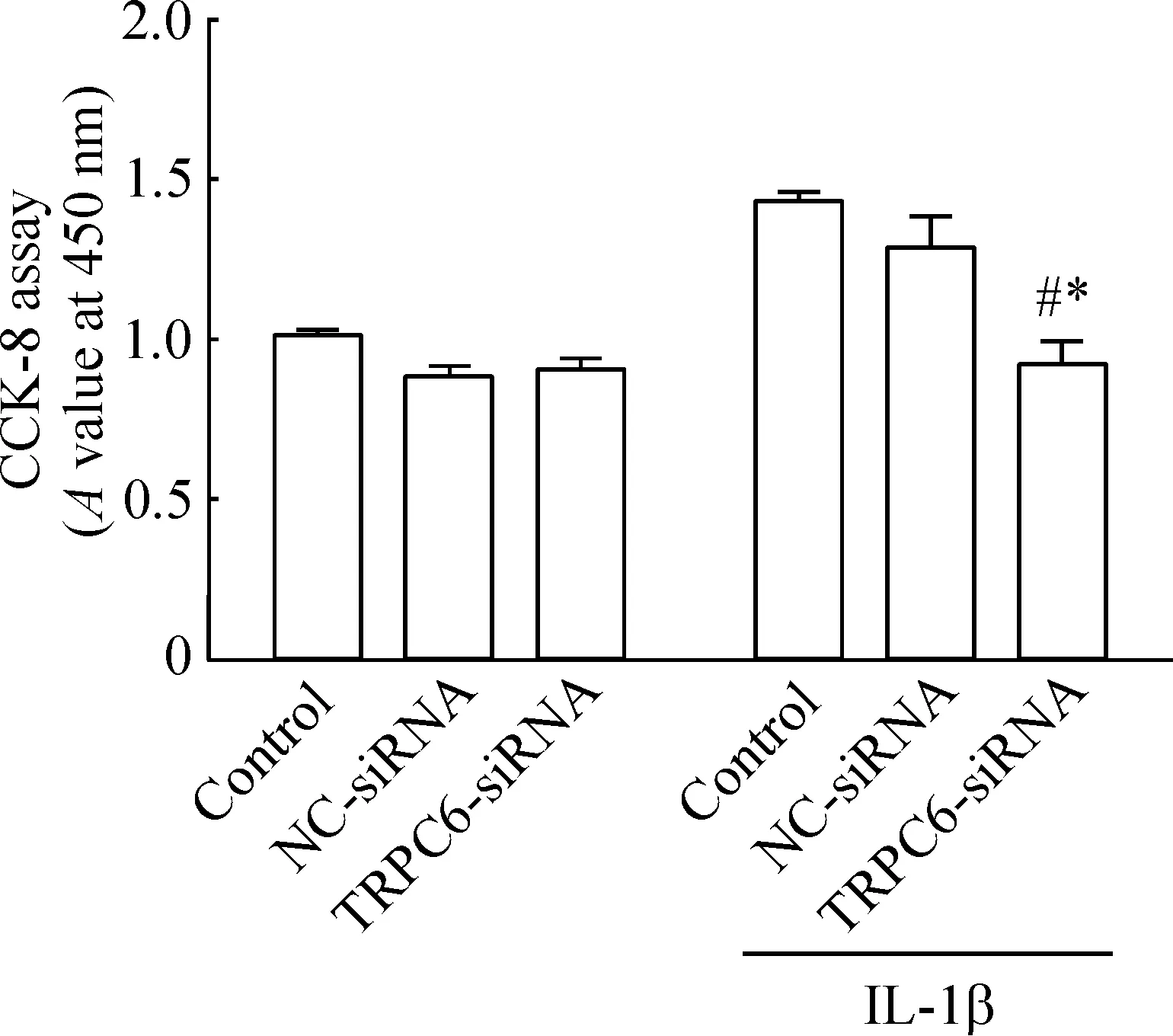
Figure 5.CCK-8 assay for determining the effect ofTRPC6 silencing on the viability of RA-FLS induced by IL-1β. Mean±SEM.n=4.*P<0.05vscontrol;#P<0.05vsNC-siRNA.
图5 沉默TRPC6对IL-1β诱导的RA-FLS细胞活力的影响
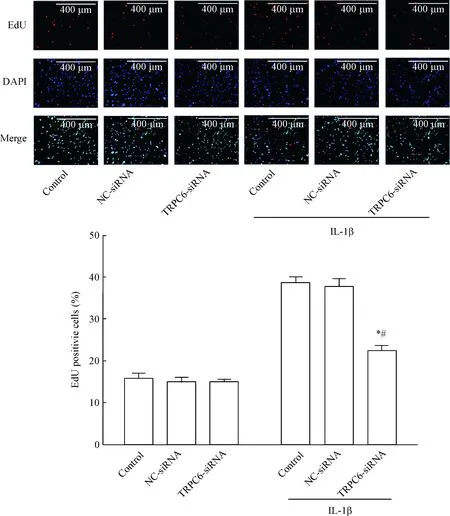
Figure 6.EdU assay for determining the effect ofTRPC6 silencing on the proliferation of RA-FLS induced by IL-1β. Mean±SEM.n=4.*P<0.05vscontrol;#P<0.05vsNC-siRNA.
图6 沉默TRPC6对IL-1β诱导的RA-FLS细胞增殖的影响
Ca2+是细胞信号转导过程中重要的第二信使,在细胞内传递信息并调控递质释放、细胞增殖、基因转录和细胞死亡等一系列生命过程。Berridge等[7]发现Ca2+信号在细胞增殖中起到重要作用。钙依赖和钙调素途径均可以影响相关细胞细胞周期的转变[8]。越来越多实验证明,激活Ca2+信号通路能影响肿瘤细胞的增殖[9]。那么,RA-FLS作为一种类肿瘤细胞,是否Ca2+信号在其增殖中也起到重要作用呢?
TRPC通道是TRP通道的一个非选择性阳离子通道亚家族[10]。它包括7个成员,TRPC1~TRPC7,主要参与细胞Ca2+转运[11]。有研究表明,TRPC通道在气道平滑肌细胞[12]和几种肿瘤细胞[13-14]的增殖能力中起作用。而TRPC6作为TRPC通道一员,也参与体内许多重要的生理和病理调节过程。TRPC6基因突变或过表达所引起的胞内钙离子信号通路异常,会通过改变细胞内Ca2+浓度而影响细胞的多种病理生理过程。那么,TRPC6是否在RA-FLS的增殖作用中起重要作用呢?
炎性滑膜炎导致的关节破坏是RA的典型病理过程。IL-1β可通过诱导RA-FLS增殖参与该过程[15]。此外,IL-1β也是RA炎性微环境的主要成分。因此,本实验利用IL-1β为增殖诱导物,发现沉默TRPC6能减缓IL-1β诱导的RA-FLS增殖,并且减少细胞向G2/M期转变。
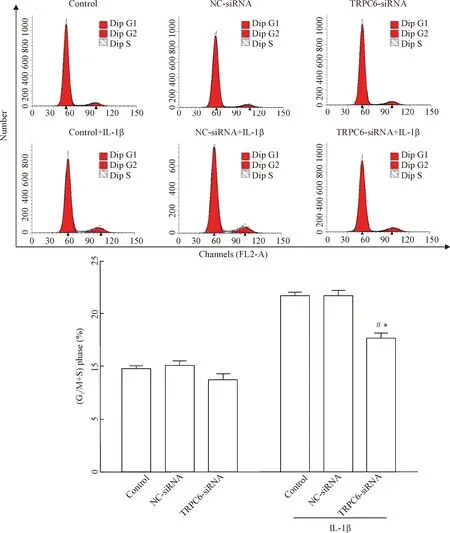
Figure 7.Flow cytometry for analyzing the effect ofTRPC6 silencing on the cell cycle of RA-FLS stimulated with IL-1β. Mean±SEM.n=4.*P<0.05vscontrol;#P<0.05vsNC-siRNA.
图7 沉默TRPC6对IL-1β诱导的RA-FLS细胞周期的影响
众所周知,细胞增殖需要Ca2+的参与,因此我们推测,TRPC6可能通过调控Ca2+参与RA-FLS的增殖作用。本实验由于缺少TRPC6调控Ca2+的直接证据,所以不能完全证明上述观点。因此下一步实验,我们将通过实时钙测定和膜片钳技术证明TRPC6调控RA-FLS的胞内Ca2+浓度。此外,本实验也缺少过表达TRPC6的反向实验。最后,TRPC6是否有联合TRPC通道亚家族的其它成员,共同参与RA-FLS的增殖作用调控,也有待进一步研究。
总之,结合本实验结果及相关文献,TRPC6可能是通过调控胞内Ca2+浓度,控制细胞向G2/M期转变,从而影响RA-FLS的增殖。因此,TRPC6可能在RA的疾病发生发展中发挥重要作用。进一步探讨TRPC6在RA中的作用及机制,有助于为以TRPC6为靶点的RA临床干预提供初步的理论依据。
[1] Scott DL, Wolfe F, Huizinga TW. Rheumatoid arthritis[J]. Lancet, 2010, 376(9746):1094-1108.
[2] 李光伟, 邢文婧, 郝静辉, 等. 钙敏感受体在缺氧诱导的大鼠肺动脉平滑肌细胞增殖中的作用[J]. 中国病理生理杂志, 2010, 26(12):2433-2437.
[3] 成 莹, 曾 欣, 许继德, 等. TRPC6在PDGF诱导的大鼠气道平滑肌细胞增殖中的作用[J]. 中国病理生理杂志, 2013, 29(12):2229-2234.
[4] Chissoe S. Genes associated with rheumatoid arthritis: US20080108077[P]. 2008-05-08.
[5] Butler DM, Piccoli DS, Hart PH, et al. Stimulation of human synovial fibroblast DNA synthesis by recombinant human cytokines[J]. J Rheumatol, 1988, 15(10):1463-1470.
[6] Li R, Sun J, Ren LM, et al. Epidemiology of eight common rheumatic diseases in China: a large-scale cross-sectional survey in Beijing[J]. Rheumatology (Oxford), 2012, 51(4):721-729.
[7] Berridge MJ, Bootman MD, Roderick HL. Calcium signalling: dynamics, homeostasis and remodelling[J]. Nat Rev Mol Cell Biol, 2003, 4(7):517-529.
[8] Kahl CR, Means AR. Regulation of cell cycle progression by calcium/calmodulin-dependent pathways[J]. Endocr Rev, 2003, 24(6):719-736.
[9] Roderick HL, Cook SJ. Ca2+signalling checkpoints in cancer: remodelling Ca2+for cancer cell proliferation and survival[J]. Nat Rev Cancer, 2008, 8(5):361-375.
[10]Clapham DE, Runnels LW, Strubing C. The TRP ion channel family[J]. Nat Rev Neurosci, 2001, 2(6):387-396.
[11]Montell C. The TRP superfamily of cation channels[J]. Sci STKE,2005,2005(272):e3.
[12]Yu Y, Fantozzi I, Remillard CV, et al. Enhanced expression of transient receptor potential channels in idiopathic pulmonary arterial hypertension[J]. Proc Natl Acad Sci U S A, 2004, 101(38):13861-13866.
[13]El BC, Bidaux G, Enfissi A, et al. Capacitative calcium entry and transient receptor potential canonical 6 expression control human hepatoma cell proliferation[J]. Hepatology, 2008, 47(6):2068-2077.
[14]Thebault S, Flourakis M, Vanoverberghe K, et al. Differential role of transient receptor potential channels in Ca2+entry and proliferation of prostate cancer epithelial cells[J]. Cancer Res, 2006, 66(4):2038-2047.
[15]Gitter BD, Labus JM, Lees SL, et al. Characteristics of human synovial fibroblast activation by IL-1 beta and TNF alpha[J]. Immunology, 1989, 66(2):196-200.
(责任编辑: 林白霜, 罗 森)
Effect of TRPC6 on IL-1β-induced proliferation of rheumatoid arthritis fibroblast-like synoviocytes
LIU Gui-wang1, XU Da-wei1, ZHANG Wei-qiong3, XU Jin-huang3, ZHENG Pei-zhong3, YE Pei4, LI Jian-hua2, HUANG Jian-rong1
(1DepartmentofOrthopaedics,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510235,China;2DepartmentofPhysiology,GuangzhouMedicalUniversity,Guangzhou511436,China;3DepartmentofOrthopaedics,ZengchengDistrictPeople’sHospitalofGuangzhou,Guangzhou511300,China;4DepartmentofOrthopaedics,NanhaiDistrictPeople’sHospitalofFoshan,Foshan528200,China.E-mail:guke16@163.com;lijianh@hotmail.com)
AIM: To investigate the effects of transient receptor potential channel 6 (TRPC6) on the proliferation of rheumatoid arthritis fibroblast-like synoviocytes (RA-FLS) induced by IL-1β. METHODS: The mRNA expression of TRPC6 in synovial tissues from RA or OA patients was studied by RT-qPCR. RA-FLS were cultured by enzyme digestion and tissue adhesion methods. The method of flow cytometry was applied to identify the RA-FLS. RA-FLS were treated with different concentrations (0, 0.25, 0.5, 1, 2, 4, 8 and 16 μg/L) of IL-1β for 36 h. The cell viability was examined by CCK-8 assay. RA-FLS were incubated with IL-1β (16 μg/L) for different time (12, 24, 36, 48, 60 and 72 h), and the cell viability was measured by CCK-8 assay. The interference efficiency of TRPC6-siRNA was determined by RT-qPCR and Western blotting. After incubation in the presence or absence of IL-1β medium, the cell viability, the percentage of EdU-positive cells and the percentage of (G2/M+S) phase were measured by CCK-8 assay, EdU labeling assay and flow cytometry, respectively. RESULTS: The mRNA expression of TRPC6 was found in synovial tissue with higher levels in RA patients than that in OA patients. TRPC6-siRNA significantly decreased the mRNA and protein expression of TRPC6 (P<0.05). When RA-FLS were treated with IL-1β, the proliferation of RA-FLS was increased (P<0.05). The differences of the cell viability, the percentage of EdU-positive cells and the (G2/M+S) phase percentage between TRPC6-siRNA group and blank control group or NC-siRNA group were significant, in the presence of IL-1β (P<0.05). However, they were not significant in the absence of IL-1β. CONCLUSION: TRPC6 is involved in the proliferation of RA-FLS induced by IL-1β. Silencing ofTRPC6 gene inhibits the growth of RA-FLS induced by IL-1β.
Transient receptor potential channel 6; Rheumatoid arthritis; Synoviocytes; Cell proliferation
1000- 4718(2017)04- 0627- 08
2016- 11- 17
2017- 01- 20
国家自然科学基金资助项目(No. 81470205);广州市属高校科研计划(No. 2012C043)
R363.2; R593.22
A
10.3969/j.issn.1000- 4718.2017.04.009
△通讯作者 黄建荣 Tel: 020-82725271; E-mail: guke16@163.com; 李建华 Tel: 020-37103061; E-mail: lijianh@hotmail.com
