高糖通过下调PGC-1α激活NFAT并促进足细胞凋亡*
2017-04-24陈恩平杜丽根邬银伟叶翠媚罗权芳
陈恩平, 杜丽根, 邬银伟, 叶翠媚, 罗权芳
(深圳市龙岗区第二人民医院, 广东 深圳 518112)
高糖通过下调PGC-1α激活NFAT并促进足细胞凋亡*
陈恩平△, 杜丽根, 邬银伟, 叶翠媚, 罗权芳
(深圳市龙岗区第二人民医院, 广东 深圳 518112)
目的: 足细胞凋亡在慢性肾病的发病发展中起着重要的作用,但目前对足细胞凋亡机制的研究还远未明确。本文旨在探讨过氧化物酶体增殖物激活受体γ共激活因子1α(PGC-1α)下调对足细胞凋亡的影响及其机制。方法:建立高糖诱导足细胞凋亡的体外模型,运用实时荧光定量PCR、Western blot、流式细胞术等方法分析高糖和PGC-1α沉默对足细胞凋亡以及相关分子mRNA和蛋白表达的影响。结果:在足细胞凋亡的体外模型中,PGC-1α表达显著下调。用siRNA沉默足细胞中的PGC-1α后,足细胞凋亡明显增加。核内活化T细胞核因子(NFAT)蛋白的表达在足细胞凋亡的体外模型也中明显增加,即NFAT活化;正常足细胞中沉默PGC-1α后NFAT也明显活化;在正常培养足细胞中沉默PGC-1α的同时沉默NFAT后,足细胞凋亡明显减轻。结论:PGC-1α的表达下调导致足细胞凋亡;NFAT可能介导了PGC-1α下调引起的足细胞凋亡。
高糖; 足细胞; 细胞凋亡; 过氧化物酶体增殖物激活受体γ共激活因子1α; 活化T细胞核因子
足细胞是具有复杂细胞骨架的高度分化细胞,是肾小球滤过的最后一道屏障,对维持肾小球滤过屏障的完整和功能起着重要的作用;所以,足细胞的损伤和凋亡必然会影响到肾小球的功能[1]。目前研究普遍认为足细胞凋亡是导致足细胞丢失和蛋白尿的主要原因之一[1-3]。足细胞凋亡在许多慢性肾病(chronic kidney diseases,CKD)如糖尿病肾病(diabe-tic nephropathy,DN)[4-5]、局灶节段性肾小球硬化(focal segmental glomerular sclerosis,FSGS)[6]的发病发展中起着重要的作用,但目前研究对足细胞凋亡机制的阐述还远未明确。
近年来国内外研究表明过氧化物酶体增殖物激活受体γ共激活因子1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)的表达下调会引起细胞凋亡,包括脐带静脉内皮细胞[7]、心肌细胞[8]、腹膜间皮细胞[9]等。然而PGC-1α表达下调是否引起足细胞凋亡目前尚未见报道。因此,本研究中,为探讨引起足细胞凋亡的机制,我们建立了高糖(high glucose,HG)诱导足细胞凋亡的体外模型。我们在这模型中检测PGC-1α的表达及凋亡相关指标的变化,并且用siRNA沉默正常培养足细胞中的PGC-1α,以观察足细胞凋亡和凋亡相关指标的变化,从而探讨PGC-1α表达下调是否引起足细胞凋亡及其机制。
材 料 和 方 法
1 材料
第3代永生化小鼠足细胞购自北京协和医学院基础学院基础医学细胞中心。
实时荧光定量PCR(ABI);超声仪(Bioruptor);激光共聚焦显微镜(LSM 510 META);显微镜(OLYMPUS IX70);低温离心机(Hettich Zentrifugen Universal 32R);全自动图像分析系统(KONTRON IBAS 2.5);生化分析仪(Biosystem BTS-330);荧光扫描仪(Typhoon 9400);低温冰箱(Thermo);生物分析仪(Agilent 2100);siRNA试剂(广州锐博公司)。
2 方法
2.1 足细胞的培养及干预条件 永生化小鼠足细胞购自北京协和医学院基础学院基础医学细胞中心。细胞常规复苏后,先在Ⅰ型胶原包被的培养瓶中加入含10% 胎牛血清和(2~10)×105U/L干扰素γ(interferon-γ,IFN-γ)的RPMI-1640培养基中培养,在33 ℃、5% CO2培养箱环境下培养2~3 d后,按一定的细胞数可分为6~8皿至37 ℃、5% CO2培养箱,用不含IFN-γ、含5% 胎牛血清的DMEM培养基培养10~14 d分化成熟。细胞表达足细胞特异性蛋白synaptopodin。
足细胞在37 ℃、5% CO2培养箱中培养至第8天后对其进行分组干预[2]:正常对照(control,Con)组、甘露醇(mannitol,MA)渗透压对照组(MA组)和高糖干预组(HG组)。先给予无血清的RPMI-1640培养基饥饿24 h,然后分别给予MA(终浓度24.5 mmol/L)、HG(终浓度30 mmol/L)或者siRNA(终浓度50 nmol/L)干预48 h[2]。
2.2 siRNA的合成和干预 小鼠PGC-1αsiRNA、活化T细胞核因子(nuclear factor of activated T-cells,NFAT) siRNA及阴性对照的siRNA由广州锐博公司合成。以DEPC水溶解,配制成20 μmol/L的溶液分装保存于-20 ℃冰箱。严格按照广州锐博公司的试剂盒说明书进行足细胞siRNA转染48 h。足细胞分组如下:(1) Con组:不予处理;(2)siRNA对照组(siCon组):给予一段无序的RNA序列干预48 h,其在培养基中的终浓度为50 nmol/L;(3)PGC-1αsiRNA干预组(siPGC-1α组):给予PGC-1αsiRNA干预48 h,培养基中PGC-1αsiRNA终浓度为50 nmol/L;(4)NFATsiRNA干预组(siNFAT组):给予NFATsiRNA干预48 h,培养基中NFATsiRNA终浓度为50 nmol/L;(5)PGC-1αsiRNA和NFATsiRNA联合干预组(siPGC-1α+siNFAT组):同时给予针对PGC-1α和NFAT的siRNA联合干预48 h,培养基中针对PGC-1α和NFAT的siRNA终浓度均为50 nmol/L。
2.3 流式细胞术Annexin V-FITC/PI双染法检测足细胞的凋亡率 足细胞干预结束后,严格按照南京凯基公司的Annexin V-FITC/PI凋亡检测试剂盒说明进行实验。常规离心收集各组细胞,每份细胞标本总数达到5×105以上。用预冷PBS缓冲液洗涤2次后加入500 mL 1×binding buffer重悬细胞,加入5 μL FITC标记的Annexin V试剂混匀后,再加入5 μL PI,混匀后避光条件下室温孵育15 min。1 h内用流式细胞仪检测足细胞凋亡率。FL1通道检测FITC标记的绿色荧光信号,FL2通道检测PI标记的红色荧光信号。在双变量流式细胞仪的散点图上,左下象限(FITC-/PI-)代表正常细胞,右下象限(FITC+/PI-)代表凋亡早期的细胞,右上象限(FITC+/PI+)代表凋亡晚期的细胞或坏死的细胞。本实验统计的凋亡足细胞包括右下象限和右上象限的细胞。
2.4 实时荧光定量PCR实验 所有PCR引物由上海Invitrogen公司合成,具体序列如下:Bax的上游引物为5’-CTGGACCATAGGTCGGAGTG-3’,下游引物为 5’-AATTCGCCGGAGACACTCG-3’;Bcl-2的上游引物为5’-GTCGCTACCGTCGTGACTTC-3’,下游引物为5’-CAGACATGCACCTACCCAGC-3’;GAPDH的上游引物为 5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物为 5’-TGTAGACCATGTAGTTGAGGTCA-3’;PGC-1α的 上游引物为5’-TATGGAGTGACATAGAGTGTGCT-3’,下游引物为 5’-GTCGCTACACCACTTCAATCC-3’。用TRIzol提取足细胞的RNA。严格按照日本TaKaRa逆转录和实时荧光定量PCR试剂盒(SYBR荧光)说明书进行mRNA逆转录和定量分析。
2.5 Western blot实验 按照南京凯基试剂盒说明提取各组足细胞总蛋白和核蛋白,BCA法定量各组蛋白浓度。聚丙烯酰胺凝胶电泳时每孔上样30 μg蛋白。5%脱脂奶粉常温封闭1 h后4 ℃摇床孵育如下Ⅰ抗(抗体稀释液由1% BSA配制,所有Ⅰ抗均为兔源性)过夜:Bax抗体(1∶500;Santa Cruz);PGC-1α抗体(1∶500;Santa Cruz);Bcl-2抗体(1∶1 000; CST);NFAT抗体(1∶500;Abcam);GAPDH抗体(1∶10 000; Sigma);Histone抗体(1∶3 000; CST)。次日,用TBST漂洗PVDF膜5 min、3次后常温孵育Ⅱ抗(抗体稀释液用1% BSA配制,均为羊抗兔Ⅱ抗;稀释比为(1∶3 000; Promega)1 h。用ECL工作液(Millipore)显影曝光。将曝光后的胶片扫描后,采用ImageJ软件分析各条带灰度值。将各目的条带灰度值除以同一标本内参照GAPDH(总蛋白)或者Histone(核蛋白)条带的灰度值得到一比值,再将该比值除以同一胶片上正常对照组的比值即为目的蛋白表达量的半定量结果。
3 统计学处理
采用SPSS 19.0统计软件进行统计学分析。所有计量资料以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析,均数间两两比较使用 Bonferroni校正的t检验。以P<0.05为差异有统计学意义。
结 果
1 HG诱导足细胞凋亡
既往已有研究表明 HG可诱导足细胞凋亡,所以为进一步研究足细胞凋亡的机制,本研究建立了足细胞凋亡的体外HG干预模型,同时也对其进行了验证。对比正常培养足细胞,HG干预后足细胞的凋亡率明显升高(P<0.05)。此外,实验结果还显示,对比正常培养足细胞,HG干预后足细胞中促凋亡的Bax的mRNA和蛋白明显升高,而抗凋亡的Bcl-2的mRNA和蛋白明显下调(P<0.05),见图1。
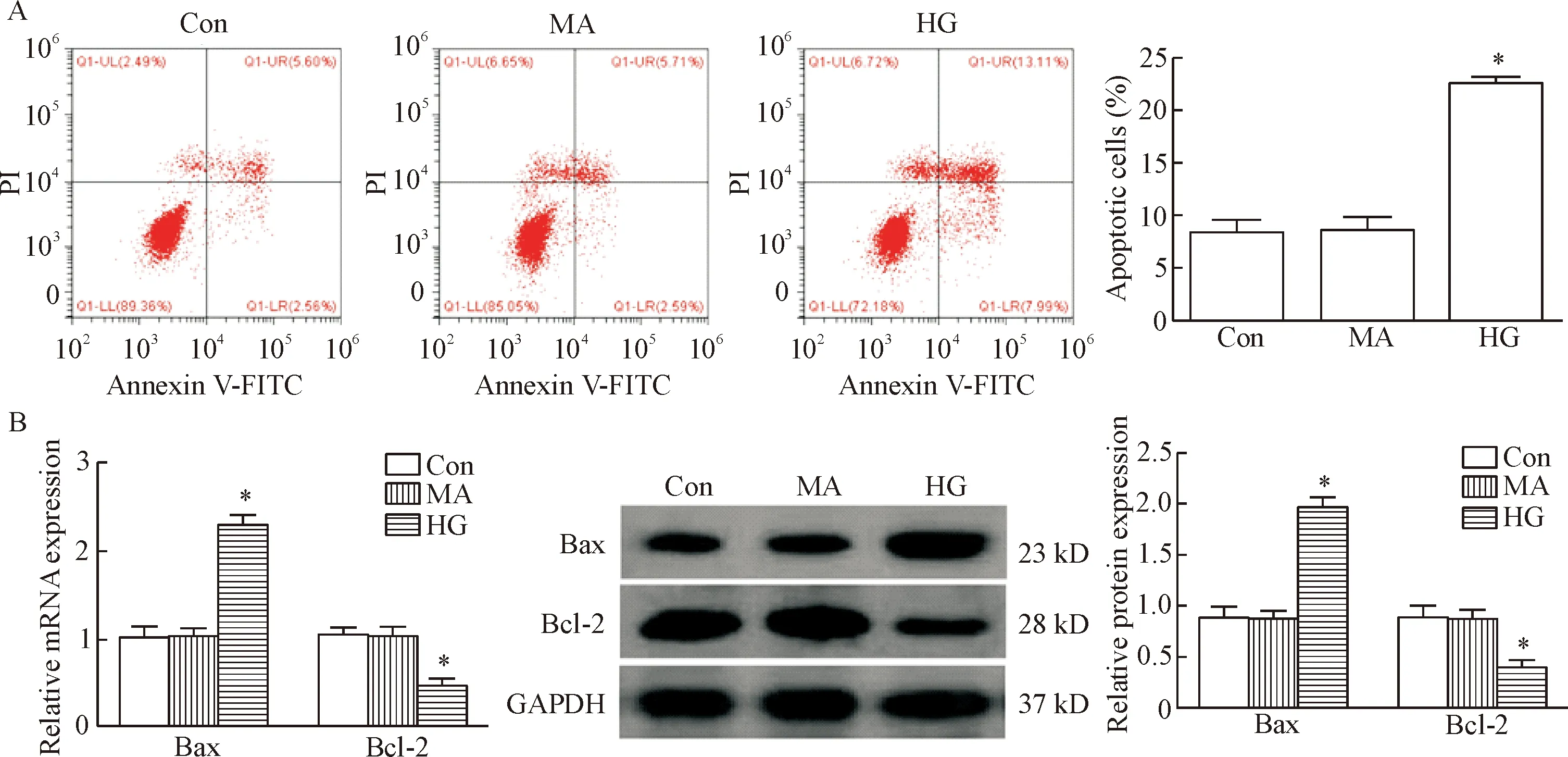
Figure 1.High glucose (HG) interventioninvitroincreased the apoptosis of podocytes. A: flow cytometry was used to analyze the apoptotic rate of podocytes (Annexin V/PI staining); B: the expression of Bax and Bcl-2 at mRNA and protein levels in the podocytes cultured under HG condition. Mean±SD.n=3.*P<0.05vsCon group.
图1 HG干预增加体内外模型中足细胞的凋亡
2 HG干预后足细胞中PGC-1α下调,NFAT活化
对比正常培养足细胞,PGC-1α的 mRNA表达在 HG损伤的培养足细胞中明显下调(P<0.05);类似地,相比正常培养足细胞,PGC-1α总蛋白的表达在HG损伤的培养足细胞中也明显下调(P<0.05)。此外,与正常培养足细胞相比,核内NFAT的蛋白表达在HG损伤的培养足细胞中明显升高(P<0.05),见图2。
3 PGC-1α下调引起足细胞凋亡
为了探讨PGC-1α表达下调对损伤足细胞的作用,我们在体外实验中进一步观察了足细胞的凋亡情况。与Con组相比,用siRNA沉默培养足细胞中的PGC-1α后,其细胞凋亡率明显增加(P<0.05),而Con组与siCon组相比差异无统计学显著性。与正常培养足细胞相比,在PGC-1α沉默的足细胞中,促凋亡指标Bax的mRNA和蛋白表达明显升高,而抗凋亡指标Bcl-2的mRNA和蛋白表达则明显下调(P<0.05),见图3。

Figure 2.The expression of PGC-1α was reduced, while the expression of nuclear NFAT was increased under high glucose (HG) condition. A: compared with normal cells, the mRNA expression of PGC-1α was significantly decreased in HG-injured podocytes; B: the total protein of PGC-1α was decreased significantly, while the protein expression of nuclear NFAT was significantly increased in HG-injured podocytes. Mean±SD.n=3.*P<0.05vsCon group.
图2 HG使足细胞PGC-1α表达下调而核NFAT表达升高
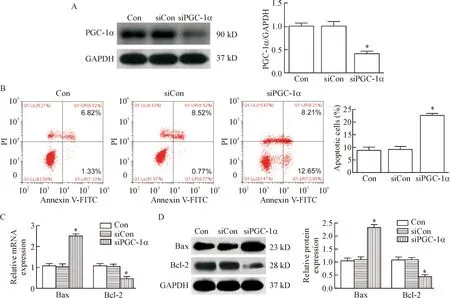
Figure 3.Down-regulation of PGC-1α induced podocyte apoptosis. A: the total protein of PGC-1α was significantly decreased after silencing ofPGC-1αby siRNA in the podocytes; B: flow cytometry was used to analyze the apoptotic rate of podocytes (Annexin V/PI staining); C: compared with Con group, the expression of Bax was significantly increased, while the expression of Bcl-2 was significantly decreased at mRNA level in thePGC-1αsilencing group; D: compared with Con group, the expression of Bax was significantly increased, while the expression of Bcl-2 was significantly decreased at protein level in thePGC-1αsilencing group. Mean±SD.n=3.*P<0.05vsCon or siCon group.
图3 PGC-1α表达下调导致足细胞凋亡
4 PGC-1α表达下调促使NFAT活化
为了进一步探索PGC-1α下调促进足细胞凋亡的机制,我们观察了在PGC-1α表达下调的足细胞中NFAT的蛋白表达。与正常组培养的足细胞相比,在PGC-1αsiRNA沉默的培养足细胞中,NFAT的蛋白表达明显升高(P<0.05),即PGC-1α的表达下调引起了NFAT的明显活化,见图4。
5 抑制NFAT表达可减轻由PGC-1α表达下调引起的足细胞凋亡
为进一步研究PGC-1α表达下调引起足细胞凋亡的机制,我们在PGC-1α表达下调的足细胞中给予NFAT siRNA干预,观察抑制NFAT表达对足细胞凋亡的影响。如图4所示,对比正常培养足细胞,PGC-1αsiRNA 沉默的足细胞的凋亡率明显增加(P<0.05);然而,在PGC-1α沉默的足细胞中给予同时沉默NFAT后,细胞凋亡明显减轻(P<0.05)。以上的这些结果提示抑制NFAT表达可减轻由PGC-1α表达下调引起的足细胞凋亡。
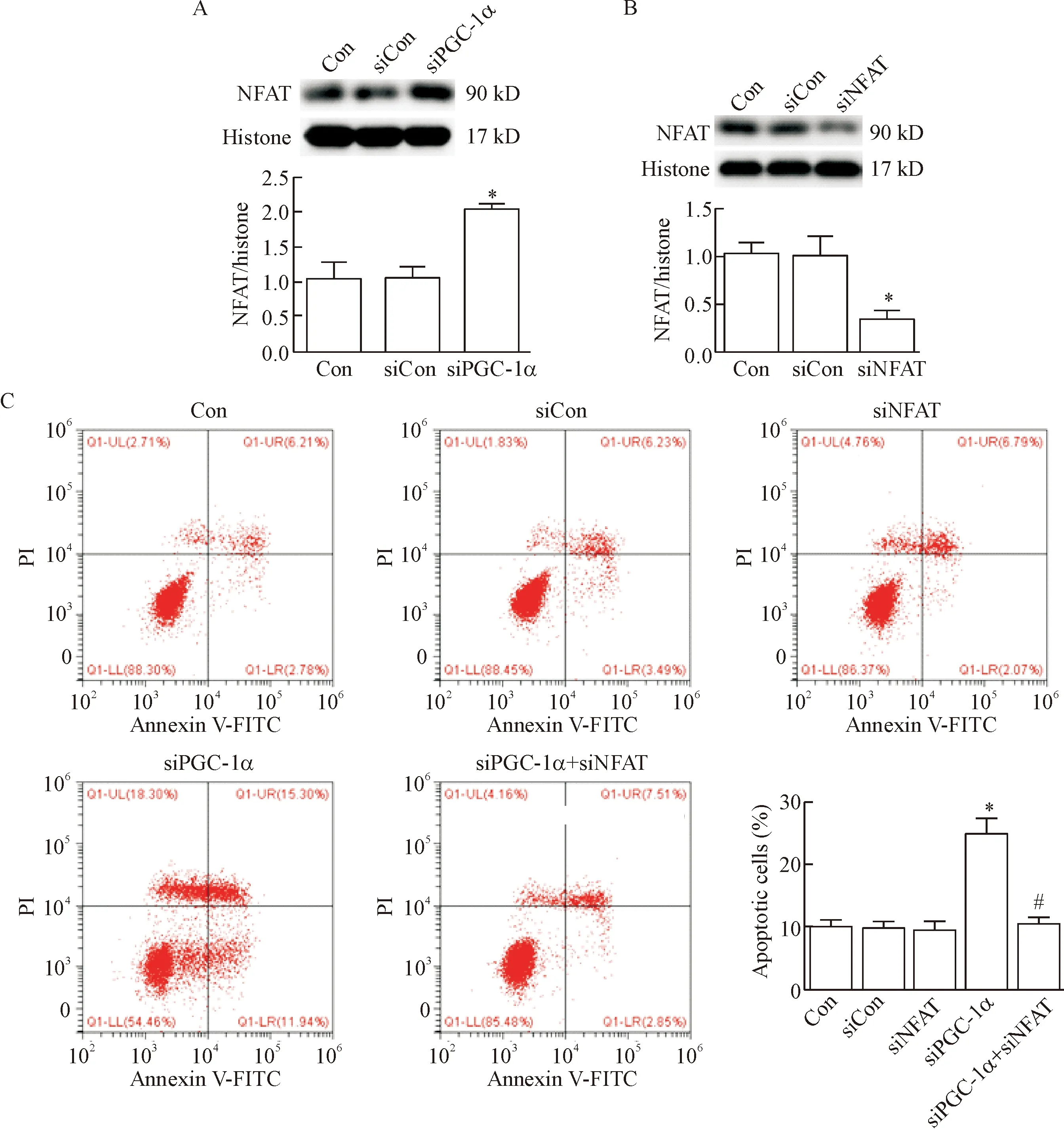
Figure 4.NFAT mediated podocyte apoptosis induced by PGC-1α down-regulation. A: the protein expression of nuclear NFAT was significantly increased afterPGC-1 silencing in normal cultured cells; B: the protein expression of nuclear NFAT was significantly decreased afterNFATsilencing in normal cultured cells; C: flow cytometry was used to analyze the apoptotic rate of podocytes (Annexin V/PI staining). Mean±SD.n=3.*P<0.05vsCon or siCon group;#P<0.05vssiPGC-1α group.
图4 NFAT介导PGC-1α表达下调引起的足细胞凋亡
讨 论
足细胞是具有复杂细胞骨架的高度分化细胞,是肾小球滤过的最后一道屏障,对维持肾小球滤过屏障的完整和功能起着重要的作用;所以,足细胞的损伤和凋亡必然会影响到肾小球的功能[1]。
本研究中,为探讨引起足细胞凋亡的机制,我们首先建立了HG诱导足细胞凋亡的体外模型。我们发现在该体外模型中PGC-1α表达显著下调。随后,我们在正常培养的足细胞中用siRNA沉默PGC-1α后,发现足细胞凋亡明显增加,说明PGC-1α的下调会导致足细胞凋亡。同时我们发现NFAT蛋白的表达在高糖诱导足细胞凋亡的体外模型中明显升高,即NFAT活化;正常培养足细胞中沉默PGC-1α后NFAT也明显活化,说明足细胞中PGC-1α的下调会引起NFAT的活化。最后为进一步确认足细胞中PGC-1α和NFAT的关系,我们在沉默PGC-1α的足细胞中同时沉默NFAT后发现,由PGC-1α表达下调诱导的足细胞凋亡明显减轻。这些结果表明NFAT可能介导了PGC-1α表达下调引起的足细胞凋亡。
PGC-1α是过氧化物酶体增殖物激活受体γ和其它核受体的转录共激活因子。与其它已知的转录共激活因子作用机制相似,PGC-1α可通过与许多不同转录因子结合,促进靶基因的转录,从而在不同组织和生物反应过程中发挥特异性和多样性功能[11]。PGC-1α在线粒体的生物合成、能量代谢、适应性产热、细胞增殖与凋亡[10-13]等起重要的调节作用。国内外研究表明PGC-1α表达下调会引起细胞凋亡,包括脐带静脉内皮细胞[7]、心肌细胞[8]、腹膜间皮细胞[9]等。并且研究还表明:葡萄籽提取物原花青素B2可通过激活AMPK-SIRT1-PGC-1α信号通路从而抑制HG引起的足细胞凋亡[10]。在本研究中,我们发现在HG诱导的足细胞凋亡的体外模型中,高糖诱导PGC-1α下调导致NFAT激活引起足细胞凋亡,但PGC-1α下调是否直接导致NFAT激活引起足细胞凋亡有待后续实验进一步加以验证。
NFAT是钙调磷酸酶(calcineurin,CaN)的下游效应蛋白,是依赖Ca2+的一类转录因子,在调控细胞炎症反应、细胞增殖和生存等方面都起着重要的作用[14-15]。它有NFAT1、NFAT2、NFAT3、NFAT4和NFAT5五个亚型[16-17]。既往研究表明在HG刺激培养的足细胞中Ca2+内流,CaN及NFAT2活化,分别用CaN抑制剂环孢素A和NFAT2抑制剂11R-VIVIT可有效阻止HG诱导的NFAT2活化,11R-VIVIT还可显著降低HG诱导的足细胞凋亡[4]。同样地,我们的研究数据也显示HG刺激培养的足细胞中NFAT明显活化。
为进一步研究高糖诱导PGC-1α下调导致NFAT激活引起足细胞凋亡的机制,我们在沉默PGC-1α的培养足细胞中发现NFAT明显活化,足细胞凋亡加重;在沉默PGC-1α的培养足细胞中同时沉默NFAT后,由PGC-1α表达下调引起的足细胞凋亡明显减轻。这说明NFAT介导了PGC-1α表达下调引起的足细胞凋亡。这在国内外尚无报道,其具体的机制有待进一步的研究。
综上所述,HG诱导PGC-1α表达下调,导致NFAT活化促进足细胞凋亡。抑制NFAT活化能减轻PGC-1α表达下调所引起的足细胞凋亡,这些结果表明NFAT可能介导了PGC-1α表达下调引起的足细胞凋亡。
[1] Jefferson JA, Alpers CE, Shankland SJ. Podocyte biology for the bedside[J]. Am J Kidney Dis, 2011, 58(5):835-845.
[2] 吕倩影, 周建华, 杨凤杰, 等. 亚溶量C5b-9可诱导足细胞的保护性自噬应答[J]. 中国病理生理杂志, 2015, 31(1):59-63.
[3] Huang Z, Zhang L, Chen Y, et al. Cdc42 deficiency induces podocyte apoptosis by inhibiting the Nwasp/stress fibers/YAP pathway[J]. Cell Death Dis, 2016, 7:e2142.
[4] Canaud G, Bienaime F, Viau A, et al. AKT2 is essential to maintain podocyte viability and function during chronic kidney disease[J]. Nat Med, 2013, 19(10):1288-1296.
[5] Li R, Zhang L, Shi W, et al. NFAT2 mediates high glucose-induced glomerular podocyte apoptosis through increased Bax expression[J]. Exp Cell Res, 2013, 319(7):992-1000.
[6] Susztak K, Raff AC, Schiffer M, et al. Glucose-induced reactive oxygen species cause apoptosis of podocytes and podocyte depletion at the onset of diabetic nephropathy[J]. Diabetes, 2006, 55(1):225-233.
[7] Marshall CB, Krofft RD, Pippin JW, et al. CDK inhibitor p21 is prosurvival in adriamycin-induced podocyte injury,invitroandinvivo[J]. Am J Physiol Renal Physiol, 2010, 298(5):F1140-F1151.
[8] Peng H, Zhong W, Zhao H, et al. Lack of PGC-1α exacerbates high glucose-induced apoptosis in human umbilical vein endothelial cells through activation of VADC1[J]. Int J Clin Exp Pathol, 2015, 8(5):4639-4650.
[9] 于胜男, 曹琼丹, 鲁美丽, 等. 黄芪多糖对糖尿病大鼠心肌细胞凋亡的影响[J].中药药理与临床, 2015, 31(4):102-105.
[10]朱雪婧, 文 枫, 杨淡昳, 等. 高糖腹膜透析液对腹膜间皮细胞PGC-1α蛋白表达以及线粒体相关氧化凋亡的影响[J].中南大学学报:医学版, 2013, 38(11): 1085-1091.
[11]Cai X, Bao L, Ren J, et al. Grape seed procyanidin B2 protects podocytes from high glucose-induced mitochondrial dysfunction and apoptosis via the AMPK-SIRT1-PGC-1α axisinvitro[J]. Food Funct, 2016, 7(2):805-815.
[12]Chung HW, Lim JH, Kim MY, et al. High-fat diet-induced renal cell apoptosis and oxidative stress in spontaneously hypertensive rat are ameliorated by fenofibrate through the PPARα-FoxO3a-PGC-1α pathway[J]. Nephrol Dial Transplant, 2012, 27(6):2213-2225.
[13]Onishi Y, Ueha T, Kawamoto T, et al. Regulation of mitochondrial proliferation by PGC-1α induces cellular apoptosis in musculoskeletal malignancies[J]. Sci Rep, 2014, 4:3916.
[14]Huang B, Cheng X, Wang D, et al. Adiponectin promotes pancreatic cancer progression by inhibiting apoptosis via the activation of AMPK/Sirt1/PGC-1α signaling[J]. Oncotarget, 2014, 5(13):4732-4745.
[15]Wang L, Chang JH, Paik SY, et al. Calcineurin (CN) activation promotes apoptosis of glomerular podocytes bothinvitroandinvivo[J]. Mol Endocrinol, 2011, 25(8): 1376-1386.
[16]Larrieu D, Thiebaud P, Duplaa C, et al. Activation of the Ca2+/calcineurin/NFAT2 pathway controls smooth muscle cell differentiation[J].Exp Cell Res, 2005, 310(1): 166-175.
[17]Rao A, Luo C,Hogan PG. Transcription factors of the NFAT family: regulation and function[J]. Annu Rev Immunol, 1997, 15:707-747.
(责任编辑: 林白霜, 罗 森)
High glucose-activated NFAT promotes podocyte apoptosis by down-regulation of PGC-1
CHEN En-ping, DU Li-gen, WU Yin-wei, YE Cui-mei, LUO Quan-fang
(TheSecondPeople’sHospitalofLonggangDistrict,Shenzhen518112,China.E-mail: 1033557448@qq.com)
AIM: To explore whether down-regulation of peroxisome proliferator-activated receptor γ coactivator (PGC)-1α induces podocyte apoptosis and its mechanism. METHODS: The podocytes were cultured under high glucose (HG) condition and the cell apoptosis was analyzed by flow cytometry. The methods of real-time PCR and Western blot were used to analyze the mRNA and protein expression of related molecules in the control, HG-treated or siRNA-treated podocytes. RESULTS: The expression PGC-1α at mRNA and protein levels was significantly decreased in HG-injured podocytes. Down-regulation ofPGC-1αexpressioninvitroby siRNA resulted in podocyte apoptosis. The nuclear protein expression of nuclear factor of activated T-cells (NFAT) was significantly increased in HG injured podocytes, indicating the NFAT activation. Down-regulation ofPGC-1αexpression also decreased the nuclear protein expression of NFAT. Moreover, silencing ofNFATexpression by siRNA significantly abolishedPGC-1αdeficiency-induced podocyte apoptosis. CONCLUSION: Down-regulation of PGC-1α induces podocyte apoptosis. NFAT mediatesPGC-1αdeficiency-induced podocyte apoptosis.
High glucose; Podocytes; Apoptosis; Peroxisome proliferator-activated receptor γ coactivator-1α; Nuclear factors of activated T-cells
1000- 4718(2017)04- 0620- 07
2016- 07- 01
2017- 03- 02
深圳市科技创新委员会基金资助项目(No. JCYJ20160429173108762)
R363; R587.2
A
10.3969/j.issn.1000- 4718.2017.04.008
△通讯作者 Tel: 0755-28870993; E-mail: 1033557448@qq.com
