皂泡量气管法测定过氧化氢催化分解反应的速率常数
2017-04-21黄浩炜罗安立关锦俊陈境凯曹铭隆
黄浩炜+罗安立+关锦俊+陈境凯+曹铭隆+潘湛昌+胡光辉+苏小辉
摘要:针对“测定过氧化氢的催化分解反应速率实验”中的水准瓶与量气管液面难以维持相平、易对反应起点误判的缺点,进行了实验改进。用废旧的碱式滴定管组装成的皂泡量气管代替水准瓶,采用医用注射器注射催化剂的方法代替直接加入法,可便于控制反应的起始时间;用注射器调整皂泡的位置,可获得更多更精确的实验数据。改进后的实验装置,在操作简便性、准确性和重现性上都有所提高。
关键词:过氧化氢;催化分解;反应速率;皂泡量气法;实验探究
文章编号:1005–6629(2017)3–0066–04 中图分类号:G633.8 文献标识码:B
1 引言
目前,测定过氧化氢催化分解速率及半衰期的方法有很多,如量气管测量氧气体积的方法[1~4]、光度法测量过氧化氢含量的方法[5~6]、高锰酸钾滴定过氧化氢的方法[7]、排水法测量氧气体积的方法[8]等。国内众多高等院校主要采用量气法测定过氧化氢催化分解的反应速率及半衰期[9~15]。实验中为了测出反应进行一定时间时产生气体的体积,要求水准瓶的液面与量气管液面保持同一水平。由于需要人手控制量气管液面和水准瓶液面保持一致,易出现两者不等压的情况,导致观察得到的体积变化读数误差较大。为此,本文对实验装置进行了改进,在使用等压法的原理下,把水准瓶换成了皂泡量气管,并采用医用注射器注射催化剂,通过测量上升皂泡的位置随时间的变化来表示反应所产生的气体体积随时间变化的关系。
2 实验部分
2.1 实验原理
常温下过氧化氢的分解反应进行得很慢,反应的化学计量式为:
由于反应(1)的速率较反应(2)慢得多,故总的反应速率由反应(1)控制,则H2O2分解反应的速率方程为:
2.2 实验装置
按图1(b)组装好装置,用注射器制造并调整出一个低位置的皂泡,打开三通活塞,通过观察皂泡位置有无变化以检查装置气密性是否良好。加入一定量的过氧化氢溶液于反应器中,加入搅拌子,重新吹出皂泡并记录所在位置。低速开启搅拌器,用注射器快速注射KI溶液,记下温度。随着反应的进行,可观察到皂泡的位置在上升,表明有氧气产生,当皂泡上升2mL距离,记下第一个数据V1,之后每上升2mL依次记下皂泡量气管的示数V2、V3、…Vt。
改进前、后实验装置如图1(a)、(b)所示。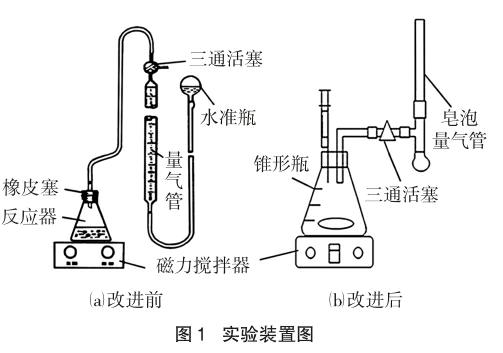
3 过程与讨论
3.1 装置的改进
图1(a)是众多高校实验室测定过氧化氢催化分解速率及半衰期的装置[17],装置通过测定反应过程中产生的气体体积随时间的变化来测定过氧化氢催化分解速率。实验中为了测出反应进行一定时间时产生氧气的体积,要求水准瓶的液面与量气管液面保持同一水平。由于需要人手控制量气管液面和水准瓶液面保持一致,易出现不等压的情况,导致观察体积变化读数误差较大。
图1(b)为本文对实验装置进行的改进,在使用等压法的原理下,把水准瓶换成了皂泡量气管,并采用医用注射器注射催化剂,通过记录上升皂泡位置随时间的变化来表示反应所产生的气体体积随时间变化的关系。改进的实验装置可避免过多的人手操作,无需控制水准瓶与量气管的液面保持水平,所以观察读数误差较水准瓶量气法小。装置简单易得,组装皂泡量气管时可利用废旧的碱式滴定管,体现了环保理念。采用了针管注射催化剂的方法,避免了起始生成的氧气逸散到空气中的问题。由于本装置操作步骤少且方便易行,故数据重现性较好。
3.2 实验过程
3.2.1 试剂与仪器
(1)药品及试剂:实验室配制18 g/L十二烷基苯磺酸钠溶液作为起泡水(也可采用一定浓度的洗洁精溶液);0.1 mol/L KI溶液;0.04 mol/L KMnO4溶液;3% H2O2溶液。KI、KMnO4、H2O2均为分析纯试剂;0.04 mol/L KMnO4溶液、3% H2O2溶液浓度需要准确标定。
(2)仪器:反应器部分由磁力搅拌器、磁力搅拌子、锥形瓶、两孔橡胶塞、医用注射器、L型玻璃管组成。其中,医用注射器有两个规格,10mL注射器用于快速注射催化剂溶液,50mL注射器用于调整皂泡起始位置。
3.2.2 实验操作
3.2.2.1 水准瓶量气法
利用图1(a)的实验装置按以下步骤进行实验:
(1)检验装置的气密性。
(2)校正开始液面读数为50mL(读数时水准瓶和量气管液面保持同一水平面)。
(3)用移液管量取10mL H2O2+20mL水+ 10mL KI溶液于锥形瓶中,加入搅拌子,塞紧橡胶塞,迅速按下秒表。
(4)轉动三通活塞,使量气管与锥形瓶相通,低速开启搅拌器,保持转速恒定,手举水准瓶使与量气管液面保持同一水平。液面每降低5mL,记录时间t和量气管的读数,总共记录10组数据。
3.2.2.2 皂泡量气管法
利用图1(b)的实验装置按以下步骤进行实验:
(1)检验装置的气密性并用肥皂水润洗皂泡量气管3~4次。
(2)打开三通活塞,连通大气。用医用注射器小心吸取10mL KI溶液,用移液管往锥形瓶里加入10mL H2O2+20mL水,组装好装置。
(3)挤压胶头,用50mL注射器吹出一个低位置的肥皂泡(本实验吹出的初始位置为3mL处),关闭三通活塞。
(4)低速开动磁力搅拌器,待转子运行正常后,马上快速地把医用注射器的活塞压到底(加入催化剂),此时皂泡将上升到一个位置,记录此位置为时间起点。观察皂泡每上升2mL,记录一次时间t,共记录10组数据。
3.3 数据处理结果
(1)列出t、Vt、V∞、V∞-Vt、ln(V∞-Vt)数据表,见表1、表2;Vt为体积间隔,t为生成相应气体体积的时间,V∞为H2O2全部分解时得到的O2体积。
(2)KMnO4溶液测定H2O2的初浓度cA0,以计算V∞。
(3)ln(V∞-Vt)对t作ln(V∞-Vt)-t图,求出直线的斜率k。
(4)计算出反应速率系数k1和半衰期t1/2。
图2、图3分别是实验装置改进前、后ln(V∞-Vt)-t图。对比图2、图3可以看出,改进前后的装置在同一实验条件下(实验室温度:21.7℃)进行实验,所得到的反应速率系数接近。图2中反应速率系数k1=0.000443s-1,半衰期t1/2=0.693/k1= 1562s;图3中反应速率系数k1=0.000501s-1,半衰期t1/2=0.693/k1=1386s。可以看出装置改进前后得出的结果相差不大,相对来说改进后的装置得出的数据相关系数更好,而且改进后的装置操作更方便、药品用量更少、实验耗时更短。
4 结语
本文提及的测定过氧化氢催化分解速率的装置与方法,通过使用皂泡量气管代替水准瓶测量反应过程中产生的气体体积,进行测定过氧化氢催化分解速率的实验,避免了过多人工操作及人工操作引起的误差;使用了注射器注射催化剂的方法,便于控制反应起始,使读数误差较改进前的装置更小,得到的实验结果更精确。
参考文献:
[1]汪丰云.化学反应速度测定的绿色化改进[J].安庆师范学院学报(自然科学版),2004,10(3):10~11.
[2]江茂生,林瑞余.用于较高温度下过氧化氢分解动力学实验的反应装置[J].大学化学,2002,17(3):39~41.
[3]张丽霞,庞承新,谭延光等.影响过氧化氢催化分解速率的因素[J].广西师范学院学报(自然科学版),2008,25(4):52~56.
[4]李云平,辛凌云,李森兰等. KI催化H2O2分解的速度常数、活化能测定研究[J].洛阳师范学院学报,2006,25(5):79~81.
[5]庄会荣,胡顺香,陈鸿琪等.靛红褪色光度法测定过氧化氢[J].理化检验(化学分册),2000,36(1):37,41.
[6]耿玉珍,刘葵,周杰等.以酸性铬蓝K作为氢供体的酶催化光度法测定过氧化氢[J].分析试验室,2000,19(5):56~58.
[7]张清,应超燕,余可那等.双氧水分解速率和稳定性研究[J].嘉兴学院学报,2010,22(3):51~53.
[8]苗伊鸣,杜淑贤.不同催化剂对过氧化氢分解的催化速率探究[J].化学教学,2011,(9):48~49.
[9]莫淑欢.过氧化氢分解动力学研究[D].南宁:广西大学硕士学位论文,2008.
[10][16][17]潘湛昌.物理化学实验[M].北京:化工出版社,2008:58~60.
[11]唐林,孟阿兰,刘红天.物理化学实验[M].北京:化工出版社,2008:78~80.
[12]邵水源.物理化學实验[M].西安:西北工业大学出版社,2011:103~106.
[13]夏海涛.物理化学实验[M].哈尔滨:哈尔滨工业大学出版社,2003:146~149.
[14]向建敏.物理化学实验[M].北京:化工出版社,2008:64-67.
[15]闫书一,向明礼,文光灿等.物理化学实验[M].成都:电子科技大学出版社,2008:51~53.
