过氧化氢提取海带中碘的实验条件优化
2015-10-15杨孝容熊俊如张桃
杨孝容+熊俊如+张桃
摘要:对普通高中化学三大版本《实验化学》教材“从海带中提取碘”的实验条件进行了优化。结果表明,用HAc调节pH 3~4,H2O2作氧化剂提取海带中碘,样品分析的相对标准偏差为0.47%~1.3%;平均加标回收率为90%~104%,相对标准偏差为1.2%~1.4%。本方法用HAc调节pH较《实验化学》用H2SO4调节的实验条件更稳定,精密度和准确度更高,可为高中化学实验教学提供有益的参考。
关键词:海带中碘的提取;过氧化氢;实验条件优化;实验改进
文章编号:1005–6629(2015)8–0048–04 中图分类号:G633.8 文献标识码:B
1 问题的提出
碘是人体必需的微量元素,海带中富含碘元素,碘作为高中化学知识与生活息息相关。在普通高中课程标准实验教科书《实验化学》的人教版、苏教版和山东版[1~3]中均编入了“从海带中提取碘”或“海带中碘元素的分离及检验”等实验。实验将海带灼烧灰化使有机碘转化为碘化物,用氧化剂将碘化物氧化为单质碘,再用有机溶剂萃取单质碘。氧化碘化物的氧化剂有过氧化氢[4,5,6]、饱和氯水[7]、溴水[8]、重铬酸钾[9]、亚硝酸钠[10]等。《实验化学》均准确称取一定量的海带,灰化后用水溶解,过滤,取滤液加硫酸调节酸度,且硫酸的加入量在比较宽的范围内变化。用硫酸调节酸度有以下不足:(1)硫酸用量较多滤液为强酸性环境,加CHCl3和H2O2后振荡分液漏斗,CHCl3层迅速出现紫红色,随着振荡次数的增加CHCl3层的紫红色变浅最后变为无色,说明碘单质被进一步氧化为无色的碘酸盐;(2)用硫酸调节pH 3~4,所需硫酸体积范围相差较小但测出碘含量悬殊较大。因硫酸调节的弱酸性不具有缓冲作用,且H2O2+2H++2I-=2H2O+I2的反应要消耗氢离子,随着反应进行溶液的pH将增大;(3)滤液中含大量的碳酸盐,当加入硫酸较少与碳酸盐反应后溶液可能为中性或碱性,CHCl3层几乎为无色。因酸度低H2O2氧化碘离子生成碘单质的速度慢,并且碘单质可能发生歧化3I2+6OH-=5I-+IO3-+3H2O生成无色易溶于水的物质。从海带中提取碘或分离检测碘,不仅从定性的角度证明海带中含有碘元素,而且可从定量的角度得到尽可能多的碘单质。从定量的角度研究H2O2提取海带中碘的条件优化尚未见报道,本研究采用了单因素变化定量研究H2O2提取海带中碘的实验条件。研究表明,3g海带于600~700℃灼烧,灰分用1:1 HAc 6~12mL溶解,加入10% H2O2 3~6mL测得碘含量基本不变,说明优化的条件稳定,可操作性强。
2 实验部分
2.1 仪器和试剂
DHG-9075电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司);ZN-400A型高速万能粉碎机(吉首市中诚制药机械厂);FC204型电子天平(上海精科天平);SX2-5-12电阻炉(上海意中电炉有限公司);瓷坩埚、泥三角、坩埚钳、电炉、量筒、分液漏斗、移液管、碱式滴定管、烧杯、玻璃棒、锥形瓶
用冰醋酸稀释为1:1 HAc;用30% H2O2稀释为10% H2O2;Na2S2O3配制为0.1 mol/L溶液,用K2Cr2O7作基准物质,间接碘量法标定其浓度,准确移取一定体积的0.1 mol/L Na2S2O3标准溶液,在250mL的容量瓶中稀释成0.00500 mol/L Na2S2O3标准溶液;0.005 mol/L的碘溶液(含0.015 mol/L KI);0.005 mol/L KI溶液;0.1 mol/L NaOH溶液;0.5%的淀粉溶液;CHCl3;实验所有试剂均为分析纯;实验用水为一次蒸馏水
实验样品:干海带(普通商场购买)
2.2 样品预处理
用刷子把购买的干海带表面的附着物刷净,在90℃干燥箱中烘干,用粉碎机粉碎成海带粉,装入自封袋备用。
2.3 实验方法
样品溶液阶段:准确称取3g海带粉于瓷坩埚中,用少量酒精润湿,在电炉上灰化后移入电阻炉,在设定温度下炉门先留小缝加热30min,再关好炉门继续加热30min。稍冷后取出,冷却至室温后将灰分全部转入50mL烧杯,加5mL蒸馏水并用玻璃棒研碎灰分,慢慢滴加10mL 1:1 HAc,加热近沸再冷却得样品溶液。
萃取和滴定阶段:将样品溶液转入分液漏斗,加入10mL CHCl3和5mL 10% H2O2,振荡,静置,分层后将CHCl3放入另一分液漏斗中,在水相层再加入10mL CHCl3萃取,如此反复2次,合并CHCl3约30mL;用20mL蒸馏水分2次返洗CHCl3,然后在CHCl3中加入0.1mol/L NaOH溶液15mL(CHCl3层应为无色)。CHCl3层从分液漏斗的下端放出,水层转入100mL的锥形瓶中,加入5mL 1:1 HAc,用0.00500mol/L Na2S2O3溶液滴定到浅黄色后再加入1mL 0.5%的淀粉溶液,继续滴定至溶液由蓝色变为无色为终点,消耗Na2S2O3为VmL。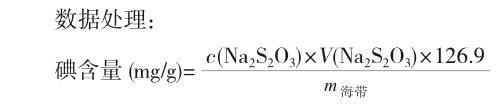
3 结果与讨论
3.1 实验条件的优化
3.1.1 过氧化氢用量的试验
600℃处理的5份样品溶液,分别加入10% H2O2 2.0mL、3.0mL、4.0mL、5.0mL和6.0mL,其余与“2.3”相同。试验结果表明,10% H2O2在3~6mL测得碘含量基本不变,但随着H2O2体积增加,CHCl3层出现紫红色的速度加快,加入5.0mL时速度较适中。实验选择10% H2O2 5.0mL。
该反应属于氧化还原反应,反应物浓度增大,氧化还原速度加快。随着H2O2体积增加,H2O2浓度增大,生成碘单质的速度加快,所以CHCl3层出现紫红色的速度加快。
3.1.2 处理灰分醋酸体积试验
600℃处理的灰分5份,分别加入1:1 HAc 6mL、8mL、10mL、11mL和12mL,其余与“2.3”相同。试验结果表明,1:1 HAc在6~12mL测得碘含量基本不变,CHCl3层出现紫红色的速度没有明显的差异且速度适中。pH计测定水相层加入H2O2前后pH均在3~4之间。实验选择加入1:1 HAc 10mL。
因灰分中的碳酸盐与HAc反应生成NaAc,再与过量HAc构成HAc-NaAc缓冲溶液,所以HAc在6~12mL变化时溶液的pH变化不大,即c(H+)变化不大,化学反应速度变化不明显。
3.1.3 灼烧温度试验
样品灼烧温度600℃、650℃、700℃和750℃,每个温度平行试验3次,其余与“2.3”节相同。试验结果表明,600℃、650℃和700℃处理样品测得碘含量没有明显差异,750℃处理样品测定值略有下降。600℃和650℃灼烧后的灰分为灰色且体积较大而膨松,用HAc溶解后的不溶物较多;700℃灼烧后固体为淡黄色较坚硬,用HAc溶解后的不溶物较少。实验选择650℃处理样品。
3.1.4 CHCl3层返洗次数试验
空白试验10mL 1:1 HAc加5mL 10% H2O2,用10mLCHCl3萃取3次,合并CHCl3约30mL,分四种情况试验,第一种不用水返洗CHCl3层,第二种用15mL水返洗CHCl3层1次,第三种用20mL水分2次返洗CHCl3层;第四种直接取30mL CHCl3。上述四种情况均加入10mL 0.005 mol/L碘溶液,其余与“2.3”相同。试验结果表明:第三和第四种情况消耗Na2S2O3体积基本相同,第一和第二种情况与第四种情况消耗Na2S2O3有一定差异。试验选择2次返洗萃取CHCl3层。
3.2 样品分析
3.2.1 样品分析结果
按“2.3”实验方法,灼烧温度为650℃,各批样品的分析结果见表1。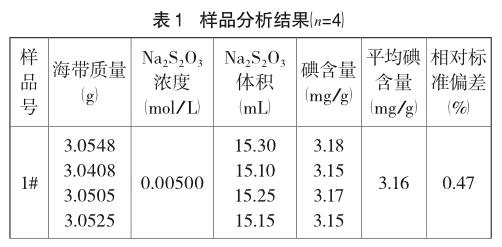

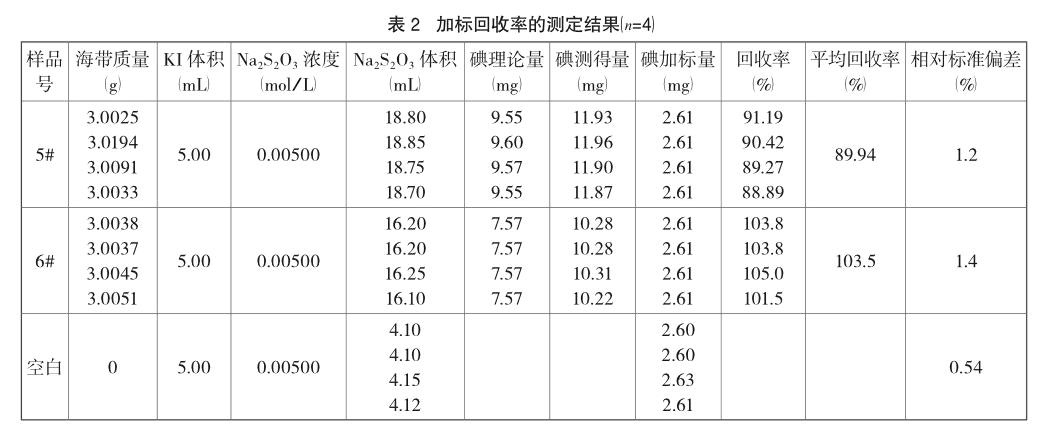
3.2.2 加标回收率的测定
加标样品的处理:样品灰化后加入KI溶液5.00mL,在电炉上缓缓加热蒸干后再放入650℃电阻炉,其余按“2.3”操作;空白试验直接取KI溶液5.00mL于分液漏斗,加入10mL 1:1 HAc,其余与“2.3”相同。
由表1分析结果可知,碘在海带中的含量属于微量组分,方法用于样品分析的相对标准偏差在0.47%~1.3%,说明方法的精密度良好;从表2可知平均回收率在90%~104%之间,说明方法的准确度较高。
4 结论
用5mL 10% H2O2作氧化剂从海带中提取碘,用HAc调节pH 3~4实为NaAc-HAc的缓冲溶液,使HAc用量在较大范围内变化时溶液pH变化不大,对生成碘单质的速度和质量没有明显的影响,并且化学反应速度适中。用H2SO4调节酸度溶液不具有缓冲作用,H2SO4用量范围变化较小但溶液pH变化可能很大,对H2O2的氧化性、生成碘单质的速度和质量(CHCl3层出现紫红色的速度和最后颜色的深浅)有明显影响。所以,用HAc调节酸度pH 3~4较H2SO4调节酸度的稳定性好,可操作性更强。
5 建议
根据条件优化,鉴于高中化学学习的需要和大部分学校的实验条件,建议“从海带中提取碘”的实验如下:称取3g干海带小块或粉于坩埚中,用酒精润湿,在通风橱中用酒精灯或酒精喷灯或电炉灰化;冷却后将灰分全部转入小烧杯中,加入 10~15mL蒸馏水,搅拌,微沸2~3min,冷却后过滤;量取6~10mL 1:1 HAc,用滴管缓慢滴入滤液中,当产生气泡较少时将HAc全部转入,经HAc处理后滤液全部转入分液漏斗中,加入CCl4或CHCl3 2~5mL,10% H2O2 3~5mL,振荡,静置。观察现象。弃去上层水相,回收下层含碘的CCl4或CHCl3溶液。
参考文献:
[1][4]宋心琦主编.普通高中课程标准实验教科书·实验化学[M].北京:人民教育出版社,2007:20~22.
[2][5]王祖浩主编.普通高中课程标准实验教科书·实验化学[M].南京:江苏教育出版社,2009:2~4.
[3][7]王磊主编.普通高中课程标准实验教科书·实验化学[M].济南:山东科学技术出版社,2007:9~12.
[6]沈文敏,李永红.“从海带中提取碘”最佳实验条件的探索[J].化学教育,2013,(6):66~68.
[8]中华人民共和国水产行业标准SC/T3010-2001海带碘含量的测定.
[9]胡小莉,李原芳,凌莉莎等.海带中提取碘的微型实验研究[J].西南师范大学学报(自然科学版),2007,32(5):168~170.
[10]汤春兰,杨文珍.光度法测定海带中微量碘[J].精细石油化工,1999,(2):57~59.
