BMP-14诱导骨髓间充质干细胞向肌腱细胞分化的实验研究
2017-04-20黄晓楠
黄晓楠
BMP-14诱导骨髓间充质干细胞向肌腱细胞分化的实验研究
黄晓楠
目的探讨应用骨形态发生蛋白14(BMP-14)诱导骨髓间充质干细胞(BMSCs)向肌腱细胞分化条件,为获取肌腱组织工程种子细胞提供方法。方法 以新西兰大白兔为实验对象,取BMSCs分离培养。建立2个培养组,分别为实验组(BMP-14诱导培养组)和对照组(自然分化组)。I型胶原免疫组化、甲苯胺蓝染色,分别使用RT-PCR法检测在不同时间点培养BMSCs的I型胶原蛋白和蛋白聚糖mRNA的表达。结果实验组BMSCs爬片免疫组化染色中可见蛋白聚糖及I型胶原蛋白染色阳性,对照组呈阴性。RT-PCR结果显示经BMP-14诱导后BMSCs中蛋白聚糖I型胶原蛋白的表达明显高于对照组。结论 BMP-14可诱导BMSCs向肌腱细胞分化。
骨髓间充质干细胞;肌腱细胞;BMP-14
骨髓间充质干细胞(BMSCs)是组织工程理想的种子细胞,具有自我更新能力和多向分化潜能,BMSCs用于成骨、成软骨、成脂及成肌等研究较为成熟,但其向肌腱细胞分化方面的研究较少,有研究显示,肌腱修复早期在肌腱局部注射BMSCs,可在组织学及生物力学方面促进肌腱的修复过程[1,2]。然而,也有学者研究认为BMSCs治疗肌腱损伤中,部分患者出现移位钙化,且与细胞浓度及治疗时间不相关[3,4],还有学者研究认为,未分化的BMSCs在特定的环境下有形成肿瘤的风险[5]。因此本实验提出采用体外分离培养BMSCs,并在特定的转化因子、转化培养条件下使其向肌腱细胞分化[6]。由于肌腱细胞主要表达蛋白聚糖I型胶原蛋白,因此应用转化类肌腱细胞及组织工程学原理方法可将再生肌腱细胞与生物支架结合来再生工程化类肌腱组织,从而为肌腱损伤的治疗提供新的方法。
1 材料与方法
1.1 实验动物
2月龄新西兰大白兔,雌雄不限,体重2.5~3.0kg,由山东省菏泽医学高等专科学校动物实验中心提供(合格证号:鲁动字第P00102015)。
1.2 主要试剂
质粒pcDNA3.1-BMP-14(Invitrogen)、I型胶原酶、Hoechst33258及Calf Thymus DN(Gibco公司)、DMEM培养基、TrizolReagent(Invitrogen公司)、胎牛血清(Sigma公司)、Percoll分离液(Pharmacia公司)、Calf Thymus DNA (Gibco公司)和Hoechst33258等试剂、I型胶原酶、聚集蛋白聚糖多克隆抗体(Sigma公司)、兔抗兔隆抗体(Neomaker公司)、胰蛋白酶(Sigma公司)、LipofectamineTM2000(Invitrogen公司)、骨形态发生蛋白14(BMP-14)、ELISA试剂盒(Sigma公司)、兔抗兔隆抗体(Neomaker公司)、胰蛋白酶(Sigma公司)、木瓜蛋白酶(E.Merck公司)、RF-5000荧光分光光度计(岛津公司)及D-Hanks液(Gibco公司)。
1.3 仪器和设备
洁净工作台、低速离心机、DL-5、CO2培养箱、USA旋转式细胞培养系统(RCCS,SyntheconInc,美国)、PTC-200 型PCR仪(MJ公司)、倒置荧光相差显微镜(德国Zeiss公司)。
1.4 BMSCs的分离和培养
取新西兰大白兔,以浓度2%戊巴比妥钠耳缘静脉全身麻醉,剃毛、消毒铺巾,骨穿针于兔髂前上棘抽取髂骨骨髓,将骨髓与Hanks液以1:1混合均匀,以1000r/min的速度离心7分钟后去脂。采用LG2DMEM进行反复冲洗所得到的冲洗液,加入含有percoll(密度1.073)的10mL离心管中,使用3500r/min速度离心7分钟,见离心管中细胞分层明显,取中间棉絮样分层细胞并以DMEM反复洗涤细胞,再以1500r/min离心20分钟,以DMEM液反复洗涤细胞2次经离心后的收集细胞缓慢加入20%胎牛血清细胞培养液中,并吹打细胞至单个细胞形成后接种在50mL培养瓶里,并将培养瓶放置在5%CO2、37℃及饱和湿度的细胞培养箱里进行细胞培养。每72小时更换培养液1次,未贴壁细胞即可经过这种反复换液、冲洗而去除,等细胞集落形成,并生长至85%融合后传代。细胞传代培养时加0.25%胰酶,并采用相差显微镜观察,此时可见梭形BMSCs变成圆形,再吸弃胰酶消化液,将BMSCs加入培养基中,并吹打细胞使之分散。采用血细胞计数板计数细胞,并以5×107P/ mL的密度接种在50mL的培养瓶里。此时细胞记作P1,重复以上操作步骤获得P1~P3,并将P3细胞作为肌腱组织种子细胞。建立2个培养组,分别为实验组(BMP-14诱导培养组)和对照组(自然分化组)。
1.5 BMSCs转染
取1 g质粒转化大肠杆菌感受态细胞,经挑单克隆后再小提质粒行酶切鉴定测序。质粒DNA中量抽提试剂盒,提取质粒在-20℃中保存备用。BMSCs传代于37℃、5%CO2、饱和湿度(95%)的细胞培养箱中培养,待细胞融合度到90%~95%时进行BMSCs转染,按照LipofectamineTM2000转染说明书进行操作,待24小时后,将转染细胞置于倒置显荧光微镜下观察细胞情况。
1.6 检测指标
1.6.1 组织学检测
甲苯胺蓝染色:取各组3、7、14、21天培养细胞制作细胞爬片,玻片细胞按染色步骤依次采用10%中性甲醛固定、水洗、甲苯胺蓝染色,染色35分钟后以95%酒精清洗玻片中剩余的甲苯胺蓝染液,染色后给与封片处理。按I型胶原免疫组化染色试剂盒操作说明进行组织学检测。
1.6.2 Ⅰ型胶原蛋白及聚集蛋白聚糖mRNA检测
两组细胞均采用RT-PCR检测法检测I型胶原蛋白及聚集蛋白聚糖mRNA表达。分别采集两组不同时间点的细胞,并采用TrizolTM试剂行细胞裂解。提取细胞总RNA,并测定RNA浓度,将RNA逆转录为cDNA,进行PCR扩增。由上海英骏生物技术有限公司合成所有引物,引物和扩增序列示于表1。

表1 引物序列与扩增长度
I型胶原RT-PCR反应条件:先在94℃预变性5min,然后在94℃变性30秒,再在60℃退火30秒,72℃延伸45秒,共32个循环,最后一个循环后再在72℃延伸10分钟。
聚集蛋白聚糖AggrecanRT-PCR的反应条件:先在94℃预变性5分钟,然后在94℃变性30秒,再在60℃退火45秒,72℃延伸40秒,共32个循环,最后一个循环后再在72℃延伸10分钟。
-actin RT-PCR的反应条件:先在94℃预变性5分钟,然后在94℃变性30秒,再在55℃退火30秒,72℃延伸30秒,共28个循环,最后一个循环后再在72℃延伸10分钟。
PCR产物经电泳、DNA吸光度扫描检测,以及显色条带图像分析系统(Launch sensiansys凝胶成像系统)检测其积分吸光度值,与 -Actin(内参基因)条带的光密度参数之比值作为mRNA表达水平的参数。
1.7 统计学分析
所有数据使用SPSS11.5(SPSSInc.,Chicago,IL,USA)医学统计学软件进行数据分析,计量资料采用(2±s)表示。采用两独立样本t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 细胞形态观察
BMSCs离心提取培养1天后,大部分BMSCs贴附于培养瓶表面,少数为长梭形,随着时间的推移,培养瓶表面上的细胞数量逐渐增加,形态也变得更加趋向于长梭形,离心培养液中可见少量分散分布的类球形、折光性弱的细胞;实验组细胞离心培养第21天收获的细胞,在倒置相差显微镜下观察到BMSCs增殖活跃,细胞数量较多,呈梭形、多边形及不规则形(图1A),对照组第21天数量较少,呈不规则形贴满瓶壁(图1B)。
2.2 免疫组化检测
甲苯胺蓝染色:实验组BMSCs在诱导21天后呈多边形或圆形,并且BMSCs的细胞浆呈异染性及紫蓝色,可见清晰胞核及核仁(图1C)。对照组BMSCs为长梭形,BMSCs的细胞浆没有观察到明显的异染性。。
I型胶原免疫组化染色:实验组BMSCs在诱导21天,后呈多边形,并且BMSCs的细胞浆呈棕褐色颗粒,胞核清晰(图1D)。对照组BMSCs绝大多数呈长梭形,胞核清晰蓝染,胞浆未见棕褐色颗粒。

图1 A实验组细胞离心培养第21天收获细胞,BMSCs增殖活跃,细胞数量较多,呈梭形、多边形及不规则形(×400);B对照组第21天呈不规则形,数量较少(×400);C实验组BMSCs诱导21天BMSCs呈多边形或圆形,胞浆呈明显的紫蓝色及异染性,胞核清晰,可见核仁(×1600);D实验组BMSCs诱导21天,BMSCs为多边形,胞浆见呈棕褐色颗粒,胞核清晰(×1600)
2.3 RT-PCR检测
两组细胞I型胶原蛋白及聚集蛋白聚糖mRNA的表达、RT-PCR检测结果见表2。从第14天开始,实验组BMSCsI型胶原蛋白及聚集蛋白聚糖条带与对照组比较有明显差别,且随培养时间延长而逐渐增加;两组在吸光度值上也存在显着性差异(P<0.05)。而对照组没有显着变化,各时间点I型胶原蛋白及聚集蛋白聚糖mRNA几乎无表达。
表2 不同时间点两组组细胞聚集蛋白聚糖及I型胶原蛋白mRNA的表达量(±s)
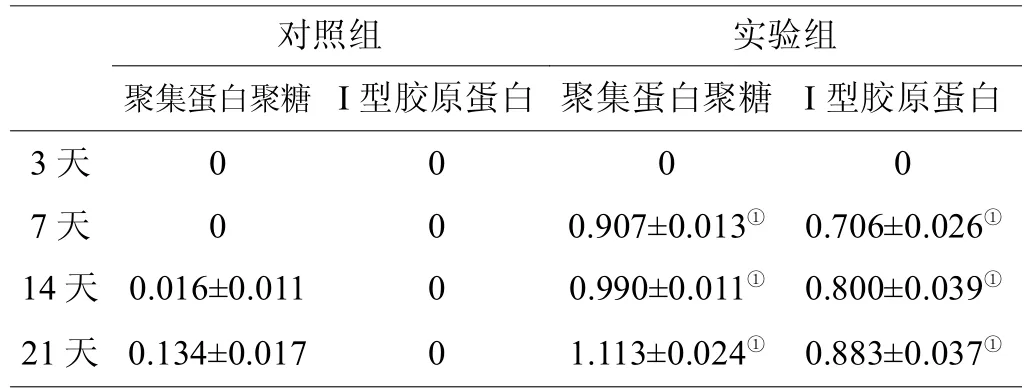
表2 不同时间点两组组细胞聚集蛋白聚糖及I型胶原蛋白mRNA的表达量(±s)
注:①聚集蛋白聚糖与I型胶原蛋白含量同对照组比较,P<0.05。
对照组 实验组聚集蛋白聚糖 I型胶原蛋白 聚集蛋白聚糖 I型胶原蛋白3天0 0 0 0 7天 0 0 0.907±0.013①0.706±0.026①14天 0.016±0.011 0 0.990±0.011①0.800±0.039①21天 0.134±0.017 1.113±0.024①0.883±0.037①0
3 讨论
肌腱损伤在临床上很常见,目前常见的治疗方法是自体肌腱的移植,但是这种方法取材有限,并且极有可能会对供区产生不良的影响[7]。尽管现在有同种异体肌腱及人工肌腱等替代材料可选择,但前者材料的排斥不可避免,后者也无法提供充足的力学稳定[8]。近年随着组织工程学的兴起,为肌腱损伤的治疗提供了一个新途径。种子细胞的来源是肌腱组织工程研究的重点之一,在目前阶段,可以作为种子细胞的有成纤维细胞、肌腱细胞及间充质干细胞[9-11]。过去研究中多应用肌腱细胞作为种子细胞,但若从自身取材创伤不可避免,从其他异体取材又极可能会引起排斥反应。此外,腱细胞在体外培养时增殖速度慢,多次传代耗时长,严重影响细胞分泌基质的能力。若以成纤维细胞作为种子细胞,其贴壁时间、排列方式及细胞生物学特性等方面,均与肌腱细胞存在着差异,这种差异是否会导致失败还有待研究。
间充质干细胞存在于成熟的骨髓基质中,它在一定条件下可向诸如脂肪、骨、软骨、肌腱、肌肉及骨髓基质等特定细胞分化的潜能[12],在组织工程中具有取材方便、体外培养时具有高效率增殖特点、可避免排斥反应等问题,以及间充质干细胞作为种子细胞,它的来源不受供体年龄限制[13,14]。
在肌腱的再生修复中,多种因子如类胰岛素生长因子(IGFs)、转化生长因子(TGF-)、骨形态发生蛋白(BMPs)等均在肌腱愈合中发挥作用。近年来,骨形态发生蛋白在肌腱发生和肌腱损伤修复中的作用逐渐被认识。骨形态发生蛋白[15]在体内能够诱导骨和腱样组织形成。动物实验证实BMP-14有诱导间充质干细胞成腱作用,并且能大大提高肌腱强度。很多体外研究已显示出BMP-12、13、14在肌腱修复中的潜在作用[16-18]。
本实验在体外环境下,利用BMP-14诱导BMSCs向肌腱细胞转化。实验组在BMSCs的细胞爬片免疫组化染色中I型胶原染色阳性,甲苯胺蓝染色阳性,而对照组呈阴性。第7~21天,实验组可检测到BMSCs的蛋白聚糖I型胶原mRNA的表达,对照组无明显表达(P<0.05)。实验组培养21天后,BMSCs的形态发从培养初期的长梭形变为丰富的多边形,且BMSC形状已与腱细胞的形状相似。蛋白聚糖I型胶原蛋白的免疫染色中,实验组BMSCs胞体着色明显,着色显示证明BMSCs胞体中已有蛋白聚糖I型胶原蛋白的表达合成,随后的RT-PCR检测进一步证实了来自基因水平的聚集蛋白聚糖及I型胶原蛋白存在于BMSCs胞体中。蛋白聚糖和I型胶原蛋白主要存在肌腱细胞中,且在BMSCs中表达明显,本组实验结果也证实通过 BMP-14转染的BMSCs已具有向肌腱细胞转化的能力,并且随着转染时间的延长这种转化趋势越明显。
组织工程肌腱与传统肌腱修复法比较,其优势明显。本实验以BMP-14作为诱导因子,成功诱导BMSCs向肌腱细胞转化,可解决肌腱组织工程的种子细胞来源不足的困境。然而这一技术要真正应用于临床治疗中,还有很长的路要走。未来的研究方向可着眼于如何在体外模拟机体内环境而进行组织工程的构建。
[1] Awad HA,Butler DL,Boivin GP,et al.Autologous mesenchymal stem cell-mediated repair of tendon[J].Tissue Eng,1999,5(3): 267-277.
[2] Kryger GS,Chong AK,Costa M,et al.A comparison of tenocytes and mesenchymal stem cells for use in flexor tendon tissue engineering[J].J Hand Surg Am,2007,32(5):597-605.
[3] Awad HA,BoivinGP,Dressler MR,et al.Repair of patellar tendon injuries using a cell-collagen composite[J].J Orthop Res,2003,21 (3):420-431.
[4] Harris MT,Butler DL,Boivin GP,et al.Mesenchymal stem cells used for rabbit tendon repair can form ectopic bone and express alkaline phosphatase activity in constructs[J].J Orthop Res,2004, 22(5):998-1003.
[5] Tasso R,Augello A,Carida'M,et al.Development of sarcomas in mice implanted with mesenchymal stem cells seededontobioscaffolds[J].Carcinogenesis,2009,30(1):150-157.
[6] 年争好,孙凯,李晖等.大鼠BMSCs成骨诱导及复合支架材料构建组织工程骨组织的研究 [J].生物骨科材料与临床研究,2015,12(1):1-5.
[7] Brigido SA.Special segment soft tissue matrices-soft-tissueaugmentation of the foot and ankle using an acellular regenerative tissue scaffold[J].Foot Ankle Spec,2009,2(5):240-244.
[8] Lui PP.Stem cell technology for tendon regeneration current status,challenges,and future research directions[J].Stem Cells Cloning,2015,8:163-174.
[9] Chen B,Li B,Qi YJ,et al.Enhancement of tendon-to-bone healing after anterior cruciate ligament reconstruction using bone marrow-derived mesenchymal stem cells genetically modified with bFGF/BMP2[J].Sci Rep,2016,6:259-270.
[10]Hao ZC,Wang SZ,Zhang XJ,Lu J.Stemcell therapy:a promising biological strategy for tendon-bone healing after anterior cruciate ligament reconstruction[J].Cell Prolif,2016,49(2):154-162.
[11]虞冀哲,董学海,陈海丹,等.间充质干细胞应用于软骨组织工程的研究进展[J].生物骨科材料与临床研究,2015,12(4):60-64.
[12]Valtieri M,Sorrentino.The mesenchymal stmmal cell contribution to homeostasis[J].J Cell Physiol,2008,217:296-300.
[13]Bonab MM,Alimoghaddam K,Talebian F,et a1.Aging of mesenchymal stem cell in vitro[J].BMC Cell Biol,2006,7:11-14.
[14]Baker N,Boyette LB,Tuan RS.Characterization of bone marrowderived mesenchymal stem cells in aging[J].Bone,2015,70: 37-47.
[15]Termaat MF,Den B0er FC,Bakker FC,et a1.Bone marphogenetie proteins:development and clinical efficacy in the treatment of fraclures and bone defects[J].J Bone Joint Surg Am,2005,87(6): 367-378.
[16]Bolt P,Clerk AN,Luu HH,et al.BMP-14 genetherapy increases tendon tensile strength in a ratmodel of A chilles tendon injury[J]. J Bone Joint Surg Am,2007,89(6):1315-1320.
[17]Murray SS,BrochmannMurray EJ,Wang JC,etal.The history and histology of bone mo rphogenetic protein[J].Histol Histopathol, 2016,31(7):721-732.
[18]Helbing T,Rothweiler R,Ketterer E,et al.BMP activity Controlled by BMPER regulates the proinfla mmatory phenotype of endothelium J[J].Blood,2011,118(18):5040-5049.
Experimental study on bone marrow mesenchymal stem cells induced to tendon cells by BMP-14
Huang Xiaonan.Orthopedics Surgery,Heze Municiple Hospital of Shandong,Heze Shandong,274031,China
Objective To explore bone marrow mesenchymal stem cells(BMSCs)induced to tendon cells by BMP-14, provided methods of obtaining tendon tissue engineering seed cells.Methods The BMSCs obtained from adult rabbit was culturedintheestablishment of twogroup-experimentalgroup(using BMP-14inducedculture)andcontrolgroup(using natural differentiation).Use collagen type I immunohistochemical and toluidine blue staining.Detect the expression of mRNA of proteoglycan and collagen type I protein by RT-PCR at different time during culture.Results Immunohistochemistry stainingofproteoglycanandcollagen typeI protein in BMSCs climbingfilmshowed positive,while the control groupshowednegative.RT-PCR results suggest that the inducedBMSCsexpressproteoglycanand collagen typeI protein higher than the control group.Conclusion BMP-14 can induce the BMSCs differentiating into the tendon cells in vitro.
BMSCs;Tendon cells;BMP-14
R318
A
10.3969/j.issn.1672-5972.2017.02.001
swgk2016-07-00170
黄晓楠(1976-)男,硕士,主治医师。研究方向:骨外科。
2016-07-22)
山东菏泽市立医院手足显微外科,山东菏泽274031
