MBD2在老年胃癌中的表达及其对胃癌细胞多药耐药性的作用
2017-04-20韩雪晶
韩雪晶
(徐州医科大学附属医院消化内科,江苏 徐州 221002)
MBD2在老年胃癌中的表达及其对胃癌细胞多药耐药性的作用
韩雪晶
(徐州医科大学附属医院消化内科,江苏 徐州 221002)
目的 探讨甲基化CpG结合域蛋白质2(MBD2)在老年胃癌中的表达及其对胃癌细胞多药耐药性的作用。方法 采用免疫组化染色法检测70份老年胃癌组织及其相应的癌旁组织标本中的MBD2表达情况,并分析其表达水平与病理参数的关系。Western印迹检测MBD2在胃癌细胞系SCG7901及其耐药细胞系中的表达。使用MBD2的小干扰RNA静默MBD2表达后,通过MTT试验检测化疗药物顺铂、5-氟尿嘧啶对胃癌细胞的半数抑制浓度(IC50)。结果 MBD2在胃癌组织中阳性表达率为72.86%,明显低于相应的癌旁组织中的92.86%(P<0.01)。MBD2在胃癌组织中表达与TNM分期、远处转移相关;其中MBD2在TNM分期为Ⅰ期和Ⅱ期的患者中阳性表达率明显高于Ⅲ期和Ⅳ期患者(P<0.05)。SGC7901/阿霉素、GC7901/长春新碱中的MBD2/β-actin灰度比值明显低于其亲本细胞SGC7901(P<0.01)。SGC7901细胞和转染无关序列对照寡核苷酸的SGC7901细胞MBD2/β-actin比值之间差异无统计学意义(P>0.05);转染MBD2特异性小干扰RNA的SGC7901细胞中MBD2/β-actin比值明显低于上述两株对照组细胞(P<0.05)。转染MBD2特异性小干扰RNA的胃癌细胞对顺铂和5-氟尿嘧啶的IC50值均明显高于转染无关序列对照寡核苷酸的胃癌细胞(P<0.01)。结论 MBD2在老年胃癌组织中表达明显降低,与临床分期和远处转移有关,可抑制胃癌细胞的多药耐药性,说明MBD2表达失调参与了胃癌的发生、发展。
胃癌;甲基化CpG结合域蛋白质2;耐药性
目前胃癌治疗效果仍不理想,约40%的患者经化疗后出现耐药〔1,2〕。相关研究发现,肿瘤的多药耐药性不但与基因缺失、异位、突变有关,还与遗传学改变存在相关性〔3〕。DNA甲基化是表观遗传学的重要调控机制之一,抑癌基因启动子高甲基化是癌症发生的一个重要因素。甲基化CpG结合域蛋白质(MBD)家族是一类与甲基化CpG二核苷酸相互结合的核蛋白,MBD2作为其成员,可将DNA甲基化与组蛋白修饰有机的联合起来发挥枢纽作用,与细胞调控、肿瘤形成与发展有着紧密关系。相关研究显示,MBD2在肺癌,特别是非小细胞肺癌,以及卵巢癌、前列腺癌、结肠癌组织中发挥明显的转录静默作用,导致MBD2与mRNA表达水平明显低于正常组织〔4〕。本研究旨在了解MBD2在胃癌组织中的表达及其对胃癌细胞多药耐药性的作用。
1 资料与方法
1.1 一般资料 收集2014年1月至2016年1月间老年胃癌住院患者手术切除的胃癌及其相应的癌旁组织标本70份,其中男45例,女25例,年龄60~84岁;腺癌65例,未分化癌5例;TNM分期:1期3例、Ⅱ期27例、Ⅲ期34例、Ⅳ期6例;淋巴结转移65例、无淋巴结转移5例。人胃癌细胞系(SCG7901),人胃癌耐药细胞系(SGC7901/阿霉素、SGC7901/长春新碱)均购于上海慧颖生物科技有限公司。放于含10%胎牛血清的DMEM培养液中常规培养。
1.2 主要试剂 免疫组化检测中兔抗人MeCP2多克隆抗体购自北京普利莱基因技术有限公司,链霉菌生物素蛋白-过氧化物酶(SP)试剂盒、二氨基联苯胺(DAB)显色试剂盒购于北京百奥莱博科技有限公司。兔抗人MBD2多克隆抗体、辣根过氧化物酶(HRP)标记的羊抗鼠二抗购于艾博抗(上海)贸易有限公司,鼠抗人β-actin单克隆抗体、增强化学发光法(ECL)显影试剂盒购于美国Sigma公司。MBD2小干扰RNA及无序列队长寡核苷酸购于上海吉玛制药技术有限公司。
1.3 免疫组化检测MBD2在胃癌组织中表达 采用SP法,将胃癌组织常规脱蜡至水,常规抗原修复、山羊血清封闭后,依次孵育MBD2多克隆抗体和酶标记羊抗兔二抗。DAB显色,常规脱水、透明、封固。高倍镜视野下观察,进行阳性细胞比例评分:阳性细胞比例≤1%为0分,2%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;染色强度评分:无色为0分,浅棕黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞比例和染色强度评分的乘积为组织学评分:<4分为阴性,≥4分为阳性。
1.4 Western印迹检测MBD2在胃癌细胞系中表达 取对数生长中期的胃癌细胞SCG7901,以及人胃癌耐药细胞SGC7901/阿霉素、SGC7901/长春新碱,提取细胞总蛋白。常规方法将蛋白经SDS-PAGE分离后,湿法转移至NC膜。以兔抗人MBD2和鼠抗人β-actin为一抗行Western印迹检测。NC膜经ECL显影液孵育后,使用E-gel Imager凝胶成像系统检测,进行灰度分析,内参为β-actin,计算MBD2的相对表达量。
1.5 胃癌细胞的药物敏感性检测 使用MTT法检测胃癌细胞的药物IC50。对转染了MBD2特异性小干扰RNA或无序列队长寡核苷酸的胃癌细胞进行计数,铺于96孔板,每孔4 000个细胞。加入顺铂或5-氟尿嘧啶,设6个浓度梯度,每个浓度设3个复孔,置于37℃、5%的CO2培养箱中孵育3 d,避光加入终浓度为0.05 mg/L的MTT,20 μl/孔,置于37℃、5% CO2培养箱中孵育4 h,弃去细胞培养液,每孔加入200 μl DMSO,振荡溶解后,490 nm波长处测量吸光度值,计算药物对胃癌细胞的抑制率和IC50。
1.6 统计学方法 应用SPSS20.0软件行t检验,χ2检验。
2 结 果
2.1 MBD2在胃癌及其癌旁组织中的表达情况 免疫组化染色显色,MBD2在癌旁组织中呈明显阳性表达,在胃癌组织中阳性表达则较弱,MBD2在胃癌组织中阳性表达率为72.86%(51/70),明显低于相应的癌旁组织中的92.86%(65/70,χ2=15.192,P<0.01),见图1。
2.2 MBD2表达与临床病理参数的关系 MBD2在胃癌组织中表达与TNM分期、远传转移相关(P<0.05);其中MBD2在TNM分期为Ⅰ期和Ⅱ期的患者中阳性表达率为80.00%(24/30),明显高于Ⅲ期和Ⅳ期患者的67.50%(27/40),差异有统计学意义(P<0.05)。见表1。
2.3 MBD2在人胃癌细胞中的表达 SGC7901/阿霉素、SGC7901/长春新碱中的MBD2/β-actin灰度比值分别为(0.582 6±0.021 6)、(0.651 2±0.017 5),明显低于其亲本细胞SGC7901的(1.000±0.000;t=24.195、18.458;P<0.01)。SGC7901细胞和转染无关序列对照寡核苷酸的SGC7901细胞中的MBD2/β-actin比值分别为(1.000±0.000)、(0.894 5±0.053 8),组间比较差异无统计学意义(P>0.05);转染MBD2特异性小干扰RNA的SGC7901细胞中的MBD2/β-actin比值为(0.566 7±0.094 2),明显低于上述两株对照组细胞(t=5.056、6.935;P<0.05)。见图2,图3。
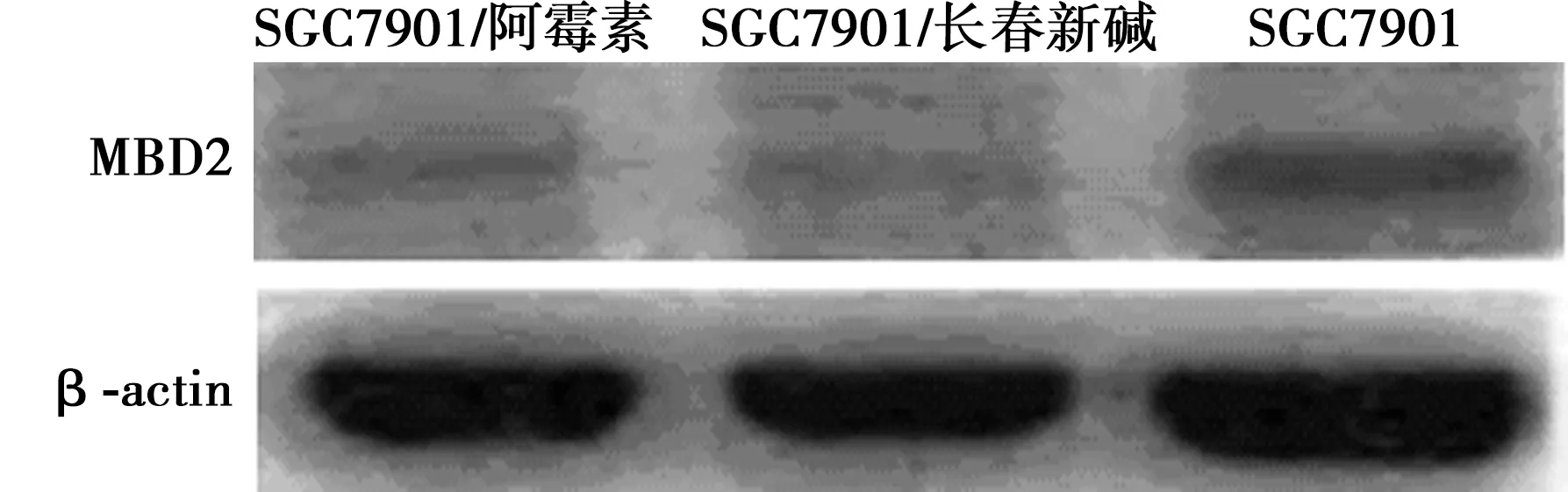
图2 MBD2在SGC7901及其耐药细胞中的表达

1为SGC7901;2为转染无关序列对照寡核苷酸的细胞表达;3为转染MBD2特异性小干扰RNA的SGC7901图3 MBD2在SGC7901细胞与转染MBD2特异性小干扰RNA或无关序列对照寡核苷酸的细胞中表达
2.4 MBD2表达降低对胃癌细胞耐药性的影响 转染MBD2特异性小干扰RNA的胃癌细胞对顺铂和5-氟尿嘧啶的IC50值分别为(2.384±0.153 7)μg/ml、(11.439±0.358 2)μg/ml,均明显高于转染无关序列对照寡核苷酸的胃癌细胞对顺铂和5-氟尿嘧啶的IC50值(8.552±0.171 2)μg/ml、(0.895±0.027 5)μg/ml(t=16.490、9.264;P<0.01)。
3 讨 论
肿瘤发生、发展过程中DNA甲基化是重要机制之一,多表现为大范围的低甲基化和局部的高甲基化〔5〕。MBD家族是一类与甲基化CpG二核苷酸相互结合的核蛋白,该家族成员中具有相同的MBD,其中MBD2可与DNA上单一对称的甲基化CpG相互结合,借助TRD和桥蛋白复合物、组蛋白乙酰化酶及其他共抑制子的相互作用,在甲基化位点处形成染色质结构,抑制转录因子与调控元件结合生成复合物〔6〕。研究已发现MBD2在肺癌、卵巢癌、前列腺癌、结肠癌组织中发挥明显的转录静默作用,导致MBD2与mRNA表达水平明显低于正常组织,但关于MBD2与胃癌关系的研究报道仍十分少见。
本次研究说明表达缺失或抑制是MBD2在胃癌组织中表达失调的主要形式。随胃癌病情的进展MBD2表达水平有下降趋势,提示MBD2表达抑制可能参与胃癌病情的发展。MBD2虽然与淋巴结转移无关,但与胃癌远处转移存在明显关联,在远处转移的胃癌组织中有更多的MBD2表达,该结果与相关研究中MBD2在雌二醇受体阳性的乳腺癌中表达水平明显高于阴性的报道相似〔7〕。提示MBD2不能简单地归结为肿瘤抑制分子。
化学治疗是目前胃癌治疗的主要手段之一,术前新辅助化疗可有效促使肿瘤降期,术后化疗可清除剩余的癌细胞和转移灶。然而肿瘤的多药耐药性严重制约了化疗的效果。相关研究认为,多种分子基因表达失调在多药耐药性产生中起到调控作用〔8〕。本次研究显示,MBD2在胃癌耐药细胞中表达水平明显低于亲本细胞,使用小干扰RNA降低其表达水平可有效提升胃癌细胞对顺铂、5-氟尿嘧啶的耐受性,说明MBD2可抑制胃癌细胞的多药耐药性。在胃癌病情发展过程中,MBD2的表达逐渐被抑制,有利于癌细胞获得多药耐药性的特性,导致恶性表型不断增强。
1 金红顺,徐 红,王 京,等.老年胃癌的诊疗研究进展〔J〕.中国老年学杂志,2016;36(7):1773-4.
2 董 倩,陈 虎.顺铂联合热疗对人胃癌耐药细胞增殖及耐药相关基因Survivin表达的影响〔J〕.中国老年学杂志,2013;33(13):3029-31.
3 Chen HY,Zhu BH,Zhang CH,etal.High CpG island methylator phenotype is associated with lymph node metastasis and prognosis in gastric cancer〔J〕.Cancer Sci,2012;103(1):73-9.
4 黄建军,戈立东,周秀田,等.MiR-222与MBD2在结肠癌组织中的表达及其临床意义〔J〕.中国癌症杂志,2012;22(1):21-4.
5 Tahara T,Shibata T,Arisawa T,etal.CpG island promoter methylation (CIHM) status of tumor suppressor genes correlates with morphological appearances of gastric cancer〔J〕.Anticancer Res,2010;30(1):239-44.
6 蒋 蕾.3.0TMRI与多层螺旋CT区分胃癌术前分期的准确性比较〔J〕.中国卫生工程学,2016;15(5):513-5.
7 Joo MK,Kim KH,Park JJ,etal.CpG island promoter hypermethylation of Ras association domain family 1A gene contributes to gastric carcinogenesis〔J〕.Mol Med Rep,2015;11(4):3039-46.
8 杨丛莲.奥沙利铂黄芩素联合应用对胃癌细胞抑制作用的影响研究〔J〕.北华大学学报(自然科学版),2016;7(5):640-3.
〔2016-07-17修回〕
(编辑 袁左鸣)
韩雪晶(1976-),女,硕士,副主任医师,主要从事消化道肿瘤基础与临床研究。
R735.2
A
1005-9202(2017)07-1666-03;
10.3969/j.issn.1005-9202.2017.07.042
