梨头草提取物对四氯化碳致小鼠急性肝损伤的修复作用
2017-04-20郭玉成赵静怡李建会郎桂森
张 雷 郭玉成 石 鑫 赵静怡 李建会 杨 阔 郎桂森
(承德医学院,河北 承德 067000)
梨头草提取物对四氯化碳致小鼠急性肝损伤的修复作用
张 雷 郭玉成 石 鑫 赵静怡 李建会 杨 阔 郎桂森1
(承德医学院,河北 承德 067000)
目的 探讨犁头草提取物对四氯化碳(CCl4)诱导大鼠急性肝损伤的修复效果和抗氧化作用。方法 体外抗氧化评价主要考察对DPPH、ABTS、羟自由基以及还原力的清除率,利用CCl4诱导昆明小鼠肝损伤后,以不同剂量的犁头草提取物灌胃7 d并且测定血清中天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、丙氨酸转氨酶(ALT)、谷氨酰转肽酶(GGT)、总胆红素(TB)和肝肾组织中的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽(GSH)以及丙二醛(MDA)等指标,HE 染色观察肝脏病理组织学变化。结果 体外抗氧化实验证明犁头草提取物具有较强的抗氧化效果,各剂量组均能降低CCl4致小鼠急性肝损伤血AST、ALP、ALT、GGT和TB的升高,降低肝肾中MDA含量,增强 SOD、CAT和GSH活性,减轻 CCl4对肝组织的病理损伤。结论 犁头草提取物对 CCl4致小鼠急性肝损伤具有一定的保护作用。
犁头草;护肝;抗氧化
犁头草属于堇菜科堇菜属草本植物,为一种侗族民间常用中药,主要分布华中及华南各省,多生于山坡林边、 溪边或荒山草地中〔1〕。在民间常用于清热解毒,除脓消炎、治痈疽、外伤感染、瘰疬、疮疡、扁桃体炎、疮疡等症。现代药理实验表明,犁头草还具有抗金黄色葡萄糖球菌及治疗急慢性骨髓炎等多种药理作用〔2,3〕,在民间常用来治疗肝病,但相关报道甚少。本实验采用体外抗氧化和体内抗氧化实验,结合四氯化碳(CCl4)致小鼠急性化学性肝损伤模型,观察犁头草提取物保护急性肝损伤和抗氧化的作用。
1 材料与方法
1.1 材料与试剂 犁头草采购于江苏省恒顺大药房,鉴定为堇菜科堇菜属植物犁头草的干燥全草。种在40℃~50℃烘干后用中药粉碎机粉碎过60目筛。清洁级健康KM小白鼠,雄性体质量(20±2)g,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证号SCKK(京)2012-0001,分笼饲养,饲料充足饮水不限,室温20℃~25℃,适应环境5 d后用于实验。谷氨酰转肽酶(GGT)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、总胆红素(TB),过氧化氢酶(CAT),丙二醛(MDA)测试盒购自西安臻品生物制品有限公司。其他试剂均为分析纯。
1.2 仪器与设备 Infinite M200TECAN 酶标仪(瑞士TECAN集团公司);AL104电子天平(Mettler-Toledo仪器公司);RE-52AA旋转蒸发仪(上海亚荣生化仪器厂);CTXNW-10B超声波循环提取机(北京弘祥生物技术开发公司);DU-800紫外扫描分光光度计(美国贝克曼库尔特公司)。
1.3 实验方法
1.3.1 犁头草提取物的提取 称取干燥草全草5 kg,用65%乙醇浸泡24 h后利用循环超声波提取仪提取45 min,减压浓缩回收乙醇得水溶液,上D-101大孔树脂,先用20%的乙醇洗脱去除杂质,再用60%的乙醇洗脱,得总黄酮的乙醇溶液,减压浓缩回收乙醇后烘干粉碎得犁头草提取物粉末。
1.3.2 犁头草提取物体外抗氧化分析
1.3.2.1 犁头草提取物对DPPH自由基的清除率 参照文献〔4〕将样品用甲醇配制成一系列浓度(50~300 μg/ml);加入提前配制的DPPH溶液(13 mg DPPH自由基甲醇定容至25 ml,避光放置)。分别用不同浓度的样品溶液 0.1 ml加入3.5 ml DPPH 甲醇溶液,振摇混匀后置于暗室中静30 min,在 517 nm波长处测定吸光度,维生素C(VC)为对照,每份样品平行操作3次,计算公式:清除率(%)=〔(AC-AS)/AC〕× 100%。式中AC为3.5 ml DPPH溶液与0.1 ml甲醇混合后的吸光度,AS为3.5 ml DPPH 溶液与0.1 ml样品溶液混合后的吸光度。
1.3.2.2 犁头草提取物对ABTS自由基的清除率 按照文献〔5〕将等量的7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾水溶液混合,避光放置 12~16 h。用无水乙醇将该溶液稀释至734 nm波长处的吸光度为(0.7±0.02),得到 ABTS 工作液。将样品用甲醇配制成一系列浓度(25~150 μg/ml),取0.15 ml样品加入2.85 ml ABTS自由基工作液,混合30 min后测定517 nm处吸光度,VC为对照,计算公式为:清除率(%)=〔(AC-AS)/AC〕×100%。式中AC为2.85 ml ABTS溶液与0.15 ml甲醇混合后的吸光度,AS为2.85 ml ABTS溶液与0.15 ml样品混合后的吸光度。
1.3.2.3 犁头草提取物对羟自由基的清除率 利用犁头草提取物清除羟基自由基能力的强弱来测定其抗氧化性的大小,参照文献〔6〕方法加以适当改进。将犁头草提取物配制成不同质量浓度(125~500 μg/ml)的样品溶液,依次加入1 ml样品、1 ml 9 mmol/L水杨酸-乙醇溶液和1 ml 9 mmol/L FeSO4溶液和1 ml 8.8 mmol/L的 H2O2溶液,混匀后于37℃恒温水浴30 min,测510 nm处吸光度。VC为对照,每份样品平行操作 3次。羟自由基清除能力由以下公式计算:清除率(%)=〔(AS-AJ)/(AC-AJ)〕×100%。式中,AS为加入样品的反应溶液吸光值,AJ为用水代替样品的溶液吸光值,AC为用水代替样品和H2O2的溶液吸光值。
1.3.2.4 犁头草提取物还原能力的测定 参照文献〔7〕将样品液配制成一系列的浓度(50~200 μg/ml),分别取1.0 ml,加入0.2 mol/L磷酸盐缓冲液(pH6.8)1 ml和1%的铁氰化钾溶液1 ml,充分混合以后,立即放入在50℃下保温20 min,取出立即冷却至室温,加入4.0 ml 10%三氯乙酸充分混合后终止反应。吸取反应液4.0 ml,加入蒸馏水2 ml和0.5 ml 0.1% FeCl3溶液,混合均匀,暗室反应30 min后在700 nm波长处比色,VC为对照。
1.3.3 犁头草提取物对CCl4诱导肝损伤的修复效果
1.3.3.1 肝损伤模型的建立和处理 昆明小白鼠60只,随机分成 6 组:正常对照组(在治疗期间喂养10 ml/kg体重0.3%的羧甲基纤维素钠);肝损伤模型组(给予10 ml/kg体重0.3%的羧甲基纤维素钠);水飞蓟素组(给予100 mg/kg体重的水飞蓟素);犁头草提取物低、中、高剂量组(分别给予100、200和400 mg/kg体重的犁头草提取物)。每天灌胃1次,连续6 d,末次给药2 h 后,除正常对照组按5 ml/kg体重腹腔注射体积分数为 6%的 CCl4橄榄油溶液1次,禁食不禁水24 h后,麻醉后眼眶取血,小鼠血样4℃ 3 500 r/min离心10 min后取血清。麻醉处死小鼠,剖腹取出肝脏和肾脏于冷的生理盐水中洗净血液备用;另外剪肝小叶置于10%甲醛中固定,待病理检测。
1.3.3.2 生化指标的测定 自动生化分析仪检测血清 ALT、AST、ALP、GGT和TB 的活性,分别取肝、肾组织加入生理盐水于冰浴中制成组织匀浆,离心后取上清液按试剂盒说明测定SOD、CAT、GSH和MDA的含量。
1.3.3.3 肝脏组织的病理切片观察 取小鼠右叶相同位置肝组织,用4℃生理盐水冲洗后,滤纸拭干,浸泡于10%中性甲醛溶液中固定,石蜡包埋,常规切片,苏木素-伊红(HE)染色,光学显微镜下观察肝组织切片的病理变化。
1.4 统计学方法 应用SPSS16.0软件进行方差分析和t检验。
2 结 果
2.1 犁头草提取物的体外抗氧化效果 犁头草提取物对DPPH的清除率呈剂量依赖性,同样,对ABTS的清除效果、对羟自由基同样表现出明显的清除率,在浓度30~150 μg/ml范围内,还原力也是浓度依赖性,虽然犁头草提取物对以上自由基的清除效果和还原力不如VC,但是依然体现出了较强的体外抗氧化能力。见图1。
2.2 犁头草提取物对CCl4致小鼠急性肝损伤模型血清中ALP、AST、ALT、GGT和TB的影响 与正常对照组比较,模型组小鼠血清中的ALP、ALT、ASP、GGT、TB的含量升高(P<0.001),经水飞蓟素和犁头草提取物治疗后,大鼠血清ALP、ALT、ASP、GGT和TB含量均有明显降低(P<0.01或P<0.001),见表1。

图1 犁头草提取物的体外抗氧化效果
2.3 犁头草提取物对CCl4致小鼠急性肝损伤模型肝和肾组织中SOD、CAT、GSH和MDA的影响 与正常对照组比较,模型组鼠肝肾组织SOD、CAT和GSH显著降低(P<0.001),而MDA的含量显著提高(P<0.001),与模型组比较,水飞蓟素和不同剂量犁头草提取物组小鼠,肝肾组织SOD、CAT和GSH显著升高(P<0.001或P<0.01),而MDA的含量显著降低(P<0.001或P<0.01)。见表2。
2.4 犁头草提取物对CCl4致小鼠急性肝损伤模型小鼠的肝组织病理形态学的影响 正常对照组小鼠肝脏的肝小叶结构正常,肝细胞围绕中央静脉,成辐射状排列,小叶间血管和胆管清晰,肝细胞无变形、坏死等损伤性改变;模型组小鼠肝结构紊乱,肝细胞出现严重的水样变性或脂肪变性,甚至坏死,伴炎症细胞浸润;水飞蓟素组小鼠肝小叶结构基本正常,但肝细胞排列紊乱,可见少量肝细胞水样变性或脂肪变性,偶见坏死,伴炎症细胞浸润;与模型组比较,犁头草提取物各剂量组明显改善小鼠肝小叶结构,不同程度地减少 CCl4诱导肝损伤中肝细胞中的炎性细胞浸润、水肿和坏死等,见图2。

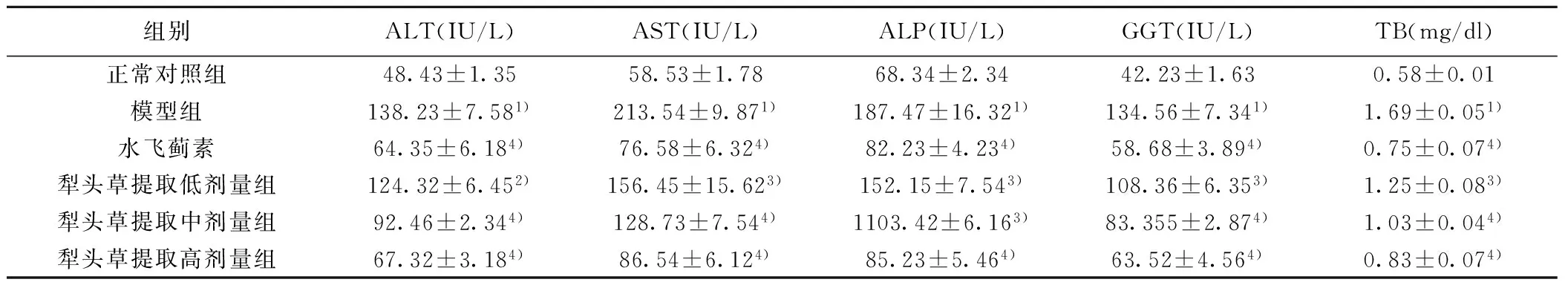
组别ALT(IU/L)AST(IU/L)ALP(IU/L)GGT(IU/L)TB(mg/dl)正常对照组48.43±1.3558.53±1.7868.34±2.3442.23±1.630.58±0.01模型组138.23±7.581)213.54±9.871)187.47±16.321)134.56±7.341)1.69±0.051)水飞蓟素64.35±6.184)76.58±6.324)82.23±4.234)58.68±3.894)0.75±0.074)犁头草提取低剂量组124.32±6.452)156.45±15.623)152.15±7.543)108.36±6.353)1.25±0.083)犁头草提取中剂量组92.46±2.344)128.73±7.544)1103.42±6.163)83.355±2.874)1.03±0.044)犁头草提取高剂量组67.32±3.184)86.54±6.124)85.23±5.464)63.52±4.564)0.83±0.074)
与正常对照组比较:1)P<0.001;与模型组比较:2)P<0.05,3)P<0.01,4)P<0.001;下表同


组别肝脏组织SOD(U/mg)CAT(U/mg)MDA(nmol/mg)GSH(mg/g)肾脏组织SOD(U/mg)CAT(U/mg)MDA(nmol/mg)GSH(mg/g)正常对照组285.15±5.4568.53±2.161.47±0.049.18±0.25234.65±3.6558.65±1.652.25±0.058.56±0.35模型组179.25±10.861)32.53±3.181)3.52±0.201)3.76±0.181)125.68±6.341)19.05±4.341)4.35±0.151)3.65±0.081)水飞蓟素组241.54±5.872)61.25±2.354)1.64±0.094)8.72±0.344)206.98±4.613)42.65±2.784)2.65±0.084)7.34±0.324)犁头草提取物低剂量组208.07±9.253)42.14±1.082)2.87±0.082)4.23±0.162)138.65±10.352)26.34±4.352)4.13±0.163)4.12±0.081)犁头草提取物中剂量组234.04±6.323)51.35±2.073)2.18±0.053)6.65±0.313)174.31±12.054)31.65±4.164)3.42±0.084)5.86±0.232)犁头草提取物高剂量组258.45±8.164)60.25±3.074)1.75±0.044)7.89±0.154)198.61±7.534)38.34±4.054)2.95±0.074)7.34±0.084)
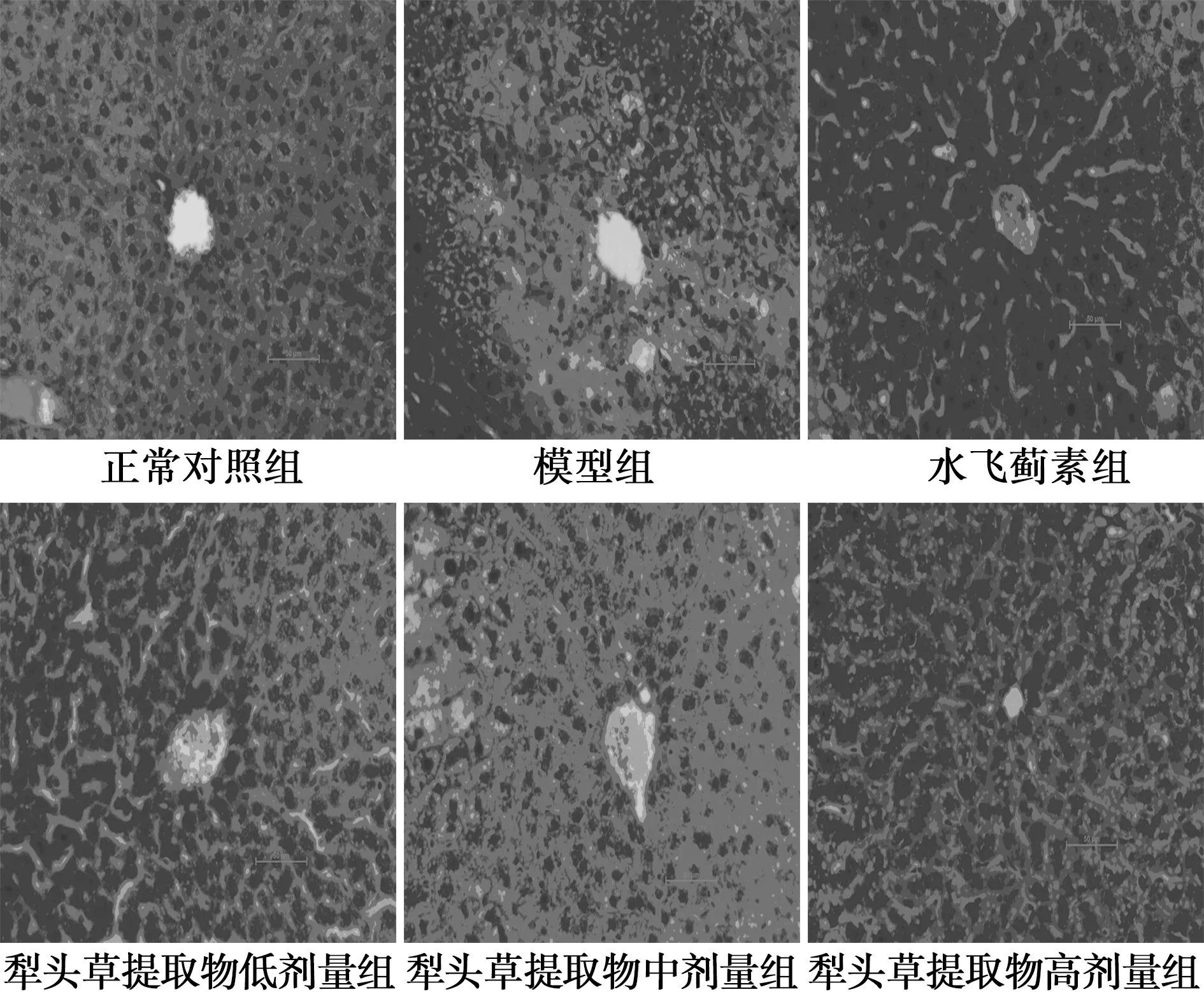
图2 各组小鼠肝组织病理切片(HE,×200)
3 讨 论
CCl4是典型的致急性肝损伤物质,高活性的代谢产物直接或间接导致的肝细胞脂质过氧化作用,导致许多活性物质如各种转氨酶和磷酸酶就会从肝脏逸出〔8〕。肝细胞出现严重的水样变性或脂肪变性,甚至坏死,伴炎症细胞浸润有关,从病理学观察可以得到验证〔9〕。CCl4经肝脏微粒体混合功能氧化酶系统作用后,生成三氯甲基游离基(·CCl3),·CCl3基的反应非常迅速,与氧反应生成CCl3OO·〔10〕。这些自由基与蛋白质和脂类反应除去氢原子的不饱和脂质从而引发脂质过氧化,导致细胞膜和肝组织损伤的完整性的损失〔8〕。GSH、SOD和CAT为关键抗氧化酶,防止氧化损伤〔11〕。SOD转化为H2O2和O2,从而参与其他抗氧化酶对氧的毒性,在酶促防御中,CAT是抗氧化防御系统的关键组成部分。这种保护机制的灵敏度增强的结果会抑制自由基诱导细胞的损伤。CAT的减少可能会导致许多有害的影响〔12〕。GSH是另一个抗氧化的参数,在肝脏和肾脏的氧化损伤中,GSH是对抗自由基的第一道防线。在CCl4处理的大鼠中,肝GSH活性降低表明对肝细胞的损害程度。MDA 是自由基攻击生物膜中的多不饱和脂肪酸而引发的脂质过氧化作用的最终分解产物,其含量的多少可反映组织细胞的脂质过氧化速率或强度〔13〕。MDA 含量异常增高会引起细胞损伤。本研究表明利用CCl4致昆明小鼠损伤后,小鼠的肝和肾组织中SOD、CAT和GSH明显降低,MDA的含量明显增加,通过犁头草提取物不同剂量的治疗,肝肾组织中的SOD、CAT和GSH的含量都明显提高,而MDA的含量明显降低。
综上所述,犁头草提取物对 CCl4诱导小鼠肝损伤具有保护作用,且具有结构特异性,其保护机制可能与清除自由基,减轻脂质过氧化,保护肝细胞膜结构和功能的完整性;提高肝细胞内SOD、CAT、GSH活性,增强机体抗氧化能力。
1 范青生,肖小年.我国抗菌植物资源研究与开发利用〔J〕.自然资源,1995;16(6):20-48.
2 郑晓辉,沈泽培,黄 枫.犁头草治疗化脓性关节炎〔J〕.中医药学刊,2005;23(8):1516-8.
3 郑民实,罗思齐.中草药抗HBsAg的实验研究〔J〕.微生物杂志,1987;12(4):1-5.
4 Lee YL,Yen MT,Mau JL.Antioxidant properties of various extracts from Hypsizigus marmoreus〔J〕.Food Chem,2007;104(1):1-9.
5 Wu LC,Hsu HW,Chen YC,etal.Antioxidant and antiproliferative activities of red pitaya〔J〕.Food Chem,2006;95:319-27.
6 Tsai SY,Hhuang SJ,Mau JL.Antioxidant properties of hot water extracts from Agrocybe cylindracea〔J〕.Food Chem,2006;98(4):670-7.
7 杨江涛,杨 娟,谢 红,等.刺梨多糖粗品与纯品体外抗氧化作业〔J〕.食品工业科技,2008;29(2):94-6.
8 鞠 洋,骆 勤,党月兰.红毛五加多糖对四氯化碳肝损伤大鼠的保护作用〔J〕.中药药理与临床,2005;21(3):25-6.
9 Singh N,Kamath V,Narasimhamurthy K,etal.Protective effects of potato peel extract against carbon tetrachloride-induced liver injury in rats〔J〕.Environ Toxicol Pharmacol,2008;26(2):241-6.
10 Recknagel RO.A new direction in the study of carbon tetrachloride hepatotoxicity〔J〕.Life Sci,1983;33(5):401-8.
11 Halliwell B,Gutteridge JMC.Role of free radicals and catalytic metal irons in human disease:an overview〔J〕.Method Enzymol,1990;186(2):59-85.
12 Ohkawa H,Ohishi N,Yagi K.Assay of lipid peroxides in animal tissues by thiobarbituric acid reaction〔J〕.Anal Biochem,1979;95(17):241-3.
13 Weber LWD,Boll M,Stampfl A.Hepatotoxicity and mechanism of action of haloalkanes:carbon tetrachloride as a toxicological model〔J〕.Crit Rev Toxicol,2003;33(2):105-36.
〔2015-08-05修回〕
(编辑 苑云杰/曹梦园)
河北省自然科学基金项目(C2009001007)
1 河北省滦平中医院
张 雷(1976-),男,硕士,副教授,主要从事医学教育研究。
R285
A
1005-9202(2017)07-1605-03;
10.3969/j.issn.1005-9202.2017.07.016
