川芎嗪抑制大鼠脑缺血再灌注损伤的机制
2017-04-20李鹏飞沈梅红吴锦萍张春兵
李鹏飞 沈梅红 吴锦萍 张春兵
(南京中医药大学附属医院检验科,江苏 南京 210029)
·基础研究·
川芎嗪抑制大鼠脑缺血再灌注损伤的机制
李鹏飞 沈梅红1吴锦萍2张春兵2
(南京中医药大学附属医院检验科,江苏 南京 210029)
目的 探讨川芎嗪(TMP)抑制脑缺血再灌注损伤(CIRI)的分子机制。方法 选择清洁级健康成年雄性SD大鼠,采用改良的Zea Longa栓线法构建大脑中动脉梗塞(MCAO)模型,并将大鼠随机分为三组(n=20):假手术组、模型组、TMP治疗组。假手术组大鼠不插入线栓,其余操作均同模型组;TMP治疗组大鼠在被拔出线栓再灌注时,腹腔注射TMP 20 mg/kg。再灌注24 h后,各组大鼠进行神经功能评分,然后麻醉处死,取材检测。干湿称重法检测大鼠脑组织含水量;2,3,5-三苯基氮化四氮唑(TTC)染色法检测大鼠脑梗死面积,HE染色观察脑组织形态;荧光定量PCR检测大鼠梗死侧脑皮层中miR-199a-5p、Bax、Bcl-2、肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6 mRNA的表达水平;酶联免疫法检测大鼠血清中炎症介质TNF-α、IL-1β和IL-6的含量;免疫组化法观察大鼠梗死侧脑皮质核转录因子(NF)-κB p65及磷酸化NF-κB p65(NF-κB p-p65)的表达。结果 TMP治疗可显著改善神经缺陷评分(P<0.05),降低脑组织含水量(P<0.05),减少梗死体积(P<0.01),减轻脑组织破坏。模型组miR-199a-5p、Bax、TNF-α、IL-1β和IL-6 mRNA的表达明显升高(P<0.05),而Bcl-2 mRNA表达水平显著降低(P<0.05)。而TMP治疗可显著降低miR-199a-5p、Bax、TNF-α、IL-1β和IL-6 mRNA的表达水平(P<0.05),增加Bcl-2 mRNA的表达(P<0.05)。与模型组比较,TMP治疗组大鼠脑皮质和血清中TNF-α、IL-1β和IL-6炎症因子含量均显著降低(P<0.05)。IHC结果显示,TMP治疗组中NF-κB p-p65阳性细胞数明显减少(P<0.05)。结论 TMP可减轻CIRI,其机制可能为抑制miR-199a-5p的表达,减少凋亡,降低炎症反应,且可降低NF-κB的活化。
川芎嗪;脑缺血再灌注损伤;凋亡;炎症
在脑缺血过程中,由于营养物质的急剧缺乏以及氧供不足可导致神经死亡。脑缺血后血流的恢复在某些情况下反而会导致进一步的组织损伤和功能障碍,这种恢复血流灌注后的有害情况称为脑缺血再灌注损伤(CIRI)〔1~3〕。我们前期综述发现,中药有效成分可以多层次地多靶向抑制CIRI〔4〕,其中,川芎被称为血中之气药,具有活血行气、消散淤血、祛风止痛之功效,其主要活性成分为川芎嗪(TMP),学名2,3,5,6-四甲基吡嗪。TMP在临床上广泛应用于治疗和预防缺血性心脑血管性疾病〔5〕。有研究表明,TMP具有多种药学性能如抗炎、钙拮抗、清除氧自由基及抗氧化损伤等〔6~8〕。微小核糖核酸(miRNA)表达紊乱是缺血性脑卒中(IS)发生发展的重要原因〔7〕。本课题组前期研究发现急性IS患者外周血血清中miRNAs的表达与健康人群有显著差异,且这些miRNAs在CIRI中扮演重要的角色〔8〕。有文献报道miR-199a-5p特异表达于神经组织中〔9〕,并参与神经再生、神经突起、突触可塑性等重要环节〔10〕。最新研究发现,TMP能改善脊髓损伤功能修复,降低神经凋亡,主要是通过miRNA发挥作用〔11,12〕。本文将探讨TMP减轻CIRI是否与miR-199a-5p有关。
1 材料与方法
1.1 实验药品与试剂 盐酸川芎嗪注射液购自无锡市第七制药厂;栓线购自北京沙东生物科技有限公司;2,3,5-三苯基氯化四氮唑(TTC)购自美国Amresco公司;10%水合氯醛购自上海国药集团化学试剂有限公司;PrimescriptTM RT-PCR Kit反转录试剂盒购自大连宝生物公司;TRIzol购自上海Invitrogen公司;mRNA、miRNA荧光定量检测试剂盒购自瑞士Roche公司;兔抗大鼠核转录因子(NF)-κB p65、磷酸化NF-κB p-p65(NF-κB p-p65)、辣根过氧化物酶标记的山羊抗兔抗体购自美国Abcam公司;大鼠白细胞介素(IL)1-β、IL-6、肿瘤坏死因子(TNF)-α ELISA检测试剂盒购自南京凯基生物公司。
1.2 实验动物分组及处理 选择清洁级健康雄性SD大鼠,体重(280±20)g,由北京维通利华动物实验有限公司〔许可证号SCXK(京)2012-0001〕提供。所有大鼠饲养于SPF级动物饲养环境〔12 h/12 h昼夜节律、(22±2)℃室温、50%~60%湿度、通风良好〕,适应性饲养1 w,大鼠自由摄食与饮水。术前大鼠禁食12 h,可自由饮水。采用随机数字表法分为假手术组、模型组、TMP治疗组。假手术组:大鼠所有操作与模型组大鼠一致,但是不用插入线栓。模型组:大鼠所有操作如下1.3所示,脑缺血2 h,再灌注24 h。TMP治疗组:大鼠线栓拔出,再灌注时腹腔注射TMP 20 mg/kg。
1.3 大鼠局灶性CIRI模型的建立 采用Zea Longa改良栓线法〔13〕。 SD大鼠用10%水合氯醛(0.35 ml/100 g体重)腹腔注射麻醉,仰卧固定。颈部正中切开皮肤,钝性分离右侧颈总动脉、颈外动脉、颈内动脉,仔细分离避免损伤迷走神经。由颈外动脉远心端结扎颈外动脉,用微型动脉夹夹住颈总动脉近心端及颈内动脉,在靠近颈总动脉分叉处用眼科剪在颈外动脉上剪一小口,将直径0.23~0.26 mm钓鱼线用线香烧成小球的一端沿小切口插入颈外动脉,剪断颈外动脉远心端,将颈外动脉反向拉直,使其与颈内动脉处于同一直线上,移去颈内动脉的动脉夹,经颈总动脉分叉处将鱼线缓慢向颈内动脉入颅脑内的方向推进约(18±0.5)mm,微遇阻力时停止,使鱼线头端到达较细的大脑中动脉起始处。缚紧预先放置于穿刺小切口处的丝线,缝合,消毒,缺血2 h后拔出栓线,建立CIRI模型。假手术组大鼠只分离暴露颈总动脉、颈外动脉、颈内动脉,结扎颈外动脉。所有大鼠在术前禁食12 h,自由饮水。
1.4 神经功能缺陷评分 使用Zea Longa五分评分标准(1989年)〔13〕,在大鼠拔出线栓后初步判断模型是否成功。对各组大鼠进行神经功能评分:0分,正常,无神经学征象;1分,出现Honer征;2分,拎起大鼠尾巴时大鼠左前肢不能伸展;3分,一侧肢体不完全瘫痪,大鼠向左侧转圈;4分,一侧肢体完全瘫痪,大鼠向左侧倾倒;5分,死亡。其中神经功能评分≥2分者纳入实验组,评分为0分或是5分者剔除。
1.5 大鼠脑梗死面积计算 各组大鼠(n=5)经10%水合氯醛腹腔注射麻醉后迅速断头取脑,去除嗅球、小脑等其他组织。取出脑组织后,置于-20℃冰冻15 min。将大脑沿冠状面切成5等份脑片,置于2%的TTC生理盐水溶液中37℃避光孵育30 min,10%甲醛中性缓冲液(pH7.4)固定过夜。TTC染色后,正常脑组织呈玫红色,梗死组织呈白色。使用微距相机拍摄,Image J图像分析软件计算并统计各组大鼠脑梗死面积百分比。计算公式:脑梗死面积百分比=梗死灶面积/全脑面积×100%。
1.6 大鼠脑含水量测定 实验动物再灌注24 h后,每组各取5只断头取脑,滤纸吸尽表面血渍后锐性刀片分离左右半球,将损伤侧半球的脑组织用电子分析天平称其湿重后置于106℃恒温干燥箱内持续干燥24 h后称其干重,脑组织含水量(%)=(湿重-干重)/湿重×100%。
1.7 苏木素-伊红(HE)染色检查脑组织病理学改变 每组大鼠(n=5)经10%水合氯醛腹腔麻醉后,迅速经左心室依次使用0.9%氯化钠盐溶液250 ml和250 ml 4%多聚甲醛溶液灌注固定到大鼠身体发僵后,迅速断头取出脑组织标本。脑组织标本保存于4℃的10%中性甲醛溶液中。24 h后依次经脱水、透明、石蜡包埋,由切片机连续切取6 μm的冠状脑组织切片,后经过脱蜡、HE染色等步骤后,置于Olympus BX50生物光学显微镜(×400)下随机选取5个视野观察形态学变化。
1.8 免疫组织化学染色检查脑皮质NF-κB p65、NF-κB p-p65的表达 将包埋好的石蜡块置于石蜡切片机,将蜡块由前向后作大脑冠状切片,每片厚5 μm,收集脑片。选择完好脑片贴于已涂有多聚赖氨酸的载玻片上,晾干使脑片紧贴,以防脱片。每只动物取1张脑切片进行免疫组织化学染色,按免疫组化测试盒操作说明进行操作。光学显微镜观察大鼠缺血侧脑皮质,并用Olympus显微图像获取系统400×拍摄图像。每张切片随机观察5个不同视野,计算5个视野中总的阳性细胞数,即为该动物的阳性细胞数。采用南京大学捷达软件公司图像分析系统测定视野中阳性细胞的平均灰度、平均光密度,计算积分光密度值(IOD),以评估阳性细胞中的蛋白含量变化。
1.9 实时定量PCR检测Bax、Bcl-2、TNF-α、IL-6、IL-1β mRNA以及miR-199a-5p的表达 大鼠在10%水合氯醛麻醉下,快速断头取脑,迅速浸于冰磷酸盐缓冲液(PBS)中洗去表面血液。将取出的大脑置于滤纸上(滤纸置于冰上),用手术剪取脑皮质层装入eppendorf管,立即置于液氮。采用Trizol法提取各组总RNA,使用核酸蛋白检测仪测定RNA浓度并利用琼脂糖凝胶电泳检测提取的总RNA的完整性后,逆转录成cDNA。
mRNA逆转录反应体系(20 μl):5×PrimescriptTM缓冲液4 μl,PrimescriptTM RT Enzyme Mix I 1 μl,Oligo dT Primer 1 μl,Random 6 mers 4 μl,总RNA RNase Free H2O 10 μl。逆转录反应条件:37℃ 15 min,85℃ 5 min,4℃ 5 min。使用Roche公司荧光定量检测试剂盒,按照试剂说明书进行实时定量PCR。 PCR反应体系(20 μl):2×荧光定量探针法反应预混液 10 μl,20×探针和扩增引物预混液1 μl,模板cDNA 1 μl,RNase Free H2O 8 μl。反应条件:95℃预变性10 min;95℃变性15 s,60℃退火、延伸1 min,扩增40个循环;在退火、延伸步骤中采集荧光信号。β-actin作为内参。
MiR-199a-5p的逆转录条件(20 μl体系):5×PrimescriptTM缓冲液4 μl,PrimescriptTM RT Enzyme Mix 1 μl,miRNA RT Primer 1 μl,RNase Free H2O和总RNA 14 μl;反应条件:16℃ 30 min,42℃ 30 min,85℃ 5 min,4℃ 5 min。使用Roche公司荧光定量检测试剂盒,按照试剂说明书进行实时定量PCR。PCR反应体系(20 μl):2×荧光定量探针法反应预混液10 μl,20×探针和扩增引物预混液1 μl,模板cDNA 1 μl,RNase Free H2O 8 μl;反应条件:95℃预变性10 min;95℃变性15 s,60℃退火、延伸1 min,扩增40个循环。在退火、延伸步骤中采集荧光信号,U6 snRNA作为内参,所有结果重复三次。结果分析用十二烷基硫酸钠(SDS)software version 2.0,分析条件设置:根据分析后图像调节Baseline的start值、stop值以及Threshold的Value值,在analysis菜单下选择analyze自动分析结果。采用相对定量法(2-ΔΔCT)计算各目的分子的相对表达量。
1.10 ELISA检测炎性因子TNF-α、IL-6、IL-1β的含量 各组大鼠再灌注24 h后,各取5只迅速断头取脑,留取血液,室温下放置2 h后,3 000 r/min离心20 min,去上清,-80℃保存。血清TNF-α、IL-1β 和IL-6 含量的测定按照ELISA 试剂盒说明书进行操作。
1.11 统计学方法 采用Graphpad Prism 5.0软件,组间比较用单因素方差分析或独立样本t检验。
2 结 果
2.1 TMP对大鼠神经功能评分的影响 模型大鼠24 h再灌注后,其神经功能缺陷评分明显增加(3.00±0.89,假手术组为1.00±0.00,P<0.001);TMP治疗后,可以显著改善模型大鼠神经功能(1.83±0.75,P<0.05)。
2.2 TMP对大鼠脑梗死体积的影响 与模型组脑梗死体积〔(35.50±1.68)%〕比较,TMP治疗组脑梗死体积〔(26.04±1.36)%〕显著下降25.61%(P<0.01)。
2.3 TMP对大鼠脑组织含水量的影响 脑组织含水量分别为:假手术组(79.24±0.419)%、模型组(82.25±1.640)%、TMP治疗组(80.30±1.286)%。与假手术组相比,模型组脑组织含水量显著升高(P<0.01),而经TMP治疗后大鼠脑组织含水量显著改善(P<0.05)。
2.4 TMP对大鼠脑组织形态的影响 脑组织HE染色结果显示:神经细胞质染色呈淡红色,胞核染色呈紫蓝色。假手术组大鼠脑组织形态结构正常,可见神经锥体细胞数量多,胞质丰富,细胞核大而圆,未见病理性损伤。模型组大鼠脑组织神经细胞缩小变形,细胞核固缩深染,核固缩呈三角形或不规则形状,部分胞核和胞质界限不清;神经组织间质水肿明显,组织结构被破坏疏松呈网状,染色浅淡,甚至在部分红染区域仅见到无明显结构的坏死组织。TMP治疗组脑组织破坏情况得到了改善,仅可见少量不同程度被破坏的神经细胞。见图1。

图1 各组大鼠脑皮质HE染色结果(×400)
2.5 TMP对大鼠脑皮质miR-199a-5p的影响 与假手术组(0.98±0.15)相比,模型组中miR-199a-5p的表达(2.32±0.55)显著上调(P<0.001),TMP治疗组miR-199a-5p表达(1.67±0.41)显著下调(P<0.05)。
2.6 TMP对大鼠脑皮质Bax、Bcl-2 mRNA表达的影响 与假手术组(Bax:0.95±0.19,Bcl-2:0.95±0.21)比较,模型组脑皮质中Bax RNA表达(2.95±0.62)上调,Bcl-2 mRNA表达(0.50±0.14)明显下降(P<0.01);TMP治疗后,Bax mRNA表达(1.88±0.32)得到显著抑制(P<0.01),Bcl-2 mRNA表达水平(1.63±0.30)明显上升(P<0.001)。
2.7 TMP对大鼠脑组织和外周血TNF-α、IL-1β和IL-6表达水平的影响 qRT-PCR结果显示,与假手术组(分别为1.05±0.20,0.80±0.26,0.94±0.05)比较,模型组TNF-α、IL-1β、IL-6 mRNA表达(2.95±0.18,2.38±1.03,3.20±1.28)显著升高(P<0.01,P<0.05);TMP治疗后,TNF-α、IL-1β、IL-6 mRNA表达(0.95±0.19,0.64±0.19,0.54±0.17)均显著降低(P<0.01,P<0.05)。
ELISA结果表明,模型组大鼠血清中促炎因子TNF-α、IL-1β、IL-6的表达含量〔(52.00±19.09)、(152.70±58.36)、(105.60±10.36)pg/ml〕比假手术组〔(23.00±6.60)、(61.48±7.96)、(66.00±3.11)pg/ml〕显著升高(均P<0.01);与模型组相比,TMP治疗组各因子的表达含量〔(29.60±7.27)、(62.93±11.74)、(79.00±5.14)pg/ml〕均显著降低(P<0.05)。
2.8 TMP对大鼠脑组织中NF-κB p65、NF-κB p-p65的影响 免疫组织化学结果表明,在模型组大鼠脑皮质中可明显观察到NF-κB p65及NF-κB p-p65阳性细胞。与假手术组(38.00±1.47,28.00±2.25)相比,模型组大鼠脑皮质中NF-κB p65(53.00±2.48)及NF-κB p-p65(56.25±3.12)表达明显升高(P<0.01,P<0.001);TMP治疗后,NF-κB p65及NF-κB p-p65表达(47.25±2.78、42.00±3.49)显著降低(P<0.05)。见图2,图3。
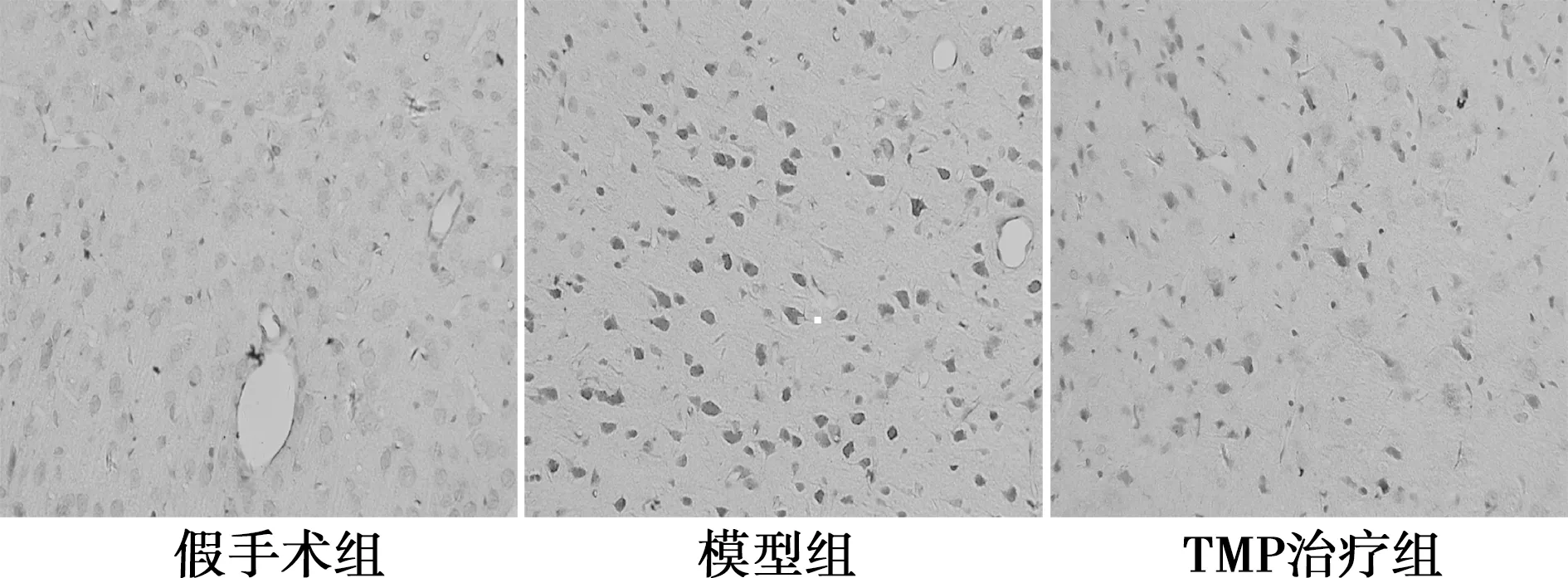
图2 各组大鼠脑皮质中NF-κB p65的表达(IHC法,×400)

图3 各组大鼠脑皮质中NF-κB p-p65的表达(IHC法,×400)
3 讨 论
脑缺血再灌注24 h后,可出现明显脑水肿、大面积梗死灶,神经元发生大片坏死、凋亡,细胞结构受损严重。本文发现TMP能够显著改善脑水肿、减少脑梗死面积以及改善神经组织的损伤,充分表明TMP具有一定的神经保护作用。IS引起一系列细胞和分子事件级联反应,包括神经兴奋性毒性、钙离子超载、氧化应激以及神经炎症〔14〕。多种体内外实验可以证实TMP能阻断多个损伤级联事件,提供神经保护作用〔15〕。凋亡与CIRI密切相关,抑制凋亡可以减轻缺血脑损伤,对脑组织具有保护作用。Kao等〔4〕发现,TMP能抑制脑缺血诱导的凋亡。Chang等〔16〕报道TMP可抑制MCAO诱导的Caspase3活化及细胞凋亡,从而降低梗死面积。同时,有文献证实,在兔子脊髓缺血模型中,TMP可以通过增加Bcl-2和降低Bax的表达发挥抗凋亡作用〔17〕。我们团队前期体外实验结果表明,TMP也可有效调节Bcl-2、Bax、Caspase3、Caspase9的表达而发挥神经保护作用〔18,19〕。本文通过体内实验观察到TMP可改善神经组织损害情况,降低Bax和上调Bcl-2的表达,证实TMP可以降低神经细胞凋亡。炎症反应是脑缺血后脑损伤的主要原因之一,控制缺血后炎症级联反应显得尤为重要。促炎因子TNF-α、IL-1β、IL-6是CIRI早期分泌释放的细胞因子,它们表达上调是脑缺血后炎症级联反应的始动因素。Wu等〔20〕发现,TMP能下调TNF-α及细胞间黏附分子-1的表达,从而降低炎性反应。Liao等〔21〕发现,TMP通过抑制小胶质细胞、星形胶质细胞及其他炎症细胞的活化、迁移及聚集,发挥神经保护作用〔16〕。Chang等〔16〕发现TMP抑制TNF-α的表达,对神经元发挥保护作用。本文研究也发现TMP可以降低脑缺血再灌注过程中炎症反应,发挥神经保护作用。炎症反应的发生主要以NF-κB信号通路为核心和关键。NF-κB参与脑缺血再灌注导致的细胞凋亡、坏死、功能下降等病程的发生发展,能促发各种炎性反应介质基因的转录激活〔22〕。在大鼠局灶性脑缺血模型中,缺血组织中NF-κB表达增强〔23〕,启动IL-1、IL-6和TNF-α等炎性因子的转录,促进白细胞黏附、渗出与聚集。这些炎性因子又可作为NF-κB的激活剂,反过来激活NF-κB〔24〕。本研究结果表明脑缺血再灌注后NF-κB被激活,TMP可以抑制NF-κB 活化,降低炎症级联损伤,减轻CIRI。miRNAs与IS病理生理过程关系紧密,我们前期研究发现急性IS患者血清中存在差异的miRNAs,这些miRNAs在CIRI中发挥重要的角色〔7,25,26〕,其中表达变化较显著的miR-199a-5p引起极大关注。 据报道,miR-199a-5p参与多种细胞进程,包括细胞分化和增殖、肿瘤发生、血管生成和自噬〔27~30〕等。尤为重要的是,miR-199a-5p调控多种细胞的凋亡和存活〔10,31,32〕。而且,miR-199a-5p主要表达在海马组织中,可促进癫痫中神经细胞的凋亡。也有研究者认为,miR-199a-5p可参与免疫应答〔33,34〕。本文发现MCAO大鼠脑皮质中miR-199a-5p高表达,而且,TMP治疗后可以降低miR-199a-5p的表达水平。推测TMP可能通过抑制miR-199a-5p的表达、降低神经细胞凋亡以及炎症的产生,从而减轻CIRI。
1 Woodruff TM,Thundyil J,Tang SC,etal.Pathophysiology,treatment,and animal and cellular models of human ischemic stroke〔J〕.Mol Neurodegener,2011;6(1):11.
2 吴锦萍,张春兵.中药有效成分保护脑缺血再灌注损伤的研究进展〔J〕.中国老年学杂志,2015;35(14):4068-70.
3 Gao HJ,Liu PF,Li PW,etal.Ligustrazine monomer against cerebral ischemia/reperfusion injury〔J〕.Neural Regen Res,2015;10(5):832-40.
4 Kao TK,Ou YC,Kuo JS,etal.Neuroprotection by tetramethylpyrazine against ischemic brain injury in rats〔J〕.Neurochem Int,2006;48(3):166-76.
5 Zhang H,Sun R,Liu XY,etal.A tetramethylpyrazine piperazine derivate cxc137 prevents cell injury in sh-sy5y cells and improves memory dysfunction of rats with vascular dementia〔J〕.Neurochem Res,2014;39(2):276-86.
6 Cheng XR,Zhang L,Hu JJ,etal.Neuroprotective effects of tetramethylpyrazine on hydrogen peroxide-induced apoptosis in pc12 cells〔J〕.Cell Biol Int,2007;31(5):438-43.
7 Jeyaseelan K,Lim KY,Armugam A.MicroRNA expression in the blood and brain of rats subjected to transient focal ischemia by middle cerebral artery occlusion〔J〕.Stroke,2008;39(3):959-66.
8 Li P,Teng F,Gao F,etal.Identification of circulating microRNAs as potential biomarkers for detecting acute ischemic stroke〔J〕.Cell Mol Neurobiol,2015;35(3):433-47.
9 Hua YJ,Tang ZY,Tu K,etal.Identification and target prediction of miRNAs specifically expressed in rat neural tissue〔J〕.BMC Genomics,2009;10:214.
10 Liu G,Detloff MR,Miller KN,etal.Exercise modulates microRNAs that affect the PTEN/mTOR pathway in rats after spinal cord injury〔J〕.Exp Neurol,2012;233(1):447-56.
11 Wang D,Li Z,Zhang Y,etal.Targeting of microRNA-199a-5p protects against pilocarpine-induced status epilepticus and seizure damage via sirt1-p53 cascade〔J〕.Epilepsia,2016;57(5):706-16.
12 Huang JH,Cao Y,Zeng L,etal.Tetramethylpyrazine enhances functional recovery after contusion spinal cord injury by modulation of microRNA-21,Fasl,PDCD4 and PTEN expression〔J〕.Brain Res,2016;1648(Pt A):35-45.
13 Longa EZ,Weinstein PR,Carlson S,etal.Reversible middle cerebral artery occlusion without craniectomy in rats〔J〕.Stroke,1989;20(1):84-91.
14 Candelario-Jalil E.Injury and repair mechanisms in ischemic stroke:considerations for the development of novel neurotherapeutics〔J〕.Curr Opin Investig Drugs,2009;10(7):644-54.
15 胡长鹏,唐 勤,邢 茂.川芎嗪抗脑缺血再灌注损伤作用机制的研究进展〔J〕.中国中医急症,2014;23(9):1680-2.
16 Chang Y,Hsiao G,Chen SH,etal.Tetramethylpyrazine suppresses hif-1alpha,TNF-alpha,and activated caspase-3 expression in middle cerebral artery occlusion-induced brain ischemia in rats〔J〕.Acta Pharmacol Sin,2007;28(3):327-33.
17 Fan LH,Wang KZ,Cheng B,etal.Anti-apoptotic and neuroprotective effects of tetramethylpyrazine following spinal cord ischemia in rabbits〔J〕.BMC Neurosci,2006;7(1):48.
18 张春兵,詹 瑧,高 峰.川芎嗪降低二甲酰胺诱导的pc12细胞凋亡〔J〕.检验医学,2009;24(12):907-10.
19 曹慧玲,高 峰,张春兵.川芎嗪对过氧化氢引起的pc12细胞损伤的保护作用〔J〕.中医药导报,2015;11(1):13-5.
20 Wu HJ,Hao J,Wang SQ,etal.Protective effects of ligustrazine on TNF-alpha-induced endothelial dysfunction〔J〕.Eur J Pharmacol,2012;674(2-3):365-9.
21 Liao SL,Kao TK,Chen WY,etal.Tetramethylpyrazine reduces ischemic brain injury in rats〔J〕.Neurosci Lett,2004;372(1-2):40-5.
22 Ridder DA,Schwaninger M.Nf-kappaB signaling in cerebral ischemia〔J〕.Neuroscience,2009;158(3):995-1006.
23 Gabriel C,Justicia C,Camins A,etal.Activation of nuclear factor-kappaB in the rat brain after transient focal ischemia〔J〕.Brain Res Mol Brain Res,1999;65(1):61-9.
24 杨 蕾,唐成和.脑室周围白质软化大鼠脑组织NF-κB p65蛋白表达与细胞凋亡的关系〔J〕.中国实用神经疾病杂志,2013;16(2):20-2.
25 Li P,Shen M,Gao F,etal.An antagomir to microRNA-106b-5p ameliorates cerebral ischemia and reperfusion injury in rats via inhibiting apoptosis and oxidative stress〔J〕.Mol Neurobiol,2016;〔Epub ahead of print〕.
26 李鹏飞,吴锦萍,高 峰,等.急性缺血性脑卒中患者血清mir-106b-5p的异常表达及意义〔J〕.临床检验杂志,2015;(9):668-72.
27 Alexander MS,Kawahara G,Motohashi N,etal.MicroRNA-199a is induced in dystrophic muscle and affects WNT signaling,cell proliferation,and myogenic differentiation〔J〕.Cell Death Differ,2013;20(9):1194-208.
28 Pencheva N,Tran H,Buss C,etal.Convergent multi-miRNA targeting of APOE drives lrp1/lrp8-dependent melanoma metastasis and angiogenesis〔J〕.Cell,2012;151(5):1068-82.
29 Chan YC,Roy S,Huang Y,etal.The microRNA mir-199a-5p down-regulation switches on wound angiogenesis by derepressing the v-ets erythroblastosis virus e26 oncogene homolog 1-matrix metalloproteinase-1 pathway〔J〕.J Biol Chem,2012;287(49):41032-43.
30 Xu N,Zhang J,Shen C,etal.Cisplatin-induced downregulation of mir-199a-5p increases drug resistance by activating autophagy in HCC cell〔J〕.Biochem Biophys Res Commun,2012;423(4):826-31.
31 Zhang J,Wu GQ,Zhang Y,etal.Propofol induces apoptosis of hepatocellular carcinoma cells by upregulation of microRNA-199a expression〔J〕.Cell Biol Int,2013;37(3):227-32.
32 Shatseva T,Lee DY,Deng Z,etal.MicroRNA mir-199a-3p regulates cell proliferation and survival by targeting caveolin-2〔J〕.J Cell Sci,2011;124(Pt 16):2826-36.
33 Chatila WM,Criner GJ,Hancock WW,etal.Blunted expression of mir-199a-5p in regulatory T cells of patients with chronic obstructive pulmonary disease compared to unaffected smokers〔J〕.Clin Exp Immunol,2014;177(1):341-52.
34 Lin HS,Gong JN,Su R,etal.Mir-199a-5p inhibits monocyte/macrophage differentiation by targeting the activin a type 1b receptor gene and finally reducing c/ebpalpha expression〔J〕.J Leukoc Biol,2014;96(6):1023-35.
〔2016-05-11修回〕
(编辑 徐 杰)
Tetramethylpyrazine inhibits cerebral ischemia/reperfusion injury in rats by modulation of miR-199a-5p,apoptosis,and inflammation
LI Peng-Fei,SHEN Mei-Hong,WU Jin-Ping,etal.
Department of Clinical Laboratory,Affiliated Hospital of Nanjing University of Chinese Medicine,Nanjing 210029,Jiangsu,China
Objective To observe the inhibitory effects of tetramethylpyrazine (TMP) on cerebral ischemia and reperfusion injury (CIRI) and further explore the underling molecular mechanisms.Methods Health adult male Sprague-Dawley(SD) rats were subjected to transient middle cerebral artery occlusion (tMCAO),and assigned into sham,model and TMP groups(n=20).TMP was administered via intraperitoneal injection (20 mg/kg) at the beginning of reperfusion after 2 h ischemia.After 24 h MCAO,the neurological function scores were evaluated.HE staining was used to evaluate the cerebral tissue morphology.qRT-polymerase chain reaction (PCR) was used to detect the expressions of miR-199a-5p,Bax,Bcl-2,TNF-α,IL-1β,and IL-6 mRNA in infarction cortex.Furthermore,enzyme-linked immunosorbent assay was used to detect the content of TNF-α,IL-6,IL-1β in rats′ peripheral blood.Animals were euthanized for immunohistochemical labeling to measure NF-κB p65 and NF-κB p-p65 levels in the infarction area.Results TMP significantly improved neurological function at 24 h after ischemia(P<0.05),decreased brain water content(P<0.05),reduced cerebral infarction volume(P<0.01).The damage of nerve cells in TMP group was improved significantly.The expressions of miR-199a-5p,Bax,TNF-α,IL-1β,and IL-6 mRNA were significantly increased in the brain of MCAO rats and Bcl-2 mRNA was markedly decreased.However,TMP markedly decreased the expressions of miR-199a-5p,Bax,TNF-α,IL-1β,and IL-6 mRNA and increased the expression of Bcl-2 mRNA in cortex.TMP also significantly reduced TNF-α,IL-1β,and IL-6 contents in serum of rats.In addition,IHC showed that TMP significantly decreased the expression of NF-κB p-p65(P<0.05).Conclusions The neuroprotective effect of TMP may be mediated at least by a portion of the inhibition of miR-199a-5p,followed by the inhibition of apoptosis,the reduction of proinflammatory cytokines,decrease the activation of NF-κB.
Tetramethylpyrazine;Cerebral ischemia and reperfusion injury;Apoptosis;Inflammation
国家自然科学基金资助课题(81403136,81373748,81171659,11574156)
1 南京中医药大学第二临床学院 2 南京中医药大学基础医学院
张春兵(1969-),男,副教授,主任技师,硕士生导师,主要从事中医药治疗脑卒中的分子机制研究。
李鹏飞(1984-),男,博士,主要从事脑卒中的分子诊断与治疗基础研究。
R743.31
A
1005-9202(2017)07-1561-05;
10.3969/j.issn.1005-9202.2017.07.001
