丙泊酚尾静脉泵注对骨髓间充质干细胞移植修复大鼠脊髓损伤的影响
2017-04-20周亚净刘建敏曹建明郝丽娜侯少科徐丽辉
周亚净 刘建敏 曹建明 郝丽娜 侯少科 穆 丽 徐丽辉
(河北医科大学附属邢台市人民医院麻醉科,河北 邢台 054001)
丙泊酚尾静脉泵注对骨髓间充质干细胞移植修复大鼠脊髓损伤的影响
周亚净 刘建敏1曹建明1郝丽娜 侯少科 穆 丽2徐丽辉1
(河北医科大学附属邢台市人民医院麻醉科,河北 邢台 054001)
目的 检测丙泊酚尾静脉泵注对骨髓间充质干细胞(BMSC)移植修复大鼠脊髓损伤的影响。方法 建立80只成年的Wistar大鼠脊髓损伤模型,用随机数字表法分为4组。①BMSC移植组经尾静脉泵注等体积BMSC细胞液。②对照组尾静脉注入培养液组。③丙泊酚组:丙泊酚注射液(2 ml·kg-1·h-1)尾静脉滴注4 h;④联合组尾静脉注射BMSC细胞后,经尾静脉泵注丙泊酚注射液(2 ml·kg-1·h-1)持续4 h。依次于术前、术后1、3 d与1~4 w通过斜板试验、改良Tarlov 评分进行运动功能评定、运动功能量表(BBB)评分。术后4 w取材进行病理切片HE染色及荧光显微镜观测CM-Dil标记的分布及BMSC存活情况。使用荧光金逆行追踪法检测脊髓损伤区神经纤维的再生,并且使用透射电镜法观测神经轴突的生长。结果 造模后,大鼠下肢运动功能评价联合组优于BMSC移植组及丙泊酚组,BMSC移植组和丙泊酚组优于对照组,差异均有统计学意义(P<0.05)。HE染色,对照组可见脊髓组织缺失及脊髓空洞形成,无神经轴索通过。BMSC移植组和丙泊酚组损伤区可见少量神经轴索样结构,脊髓空洞较小,联合组可见较多神经轴索样结构,未见脊髓空洞。术后4 w,荧光金阳性神经纤维数和CM-Dil阳性细胞:对照组最少,BMSC移植组和丙泊酚组次之,联合组最多,组间差异均有统计学意义(P<0.05)。透射电镜观察,BMSC移植组和丙泊酚组横断面正中可见新生的无髓及有髓神经纤维,联合组无髓及有髓神经纤维数多于其他组,对照组电镜下有髓及无髓神经纤维数最少。结论 丙泊酚尾静脉泵注可以提高向神经功能细胞分化及移植的BMSC在脊髓损伤区的存活,促进BMSC移植修复大鼠脊髓损伤的效果。
骨髓间充质干细胞;丙泊酚;脊髓损伤;移植;治疗;修复
脊髓损伤具有病情重、发病急、致残率、致死率高,预后差等特点,如何在临床工作中有效治疗脊髓损伤,降低致残率及死亡率,达到最佳功能康复,改善患者预后仍然是一个困扰着神经外科医生的重大难题〔1,2〕。骨髓间充质干细胞(BMSCs)在一定条件下可以被诱导分化为各种神经功能细胞,在移植后起到修复神经损伤的作用,为临床治疗脊髓损伤提供了新思路〔3〕。丙泊酚是具有神经保护作用的麻醉药物,其在脊髓损伤治疗中的应用引起研究者的关注。本研究讨论丙泊酚尾静脉泵注对移植BMSC修复大鼠脊髓损伤的影响。
1 材料与方法
1.1 实验动物和主要试剂 1只雌雄不限1个月龄Wistar大鼠,80只成年雌性,体重200~250 g健康Wistar大鼠〔许可证号SCXK(冀)20080004〕,该大鼠购于河北省实验动物中心;L-DMEM培养基(美国Gibco BRL公司产品);胎牛血清(FBS)(Hyclone公司产品);0.01 mol/L PBS(粉剂,pH7.2)(上海信然生物技术有限公司); EDTA(天津市化学试剂一厂);胰蛋白酶(GibcoBRL公司);细胞培养箱(美国Thermo Forma 公司)。CM-Dil、谷氨酰胺(美国Sigma公司);荧光金(aminostilbamidine,methanesulfonate)(Invitrogen,美国)
1.2 大鼠BMSC的培养及鉴定 1只1个月龄的Wistar大鼠处死后,将其浸入75%的酒精容器中进行彻底消毒,约为10 min。在确保无菌操作情况下取大鼠双侧胫骨及股骨,切除两侧的骨端,通过含5%胎牛血清1 ml的DMEM完全培养基自一端清洗骨髓腔,制成单细胞悬液,细胞数为3×104个/ml,接种于100 ml的培养瓶中,于饱和湿度37℃、5%的CO2的孵育箱中培养,在 24 h后进行全量换液,3 d换液1次并按1∶2的比例进行传代。每天用显微镜观察细胞的生长情况,当细胞融合到80%以上时,接而进行再次传代,按1∶3比例进行。进行多次传代培养扩增后,该其BMSC逐渐纯化。用流式细胞仪法观察表面抗原鉴定BMSCs。
1.3 CM-Dil标记BMSC 在避光后吸取5 μl的CM-Dil液,加入1.5 ml的EP管中,再加入1ml含5%胎牛血清的完全培养液,混匀后,即得CM-Dil标记液。提取贴壁并且融合达80%的BMSC,吸弃培养液后,加入上述标记液40 μl/cm2,用PBS清洗3次,饱和湿度37℃、5% CO2的恒温培养箱孵育20 min,再吸弃标记液,加入5 ml 37℃的含5%胎牛血清完全培养液,孵育10 min吸弃后,再加入含5%胎牛血清完全培养液清洗3次。在荧光显微镜下于检测培养24 h后,BMSC标记形态和CM-Dil标记效果。传代时取适量的BMSC由流式细胞仪测CM-Dil的标记率。
1.4 动物模型的建立及分组 80只体重200~250 g的雌性Wistar大鼠,在实验室中饲养2 w后,用10%的水合氯醛按照350 mg/kg腹腔注射麻醉,俯卧位将大鼠固定在实验平台上,腰背部备皮满意后,按T8~9棘突为切口中心,自大鼠背部正中逐层切开,咬除T8~9棘突和部分椎板,充分显露T7~10的椎板和棘突,将其暴露硬膜保持完整,作为损伤区。运用改良的Allen法打击〔3,4〕,将由2.5 cm高度处10 g的重物自由落下,撞击脊髓组织及大鼠硬膜(术后双下肢瘫痪且大鼠尾巴痉挛摆动表明成功)。双氧水清洗伤口,然后逐层缝合背部切口。在术后每天挤尿2~3次,直至大鼠恢复了排尿反射为止。动物分组:随机数字表法分为每组20只,共4组 。在其建模后6 h运用1 ml注射器经尾静脉注入不同的移植液:BMSC组为注射1 ml BMSC(3×106个)悬液移植组。对照组为注射1 ml培养液组。联合组:在尾静脉注射1 ml BMSC(3×106个)悬液的同时通过尾静脉留置针持续泵注丙泊酚注射液(2 ml·kg-1·h-1)持续4 h。丙泊酚组:运用尾静脉留置针泵注丙泊酚注射液(2 ml·kg-1·h-1)持续4 h。
下肢运动功能评价:所有大鼠均在造模前、后1、3 d、1、2、3、4 w对4组大鼠进行运动功能评定。评定项目〔5,6〕包括改良Tarlov评分〔4〕,运动功能量表(BBB)评分〔7,8〕,斜板试验〔9〕。评定时间均统一为上午8∶00开始。评分均为两人合评。使用双盲法对4组大鼠进行评分,分别于术前、术后1、3 d与1~4 w对4组大鼠进行检测,共分析6次,取平均值。
1.5 HE及荧光显微镜观察 造模后4 w,4组均处死5只大鼠,取材行免疫组织化学和HE染色,10%水合氯醛350 mg/kg麻醉满意后剖胸,完全的表露了大鼠的心脏,运用升主动脉插管,首先剪开右心耳后用生理盐水清洗,其次4%多聚甲醛再固定后,完整地取出损伤区的脊髓组织,取损伤部位的脊髓组织约1 cm,在酒精梯度脱水后行脊髓的纵行冰冻切片,其厚度为20 μm。进行HE染色:在苏木素染色5 min后,经自来水清洗,使用盐酸酒精分化10 s,再次使用伊红染色7 min,自来水冲洗10 min,自来水洗后,以梯度酒精脱水,通过二甲苯透明,用中性树胶封片。在各组脊髓损伤处组织实行常规冰冻切片后,用荧光显微镜分析。然后随机取10个视野,于高倍镜下(×200)观察,分析各个视野阳性细胞数,取均值作为各组阳性CM-Dil细胞数。
1.6 荧光金逆行追踪 在大鼠脊髓损伤术后4 w,4组分别随机取6只大鼠,麻醉满意后于股外侧肌间隙完全显露坐骨神经后,每侧坐骨神经按照0.1 μl/min的注射速度注射0.4 μl的 2%的荧光金,运用止血钳夹挫大鼠伤坐骨神经后,坐骨神经的挫伤区多处于避光下条件经微量注射器注射荧光金,注射时留针5 min,使用8万U的青霉素盐水反复清洗切口后,逐层缝合,术后进行正常饲养。1 w后对脊髓损伤区进行组织学观察。将30%的蔗糖保存于4℃的冰箱过夜,次日-18℃条件下通过OCT 冰冻切片包埋后行20 μm冠状面和横断面的冰冻切片,各切片分别于高倍镜(×200)下任取10个视野,检测每个视野中荧光金标记的神经纤维数,取其平均值作为各组的荧光金阳性神经纤维数。
1.7 透射电镜观察 在大鼠脊髓损伤术后4 w,四组各随机抽取大鼠6只,用2.5%的戊二醛固定过夜,经心给大鼠灌注2.5%的戊二醛后取材,取脊髓损伤区中心脊髓组织宽1 mm,长1 cm,锇酸4℃下固定2 h,经反复漂洗后,使用丙酮梯度脱水,经环氧树脂6101包埋后,4℃条件下醋酸铀染色4 h,进行透射电镜观察。
1.8 统计学方法 应用SPSS17.0软件进行LSD法单因素方差分析及t检验。
2 结 果
2.1 BMSC形态观察 经5 d培养后,培养瓶中集落数及BMSC明显增多。传1~3代的BMSC增殖活跃,可见大多数细胞传代培养后呈单层贴壁生长,多为大多角形、梭形或三角形,BMSC形态逐渐保持一致,以梭形BMSC为主,折光性强,可见两个或多个突起,核仁及细胞核可见,细胞融合后,平行状或旋涡状生长,见图1。 流式细胞仪分析CD29、CD44、CD166、CD105表达阳性,CD34、CD86、CD80阴性,BMSCs的均一性好,纯度达95%以上。

原代

第三代
2.2 下肢运动功能评价结果 见表1。术前全部大鼠的BBB评分、改良的Tarlov评分及斜板试验差异均无统计学意义(P>0.05)。经相关治疗后,BMSC组、丙泊酚组、联合组三项评分在各时间点(造模后2~4 w)较对照组都明显增加(P<0.05)。而联合组三项评分在术后2~4 w较丙泊酚组、BMSC组高(P<0.05)。

组别损伤前损伤后1d3d1w2w3w4wBBB评分 对照组21.00±0.000.00±0.001.24±0.062.44±0.698.35±1.4711.11±1.3213.78±0.66 BMSC组21.00±0.000.00±0.002.41±0.073.90±1.0010.23±1.501)2)12.68±1.761)2)15.12±0.141)2) 丙泊酚组21.00±0.000.00±0.002.43±0.043.95±1.0110.25±1.281)2)12.15±1.431)2)15.22±0.141)2) 联合组21.00±0.000.00±0.003.42±0.076.10±1.0312.29±1.231)14.75±1.321)17.56±0.221)2)斜板试验 对照组42.50±2.3415.82±1.6416.49±1.3421.83±2.1322.91±2.1426.21±2.3228.12±1.43 BMSC组42.50±1.5416.76±2.1918.91±1.5424.58±2.2130.22±2.301)2)34.53±2.061)2)38.63±2.121)2) 丙泊酚组42.50±2.3116.84±2.1718.83±1.5124.65±1.4330.32±2.091)2)34.25±2.341)2)38.22±2.211)2) 联合组42.51±2.7318.53±2.5421.59±2.0225.42±2.2133.49±2.381)38.51±2.521)41.41±2.291)改良Tarlov评分 对照组5.00±0.000.00±0.000.41±0.140.82±0.131.63±0.322.45±0.222.66±0.54 BMSC组5.00±0.000.00±0.000.72±0.181.58±0.192.79±0.321)2)3.60±0.201)2)3.88±0.321)2) 丙泊酚组5.00±0.000.00±0.000.73±0.191.61±0.202.80±0.531)2)3.61±0.191)2)3.87±0.291)2) 联合组5.00±0.000.00±0.000.82±0.181.84±0.153.03±0.331)3.45±0.221)4.15±0.211)
与同时期对照组比较:1)P<0.05;与同时期联合组比较:2)P<0.05
2.3 HE染色和荧光显微镜观察 大鼠脊髓损伤造模后4 w,光镜下,对照组脊髓损伤区可见脊髓组织断裂,为瘢痕连接,有明显空洞形成。丙泊酚组及BMSC组的组织空洞较联合组大,较对照组小。联合组损伤处脊髓组织空洞几乎消失,见图2。联合组及BMSC组荧光显微镜下均可见散在的CM-DIL染色阳性的红色荧光:丙泊酚组(0±0.00)个/高倍视野,对照组(0±0.00)个/高倍视野,BMSC组(23.56±9.48)个/高倍视野,联合组(42.58±8.60)个/高倍视野,BMSC组及联合组之间差异有统计学意义(P<0.01),丙泊酚组和对照组、联合组和BMSC组相比差异有统计学意义(P<0.01)。见图3。
2.4 FG皮质脊髓束逆行追踪 对照组大鼠脊髓损伤区头侧端FG 标记的阳性神经纤维数为(9.3±3.2)个;BMSC组为(26.3±3.4)个;丙泊酚组为(25.3±4.2)个,联合组为(42.6±5.1)个,见图4。与对照组比,联合组差异有统计学意义(P<0.01);与对照组相比,丙泊酚组、BMSC组差异有统计学意义(P<0.05)。
对照组

对照组

丙泊酚组

BMSC组

联合组

对照组

BMSC组

丙泊酚组

联合组
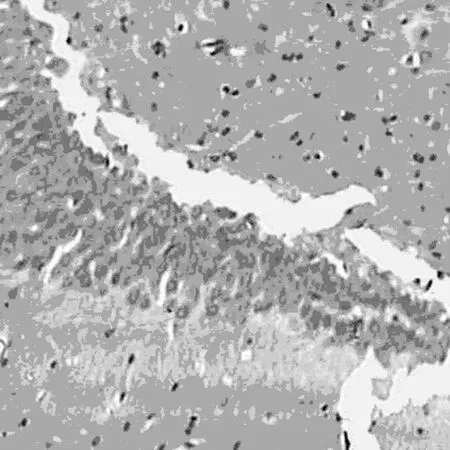
2.5 透射电镜 通过透射电镜检测表明术后4 w,对照组可见少量有髓神经纤维及胶质瘢痕,巨噬细胞吞噬变性坏死的有髓神经纤维。在联合组的透射电镜分析可见大量的无髓神经纤维及有髓神经纤维,数量轴突的较多,再生轴突可见完整髓鞘。丙泊酚组及BMSC组的大鼠脊髓损伤区中可见到较多的无髓神经纤维及有髓神经纤维,较联合组少而多于对照组,见图5。
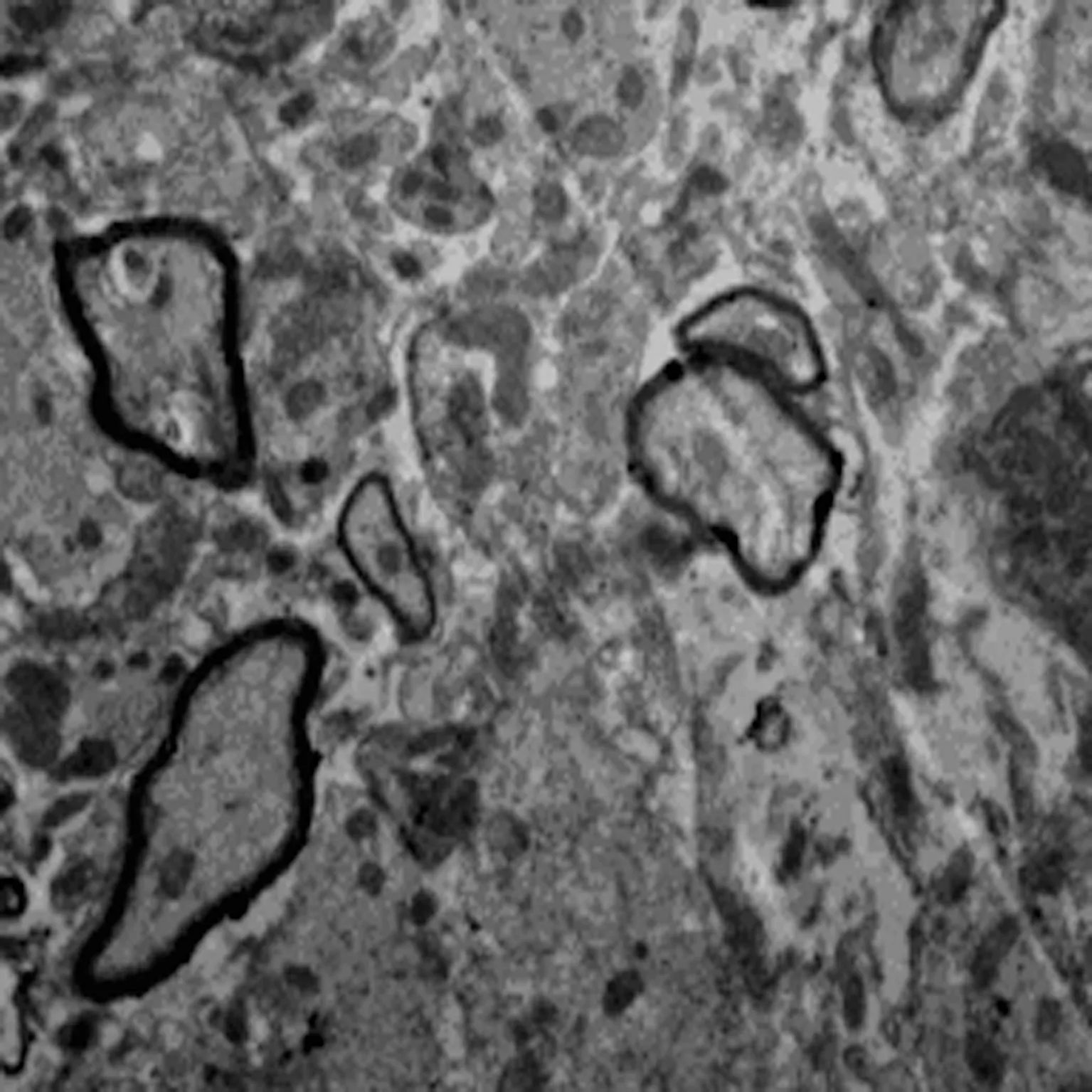
对照组
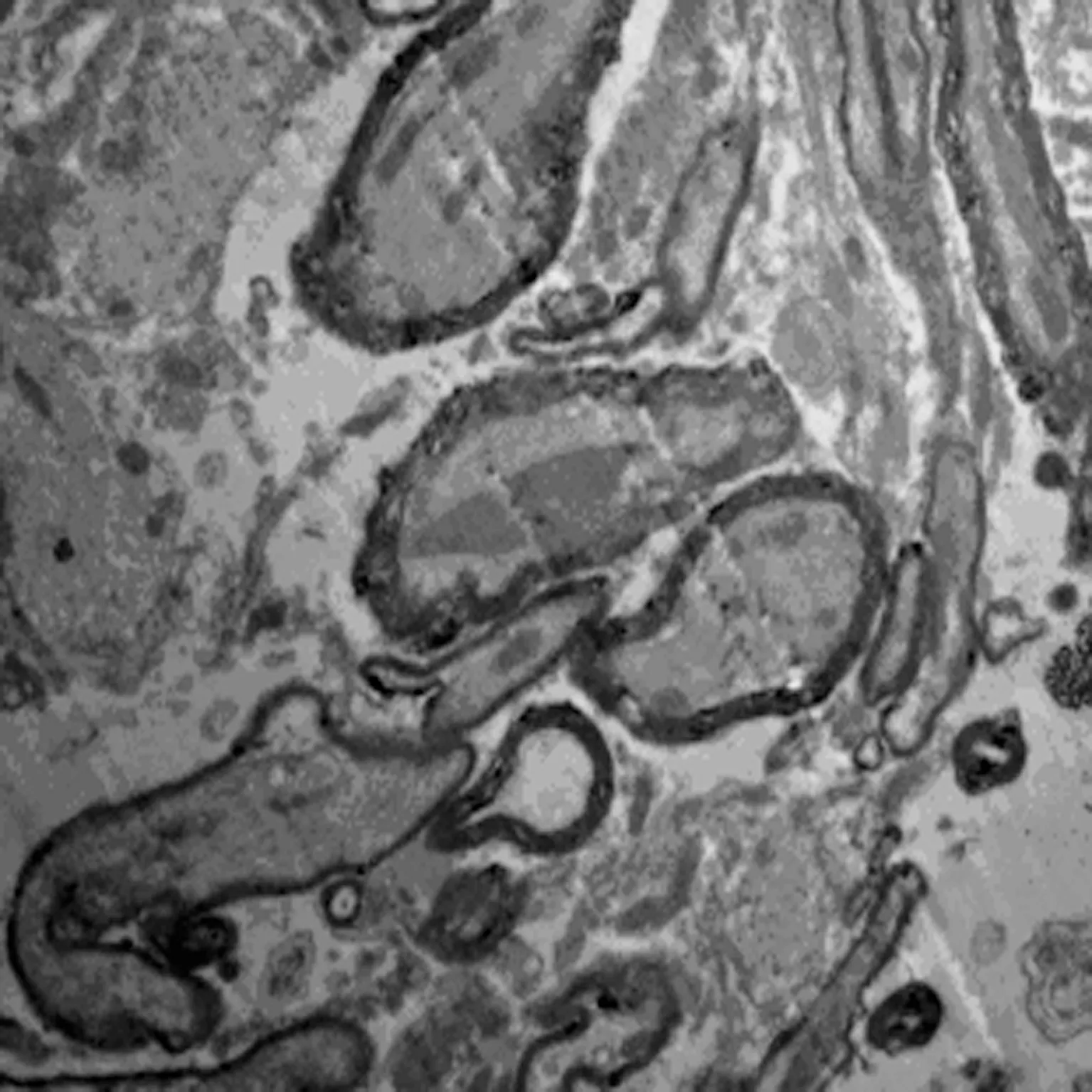
联合组

BMSC组
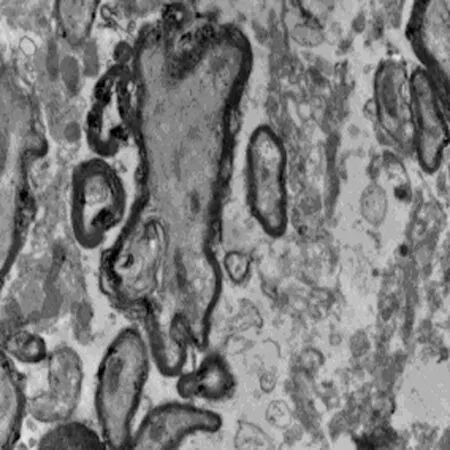
丙泊酚组
3 讨 论
社会现代科技的高速发展,脊髓损伤作为神经外科的常见疾病,是一个极其复杂的病理生理过程,不但发病急、病情变化迅速,致残率、预后差及致死率高,给家庭以及社会带来了沉重的经济负担〔10〕。急性脊髓损伤后早期微循环障碍导致局部缺血缺氧并发生免疫炎症反应,肿瘤坏死因子α、白细胞介素1等炎症因子被大量激活,小胶质细胞和星形胶质细胞的增殖、活化、迁徙,形成继发细胞毒性并形成瘢痕,持续的脊髓代谢紊乱缺血及缺氧,不利于轴突及神经元的再生,最终导致继发性脊髓损伤〔10,11〕。
目前临床上治疗脊髓损伤的主要方式是理疗康复方法及营养神经挽救损伤区及周围濒临坏死的神经元,促进神经元功能的修复,逆转脊髓的缺血缺氧〔12〕。但人脊髓损伤不具有自我修复神经元的能力,因此治疗效果不理想〔13〕。伴随着脊髓损伤组织工程研究的不断深入,又发现存在于骨髓、脐带血、外周血、胎盘等多种组织的BMSCs是一类特殊的干细胞,在一定条件诱导下具有自我更新、多向分化、迁移的能力〔14〕,能在体外分化培养扩增为多种遗传稳定的组织细胞,包括成神经元、成软骨细胞、脂肪细胞、骨细胞、肌肉细胞、神经胶质细胞等〔15〕,所以作为理想的神经元移植供体BMSCs移植后分化成神经胶质及神经元,修复受损的神经元,为了进一步治疗脊髓损伤展现了一种更为有效的新方法〔16〕。宿主体内移植存活的BMSCs在受损伤脊髓部位产生和释放趋化因子的影响向损伤区域迁移、聚集,分化为神经元和胶质细胞,分泌多种生长因子,抑制炎症因子的表达,保护并促进神经元的再生重构,诱导损伤区域微血管的再生,降低局部的继发性炎症反应,而其分化的反应性神经细胞有治疗脊髓损伤的作用〔17〕。
丙泊酚能够抑制自由基的生成,具有抗氧化活性,抑制脂质过氧化反应生成,阻碍于自由基的级链反应,因此丙泊酚可以降低神经氧代谢率,调解特定细胞通路,S100β蛋白是神经组织中的一种酸性钙结合蛋白,该研究说明脊髓损伤后血清S100β蛋白含量的增加,早期应用丙泊酚可以减低血清S100β蛋白含量,减少脊髓组织总钙含量,降低脊髓含水量,在一定程度上提供神经保护作用〔18〕。
本研究显示,丙泊酚尾静脉泵注可以有效提高BMSC在向神经功能细胞的分化及脊髓损伤区的存活率,优化BMSC移植修复大鼠脊髓损伤的效果,在进一步临床工作中将会成为治疗脊髓损伤的新方法和思路。
1 Furukawa S,Sameshima H,Yang L,etal.Activation of acetylcholine receptors and microglia in hypoxic-ischemic brain damage in newborn rats〔J〕.Brain Dev,2013;35(7):607-13.
2 Ohira T,Ando R,Okada Y,etal.Sequence of busulfan-induced neural progenitor cell damage in the fetal rat brain〔J〕.Exp Toxicol Pathol,2013;65(5):523-30.
3 Li Q,Liu TY,Zhang L,etal.The role of bFGF in down-regulating α-SMA expression of chondrogenically induced BMSCs and preventing the shrinkage of BMSC engineered cartilage〔J〕.Biomaterials,2011;32(21):4773-81.
4 Finch AM,Wong AK,Paczkowski NJ,etal.Low-molecular-weight peptidic and cyclic antagonists of the receptor for the complement factor C5a〔J〕.J Med Chem,1999;42(11):1965-74.
5 Haku T,Okuda S,Kanematsu F,etal.Repair of cervical esophageal perforation using longus colli muscle flap:a case report of a patient with cervical spinal cord injury〔J〕.Spine J,2008;8(5):831-5.
6 Pearse DD,Sanchez AR,Pereira FC,etal.Transplantation of Schwann cells and/or olfactory ensheathing glia into the contused spinal cord:survival,migration,axon association and functional recovery〔J〕.Glia,2007;55(9):976-1000.
7 Pallini R,Vitiani LR,Bez A,etal.Homologous transplantation of neural stem cells to the injured spinal cord of mice〔J〕.Neurosurgery,2005;57(45):1014-25.
8 Albin RL,Mink JW.Recent advances in Tourette syndrome research〔J〕.Trends Neurosci,2006;29(1):175-82.
9 Young W.Spinal cord contusion models〔J〕.Prog Brain Res,2002;137(6):231-55.
10 Björklund E,Lindberg E,Rundgren M,etal.Ischaemic brain damage after cardiac arrest and induced hypothermia-a systematic description of selective eosinophilic neuronal death.A neuropathologic study of 23 patients〔J〕.Resuscitation,2014;85(4):527-32.
11 Ariake K,Ohtsuka H,Motoi F,etal.GCF2/LRRFIP1 promotes colorectal cancer metastasis and liver invasion through integrin-dependent RhoA activation〔J〕.Cancer Lett,2012;325(1):99-107.
12 Guan OH,Chen ZQ,Huang CP,etal.Attachment,proliferation and differentiation of bMSCs on gas-jet/electrospun nHAP/PHB fibrous scaffolds〔J〕.Appl Surface Sci,2008;255(2):324-7.
13 Chen CJ,Sun BH,Qu JP,etal.Avermectin induced inflammation damage in king pigeon Brain〔J〕.Chemosphere,2013;93(10):2528-34.
14 Jiang IQ,Zhao J,Wang SY,etal.Mandibular repair in rats with premineralized silk scaffolds and BMP-2-modified bMSCs〔J〕.Biomaterials,2009;30(27):4522-32.
15 Liu X,Sun HY,Yan D,etal.In vivo ectopic chondrogenesis of BMSCs directed by mature chondrocytes〔J〕.Biomaterials,2010;31(36):9406-14.
16 Xiang SY,Dusaban SS,Brown JH,etal.Lysophospholipid receptor activation of RhoA and lipid signaling pathways〔J〕.Biochim Biophys Acta Mol Cell Biol Lipid,2013;1831(1):213-22.
17 Choi YJ,Lee DH,Park SH,etal.Induction of human microsomal prostaglandin E synthase 1 by activated oncogene RhoA GTPase in A549 human epithelial cancer cells〔J〕.Biochem Biophys Res Comm,2011;413(3):448-53.
18 Yu QJ,Hu J,Yang J,etal.Protective effect of propofol preconditioning and postconditioning against ischemic spinal cord injury〔J〕.Neurol Regener Res,2011;6(12):951-5.
〔2016-03-18修回〕
(编辑 苑云杰/曹梦园)
1 河北医科大学附属邢台市人民医院创伤骨科 2 河北医科大学附属邢台市人民医院手术室
周亚净(1981-),女,硕士,主治医师,主要从事麻醉学研究。
R3
A
1005-9202(2017)07-1598-05;
10.3969/j.issn.1005-9202.2017.07.014
