埃博拉疫苗临床研究进展
2017-04-17侯利华
侯利华
军事医学科学院 生物工程研究所,北京 100071
综述
埃博拉疫苗临床研究进展
侯利华
军事医学科学院 生物工程研究所,北京 100071
2014年西非埃博拉疫情暴发后,多个埃博拉疫苗临床试验陆续开展。开展临床试验的埃博拉疫苗主要是病毒载体类疫苗,例如人腺病毒载体(Ad5和Ad26)、3型黑猩猩腺病毒载体(ChAd3)、水泡性口炎病毒载体(VSV)、痘病毒载体(MVA)。从免疫策略上来说,包括单次免疫与初免-加强两种免疫策略。基于Ad5、Ad26、ChAd3和MVA载体的埃博拉疫苗在Ⅰ、Ⅱ期临床试验中显示了良好的免疫原性,基于VSV载体的疫苗更是在Ⅲ期临床试验中显示了很好的保护性。
埃博拉疫苗;临床试验;病毒载体疫苗;免疫原性
在2014年西非埃博拉疫情暴发之前,世界范围内共开展了3项埃博拉疫苗研究。2014年西非埃博拉疫情暴发后,20余个埃博拉疫苗临床试验陆续开展。目前开展临床试验的埃博拉疫苗主要是病毒载体类疫苗,例如人腺病毒载体(Ad5和 Ad26)、3型黑猩猩腺病毒载体(chAd3)、水泡性口炎病毒载体(VSV)、痘病毒载体(MVA),以及DNA疫苗和VLP疫苗。从免疫策略上来说,包括单次免疫与初免-加强两种免疫策略。截至2016年12月,国际上尚无埃博拉疫苗获得批准上市,但有数个疫苗进入临床研究阶段(表1)。
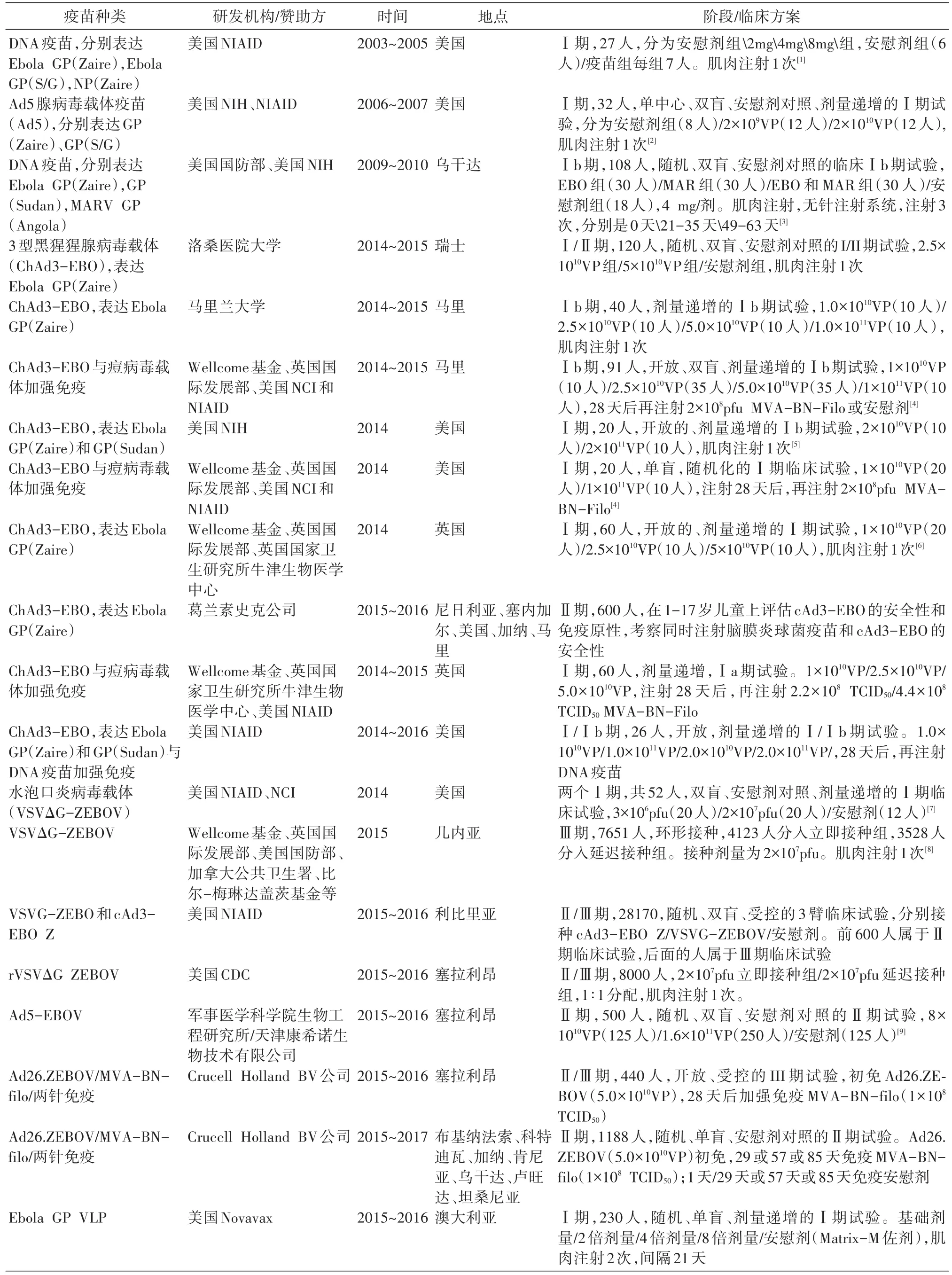
表1 截至2016年9月已开展(或登记)的埃博拉疫苗临床试验进展
1 DNA疫苗
1.1 分别表达 Ebola GP(Zaire)、Ebola GP(S/ G)、NP(Zaire)
该疫苗由美国国家过敏症和传染病研究所(NIAID)研制,临床试验在2003~2005年开展[1],是最早开展的埃博拉疫苗临床试验,为随机、双盲、安慰剂对照的Ⅰ期临床试验,研究结果表明埃博拉的DNA疫苗是安全且有免疫原性的。编码Ebola GP(Zaire)、GP(Sudan/Gulu)和NP蛋白的3个质粒,同时进行肌肉注射,分为2、4、8 mg组和安慰剂组,共计27人。疫苗安全性好,无严重不良反应。在20名疫苗组试验者中,至少有一种抗原成分能被ELISA或细胞免疫反应检测到。6名受试者检测到CD8+的特异性T细胞反应。
1.2 分别表达Ebola GP(Zaire)、GP(Sudan)、MARV GP(Angola)
2009~2010年美国国防部和美国NIH资助在乌干达开展了一项DNA疫苗的随机、双盲、安慰剂对照的临床Ⅰb期试验[5],该试验分为3组,即分别表达Ebola Zaire GP组(EBO组)、Mar⁃burg GP组(MARV组)和同时注射的二联疫苗组,分别在0、4、8周免疫,使用Biojector 2000无针注射系统进行肌肉注射。研究结果表明,该注射方式和疫苗耐受性好,无严重的局部与全身不良反应。EBO疫苗组中17/30产生了EBO特异性抗体反应,二联疫苗组中有14/30产生了EBO特异性抗体反应,MARV疫苗组9/29产生了特异性抗体反应,二联疫苗组中有7/30产生了MARV特异性抗体反应。EBO疫苗组中19/30产生了EBO特异性T细胞反应,二联疫苗组中有10/30产生了EBO特异性T细胞反应,MARV疫苗组15/29产生了特异性T细胞反应,二联疫苗组中有13/30产生了MARV特异性T细胞反应。
从以上结果可以看出,埃博拉的DNA疫苗免疫程序复杂,免疫原性弱,不适合紧急公共卫生事件中使用。
2 病毒载体类疫苗
2.1 黑猩猩腺病毒载体-埃博拉疫苗(ChAd3-ZEBOV vaccine)
该疫苗以黑猩猩3型腺病毒(ChAd3)为载体,表达Zaire型EBOV GP蛋白,疫苗类型为复制缺陷型重组腺病毒,在人体内不能持续复制。疫苗由美国NIAID研制,商业开发权授予英国制药企业葛兰素史克公司(GSK)合作,目前在clincaltrial.gov登记注册的临床试验已有10个左右。在非洲国家利比里亚开展了Ⅲ期临床试验。
2.1.1 Ⅰ期临床试验-1 2014年11月27日,在《新英格兰医学杂志》发表了ChAd3-EBOI期临床试验的初步结果[5]。该研究对ChAd3-EBO进行了第一阶段剂量递增的开放性试验,为双价疫苗,疫苗含有1∶1的分别表达Ebola Zaire和Ebola Sudan型GP的病毒载体。将20个健康成年人编成2组,10人/组,以肌肉注射方式进行接种,剂量为2×1010或2×1011VP,观察期为免疫后4周。在本项研究中没有发现安全性问题,但是有2名接种剂量为2×1011VP的受试者在免疫后1天内出现了短暂发热症状。20个受试者体内均产生了包膜糖蛋白特异的抗体,接种2× 1011VP的组别要比接种2×1010VP的组别拥有更高的抗体效价(针对Zaire的抗体的几何平均效价比为2037∶331;P=0.001),同时接种2×1011VP的组别也拥有更高比例的糖蛋白特异的T细胞反应。其中,2×1011VP的组别中10个人均有CD4反应,而2×1010VP组别中仅有3个人有CD4反应(P=0.004);检测了CD8反应,2×1011VP组别中有7人有反应,而2×1010VP组别中只有2人有反应(P=0.07)。
由于该疫苗的埃博拉病毒包膜糖蛋白基因序列为Zaire-Mayinga(1976)型,考虑到2014年暴发的 Zaire-Guinea(2014)型糖蛋白序列与Zaire-Mayinga(1976)型同源性为97.6%,以Zaire-Guinea(2014)型糖蛋白为抗原,检测到的抗体几何平均滴度在2周和4周时分别为177和623,而以Zaire-Mayinga(1976)型糖蛋白为抗原检测到的抗体几何平均滴度在2周和4周时分别为376和2037,说明2种抗原之间的抗原性存在着差异,也就暗示着采用Zaire-Guinea(2014)型糖蛋白作为2014年疫情的抗原可能会具有更好的保护性。
该文章认为ChAd3-EBO疫苗的不良反应和免疫反应取决于剂量。当剂量为2×1011VP时,Zaire型包膜糖蛋白特异的抗体反应处于与已报道的非人灵长类试验中疫苗诱导的保护性免疫范围内。
2.1.2 Ⅰ期临床试验-2 2015年1月28日在《新英格兰医学杂志》发表了另外一篇ChAd3-EBOⅠ期临床试验的初步结果[6]。本实验中评价了单价ChAd3-EBO Z(Zaire)的免疫原性和安全性,试验地点在英国,共招募60名受试者,平均分入3个剂量组,分别是1×1010、2.5×1010、5× 1010VP。安全性观察截至免疫后4周,研究结果表明3个剂量组均未发现安全性问题。2/59受试者发烧,4名受试者在免疫后2周发生了延长的活化部分凝血活酶时间(3例在中剂量组,1例在高剂量组)。8名受试者出现了暂时的高胆红素血症(6例在中剂量组,2例在高剂量组)。免疫4周后,高剂量组的ELISA抗体的几何平均值最高(469,68%阳转率)。采用与上一个临床试验同样的检测方法,3个剂量组的抗体EC90值分别为235、402和469。在利用灭活病毒(2014 Guinea基因型)作为包被抗原检测时,6/35(17%)有阳性反应,低剂量组2/10,中剂量组1/12,高剂量组3/13。ELISPOT方法检测的T细胞反应阳性率为100%,14天时到达峰值(中位数为693 SFC/106细胞)。流式细胞术检测到了CD4+和CD8+的T细胞免疫反应。在测试的所有剂量中,抗体水平和T细胞免疫水平均低于同类疫苗在食蟹猴体内激发的免疫水平。
2.1.3 Ⅰ期临床试验-3 2015年11月,Tapia等在《柳叶刀传染病》发表了用ChAd3-EBO初免,利用痘病毒载体的MVA-BN-Filo进行加强免疫的Ⅰ期临床试验结果[4],该文章综合了3个临床Ⅰ期结果。在美国进行的是单盲、随机的Ⅰ期临床试验,招募18~65岁的成年人;在马里进行的是开放和双盲、剂量递增的Ⅰb临床试验,招募18~50岁的医务人员,其中部分受试者划入巢式、随机、双盲和安慰剂对照的MVA-BN-Filo疫苗组。在马里和美国的临床试验随机化中,采用计算机按照1∶1随机分配至不同的剂量组中,马里受试者的剂量分别为1×1010、2.5×1010、5×1010和1×1011VP,美国受试者的剂量分别为1×1010和1×1011VP。马里受试者随机分入巢式试验中,接受注射2×108PFU的MVA-BN-Filo或安慰剂(生理盐水)。在马里试验的双盲部分,研究者、临床工作人员、受试者和免疫学实验室工作人员保持盲态,但研究药师、疫苗注射人员和统计师不是盲态。在美国临床试验中,研究者不是盲态,但受试者是盲态。主要研究终点是免疫7天后的安全性,由副反应发生率来判断。
本试验于2014年10月至2015年2月进行,在马里共入组91名受试者,1×1010VP组10人,2.5×1010VP组35人,5×1010VP组35人,1×1011VP组11人;在美国共入组受试者20人,1×1010VP组10人,1×1011VP组10人。马里受试者中共有52人加强免疫了MVA-BN-Filo(27人)或安慰剂(25人)。研究结果表明2种疫苗都没有安全性问题。马里的91名受试者中有7人(8%)出现了发热(5×1010VP组5人,1×1011VP组2人),发热持续时间不超过24小时;美国的20名受试者中4人出现发热,均在1×1011VP组,持续时间不超过24小时;加强免疫MVA-BN-Filo的27名马里受试者中,有15人出现注射部位疼痛或虚弱。
检测了免疫4周后抗体的GMT值,1×1011VP组的抗体均值显著高于其他剂量组,抗体水平在免疫4周后达到峰值,在接下来的12周缓慢下降。经过MVA-BN-Filo加强之后,抗体均值上升36倍,且能在此高水平维持。接受高剂量组chAd3-EBO的抗体水平高于低剂量组。加强免疫组与非加强免疫的受试者在基础水平上没有差异。初免-加强免疫时间间隔也没有差异,加强免疫4周后的抗体GMT为9297.6,显著高于初免后28天的抗体GMT(356.4),平均值增长了26倍。观察了5名1×1011VP组受试者chAd3-EBO-Z的抗体持久性,免疫后259天,抗体水平轻微下降。初次免疫后,T细胞反应较轻微,chAd3-EBO-Z初免后,14/49受试者CD4+细胞或CD8+细胞的T细胞免疫反应阳性。在加强免疫后7天,CD4+细胞或CD8+细胞的T细胞免疫反应均增加。
2016年4月,Ewer在《新英格兰医学杂志》发表了ChAd3-EBO-Z初免、MVA-Filo加强免疫的长期免疫效果观察结果[10]。初次免疫受试者的剂量分别为1×1010、2.5×1010和5×1010,每组20人,每组中10人接受MVA-Filo加强免疫。免疫4周后,chAd3-EBO-Z初免与rVSV-ZEBOV免疫学效果相似,chAd3-EBO-Z的抗体滴度为752,而rVSV-ZEBOV的抗体滴度为921。2种疫苗的中和抗体滴度也相似,分别为 14.9和 22.2。MVA-Filo加强免疫后,抗体滴度升高了12倍,达到9007;CD8+T细胞反应升高了5倍,中和抗体滴度显著升高,达到139。ChAd3-EBO-Z免疫后6个月的抗体滴度为758,而经过MVA-Filo加强的受试者加强后6个月的抗体滴度为1750,加强后的免疫效果更好一些。
2.1.4 Ⅰ/Ⅱa期临床试验-4 2016年3月,Santis等在《柳叶刀传染病》杂志上发表了在瑞士洛桑开展的ChAd3-EBO-Z疫苗的随机、双盲、安慰剂对照的临床试验结果[11]。共120名受试者,分为安慰剂组(20人)、2.5×1010组(51人)和5×1010组(49人)。75%的高剂量组受试者、79%的低剂量组受试者及25%的安慰剂组受试者出现了局部不良反应。疲劳和恶心是最常见的系统不良反应,出现在62%的高剂量组受试者、60%的低剂量组受试者及25%的安慰剂组受试者中。头痛和发热也是较为常见的系统不良反应。免疫后28天,针对Ebola GP抗体值达到峰值,高剂量组为51 μg/mL,低剂量组为44.9 μg/mL,安慰剂组为3.2 μg/mL。免疫后180天,抗体值降低到高剂量组为25.5 μg/mL,低剂量组为22.1 μg/mL,安慰剂组为3.2 μg/mL。高剂量组受试者中,57%产生CD4+T细胞反应,67%产生CD8+T细胞反应;低剂量组受试者中,61%产生CD4+T细胞反应,69%产生CD8+T细胞反应。
2.2 人腺病毒 26载体埃博拉疫苗(Ad26-EBOV)
2016年 Milligan等在 JAMA发表了利用Ad26.ZEBOV与MVA-BN-Filo加强的临床试验结果[12]。该产品由美国制药公司Johnson&Johnson研制。这是一项单中心、随机、安慰剂对照、观察者盲态的Ⅰ期临床试验,在英国牛津开展,开始于2014年12月,结束于2015年10月。共入组87名18~50岁的受试者,分为5组,72人随机分入4组,每组18人,2组为首次免疫Ad26.ZE⁃BOV,分别再于免后29、57天免疫MVA-BN-Fi⁃lo;2组为首次免疫MVA-BN-Filo,分别再于免后29、57天免疫Ad26.ZEBOV。15人分配至开放研究组,首次免疫Ad26.ZEBOV,再于免后15天免疫MVA-BN-Filo。未见疫苗相关的严重不良事件。在随机组内,MVA-BN-Filo免后未出现发热,而Ad26.ZEBOV免后5%的受试者出现发热。在开放研究组,Ad26.ZEBOV免后27%的受试者出现发热。在随机组内,97%的Ad26.ZE⁃BOV接种者初次免疫后28天可检测到抗体,而23%的MVA-BN-Filo接种者初次免疫后28天可检测到抗体,在加强免疫后21天,所有受试者均可检测到抗体。加强免疫后7天,86%的受试者检测到特异性T细胞反应。免疫后240天,所有接种疫苗的受试者抗体仍然维持在高水平。
2.3 水泡性口炎病毒载体-埃博拉疫苗(rVSVZBEOV vaccine)
该疫苗是利用改造后的水泡性口炎病毒载体,表达Zaire Kikwit 1995型EBO GP蛋白,疫苗类型为复制型重组VSV病毒,在人体内能够持续复制,由加拿大公共卫生署研制,目前商业开发权转让给美国默克公司。
2.3.1 Ⅰ期临床试验-1 2015年4月1日在《新英格兰医学杂志》发表了VSV疫苗的Ⅰ期临床试验结果[7],是一项双盲、安慰剂对照、剂量递增的Ⅰ期临床试验,试验地点在美国,共入组52人,分为2个临床试验点,每个点26人,分为2组,2×107PFU组和3×107PFU组,每组13人中,10人注射疫苗,3人注射安慰剂。
该疫苗最常见的不良反应为注射部位疼痛、肌肉痛和虚弱,所有受试者均出现了暂时的VSV病毒血症。免疫后14天,2×107PFU组,19/ 20(95%)受试者阳转;3×107PFU组,18/20(90%)受试者阳转。2×107PFU组的抗体GMT值为857,而3×107PFU组的抗体GMT值为283。免疫4周后,所有受试者100%阳转,2×107PFU组的抗体 GMT值高于3×107PFU组(4079 vs 1300),基于假病毒的中和抗体水平分别为441和223。该试验未进行T细胞免疫检测。
2.3.2 Ⅰ期临床试验-2 2015年4月1日在《新英格兰医学杂志》发表了另外一篇VSV载体疫苗的Ⅰ期临床试验结果,包括3个开放、剂量递增的Ⅰ期试验和1个随机、双盲、对照的Ⅰ期试验,试验地点在欧洲和非洲,共入组158人。未发现严重的疫苗相关副反应。轻到中度的早期反应较为常见,但是暂时性的。在注射3×106PFU以上的110人受试者中,103人(94%)在免疫后3天内出现了疫苗的病毒血症,在唾液和尿液中未检测到rVSV。免疫后2周时,日内瓦的51名受试者中,有11名(22%)出现了1~4个关节的关节炎,疼痛持续的平均时间是8天左右。在德国和肯尼亚的40名受试者中出现了2个自限性疾病的受试者,1例在滑膜液中检出病毒,1例在皮肤水泡中检出病毒,说明在免疫后2周病毒仍在外周组织复制。
共分为6个剂量组,即3×105、3×106、1×107、2×107、5×107PFU组和安慰剂组。ELISA检测抗体时,低水平的阳性值在一些地方检测出(12/ 23,52%)。免疫4周后,所有疫苗组受试者都检测到了抗体,最低剂量3×105PFU组也显示出了免疫原性。在使用灭活病毒作为抗原的ELISA检测中,血清阳转率为53%。利用假病毒检测中和抗体时,91名受试者中有76人出现了阳转。尽管在GP蛋白ELISA和假病毒中和抗体之间有相关性,在试验中还是观察到一些较大的差异。在日内瓦的试验中,5×107PFU组和1× 107PFU组受试者中ELISA检测到了相似的GP抗体水平,GMT值分别为1780和1064,而中和抗体值分别为273和99,说明高剂量可能会激发更高的中和抗体水平。
2016年4月,在《新英格兰医学杂志》发表了该研究的最终研究结果[13]。未见疫苗相关的严重不良反应,轻到中度的早期不良反应常见但是很短暂。30%的受试者出现了发热。在免疫后180天时,抗体滴度仍维持在较高水平。与免疫后28天抗体值相比,抗体变化范围在0.59~1.59倍之间。
2.3.3 Ⅲ期临床试验 2015年7月31日在《柳叶刀》杂志发表了一项rVSV-ZEBOV疫苗的Ⅲ期临床试验[8],该研究于2015年4月1日至7月20日在几内亚开展,由WHO负责实施。这是一项开放、随机分组的环形接种试验,作为国家监测体系的一部分,由埃博拉反应小组来独立确定疑似Ebola病例,实验室确认新病例之后,首先定义这个组的接触者和接触者的接触者,按1∶1随机分配至立即接种组和延迟(21天后)接种组中,接种剂量为2×107PFU,未怀孕或哺乳期的成年人都可以入组。块随机(Block randomis⁃ation)是通过随机变化块、地域(城市或农村)、环的大小(≤20人或>20人)来进行分层。该试验是开放设计的,对受试者和不同接种时间的区域内的队伍来说不可能保持盲态,但埃博拉响应小组和实验室检测人员并不清楚立即接种组和延迟接种组的分配。考虑到体内病毒潜伏期约10天,预设的主要研究重点是入组后10天出现埃博拉病毒病症状且实验室确认的病例,根据立即接种组和延迟接种组的发病情况来进行分析。
试验共招募7651人,分90群(cluster),其中48群(4123人)立即接种,即在出现病例后,周围接触人群马上接种疫苗;42群(3528人)延迟接种(21天后),即出现病例后,周围接触人群在21天后接种疫苗。结果表明在接种10天之后,立即接种组没有出现感染病例,而延迟接种组出现了16例新发病例。在立即接种组和延迟接种组接种6天后,均没有出现新发病例,疫苗显示了良好的保护效果。试验中,共报告了43例SAE,其中1例被认为可能与疫苗接种相关(1例受试者出现了高热)。
2016年12月,Henao-Restrepo等在《柳叶刀》发表了VSV-ZEBOV疫苗的Ⅲ期临床试验的最终研究报告[14]。受试者人群包括几内亚和塞拉利昂的唐克里里和邦巴里地区,Ⅲ期临床试验最终招募8334人,根据感染病例分为117个群,其中包括194名儿童,5837人接种疫苗。该试验只监测了不良反应和Ebola病毒感染情况,未进行血清抗体方面的检测。在随机化分组部分,4539名受试者分为51个群,分配至立即接种组(3232人合格,2151人同意,2119人立即接种);4557人分为47个群,分配至延迟接种组(3096人合格,2539人同意,2041人随机化分组后21天接种)。立即接种组在接种10天后无发病人数,而延迟接种组在随机化分组后10天有16人(7个群)发病,疫苗显示了100%的有效性(95%CI 68.9~100.0,P=0.0045)。此外,19个非随机化分群共计2745人,其中2006人合格,1677人进行了立即接种,其中包括194名儿童。在所有的117个群中,立即接种组在接种10天后无发病人数,而延迟接种组在随机化分组后10天有23人(11个群)发病,总体而言,预估疫苗有效率为100%(95%CI 79.3~100.0,P= 0.0033)。所有疫苗接种者访视至84天,在免疫后14天53.9%的受试者至少报告了1项不良反应,大部分是轻度的。主要的副作用是头痛(25.4%)、疲劳(18.9%)和肌肉痛(13.1%)。出现了80例严重不良事件。2例被判定为与疫苗有关,分别是发热和过敏反应;1例流感样疾病是可能相关。3例均康复,无后遗症。
2.4 人5型腺病毒载体-埃博拉疫苗(Ad5-EBOV)
该疫苗是以人5型腺病毒(Ad5)为载体表达EBOV GP蛋白,疫苗类型为复制缺陷型重组腺病毒,在人体内不能持续复制。
2.4.1 Ⅰ期临床试验 2015年3月25日在《柳叶刀》发表了Ad5-EBOV的Ⅰ期临床试验[15],这是在江苏省泰州市进行的一项随机双盲、安慰剂对照的临床Ⅰ期研究。18~60岁的健康成年人顺序入组,按照2∶1的比例分别编入安慰剂组、低剂量组和高剂量组。所有参加者、研究者和实验室人员均为盲态。主要的安全性终点为接种7天内的征集性不良反应。主要的免疫原性终点是接种后28天的糖蛋白特异的抗体滴度和T细胞反应
在2014年12月28日至2015年1月9日间共招募120名受试者,分别入组低剂量组、高剂量组和安慰剂组,每组40人。受试者观察到28天。在接种7天内82名受试者(68%)报告至少有1项征集性副反应(安慰剂组19例,低剂量组27例,高剂量组36例,P=0.0002)。最常见的反应为注射部位的轻微疼痛,安慰剂组8人(20%),低剂量组14人(35%),高剂量组29例(73%),组间P<0.0001。其他副反应和实验室检测在组间无显著性差异。低剂量和高剂量组的受试者的糖蛋白特异的抗体水平显著升高,在14天时抗体GMT值分别为421.4和820.5(P< 0.0001);在28天时抗体几何平均值分别为682.7和1305.7(P<0.0001)。14天时T细胞反应达到峰值,低剂量组SFC中位数为465.0,高剂量组为765.0。共有21人(18%)轻微发热,包括安慰剂组9人、低剂量组6人和高剂量组6人。未观察到严重的副反应。研究结果表明高剂量疫苗Ad5-EBOV是安全的,免疫原性很强。1针高剂量Ad5-EBOV在14天时就能激发产生糖蛋白特异的体液免疫和T细胞反应来抵抗埃博拉病毒感染。
2016年12月22日,Ad5-EBOV加强免疫的研究结果发表在《柳叶刀全球卫生》上[16]。与上一研究同样的一批受试者,在首次免疫后6个月,再次接受同样剂量的疫苗免疫,观察至免疫后1年。原初的临床试验招募的120名受试者中,有110人参加了加强免疫(高剂量组38人,低剂量组35人,安慰剂组37人),初次免疫后6个月进行同种疫苗的加强免疫,诱导了针对埃博拉糖蛋白的强烈的体液免疫反应,这一反应强度要高于单针初次免疫所激发的免疫反应。加强免疫后28天抗体水平快速增长,相比于加强免疫前,低剂量组增长了30倍以上,达到6110.3(95%CI 4705.4~7934.6),高剂量组增长了20倍,达到11824.9(8903.6~15704.8)。接受1.6×1011VP疫苗的高剂量组受试者相比于低剂量组显示出更强的加强免疫后抗体滴度。然而,在此之后抗体水平逐渐下降。到加强免疫后12个月,低剂量组和高剂量组的抗体几何平均值分别为674.1(95%CI 505.9~898.2)和856.8(573.8~1279.2),仍然维持在相对较高的水平。
加强免疫后,特异T细胞反应适度增强,在低剂量组中,IFN-γ的斑点形成细胞数为23.3(IQR 16.7~90.0),高剂量组中这一数值为95.0(63.3~196.7),均显著高于安慰剂组。相比于加强免疫前,虽然加强免疫诱导了更高水平的IFN~γ表达,但这一表达水平显著低于初次免疫后28天的IFN~γ表达水平。研究结果表明在初免疫后6个月进行同种疫苗加强免疫能够引起强烈而持久的抗体反应。
2.4.2 Ⅱ期临床试验 2016年12月22日,在塞拉利昂开展的Ad5-EBOVⅡ期临床试验结果发表于《柳叶刀》[9]。这是一项随机、观察员单盲、安慰剂对照的Ⅱ期临床试验。18~50周岁的健康成年人随机以2∶1∶1的比例分别接受单针次高剂量(1.6×1011VP)和低剂量(8.0×1010VP)Ad5-EBOV或安慰剂,疫苗接种后对所有受试者进行6个月的随访。共招募500名受试者,分别接种了高剂量疫苗(250人)、低剂量疫苗(125人)或安慰剂(125人)。疫苗接种受试者的征集性注射部位不良反应显著高于安慰剂组(P= 0.0077),但大多数反应是轻度或中度的。高剂量疫苗组报告了3例严重不良反应事件。Ad5-EBOV诱导的ELISA EC90抗体阳性反应在免疫后14天可检测到,抗体反应在免疫后28天达到峰值,低剂量组抗体滴度为1471.8(95%CI:1151.0~1881.8),高剂量组抗体滴度为 2043.1(1762.4~2368.4)。疫苗诱导产生的抗体在之后的几个月内迅速下降。该研究表明Ad5-EBOV疫苗在塞拉利昂健康成年人中是安全的,且具有高免疫原性,以低剂量(8.0×1010VP)进行接种最佳。
3 结语
目前,已有临床数据证实,GP蛋白具有良好的免疫原性,可刺激机体产生免疫保护。rVSV-ZBEOV疫苗更是在Ⅲ期临床试验中验证了其保护性,证实了以GP蛋白为目标抗原的病毒载体疫苗的可行性。多种病毒载体类疫苗在人体上显示了很好的安全性和免疫原性,有望发展成为埃博拉疫苗。
[1]Martin J E,Sullivan N J,Enama M E,et al.A DNA vaccine for Ebola virus is safe and immuno⁃genic in a phase I clinical trial[J].Clin Vaccine Im⁃munol,2006,13:1267-1277.
[2]Ledgerwood J E,Costner P,Desai N,et al.A repli⁃cation defective recombinantAd5 vaccine expressing EbolavirusGP issafeandimmunogenicin healthy adults[J].Vaccine,2010,29(2):304-313.
[3]Kibuuka H,Berkowitz N M,Millard M,et al.Safe⁃ty and immunogenicity of Ebola virus and Marburgvirusglycoprotein DNA vaccinesassessed separately and concomitantly in healthy Ugandan adults: a phase 1b,randomised,double-blind,placebo-con⁃trolled clinicaltrial[J].Lancet,2015,385(9977):1545-1554.
[4]Tapia M D,Sow S O,Lyke K E,et al.Use of ChAd3-EBO-Z EbolavirusvaccineinMalianand US adults,and boosting of Malian adults with MVABN-Filo:a phase 1,single-blind,randomised trial, a phase 1b,open-label and double-blind,dose-esca⁃lation trial,and a nested,randomised,double-blind, placebo-controlled trial[J].Lancet Infect Dis,2016,16 (1):31-42.
[5]Ledgerwood J E,Sullivan N J,Graham B S.Chim⁃panzee adenovirus vectorEbola vaccine-preliminary report[J].N Engl J Med,2015,373(8):776.
[6]Ewer K,Rampling T,Venkatraman N,et al.A mon⁃ovalent chimpanzee adenovirus Ebola vaccine-prelimi⁃nary report[J].N EnglJ Med,2016,374(17):1635-1646.
[7]Regules J A,Beigel J H,Paolino K M,et al.A recombinantvesicularstomatitisvirusEbola vaccine [J].N Engl J Med,2017,376(4):330-341.
[8]Henao-Restrepo A M,Longini I M,Egger M,et al.Efficacy and effectiveness of an rVSV-vectored vac⁃cine expressing Ebola surface glycoprotein:interim re⁃sultsfrom the Guinea ring vaccination cluster-ran⁃domised trial[J].Lancet,2015,386(9996):857-866.
[9]Zhu F,Wurie A,Hou L,et al.Safety and immuno⁃genicity of a recombinant adenovirus type-5 vectorbased Ebola vaccine in healthy adults in Sierra Le⁃one:a single-centre,randomised,double-blind,place⁃bo-controlled, phase 2 trial[J].Lancet, 2017,389 (10069):621-628.
[10]Ewer K,Rampling T,Venkatraman N,et al.A mon⁃ ovalent chimpanzee adenovirus ebola vaccine boosted with MVA[J].N EnglJ Med,2016,374(17):1635-1646.
[11]Santis O D,Audran R,Pothin E,et al.Safety and immunogenicity ofa chimpanzeeadenovirus-vectored Ebola vaccine in healthy adults:a randomised,dou⁃ble-blind,placebo-controlled,dose-finding,phase 1/2a study[J].Lancet Infect Dis,2016,16(3):311-320.
[12]Milligan I D, Gibani M, Sewell R,et al.Safety and immunogenicity ofnoveladenovirus type 26-and modified vaccinia ankara-vectored ebola vaccines: a randomized clinicaltrial[J].JAMA,2016,315(15): 1610-1623.
[13]Agnandji S T,Huttner A,Zinser M E,et al.Phase 1 trials of rVSV Ebola vaccinein Africa and Europe [J].N Engl J Med,2016,374(17):1647-1660.
[14]Henao-Restrepo A M,Camacho A,Longini I M,et al.Efficacy and effectivenessofan rVSV-vectored vaccine in preventing Ebola virus disease:final re⁃sultsfrom the Guinea ring vaccination,open-label, cluster-randomised trial(Ebola Ça Suffi t!)[J].Lancet, 2016,S0140-6736(16):32621-32626.
[15]Zhu F,Hou L,Li J,et al.Safety and immunogenic⁃ity of a novel recombinant adenovirus type-5 vectorbased Ebola vaccine in healthy adults in China:pre⁃liminary report of a randomised,double-blind,place⁃bo-controlled, phase 1 trial[J].Lancet, 2015,385 (9984):2272-2279.
[16]Li J,Hou L,Meng F,et al.Immunity duration of a recombinant adenovirus type-5 vector-based Ebola vaccine and a homologous prime-boost immunisation in healthy adultsin China:finalreportofa ran⁃domised,double-blind,placebo-controlled,phase 1 trial[J].LancetGlob Health,2016,S2214-109X(16): 30367-30369.
An Overview of Clinical Trials for Ebola Vaccines
HOU Li-Hua*
Beijing Institute of Biotechnology,Beijing 100071,China
*Corresponding author,houlihua@sina.com
Several clinical trials for Ebola vaccines started after Ebola epidemic outbreak in 2014.Ebola vac⁃cines in the clinical trials mainly focused on viral vectors,such as human adenovirus vector(Ad5 and Ad26), Chimpanzee adenovirus vector(chAd3),vesicular stomatitis virus vector(VSV),vaccinia vector(MVA).Different vac⁃cination strategies were used in the clinical trials,including one immunization and prime-boost immunization.Those Ebola vaccines based on Ad5,Ad26,ChAd3 and MVA vectors showed good immunogenicity in phaseⅠand phaseⅡ clinical trials,and Ebola vaccine based on VSV vector showed protection efficacy in phaseⅢ clini⁃cal trial.
Ebola vaccine;clinical trials;virus-vector vaccines;immunogenicity
R373;R392
A
1009-0002(2017)01-0035-09
10.3969/j.issn.1009-0002.2017.01.007
2017-01-02
侯利华(1973-),女,研究员
侯利华,(E-mail)houlihua@sina.com
