埃博拉病毒截短型糖蛋白GPdmucin的表达与纯化
2017-04-17范鹏飞迟象阳宋小红房婷吴诗坡陈旖王潇霖张冠英于长明陈薇
范鹏飞,迟象阳,宋小红,房婷,吴诗坡,陈旖,王潇霖,张冠英,于长明,陈薇
军事医学科学院 生物工程研究所疫苗与抗体工程研究室,北京 100071
研究报告
埃博拉病毒截短型糖蛋白GPdmucin的表达与纯化
范鹏飞,迟象阳,宋小红,房婷,吴诗坡,陈旖,王潇霖,张冠英,于长明,陈薇
军事医学科学院 生物工程研究所疫苗与抗体工程研究室,北京 100071
目的:确定黏蛋白区缺失的埃博拉病毒包膜糖蛋白(GPdmucin)的最佳表达系统,并获得纯化的GPdmucin。方法:从埃博拉病毒的包膜糖蛋白(GP)全长基因上扩增GPdmucin序列,构建至pET32a、pFastBac1和pcDNA3.4三种不同表达系统的质粒中,分别在原核、昆虫和哺乳动物表达系统中进行表达,并用特异抗体鉴定表达情况。结果:原核系统表达的GPdmucin不稳定,活性差;在昆虫表达系统中,GPdmucin在细胞内以不溶形式表达;利用Expi293瞬时蛋白表达系统,GPdmucin在哺乳动物细胞中可溶性表达,Ni柱亲和层析获得的目的蛋白纯度达90%以上,且与特异抗体具有很好的结合活性。结论:获得哺乳动物细胞表达系统表达的GPdmucin蛋白,将用于GPcl的制备、GP抗体筛选、疫苗效果评价及病毒致病机理的研究。
埃博拉病毒;截短型糖蛋白;哺乳动物表达系统;生物学活性
2014年西非暴发埃博拉疫情,引起了世界范围的广泛关注和重视。埃博拉病毒属包括扎伊尔型(EBOV)、本迪布焦型(BDBV)、苏丹型(SUDV)、塔伊森林型(TAFV)和莱斯顿型(RESTV)等5种病毒[1-2],其中扎伊尔型埃博拉病毒对人类和非人灵长类有着极强的致死率,也是造成2014年埃博拉疫情的病原体。埃博拉病毒可引起快速而致命的出血热,严重威胁着人类健康,但截至目前尚无获批的针对埃博拉病毒的治疗和预防措施[3-5]。埃博拉病毒的糖蛋白(glycoprotein,GP)被认为与病毒入侵和细胞毒性相关,因而成为疫苗和抗体研究的重要靶标[6-7]。在病毒膜表面糖蛋白以三聚体形式存在,每个糖蛋白单体由GP1和GP2这2个亚基通过二硫键连接构成。根据结构和功能特点,GP1亚基可被划分成受体结合区(receptor bind⁃ing domain,RBD)、聚糖帽(glycan cap,GC)和黏蛋白区(mucinlike domain,MLD)[6,8]。病毒入侵过程中,病毒颗粒通过胞饮作用进入细胞[9-10]。在次级内体中病毒膜表面的糖蛋白被组织蛋白酶水解,切掉GC和MLD,暴露出被部分遮蔽的RBD。水解产生的待发状态GP(primed GP,GP⁃cl)通过与晚期内体表面的受体NPC1的C结构域(NPC1-C)结合,促进晚期内体与病毒膜融合,进而释放病毒RNA[11-15]。相关研究表明,删掉黏蛋白区后的GP,即GPdmucin(33~310 aa,463~632 aa),在体外可被嗜热菌蛋白酶水解切掉其上的GC,产生与自然感染过程中功能相似的GPcl结构[15,17-18]。表达构象完整、生物学活性良好的GPdmucin,对于GPcl的制备、埃博拉病毒抗体的检测和筛选等具有重要意义。目前,文献报道大多采用昆虫细胞表达系统制备GPd⁃mucin[16,18],也有报道采用HEK293T细胞表达该蛋白[19]。我们分别在原核、昆虫和哺乳动物细胞表达系统中对扎伊尔型埃博拉病毒的GPdmucin进行了表达,并用GP特异抗体MIL77-1/2/3[20]对纯化得到的蛋白进行了鉴定。
1 材料与方法
1.1 材料
Expi293细胞、Sf9细胞、pcDNA3.4质粒、pDC316-GGPopt质粒由本实验室保存;大肠杆菌Top10、BL21感受态细胞购自天根生化科技有限公司;限制性内切酶EcoRⅠ、HindⅡ、XhoⅠ、NdeⅠ购自NEB公司;胶回收试剂盒购自Omega公司;T4DNA连接酶、Pyrobest DNA聚合酶购自TaKaRa公司;转染级质粒小提系统购自Promega公司;Expi293培养基和转染试剂盒购自Gibco公司;蛋白电泳marker和BCA蛋白定量试剂盒购自 Thermo公司;Histrap FF纯化柱购自GE Healthcare公司;Western印迹化学发光试剂、离心浓缩管等购自Millipore公司;山羊抗人IgG Fc二抗购自Abcam公司;引物由上海生工生物工程股份有限公司合成;MIL771/2/3抗体由军事医学科学院基础医学研究所沈倍奋院士赠送(MIL77-1/2/3为埃博拉病毒中和单抗混合物ZMapp[21-22]所包含的3株抗体的优化株,其结合的表位已知,MIL77-1和MIL77-2结合于GP2亚基,MIL77-3结合于聚糖帽)。
1.2 重组表达质粒的构建
根据图1所示GPdmucin的结构设计构建质粒所需引物(表1)。
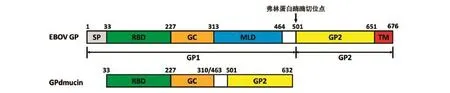
图1 GPdmucin结构示意图

表1 重组质粒构建的引物及序列
1.2.1 构建 pET32a-GPdmucin表达质粒 以pDC316-GGPopt为模板,用引物1、2扩增GPdmu⁃cin1片段,用引物3、4扩增GPdmucin2片段(PCR扩增条件:预变性95℃ 5min;变性95℃ 30 s,退火60℃ 30 s,延伸72℃ 50 s,共30个循环;72℃再延伸10min);以GPdmucin1和GPdmucin2回收产物为模板,用引物1、7扩增NdeⅠ-GPd⁃mucin-XhoⅠ片段(PCR扩增条件:预变性95℃5min;变性95℃ 30 s,退火 60℃ 30 s,延伸72℃ 90 s,共30个循环;72℃再延伸10min);NdeⅠ/XhoⅠ分别双酶切GPdmucin片段和pET32a质粒,回收目的片段后,将GPdmucin连接至pET32a载体;将pET32a-GPdmucin转化大肠杆菌Top10感受态细胞,挑取单克隆菌落交上海生工生物工程公司测序,提取质粒。
1.2.2 构建pFastBac1-gp67-GPdmucin-His表达质粒 合成gp67-GPdmucin(T42V/T230V)-His6基因,以其为模板,用引物6、8扩增EcoRⅠ-gp67-GPdmucin-His6-HindⅢ片段;EcoRⅠ/HindⅢ分别双酶切pFsatBac1质粒和GPdmucin片段,回收目的片段后,将GPdmucin连接至pFsatBac1质粒;将pFsatBac1-GPdmucin质粒转化大肠杆菌DH10Bac感受态细胞,涂X-gal平板,37℃孵育48 h;挑取白色克隆用M13引物和特异性引物PCR鉴定后交上海生工生物工程公司测序,提取质粒。
1.2.3 构建pcDNA3.4-GPdmucin表达质粒 以pDC316-GGPopt为模板,用引物5、9扩增信号肽tPA(PCR扩增条件:预变性95℃ 5min;变性95℃ 30 s,退火60℃ 30 s,延伸72℃ 10 s,共30个循环;72℃再延伸10min);以pET32a-GPd⁃mucin为模板,用引物10、4扩增GPdmucin片段;以前面2个PCR产物的回收片段为模板,用引物5、6扩增EcoRⅠ-tPA-GPdmucin-His6-HindⅢ片段;EcoRⅠ/HindⅢ分别双酶切pcDNA3.4质粒和插入片段,连接后转化大肠杆菌Top10感受态细胞,挑取单克隆菌落交上海生工生物工程公司测序,提取质粒。
1.3 GPdmucin在原核细胞中的表达
将 pET32a-GPdmucin质粒转化大肠杆菌BL21感受态细胞,挑取单克隆菌落转接至5mL含氨苄西林的LB培养基中,37℃、220 r/min振荡培养过夜;第2 d将菌液按1∶100转接至200mL新的含氨苄西林的LB培养基中,振荡培养约2.5 h至D600nm为0.6~0.8;加IPTG至终浓度为1mmol/L,37℃继续培养4 h;菌液于4℃、8000 r/min离心15min,收集菌体,用裂解缓冲液重悬,匀浆后超声波破碎细胞;4℃、10000 r/min离心15min,弃上清;包涵体用含2%DOC的裂解缓冲液洗涤,用含8 mol/L尿素的裂解缓冲液重悬;依次在含4、2、1、0.5、0 mol/L尿素的1×TGE缓冲液中透析,透析条件为4℃,每次透析6 h以上;透析液离心去除沉淀,上清经0.2 μm滤膜过滤后,用离心超滤管浓缩。
1.4 GPdmucin在昆虫细胞中的表达
处于对数期的Sf9细胞计数后铺6孔板,每孔8×105细胞;各取100 μL的空白培养基,一份(A)加入8 μL的Cell fectinⅡ,一份(B)加入0.5 ng的pFsatBac1-GPdmucin;A液室温静置30min后与B液混合,混合后的AB液室温放置20min;将上述混合液缓慢滴加至细胞中,28℃孵育约5 h后更换2mL完全培养基;28℃继续培养,定期观察,直到细胞出现病变;500 r/min离心5min,收获细胞上清,上清中包含P1代杆状病毒;以MOI=0.1感染Sf9细胞扩增获得高滴度的P2代病毒;P2代病毒经Q-PCR测定滴度后,避光短期保存于4℃,长期保存于-80℃;分别以MOI=0.1、0.5、1、5、10用P2代杆状病毒感染Sf9细胞,28℃培养96 h,收取细胞和上清,鉴定蛋白表达情况。
1.5 GPdmucin在哺乳动物细胞中的表达
转染前1 d测定Expi293细胞的数量和活率,接种2×106细胞至30mL试剂盒推荐的培养基中;以120 r/min转速悬浮培养,温度为37℃,CO2含量为5%;转染当天,检测细胞生长密度达到3×106/mL时,吸取80 μL ExpiFectamine 293试剂加入1.5mL培养基中,轻轻混匀后室温孵育5min;取构建好的pcDNA3.4-GPdmucin质粒30 μg加入1.5mL培养基中,轻轻混匀;将含有转染试剂或转染质粒的2种溶液混合,混匀后室温孵育25min以形成转染复合物,然后将其加入细胞培养瓶中;转染后12~16 h,在培养瓶中分别加入150 μL转染增强剂1和1.5mL转染增强剂2,继续培养144 h收样;收集的样品于4℃、8000 r/min离心10min,留上清。
1.6 Western印迹鉴定GPdmucin的表达
收集细胞表达样品,在含巯基乙醇的SDS上样缓冲液中煮沸5min;将蛋白电转移至硝酸纤维素膜上,电转条件为300 mA、1 h;用5%的脱脂奶粉于4℃封闭1 h,然后将MIL77-3抗体稀释至1 μg/mL,室温孵育1 h;1×TBST洗膜5次,6min/次;加入HRP标记的二抗,室温孵育1 h;1×TBST洗膜5次,6min/次;在膜上滴加化学发光试剂,室温孵育5min;将膜在化学发光成像系统中曝光。
1.7 Ni柱亲和层析纯化GPdmucin
采用Ni柱亲和层析纯化携带His标签的GPdmucin。Expi293培养液于4℃、8000 r/min离心15min,收集上清;用上样缓冲液(20mmol/L咪唑,500mmol/L NaCl,20mmol/L PB)平衡Histrap纯化柱;表达上清经0.22 μm滤器抽滤后,过纯化柱;上样缓冲液平衡纯化柱后,用洗脱缓冲液(500mmol/L咪唑,500mmol/L NaCl,20mmol/L PB)梯度洗脱蛋白,收集出现的蛋白峰。
1.8 ELISA鉴定纯化的GPdmucin的活性
纯化的GPdmucin以1 μg/mL包被,4℃孵育过夜;用2%BSA的封闭液室温孵育1 h;PBST洗涤2次后,用0.2%BSA稀释液将MIL77-1/2/3抗体从10 μg/mL的首孔浓度做1/2梯度稀释,室温孵育1 h;PBST洗涤6次后,加入HRP标记的二抗,室温孵育1 h;PBST洗涤6次,加入TMB单组分显色液室温显色5min;加入终止液,读取D450nm/630nm值。
2 结果
2.1 GPdmucin基因片段的扩增与鉴定
根据图1设计的GPdmucin,首先扩增2个拼接片段 GPdmucin1(834bp)和 GPdmucin2(510 bp),电泳分析结果与理论长度相符(图2)。将二者通过重叠延伸PCR融合成1344 bp的GPd⁃mucin片段,条带大小正确。将目的片段切胶回收后,用于构建各表达质粒。
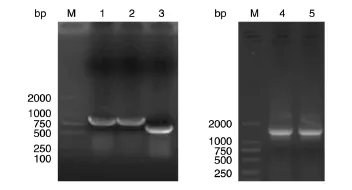
图2 PCR扩增GPdmucin片段
2.2 大肠杆菌BL21细胞表达不溶性及MIL77-1/3结合活性差的GPdmucin
GPdmucin在大肠杆菌BL21原核表达系统中表达量较高,1 L菌体可收获超过200 mg的包涵体。收集的菌体经超声波破碎、2%DOC洗涤,杂蛋白被很好地去除(图3)。在蛋白复性过程中,蛋白样品透析至1×TGE溶液中时出现少许絮状沉淀,经高速离心可去除。
为了分析得到的目的蛋白的构象是否正确及生物学活性是否完整保留,我们用结合于聚糖帽区域的 MIL77-3和结合于 GP2区域的MIL77-1分别作为一抗进行了ELISA分析,发现MIL77-1不能与原核系统表达的GPdmucin结合,而MIL77-3能与其弱结合(图4)。说明大肠杆菌BL21表达的GPdmucin经复性后与天然构象的GP在生物学活性上存在一定的差异,不能作为后期相关实验的材料。
图3 SDS-PAGE分析蛋白复性过程
图4 ELISA鉴定大肠杆菌BL21表达的GPdmucin与MIL77-1/3的结合
2.3 Sf9细胞内表达不溶性GPdmucin
我们用SOC培养基将pFastBac1-GPdmucin质粒转化大肠杆菌DH10Bac感受态细胞后进行蓝白斑筛选,挑选出序列正确的阳性克隆。用提取的质粒感染Sf9细胞,收集P1代病毒后扩增得到的P2代病毒,经Q-PCR测定滴度约为4.70×108pfu/mL。为了确定最佳感染复数,我们选取了0.1、0.5、1、5、10共5个MOI的病毒去感染Sf9细胞。收集感染后细胞的表达上清和胞体,用MIL77-3阳性抗体进行Western印迹分析。所有表达上清中均未检测到特异条带,而细胞样品中可以检测到目的蛋白,且细胞沉淀中蛋白的量随 MOI的增加而明显增多(图5A)。确定蛋白表达在胞内后,为了进一步分析GPdmucin蛋白的表达是否可溶,我们对收集的细胞超声波破碎后用上清和沉淀做了相同的Western印迹分析,最后确定GPdmucin以不可溶的形式表达于细胞中(图5B),这种情况下蛋白构象可能不正确而且难以进行纯化。
图5 Western印迹鉴定Sf9细胞表达的GPdmucin
2.4 Expi293细胞表达可溶性及MIL77-1/2/3结合活性良好的GPdmucin
我们采用未突变的GPdmucin基因序列构建了pcDNA3.4-tPA-GPdmucin-His质粒,然后在Ex⁃pi293系统中对目的蛋白进行了表达,经Ni柱纯化获得了GPdmucin。纯化过程各环节产物的SDS-PAGE分析结果如图6所示。
GP的基因序列中含有弗林蛋白酶(Furin)酶切位点(图1箭头所示),在细胞内合成的GP多肽链会被弗林蛋白酶酶切,形成通过二硫键连接的GP1(1~501 aa)和GP2(502~676 aa)2个亚基[6]。因此,构建的GPdmuin也是由与之对应的2部分组成,即GP1dmucin(33~310 aa,463~501 aa)和GP2(502~632 aa)。在还原剂存在的条件下,二硫键会被打开,因而呈现出相对分子质量为50 000~60 000和15 000~20 000的2条带(图6,泳道9)。条带弥散的原因是GPdmucin含有多个糖基化位点,糖基化修饰使得蛋白相对分子质量不均一。
对纯化收集的蛋白用相对分子质量30 000的离心超滤管浓缩,目的蛋白得到很好的富集,且滤过液中无目的蛋白损失。在非还原SDSPAGE中,GPdmucin为相对分子质量为70 000~75 000的单一条带(图6,泳道11),经ImageJ软件分析,蛋白纯度在90%以上。
对得到的蛋白用特异抗体MIL77-1/2/3通过Western印迹(图7A)和ELISA(图7B)分析其构象是否正确以及生物学活性是否良好。MIL77-1/2/3与 GPdmucin结合的 EC50值分别为0.020、0.072和0.017 μg/mL,与文献报道相符。几株特异抗体均能很好地与GPdmucin结合,提示其空间构象正确。Expi293系统表达的GPdmucin生物学活性得到很好保留,可满足后期研究需求。

图6 SDS-PAGE分析GPdmucin纯化过程
图7 Western印迹(A)和ELISA(B)分析鉴定Expi293表达的GPdmucin
3 讨论
丝状病毒科病毒的GP序列之间有着较高的序列同源性和结构相似性[18,23-24],因此对其中一种GP的研究具有广谱的意义,可为其他种病毒的研究提供相关信息。
我们用原核、昆虫和哺乳动物3种表达系统对GPdmucin进行了表达,发现3种系统的表达效果有着较大的差异。原核表达的优点是表达量较高,1 L菌液中的目的蛋白量可达几百毫克。但原核表达有着诸多缺点,如无糖基化修饰、以包涵体形式存在、蛋白复性过程复杂、目的蛋白构象不完全正确等。在实验过程中我们还发现复性得到的蛋白不是很稳定,冻融易出现沉淀。目前文献报道的表达GPdmucin基本采用昆虫细胞系统,经过我们多次尝试发现蛋白在该系统中确有表达,并且MOI越大蛋白表达量越高,但重组蛋白以不溶形式表达在细胞内。GPdmucin在昆虫系统中未能成功表达的原因,可能是使用的细胞状态欠佳或表达条件还须进一步优化。将GPdmucin的基因融合tPA信号肽和His标签后构建至pcDNA3.4质粒中,瞬转Expi293细胞构建GPdmucin的哺乳动物细胞表达体系,结果在上清中检测到目的蛋白的表达,亲和层析纯化获得GPdmucin,并且经特异抗体鉴定其构象正确、活性较好。
我们采用哺乳动物细胞表达制备了截短型GP——GPdmucin,30mL培养体系可以得到约3.5 mg纯化蛋白,最终得到的GPdmucin在埃博拉病毒临床受试者血清抗体检测中显示出较好的活性。相较昆虫表达系统而言,该系统方便快捷,表达量高;并且Expi293来源于人胚肾上皮细胞,采用该细胞表达的蛋白可能更接近于天然感染过程中病毒基因产生的蛋白。本研究对于丝状病毒科其他病毒膜表面GP的表达、GPdmucin和GPcl的制备具有借鉴意义,可为埃博拉病毒抗体的检测、疫苗的效力评价以及治疗性抗体中和机制的研究提供帮助。
[1]Fusco M L,Hashiguchi T,Cassan R,et al.Protec⁃tive mAbs and cross-reactive mAbs raised by immu⁃nization with engineered Marburg virus GPs[J].PLoS Pathog,2015,11(6):e1005016.
[2]Holtsberg F W,Shulenin S,Vu H,et al.Pan-ebo⁃lavirus and Pan-filovirus mouse monoclonal antibod⁃ies:protection against Ebola and Sudan viruses[J].J Virol,2015,90:266-278.
[3]Burke J,Declerq R,Ghysebrechts G.Ebola haemor⁃rhagic fever in Zaire,1976[J].Bull World Health Or⁃gan,1978,56:271-293.
[4]Muyembe-Tamfum JJ,MulanguS,MasumuJ,et al.Ebola virus outbreaks in Africa:past and present [J].Onderstepoort J Vet Res,2102,79:1-8.
[5]WHO Ebola Response Team.Ebola virus disease in West Africa-the first 9 months of the epidemic and forward projections[J].N Engl J Med,2014,371:1481-1495.
[6]Lee J E,Fusco M L,Hessell A J,et al.Structure ofthe Ebola virusglycoprotein bound to an anti⁃body from a human survivor[J].Nature,2008,454: 177-182.
[7]Lee J E,Saphire E O.Ebolavirus glycoprotein struc⁃ture and mechanism of entry[J].Future Virol,2009,4: 621-635.
[8]SanchezA,YangZ Y,Xu L,etal.Biochemical analysisofthe secreted and virion glycoproteinsof Ebola virus[J].J Virol,1998,72:6442-6447.
[9]Saeed M F,Kolokoltsov A A,AlbrechtT,etal.Cellularentry ofebolavirusinvolvesuptakebya macropinocytosis-like mechanism and subsequent traf⁃ficking through early and late endosomes[J].PLoS Pathog,2010,6:e1001110.
[10]Nanbo A,Imai M,Watanabe S,et al.Ebolavirus is internalized into host cells via macropinocytosis in a viral glycoprotein-dependent manner[J].PLoS Pathog, 2010,6:e1001121.
[11]Carette J E,Raaben M,Wong A C,et al.Ebola vi⁃rus entry requires the cholesterol transporter Nie⁃mann-Pick C1[J].Nature,2012,477(7364):340-343.
[12]Jeffers S A,Sanders D A,Sanchez A.Covalent modifications of the Ebola virus glycoprotein[J].J Vi⁃rol,2002,76:12463-12472.
[13]Cote M,Misasi J,Ren T,et al.Cunningham,small molecule inhibitors reveal Niemann-pick C1 is essen⁃tialforEbola virus infection[J].Nature,2011,477: 344-348.
[14]Miller E H,Obernosterer G,Raaben M,et al.Ebo⁃la virus entry requires the host-programmed recogni⁃tion of an intracellular receptor[J].EMBO J,2012,31: 1947-1960.
[15]NgM,NdungoE,JangraR K,etal.Cellentry by a novel European filovirus requires host endosom⁃al cysteine proteases and Niemann-pick C1[J].Virolo⁃gy,2014,0:637-646.
[16]Wang H,Shi Y,Song J,et al.Ebola viral glycopro⁃tein bound to its endosomal receptor Niemann-pick C1[J].Cell,2016,164:258-268.
[17]Schornberg K,Matsuyama S,Kabsch K,et al.Role ofendosomalcathepsins in entry mediated by the Ebola virus glycoprotein[J].J Virol,2006,4174-4178.
[18]HashiguchiT,FuscoM L,BornholdtZ A,etal.StructuralbasisforMarburg virusneutralization by a cross-reactive human antibody[J].Cell,2015,160: 904-912.
[19]Keck Z Y,Enterlein S G,Howell K A,et al.Ma⁃caque monoclonal antibodies targeting novel con⁃served epitopes within Filovirus glycoprotein[J].J Vi⁃ rol,2015,90:279-291.
[20]Qiu X,Audet J,LvM,et al.Two-mAb cocktail protects macaques against the Makona variant of Eb⁃ola virus[J].SciTransl Med,2016,8:329ra33.
[21]Qiu X,Wong G,Audet J,et al.Reversion of ad⁃vanced Ebola virus disease in nonhuman primates with ZMapp[J].Nature,2014,514(7520):47-53.
[22]Davidson E,Bryan C,Fong R H,et al.Mechanism of binding to Ebola virus glycoprotein by the ZMapp,ZMAb,and MB-003 cocktail antibodies[J].J Virol,2015,89:10982-10992.
[23]Flyak A I,Shen X,Murin C D,et al.Cross-reac⁃tive and potent neutralizing antibody responses in hu⁃man survivors of natural Ebolavirus infection[J].Cell, 2016,164:392-405.
[24]Carroll S A,Towner J S,Sealy T K,et al.Molecu⁃lar evolution ofviruses ofthe family Filoviridae based on 97 whole-genome sequences[J].J Virol, 2013,87(5):2608-2616.
(“科研管理”、“综述”、“研究报告”栏目责任编辑:阎明凡;英文审校:于学玲)
Expression and Purification of a Truncated Form of Ebola Virus Glycoprotein
FAN Peng-Fei,CHI Xiang-Yang,SONG Xiao-Hong,FANG Ting,WU Shi-Po, CHEN Yi,WANG Xiao-Lin,ZHANG Guan-Ying,YU Chang-Ming*,CHEN Wei*
Laboratory of Vaccine and Antibody Engineering,Beijing Institute of Biotechnology,Beijing 100071,China
*Co-corresponding authors,YU Chang-Ming,E-mail:yuchangming@126.com;CHEN Wei,E-mail:cw0226@foxmail.com
Objective:To determine the optimal expression system of a truncated envelope glycoprotein(GPdmu⁃cin)of Ebola virus,and to obtain purified GPdmucin.Methods:The GPdmucin sequences were amplified from full-length gene of glycoprotein(GP)and cloned into pET32a,pFastBac1 and pcDNA3.4 vectors,then they were transfected into prokaryotic,insect and mammalian expression systems,respectively.The expression of GPdmucin was identified through Western blotting.Results:The GPdmucin expressed in prokaryotic cells was unstable,and had poor biological activity.In the insect expression system,insoluble GPdmucin was expressed intracellularly.Sol⁃uble GPdmucin was produced in Expi293 mammalian transient protein expression system,and the purity of which was over 90%after purification by Ni affinity chromatography.The biological activity of GPdmucin was confirmed⁃with specific antibodies in ELISA.Conclusion:GPdmucinhas been expressed in mammalian expression systems, and it can be used in production of GPcl,screening of GP specific antibodies,evaluation of vaccine efficacy and research on viral pathogenesis.
Ebola virus;GPdmucin;mammalian expression system;biological activity
Q78;R392
A
1009-0002(2017)01-0050-08
10.3969/j.issn.1009-0002.2017.01.009
2017-01-02
国家科技重大专项(2014ZX09J14301)
范鹏飞(1993-),男,硕士研究生
于长明,(E-mail)yuchangming@126.com;陈薇,(E-mail)cw0226@foxmail.com
