制备禽致病性大肠杆菌菌蜕的三种方法比较
2017-04-16胡剑刚董洪亮付立霞左佳坤吴小卡米荣升黄燕陆珂陈兆国韩先干胡世君
胡剑刚,董洪亮,付立霞,左佳坤,吴小卡,米荣升,黄燕,陆珂,陈兆国,韩先干,胡世君
1 西南大学动物科学学院,重庆 402460
2 中国农业科学院上海兽医研究所,上海 200241
3 扬州大学 动物科学与技术学院 江苏省人畜共患病学重点实验室,江苏 扬州 225009
细菌菌蜕是应用噬菌体 PhiX174的裂解基因E在革兰氏阴性菌中表达后形成不含细胞质及细胞器的细菌空壳,通常是通过对裂解基因E的严格温度调控实现[1-3]。裂解基因E编码一种含91个氨基酸的膜蛋白,该蛋白能够融合在革兰氏阴性菌的内外膜并使菌膜形成 1个直径40−200 nm的特异性跨膜通道[4-5]。在渗透压的作用下,使菌体内容物排出,但内外膜结构和成分基本不变,细菌菌蜕作为一种优良的新型疫苗及佐剂正受到越来越多的关注[6-7]。
细胞穿透肽 (Cell penetrating peptides,CPPs) 是一些能穿透细胞膜的小分子肽,它们一般不超过30个氨基酸,总体多带正电荷,具有两极性[8]。CPPs可以充当药物分子的运载工具,并且有些本身就具有一定的生物学功能[9-10]。发现最早的细胞穿透肽是人免疫缺陷病毒的反式转录激活 (Trans-activator of transcription,Tat)蛋白,随后又在自然界发现和人工合成了各种细胞穿透肽,这些细胞穿透肽不受细胞类型的限制,共价或非共价结合一些核酸、蛋白或颗粒性物质穿过细胞膜进入细胞[11]。细胞穿透肽的研究多集中于对真核细胞的作用,对细菌等原核细胞研究较少。有研究表明,由于原核生物不存在膜修复机制,一些具有抗微生物作用的细胞穿透肽作用于细菌后,能产生类似菌蜕的结构;模型两亲肽 (Model amphipathic peptide,MAP)是一个大小为18个氨基酸的细胞穿透肽[12]。为了验证 MAP是否能裂解禽致病性大肠杆菌(Avian pathogenicEscherichia coli,APEC) 形成菌蜕,本研究通过利用噬菌体 PhiX174的裂解基因E构建的溶菌质粒pBV220-E、合成细胞穿透肽MAP以及构建表达MAP的pBV220-MAP,分别作用于APEC分离株DE17制备菌蜕,分析比较它们的差异,为进一步研究菌蜕疫苗、提高菌蜕疫苗的安全性研究提供参考。
1 材料与方法
1.1 菌株、载体及试剂
APEC DE17株分离于大肠杆菌感染鸭,由本实验室保存[13];大肠杆菌 DH5ɑ感受态、质粒抽提试剂盒购买自天根 (Tiangen) 公司;pBV220温度敏感型载体由本实验室保存[14],PhiX174 DNA、DNA marker、Ligation mix试剂盒、PCR mix、限制性内切酶EcoR Ⅰ和PstⅠ均购自TaKaRa公司;DNA纯化回收试剂盒购自Thermo Fisher公司。所用引物 (表1) 均由上海华津生物科技有限公司合成。
1.2 溶菌质粒pBV220-E的构建
根据GenBank上的噬菌体PhiX174的裂解基因E序列 (Accession No. 9626372),设计1对引物 E-F、E-R扩增E基因的 ORF,跨幅为276 bp。在引物 5′端分别引入限制性酶切位点EcoR Ⅰ和PstⅠ,用于构建表达质粒。
PCR扩增条件为:94 ℃4 min ;94 ℃ 40 s,52 ℃ 40 s,72 ℃ 30 s,30 个循环;72 ℃延伸10 min。PCR产物经1.0%琼脂糖凝胶电泳检测扩增结果,PCR扩增产物用DNA纯化试剂盒回收。
对pBV220和E基因进行EcoR Ⅰ和PstⅠ双酶切,用 Ligation mix连接酶连接,转化DH5α,鉴定阳性克隆,将鉴定正确的质粒命名为pBV220-E。
1.3 运用溶菌质粒pBV220-E制备DE17菌蜕
分别将质粒pBV220和溶菌质粒pBV220-E与100 μL DE17电转化感受态混合,加入到1 mm的电转杯中,用BIO-RAD电转仪进行电转,电转电压2.2 kV,电转后立即加SOC,28 ℃摇菌1 h,涂布于LB (100 μg/mL氨苄青霉素) 平板28 ℃培养。挑取单菌落进行鉴定,筛选阳性克隆。
将含有质粒pBV220或溶菌质粒pBV220-E的阳性克隆DE17接种于LB (100 μg/mL氨苄青霉素) 液体培养基,28 ℃、200 r/min摇床培养至OD600值为 1,分别接种于 2份 100 mL LB(100 μg/mL氨苄青霉素) 液体培养基中,28 ℃、200 r/min摇床培养至OD600值约为0.4。迅速将温度升高至42 ℃进行诱导,每30 min取一次样,利用分光光度计测其OD600值,绘制溶菌曲线。
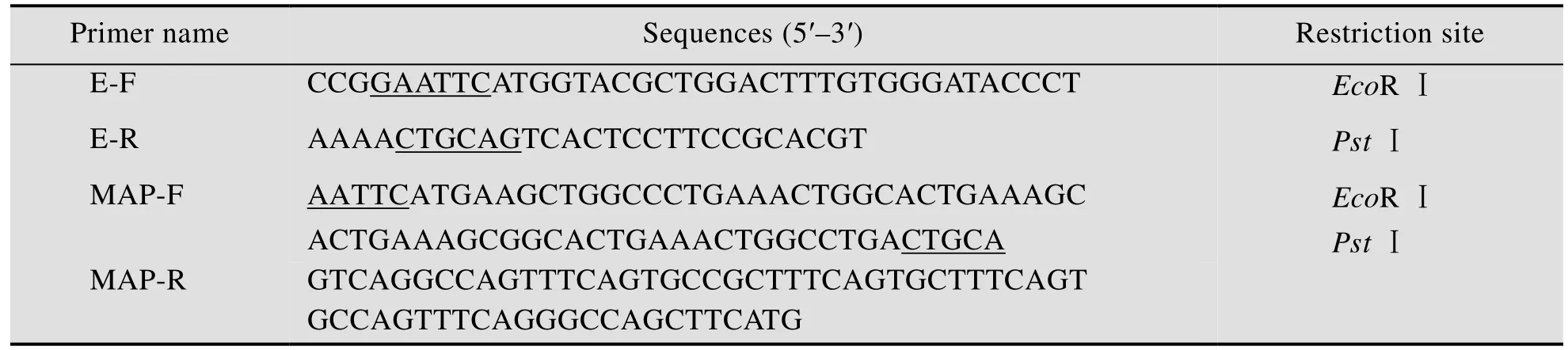
表1 本研究中所用引物序列Table 1 Primers sequence used in this study
分别取上述42 ℃诱导0 h和4 h后的菌液100 μL,用无菌PBS溶液进行梯度稀释后,取20 μL接种到LB固体培养基上。37 ℃恒温培养过夜后进行活菌计数,统计各梯度活菌数 (CFU),每个稀释度3个重复;通过适当梯度CFU计算溶菌效率。计算细菌溶菌效率,计算公式为:溶菌率=(1−诱导后CFU/诱导前CFU)×100%。
1.4 细胞穿透肽MAP制备DE17菌蜕
参照文献[15],经上海吉尔多肽有限公司合成细胞穿透肽MAP,其氨基酸序列 (从N端→C端) 为KLALKLALKALKAALKLA,分子式为C90H170N24O18,分子量大小1876.51,纯度≥90.60%。
用过滤除菌的10 mmol/L的Na2HPO4溶解合成的细胞穿透肽MAP,配制成10 μmol/L的MAP溶液备用。接种DE17于液体LB培养基,37 ℃培养至对数生长期,收集菌体,用无菌PBS清洗3遍后,分别用10 μmol/L的MAP溶液稀释DE17菌体至OD600值为0.1和0.2,用10 mmol/L的 Na2HPO4溶液稀释 DE17菌体至OD600值为0.1和0.2,作为对照组。将上述菌液接种于96孔板 (每孔 200 μL,3 个重复),21 ℃作用 1 h。
将96孔板中作用1 h后的菌液取出100 μL,作梯度稀释后,接种到LB固体平板上,37 ℃恒温培养12 h。统计各组活菌数 (CFU),计算MAP的溶菌效率。
1.5 pBV220-MAP质粒的构建及DE17菌蜕的制备
根据细胞穿透肽MAP的氨基酸序列,经优化后,获得编码MAP的核苷酸序列,设计引物MAP-F和 MAP-R,在引物 MAP-F的 5′和 3′端分别引入限制性酶切位点EcoRⅠ和PstⅠ,扩增MAP的核苷酸序列,引物序列见表1。
用STE缓冲液 (10 mmol/L Tris-HCl,50 mmol/L NaCl,1 mmol/L EDTA) 分别溶解引物MAP-F与MAP-R,然后将溶解后的MAP-F与MAP-R等体积混合后于94 ℃水浴5 min,冷却至室温。变性退火后的引物形成可与EcoRⅠ/PstⅠ酶切产物互补的粘性末端,用连接酶将其连入经EcoRⅠ/PstⅠ酶切后的pBV220载体中,得到重组质粒pBV220-MAP。
构建的 pBV220-MAP质粒送到上海华津生物科技有限公司测序。参照 1.3中用质粒 pBV220-E制备菌蜕的方法,用质粒pBV220-MAP作用于DE17制备菌蜕。
1.6 扫描电镜观察
将正常培养的 DE17、溶菌质粒 pBV220-E诱导后的 DE17及细胞穿透肽 MAP作用后的DE17菌体分别收集起来,2.5%戊二醛4 ℃固定过夜,用PBS (pH 7.2) 洗涤3次后,然后用四氧化锇4 ℃固定1.5 h。乙醇逐级脱水,乙酸戊二酯置换,干燥后喷金,在扫描电镜下观察 (美国FEI公司,Tecnai G2 F30 S-TWIN)。
2 结果
2.1 溶菌质粒pBV220-E及pBV220-MAP的构建
用E基因特异性引物,以PhiX174 DNA为模板,扩增出一条约276 bp的条带,与预期结果相符。电泳检测结果表明,溶菌质粒pBV220-E经EcoRⅠ和PstⅠ双酶切获得了与预期大小相同的目的片段。同时溶菌质粒 pBV220-E测序结果表明,E基因已被克隆至温控载体pBV220中,且阅读框架正确,证明已成功构建溶菌质粒 pBV220-E (图 1)。
测序结果表明,成功构建溶菌质粒pBV220-MAP (图 2)。
2.2 溶菌质粒制备DE17菌蜕及其裂解效率
将含有溶菌质粒pBV220-E的DE17菌株,28 ℃培养至OD600为0.4,温度迅速升至42 ℃开始诱导,前30 min,OD600值上升至0.9,然后开始下降,60 min后其OD600值基本无变化。而含有质粒pBV220或pBV220-MAP的DE17菌株其OD600值持续上升,未见明显下降 (图3)。
溶菌质粒pBV220-E对DE17的裂解效率检测表明,溶菌前菌液的CFU为2.63×107,而溶菌后的CFU为2.5×104,溶菌效率达到99.9%;而pBV220-MAP对DE17诱导前和诱导后的菌液进行计数,计算溶菌效果,结果发现无溶菌效果。

图1 PCR扩增E基因和溶菌表达载体酶切鉴定结果Fig. 1 PCR amplification of E gene and endonuclease digestion identification of the lysis vector pBV220-E.M: DNA marker (DL5000); 1: PCR product of the E gene; 2: double endonuclease digestion of pBV220-E;3: negative control.

图2 pBV220-MAP测序结果Fig. 2 The sequence result of pBV220-MAP.

图3 分别含有pBV220、pBV220-E或pBV220-MAP的DE17溶菌与生长曲线Fig. 3 Growth and lysis curves of DE17 harboring the plasmid pBV220, pBV220-E or pBV220-MAP, respectively.
2.3 细胞穿透肽MAP作用DE17产生菌蜕
DE17菌体用10 μmol/L的细胞穿透肽MAP溶液稀释成OD600为0.1和0.2,作用1 h后,CFU统计如表2所示。
细胞穿透肽 MAP对 DE17的裂解作用表明,10 μmol/L的细胞穿透肽 MAP溶液作用OD600=0.1的 DE17菌液后,其溶菌效率达到100%,对OD600=0.2的DE17菌液也具有一定灭活作用。而对照组10 mmol/L的Na2HPO4溶液对OD600为0.1和0.2的DE17作用1 h后不发生溶菌作用。

表2 细胞穿透肽MAP灭活效果Table 2 The inactivation efficiency of MAP
2.4 扫描电镜观察
扫描电镜观测结果如图4所示,正常培养的DE17对照呈现完整的细胞表面结构。运用溶菌质粒pBV220-E制备的DE17菌蜕,两端或中部形成可见的跨膜孔道 (箭头所示),裂解细菌保存了基本完好的外膜结构,呈现典型的菌蜕结构。细胞穿透肽 MAP作用后的 DE17并未看到明显的穿孔,但表面膜形态结构形成一定的沟壑状 (图4)。
3 讨论

图4 DE17及其菌蜕扫描电镜图 (放大倍数为40000倍)Fig. 4 Scanning electron micrograph of DE17 and DE17 bacterial ghosts (40000×). (A) DE17. (B) DE17 bacterial ghosts induced by the lysis plasmid pBV220-E. (C) DE17 bacterial ghosts induced by the cell penetrating peptide MAP.
细菌菌蜕作为一种优良的新型疫苗及佐剂正受到越来越多的关注,菌蜕作为疫苗与传统的疫苗相比,不存在毒力返强等问题,保留了良好的免疫原性,可刺激机体产生更强的免疫反应,因此较常规疫苗具有更好的免疫保护效果,同时还具有天然免疫佐剂效应和靶向性载体的作用[16-19]。制备细菌菌蜕通常通过噬菌体PhiX174裂解基因E的可控性表达实现,但一些细菌尤其是大肠杆菌不能实现完全灭活,为了更好地提高溶菌效率,往往共表达金黄色葡萄球菌核酸酶基因 (SNA基因),但仍难以达到100%的裂解效率[20-23]。细胞穿透肽是近十几年来陆续发现的一些具有穿透细胞膜的小分子肽,根据结构特点可以将CPPs分为阳离子型、两亲性型和疏水型。由于它们不受细胞类型的限制,且能够结合携带一些难以进入细胞的物质穿过细胞膜发挥其作用,所以其作为一种新型的载体也受到越来越多的重视。关于细胞穿透肽的研究主要集中于对真核细胞的作用,对细菌等原核生物的研究较少,有国外学者发现一些细胞穿透肽具有抗微生物的作用,并能够快速作用大肠杆菌产生菌蜕结构。然而,现在关于CPPs的穿膜机制仍然不是很清楚,自从有细胞穿透肽报道以来,转导机制就一直是研究热点,但是确切的机制目前仍不明确,国外学者提出了一些假说,多数学者赞同内吞介导的穿膜机制[24-25],但仍然存在诸多争议。本研究通过构建温控敏感型溶菌质粒pBV220-E、合成细胞穿透肽MAP和构建表达MAP的 pBV220-MAP质粒,开展了对APEC分离株DE17菌蜕制备研究。通过实验结果可以看出,溶菌质粒构建费时,需要多个步骤导入DE17,作用于DE17产生菌蜕需要较长时间,且无法达到 100%的溶菌效率;与之相比,细胞穿透肽MAP作用于DE17产生菌蜕过程方法简便,只需要一定浓度的 MAP与DE17共培养,且能快速产生菌蜕,对低浓度的菌量 (OD600=0.1) 可以达到 100%的溶菌效率,但是由于多肽合成成本较高,因此受到一定的限制。而构建的pBV220-MAP溶菌质粒无法在胞内发挥类似于裂解基因E的溶菌作用,推测可能的原因如下:1) 有可能是在胞内不能正常表达或是表达的量不足,而不能起到溶菌作用;2) 也有可能是 MAP只能在胞外发挥作用,而在胞内表达的MAP不具有穿膜能力,不能有效分泌到胞外发挥作用,具体机制仍有待进一步研究。此外,研究表明,显示细胞穿透肽进入细胞可能有多个通路,具体哪一种通路占主导方式可能与细胞穿透肽本身、穿透肽浓度、其携带的载物及靶组织有关[24,26-27]。
对不同方法制备的 APEC的菌蜕形态研究表明,温控溶菌质粒产生的菌蜕能形成典型的跨膜孔道,该膜蛋白能融合在革兰氏阴性菌的内外膜从而形成1个直径在40–200 nm的特异性跨膜通道[4]。而细胞穿透肽 MAP作用产生的菌蜕形成一定的沟壑状,研究表明,细胞穿透肽的穿膜机制主要有直接转运、细胞内吞和通过形成某种跨膜结构发生转导的方式进行[28],可能正是由于E基因与细胞穿透肽对细菌的作用机制不同,从而导致两者产生菌蜕的形态有明显差异,裂解效率也存在一定差距,但是两种方法产生的细菌菌蜕均保持了基本完整的外膜结构。
本研究通过研究不同的 APEC菌蜕制备方式,分析比较其差异,为进一步研究菌蜕疫苗、提高菌蜕疫苗的安全性提供参考。
[1] Witte A, Bläsi U, Halfmann G, et al. Phi X174 protein E-mediated lysis ofEscherichia coli.Biochimie, 1990, 72(2/3): 191–200.
[2] Halfmann G, Götz F, Lubitz W. Expression of bacteriophage PhiX174 lysis geneEinStaphylococcuscarnosusTM300. FEMS Microbiol Lett, 1993, 108(2): 139–143.
[3] Lubitz W. Bacterial ghosts as carrier and targeting systems. Expert Opin Biol Ther, 2001, 1(5): 765–771.
[4] Witte A, Brand E, Mayrhofer P, et al. Mutations in cell division proteins FtsZ and FtsA inhibit φX174 protein-E-mediated lysis ofEscherichia coli. Arch Microbiol, 1998, 170(4): 259–268.
[5] Guo RX, Geng SZ, Jiao HM, et al. Evaluation of protective efficacy of a novel inactivatedSalmonella pullorumghost vaccine against virulent challenge in chickens. Vet Immunol Immunopathol, 2016, 173: 27–33.
[6] Kudela P, Koller VJ, Lubitz W. Bacterial ghosts(BGs)–advanced antigen and drug delivery system.Vaccine, 2010, 28(36): 5760–5767.
[7] Sadeyen JR, Wu ZG, Davies H, et al. Immune responses associated with homologous protection conferred by commercial vaccines for control of avian pathogenicEscherichia coliin turkeys. Vet Res, 2015, 46: 5.
[8] Sebbage V. Cell-penetrating peptides and their therapeutic applications. Biosci Horiz, 2009, 2(1):64–72.
[9] Taylor BN, Mehta RR, Yamada T, et al. Noncationic peptides obtained from azurin preferentially enter cancer cells. Cancer Res, 2009, 69(2): 537–546.
[10] Johansson HJ, El-Andaloussi S, Holm T, et al.Characterization of a novel cytotoxic cell-penetrating peptide derived from p14ARF protein. Mol Ther, 2007, 16(1): 115–123.
[11] Frankel AD, Pabo CO. Cellular uptake of the tat protein from human immunodeficiency virus. Cell,1988, 55(6): 1189–1193.
[12] Palm C, Netzereab S, Hällbrink M. Quantitatively determined uptake of cell-penetrating peptides in non-mammalian cells with an evaluation of degradation and antimicrobial effects. Peptides,2006, 27(7): 1710–1716.
[13] Chen WJ, Han XG, He L, et al. Characterization of duck pathogenicEscherichia coli. Chin J Animal Infect Dis, 2010, 18(2): 34–40 (in Chinese).陈文静, 韩先干, 何亮, 等. 鸭致病性大肠杆菌的分离鉴定及其生物学特性分析. 中国动物传染病学报, 2010, 18(2): 34–40.
[14] Zhang ZQ, Yao LH, Hou YD. Construction and application of a high-level expression vector containing PRPLpromoter. Chin J Virol, 1990,6(2):111–116 (in Chinese).张智清, 姚立红, 侯云德. 含PRPL启动子的原核高效表达载体的组建及其应用. 病毒学报, 1990,6(2): 111–116.
[15] Palm-Apergi C, Hällbrink M. A new rapid cell-penetrating peptide based strategy to produce bacterial ghosts for plasmid delivery. J Control Release, 2008, 132(1): 49–54.
[16] Riedmann EM, Kyd JM, Cripps AW, et al.Bacterial ghosts as adjuvant particles. Expert Rev Vaccines, 2007, 6(2): 241–253.
[17] Hajam IA, Dar PA, Appavoo E, et al. Bacterial ghosts ofEscherichia colidrive efficient maturation of bovine monocyte-derived dendritic cells. PLoS ONE, 2015, 10(12): e0144397.
[18] Jawale CV, Lee JH. Evaluation of immunogenicity and protective efficacy of adjuvantedSalmonella typhimuriumghost vaccine against salmonellosis in chickens. Vet Q, 2016, 36(3): 130–136.
[19] Liu J, Wang WD, Liu YJ, et al. Mice vaccinated with enteropathogenicEscherichia colighosts show significant protection against lethal challenges. Lett Appl Microbiol, 2012, 54(3):255–262.
[20] May T, Gleiter S, Lilie H. Assessment of cell type specific gene transfer of polyoma virus like particles presenting a tumor specific antibody Fv fragment. J Virol Methods, 2002, 105(1): 147–157.
[21] Haidinger W, Mayr UB, Szostak MP, et al.Escherichia colighost production by expression of lysis geneEand Staphylococcal nuclease. Appl Environ Microbiol, 2003, 69(10): 6106–6113.
[22] Haidinger W, Szostak MP, Beisker W, et al. Green fluorescent protein (GFP)-dependent separation of bacterial ghosts from intact cells by FACS.Cytometry, 2001, 44(2): 106–112.
[23] Langemann T, Koller VJ, Muhammad A, et al. The Bacterial ghost platform system: production and applications. Bioeng Bugs, 2010, 1(5): 326–336.
[24] Gump JM, June RK, Dowdy SF. Revised role of glycosaminoglycans in TAT protein transduction domain-mediated cellular transduction. J Biol Chem, 2010, 285(2): 1500–1507.
[25] Järver P, Langel Ü. Cell-penetrating peptides--a brief introduction. Biochim Biophys Acta, 2006,1758(3): 260–263.
[26] Jiao CY, Delaroche D, Burlina F, et al.Translocation and endocytosis for cell-penetrating peptide internalization. J Biol Chem, 2009,284(49): 33957–33965.
[27] Maniti O, Piao HR, Ayala-Sanmartin J. Basic cell penetrating peptides induce plasma membrane positive curvature, lipid domain separation and protein redistribution. Int J Biochem Cell Biol,2014, 50: 73–81.
[28] Guo ZR, Peng HY, Kang JW, et al. Cell penetrating peptides: research progress of a novel non-viral vectors. China Biotechnol, 2016, 36(6):100–106 (in Chinese).郭争荣, 彭焕彦, 亢继文, 等. 细胞穿透肽: 一种新型非病毒载体. 中国生物工程杂志, 2016,36(6): 100–106.
