戴氏虫草菌丝体抗肿瘤化学成分研究
2017-04-15刘柏岑潘卫东娄华勇晏文涛吴
刘柏岑 +潘卫东 +娄华勇 晏文涛++吴翱兰+刘杰麟
摘要:研究戴氏虫草菌丝体抑制肿瘤细胞增殖活性有效部位的化学成分及其抑制肿瘤细胞活性。采用液体深层发酵制备戴氏虫草菌丝体,MTT法筛选其抑制肿瘤细胞增殖活性的有效部位,反复正相柱层析,Sephadex LH-20等方法分离纯化其有效部位中的化学成分,利用EI、ESI及1D-NMR等技术对其结构进行鉴定;并研究他们对肿瘤细胞增殖的抑制活性。结果显示,戴氏虫草菌丝体石油醚、乙酸乙酯萃取部位为抑制肿瘤细胞增殖活性部位,并从中分离得到6个化合物,分别为反式-16-十八碳烯酸(化合物1)、壬二酸(化合物2)、5α,8α-麦角甾-6,22-二烯-3β-醇(化合物3)、亚油酸甲酯(化合物4)、亚油酸(化合物5)和十七-烷醇(化合物6)。活性检测表明,化合物2对舌癌Tca-8113细胞增殖具有较高的抑制活性,IC50值为31.90 μmol/L,化合物3对乳腺癌MDA-MB-435细胞和BT474细胞具有较高的细胞增殖抑制活性,IC50值分别为25.57、26.31 μmol/L。从戴氏虫草菌丝体抑制肿瘤细胞增殖的活性部位中分离到6个化合物,化合物1~2、4~6为首次从该菌丝体中分离得到。化合物2、3分别选择性地对 Tca-8113 细胞和MDA-MB-435细胞、BT474细胞有较强的细胞增殖抑制活性,可能为戴氏虫草菌丝体抑制肿瘤细胞增殖的有效成分。
关键词:戴氏虫草;菌丝体;单体化合物;MTT法;抑制肿瘤细胞增殖
中图分类号: S182文献标志码: A
文章编号:1002-1302(2017)05-0174-04
戴氏虫草(Cordyceps taii)及其无性型戴氏绿僵菌(Metahizium taii)是从贵州省都匀市茶场分离到的一种虫草菌属真菌[1],属于子囊菌纲肉座菌目麦角菌科虫草菌属,与中国传统名贵中药冬虫夏草、蝉花、蛹虫草等是同属真菌,当地民间常将其作药用和保健食品。戴氏虫草多糖(CDP)可诱导红白血病K562细胞与早幼粒白血病HL60细胞分别向红细胞系和粒细胞系方向分化[2]。戴氏虫草菌丝体的有效部位能明显影响小鼠免疫器官指数,抑制肿瘤组织血管形成,并抑制恶性黑色素瘤细胞B16向肺转移[3]。这提示戴氏虫草菌丝体有潜力作为肿瘤治疗的生物反应调节剂和癌化学预防药物。迄今,对戴氏虫草菌丝体在开发利用方面仍缺乏系统研究,有关其药理活性物质基础的报道甚少。本试验通过对戴氏虫草菌丝体95%乙醇提取物的石油醚和乙酸乙酯萃取部位进行抑瘤活性导向分离、纯化,共得到6个化合物。其中,5个化合物均为首次从该真菌菌丝体中分离得到,并通过MTT法对这些化合物进行抑制肿瘤细胞增殖活性研究,以期为戴氏虫草菌丝体的深入研究与开发利用提供科学依据。
1材料与方法
[HTK]1.1主要试剂与仪器[HT]
Sephadex LH-20(Amersham Biosciences公司),柱层析用硅胶(300~400、200~300、40~80目)、GF254薄层层析板(青岛海洋化工厂),10%磷钼酸显色剂,二甲基亚砜(DMSO,Solarbio公司),高糖DMEM细胞培养基(Hyclone公司),胎牛血清(杭州四季青公司),0.25%胰蛋白酶(Hyclone公司),青霉素链霉素混合液双抗,台盼蓝(美国Sigma公司),顺铂冻干粉(齐鲁制药有限公司),甲基噻唑蓝MTT(范博公司)。所用有机溶剂均为工业级试剂经重蒸纯化处理。RZJ-APJ100L机械搅拌不锈钢发酵罐(南京润泽生物工程),INOVA-400 MHz核磁共振仪、WNMR-I 500 MHz核磁共振波谱仪(中国科学院武汉物理与数学研究所),惠普HP-1200紫外分光光度测定仪,HP-5973型质谱仪(HP,美国),通用酶标仪(美国BIOTEK公司)。
1.2菌株培养
试验用戴氏虫草的无性型——戴氏绿僵菌菌株(GZ201206)保存于贵州医科大学组织工程与干细胞实验中心。种子/发酵培养基:麦芽糖5 g,蛋白胨10 g,葡萄糖25 g,酵母浸膏5 g,水1 L,pH自然。菌种培养条件:(28±0.5)℃,100 r/min,600 L/h溶氧量。
1.3细胞培养
人乳腺癌MDA-MB-435细胞(法国医学科学研究院陆核教授馈赠),人乳腺癌BT474细胞和人舌癌Tca-8113细胞保存于贵州医科大学组织工程与干细胞实验中心细胞库。复苏细胞,于37 ℃、5% CO2细胞培养孵箱中培养,2~3 d换液传代1次,取对数生长期细胞进行试验。
[HTK]1.4提取[HT]
戴氏虫草发酵菌丝体3.4 kg,95%食用乙醇回流提取3次,每次1.5 h,合并过滤提取液,减压浓缩得到食用乙醇提取浸膏。加适量水进行溶解浸膏,利用液液两相萃取方法用石油醚、乙酸乙酯、正丁醇萃取,减压回收得各萃取层浸膏,并用MTT法对3个萃取部位的抑制肿瘤细胞增殖活性进行研究。
[HTK]1.5戴氏虫草菌丝体萃取部位抑制肿瘤细胞增殖活性的筛选方法[HT]
MDA-MB-435细胞以每孔10 000個接种于96孔培养板中,24 h后,于96孔板中加入已配制好的石油醚、乙酸乙酯、正丁醇浸膏溶液各100 μL,其中每个浸膏的浓度依次为0.01、0.10、1.00 g/L,每组设3个复孔,3次独立重复试验,待加药完毕后,置于37 ℃、5% CO2细胞培养孵箱中继续培养;48 h后,每孔加入5 mg/mL MTT液20 μL,置于37 ℃、5% CO2细胞培养孵箱中继续培养2~4 h;弃掉96孔板中的液体,每孔加入150~200 μL DMSO,室温充分振荡,使紫色结晶充分溶解,选择490 nm波长测定各孔D值,计算细胞生长抑制率。
[JZ]肿瘤细胞生长抑制率=(1-D加药组/D对照组)×100%。
式中:D对照组为不加药品只加细胞液培养后的吸光度,D加药组为细胞液和药品共同培养后的吸光度。
[HTK]1.6戴氏虫草菌丝体抑制肿瘤细胞增殖活性部位分离与纯化[HT]
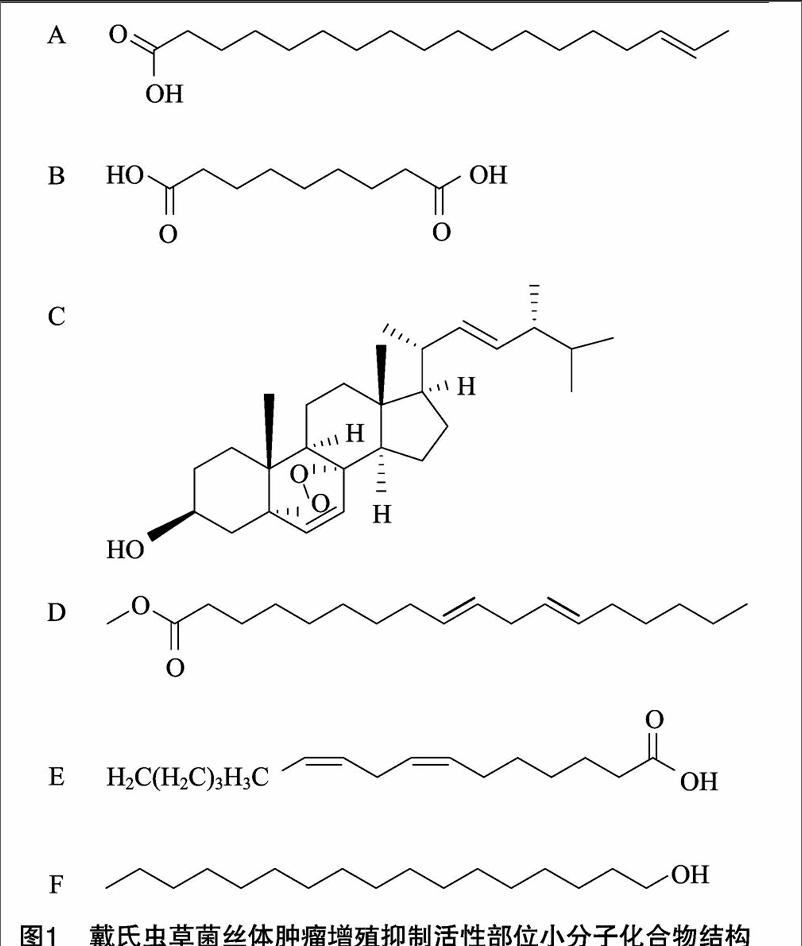
根据肿瘤细胞增殖抑制活性结果,对石油醚和乙酸乙酯浸膏(184.85 g)进行硅胶柱层析,其洗脱剂比例为石油醚 ∶[KG-*3]乙酸乙酯(100 ∶[KG-*3]1,50 ∶[KG-*3]1,10 ∶[KG-*3]1,5 ∶[KG-*3]1,4 ∶[KG-*3]1,2 ∶[KG-*3]1,1 ∶[KG-*3]1,0 ∶[KG-*3]1),乙酸乙酯 ∶[KG-*3]甲醇(10 ∶[KG-*3]1,5 ∶[KG-*3]1,1 ∶[KG-*3]1,0 ∶[KG-*3]1)梯度洗脱,得到混合组分13个,分别对组分Fr.4,Fr.5,Fr.10,Fr.15进行反复正相硅胶柱层析,凝胶纯化,重结晶等方法,借助TLC检识,质谱、1H-NMR、13C-NMR数据与现有文献的数据进行对比,分离得到化合物1(反式-16-十八碳烯酸[4],30 mg)、化合物2(壬二酸[5-6],25 mg)、化合物3(5α,8α-麦角甾-6,22-二烯-3β-醇[7-8],15 mg)、化合物4(亚油酸甲酯[9-10],5 mg),化合物5(亚油酸[11],20 mg)、化合物6(十七-烷醇[12-13],8 mg)。
[HTK]1.7单体化合物的抑制肿瘤细胞增殖活性的测定方法[HT]
MDA-MB-435细胞,BT474细胞,Tca-8113细胞,分别以每孔调整细胞8 000、7 000、10 000个接种于96孔培养板中,24 h后,于96孔板中加入已配制好的化合物2和化合物3各100 μL,其中每个药物的浓度依次为3.125、6.250、12.500、25.000、50.000 μmol/L,每组设3个复孔,3次独立重复试验,后续操作参照“1.5”节,其中IC50用SPSS 17.0统计软件进行分析。
2结果与分析
[HTK]2.1戴氏虫草菌丝体不同萃取部位抑制肿瘤细胞增殖的活性[HT]
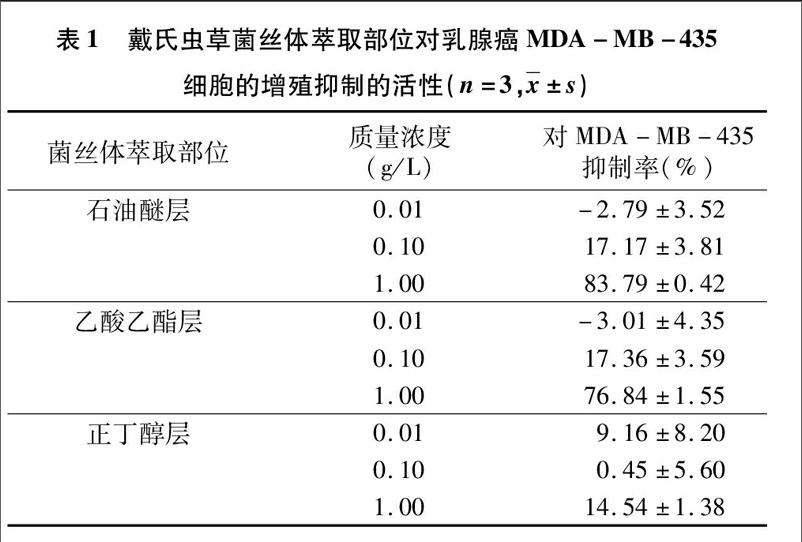
通过MTT法测定了戴氏虫草菌丝体的石油醚、乙酸乙酯、正丁醇萃取部位不同浓度对乳腺癌MDA-MB-435细胞增殖的抑制活性,表1抑瘤活性评价结果提示,与未加药组比较,石油醚、乙酸乙酯萃取部位均对MDA-MB-435细胞有较明显增殖抑制活性,且在浓度1 g/L时,抑制作用最为明显,其抑制率分别为(83.79±0.42)%、(76.84±1.55)%。正丁醇萃取部位对MDA-MB-435细胞抑制作用不明显。随着戴氏虫草菌丝体的石油醚、乙酸乙酯萃取物浓度升高,抑制作用成剂量相关性。因此对该有效部位所含化学成分进行系统分离纯化。
2.3戴氏虫草菌丝体单体化合物的抑制肿瘤细胞增殖活性[HT]
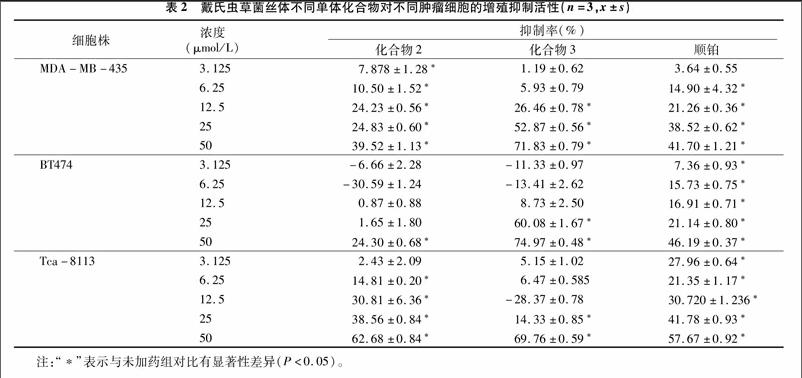
通过MTT法检测从戴氏虫草菌丝体的肿瘤细胞增殖抑制活性部位中分离得到的小分子化合物:壬二酸(化合物2)和5α,8α-麦角甾-6,22-二烯-3β-醇(化合物3)对乳腺癌MDA-MB-435细胞、乳腺癌BT474细胞、舌癌Tca-8113细胞的增殖抑制活性(表2和表3)。结果所示,溶剂对照组DMSO在0.3%、0.2%、0.1%体积分数时,对肿瘤细胞无[CM(25]明显增殖抑制活性。化合物2和化合物3对MDA-MB-[CM)]
[FK(W22][TPLBC1.tif][FK)]
435细胞、BT474细胞、Tca-8113细胞有不同程度的抑制活性。与未加药组相比,具有显著性差异(P<0.05)。其中,化合物2对舌癌Tca-8113细胞增殖具有较高的抑制活性,在浓度3.125~50 μmol/L时,呈较好剂量依赖关系,抑制率为(2.43±2.09)%、(14.81±0.20)%、(30.81±6.36)%、(38.56±0.84)%、(62.678±0.84)%,IC50值为 31.90 μmol/L;5α,8α-麦角甾-6,22-二烯-3β-醇对乳腺癌MDA-MB-435细胞和BT474细胞具有较高的抑制细胞增殖活性,在浓度3.125~50 μmol/L时,呈较好剂量依赖关[CM(25]系,抑制率分别
3讨论
戴氏虫草是1991年由我国学者梁宗琦教授等在贵州省首次发现、鉴定并命名的虫草真菌。据文献报道,Liu等对戴氏虫草菌丝体的氯仿萃取部位进行了体外抑瘤活性检测,该萃取部位对人肺癌A549细胞和胃癌SGC-7901细胞有较显著的抑制活性[14]。也有相关文献报道,与戴氏虫草有种属亲缘关系的蛹虫草的菌丝体乙醇提取物可阻滞人类大肠癌RKO细胞的G2/M细胞周期,诱导细胞凋亡[15]。多数虫草的抗肿瘤部位集中在氯仿、醇提取物中,而本研究通过MTT法对戴氏虫草菌丝体的石油醚、乙酸乙酯、正丁醇萃取部位进行初步抑制肿瘤细胞增殖活性研究,筛选出石油醚、乙酸乙酯萃取部位具有抑制肿瘤细胞增殖活性;并通过反复硅胶柱层析对抑制肿瘤细胞增殖活性部位进行提取、分离和凝胶纯化,共分离得到6个单体化合物。分别为反式-16-十八碳烯酸(化合物1)、壬二酸(化合物2)、5α,8α-麥角甾-6,22-二烯-3β-醇(化合物3)、亚油酸甲酯(化合物4)、亚油酸(化合物5)和十七-烷醇(化合物6)。李小刚等在戴氏虫草[16]、王刚等在蛹虫草[17]中也检测到化合物3的存在;在东北天南星[18]和三叶青[19]中也检测到化合物2的存在;在商陆[20]和甘蔗叶[21]中也检测到化合物4的存在;在北虫草中[22]也检测到化合物5的存在;在粉条儿菜[12]和天山雪莲[13]中也检测到化合物6的存在,查阅中外文献,未发现化合物1、2、4、5、6在戴氏虫草菌丝体中分离得到。因此,除5α,8α-麦角甾-6,22-二烯-3β-醇外,其余5种单体化合物是首次在戴氏虫草菌丝体中发现和鉴定。
从海洋链格孢属真菌[WTBX][STBX]Alternaria[WTBZ][STBZ] sp.MNP801菌体中曾分离到化合物3,并表明该化合物对肺癌H460细胞、大鼠肾上腺嗜铬细胞瘤PC12细胞、淋巴癌U973细胞具有强的抑制活性,其IC50值分别为119.77、20.33、34.11 μmol/L[23];在鲍姆氏层孔菌Phellinus baumii子实体中也分离到该化合物,对慢性骨髓性白血病K562细胞具有抑制活性,其IC50值为 164.9 μmol/L[24]。本研究通过MTT方法测定5α,8α-麦角甾-6,22-二烯-3β-醇对乳腺癌MDA-MB-435细胞、乳腺癌BT474细胞、舌癌Tca-8113细胞的增殖抑制活性,结果表明该化合物对3株癌细胞具有一定的增殖抑制活性,其中,该化合物对MDA-MB-435细胞和BT474细胞抑制作用较为明显,IC50分别为(25.57±0.20)、(26.31±0.71)μmol/L。
另有相关报道显示,化合物2在一定浓度范围内对小鼠和人黑色素瘤细胞的增殖和细胞活力的抑制作用呈剂量和时间依赖性,其机制是抑制肿瘤的DNA合成和纤维蛋白溶酶原激活物活性,引起线粒体肿胀和空泡[25]。从壬二酸(AA)结构修饰得到二乙基壬二酸酯(DA)和壬二酸-β-环糊精复合物(AACD),以长春新碱作为阳性对照,采用MTT法比较AA、DA、AACD对宫颈癌细胞(HeLa),口腔表皮样癌KB细胞和鼠黑色素瘤B16F10细胞的抗增殖活性,结果表明AA抗癌效率低于长春新碱,并且DA和AACD比AA抑制癌细胞更有效[26]。本研究通过MTT方法测定壬二酸对乳腺癌 MDA-MB-435细胞、乳腺癌BT474细胞、舌癌Tca-8113细胞的增殖抑制活性,结果表明壬二酸对3株癌细胞具有一定的增殖抑制活性,其中,该化合物对Tca-8113细胞抑制作用较为明显,其IC50为(31.90±1.15)μmol/L。
在抑制肿瘤细胞增殖活性试验中,戴氏虫草菌丝体来源的单体化合物2和化合物3对乳腺癌MDA-MB-435细胞、乳腺癌BT474细胞、舌癌Tca-8113细胞有一定的抑制细胞增殖活性,说明化合物2和化合物3有可能是戴氏虫草菌丝体抗肿瘤的重要物质基础,可能具有潜在的抗癌药物开发价值,其抑瘤机制和其余几种单体化合物的作用还有待进一步研究。
[HS2*3][HT8.5H]参考文献:
[1]全宇,刘永翔,刘作易,等. 贵州绿僵菌和戴氏绿僵菌分类地位的确证[J]. 贵州农业科学,2012,40(5):84-87.
[2]程萍,雷艳霞,刘杰麟. 戴氏虫草多糖诱导肿瘤细胞分化的研究[J]. 贵阳医学院学报,2015,40(8):806-809.
[3]张晓杰,李小刚,肖建辉. 戴氏虫草菌抗肿瘤抗转移效应及其物质基础[R]. 上海:中国菌物学会,2015.
[4]Al-Dulayymi J R,Baird M S,Mohammed H,et al. The synthesis of one enantiomer of the α-methyl-transcyclopropane unit of mycolic acids[J]. Tetrahedron,2006,62(20):4851-4862.
[5]汪瓊,徐永艳. 香花藤化学成分的研究[J]. 中草药,2015,46(12):1742-1748.
[6]任赛赛,罗彭,潘为高,等. 龙船花的化学成分研究[J]. 中草药,2012,43(11):2116-2119.
[7][JP2]Noh H J,Yang H H,Kim G S,et al. Chemical constituents of Hericium erinaceum associated with the inhibitory activity against cellular senescence in human umbilical vascular endothelial cells[J]. Journal of Enzyme Inhibition and Medicinal Chemistry,2015,30(6):934-940.[JP]
[8]白柏,陈雨,刘文娟,等. 灰毡毛忍冬根的石油醚部位化学成分研究[J]. 中药材,2015,38(3):518-520.
[9]朱珠,马琳,朱海燕,等. 民族药珠芽艾麻化学成分研究[J]. 中药材,2011,34(2):223-225.[ZK)]
[10]孙程亮,李政辉,冯涛,等. 大白口蘑子实体的化学成分研究[J]. 安徽中医药大学学报,2014,33(4):81-86.
[11][JP2]崔香,李长伟,吴长景,等. 淡紫拟青霉ZBY-1的次级[JP3]代谢产物及其抗肿瘤活性[J]. 国际药学研究杂志,2013,40(6):765-794.[JP]
[12]李林珍,王孟华,孙建博,等. 粉条儿菜化学成分的研究[J]. 中国药科大学学报,2014,45(2):175-177.
[13]景临林,何蕾,樊鹏程,等. 天山雪莲抗缺氧活性成分研究[J]. 中药材,2015,38(1):89-92.
[14]Liu R M,Zhang X J,Liang G Y,et al. Antitumor and antimetastatic activities of chloroform extract of medicinal mushroom Cordyceps taii in mouse models[J]. BMC Complementary and Alternative Medicine,2015,15:16.[ZK)][HT][HJ][HT][FL)][LM]
[HT8.]
[15]Lee H H,Lee S,Lee K,et al. Anti-cancer effect of Cordyceps militaris in human colorectal carcinoma RKO cells via cell cycle arrest and mitochondrial apoptosis[J]. DARU-Journal of Pharmaceutical Sciences,2015,23(1):35.
[16]李小刚,潘卫东,张晓杰,等. 黔产戴氏虫草发酵菌粉的抗肿瘤化学成分研究[J]. 中药材,2015,38(10):2083-2086.
[17]王刚,麻兵继,刘吉开. 人工蛹虫草化学成分研究[J]. 中草药,2004,35(5):493-495.
[18]李春娜,刘洋洋,李朋收,等. 东北天南星化学成分及药理作用[J]. 吉林中医药,2015,35(3):293-296.
[19]丁丽,章璐幸,邱彦,等. 三叶青三氯甲烷部位化学成分及其抗肿瘤活性研究[J]. 中国药学杂志,2015,50(21):1857-1860.
[20]王鹏程,赵珊,王秋红,等. 商陆脂溶性成分的GC-MS分析及其利尿、致泻作用研究[J]. 辽宁中医药大学学报,2016,18(2):15-17.
[21]张金玲,黄艳,刘布鸣,等. 甘蔗叶脂溶性成分的GC-MS分析[J]. 广西中医药,2015,38(3):70-73.
[22]李万芳,闫滨,王璐,等. 北蟲草醚提物成分与抗肿瘤活性分析[J]. 时珍国医国药,2014,25(1):60-62.
[23]王鸿,陈俊,倪建良,等. 生物活性导向分离海洋真菌Alternaria sp.MN801次级代谢产物[J]. 浙江工业大学学报,2014,42(1):41-44.
[24]冯娜,吴娜,杨焱,等. 鲍姆氏层孔菌子实体中化合物的分离鉴定及其体外抑制肿瘤的研究[J]. 菌物学报,2015,34(1):124-130.
[25] Breathnach A S,Robins E J,Nazzaro-Porro M,et al. Hyperpigmentary disorders—mechanisms of action:Effect of azelaic acid on melanoma and other tumoral cells in culture [J]. Acta Derm Venereol,1989,143:62-66.
[26]Manosroi A,Panyosak A,Rojanasakul Y,et al. Characteristics and anti proliferative activity of azelaic acid and its derivatives entrapped in bilayer vesicles in cancer cell lines[J]. Journal of Drug,2007,15(5):334-341.
