3株真菌固态发酵产木质素降解酶的研究
2017-04-15钱静亚张正沛季蓉蓉马真陈菊
钱静亚++张正沛+季蓉蓉+马真+陈菊++李佳少++张志才+葛才林

摘要:对菌株JS-1008、米曲霉CGMCC5992、黄孢原毛平革菌CICC40719等3株真菌固态发酵产木质素降解酶、纤维素酶、半纤维素酶进行了研究。结果表明,3株菌株中,米曲霉发酵产木质素降解酶活性最高,木质素过氧化物酶和锰过氧化物酶活性可达2.08、1.79 U/g DS,产纤维素酶、半纤维素酶活性则相对较低,分别为1.69、4.19 U/g DS,木质素降解率为7.23%;菌株JS-1008产木质素降解酶、纤维素酶、半纤维素酶的活性均较低,木质素降解率最低;黄孢原毛平革菌产木质素降解酶的水平最低,木质素过氧化物酶、锰过氧化物酶的活性分别为0.40、0.51 U/g DS,但产纤维素酶、半纤维素酶的活性最高,分别达到2.54、10.86 U/g DS,木质素降解率达11.7%。
关键词:菌株JS-1008;米曲霉;黄孢原毛平革菌;木质素过氧化物酶;锰过氧化物酶
中图分类号: S182文献标志码: A
文章编号:1002-1302(2017)05-0277-04
木质素是自然界中除纤维素外的第2大聚合物,由苯丙烷单元通过醚键、碳碳键连接形成聚酚类三维网状结构,由于其复杂、稳定、多样的无定形三维体型而成为农作物秸秆中比纤维素更难降解的成分,導致秸秆营养价值、利用率低[1]。要彻底降解纤维素,关键在于降解包裹在纤维素晶体外面的木质素以及半纤维素。因此,秸秆利用研究从过去的降解纤维素的研究转向了木质素降解研究[2]。
木质素降解过程中的关联酶系主要有3类:H2O2产生酶系(如葡萄糖氧化酶、乙二醛氧化酶等)、木质素氧化酶系(木质素过氧化物酶、锰过氧化物酶、漆酶等)、其他酶系(甲基化酶、纤维二糖脱氢酶等)[3]。在木质素氧化酶系中,研究较多的酶主要有木质素过氧化物酶、锰过氧化物酶、漆酶[4]。木质素过氧化物酶是降解木质素酶系的主要成分,在木质素降解中起关键作用[5]。锰过氧化物酶在Mn2+、H2O2存在时,能氧化分解芳香环多聚体,被认为是木质素降解的关键酶之一[6]。
自然界中产生降解木质素降解酶的微生物有真菌、放线菌、细菌等,其中可彻底将木质素降解为CO2、H2O的是白腐真菌,如黄孢原毛平革菌(Phanerochaete chrysosporium)[7]、红色毛癣菌(Trichophyton rubrum)[8]、栓菌属(Trametes)[9]、侧耳属(Pleurotus)[10]、糖单孢菌属(Saccharomonospora)[11]、不动细菌属菌株B-2(Acinetobacter sp. B-2.)、Pandoraea sp.B-6、纤孔菌属菌株(Inonotus sp.)[12]等。但是白腐真菌在人工培养条件下产生的木质素降解酶活性较低,造成木质素酶生产成本较高,因此有必要探索木质素降解酶活性高的真菌。
笔者前期从污泥中分离得到了菌株JS-1008和米曲霉CGMCC5992,但未对其降解木质素进行系统研究。本研究比较菌株JS-1008、米曲霉CGMCC5992、黄孢原毛平革菌产木质素降解酶、纤维素酶、半纤维素酶的能力,试图找到1株产高活性木质素降解酶活性的菌株,以期为降低木质素酶的生产成本,实现其工业化生产应用奠定基础,也为真菌降解秸秆木质纤维素并用于秸秆的资源化利用提供依据。
1材料与方法
1.1材料
1.1.1菌种
JS-1008,分离自江苏大学玉带河污泥样品中,初步鉴定为匍枝根霉。米曲霉,分离自江苏大学玉带河污泥样品中,现保存于中国微生物菌种保藏管理委员会普通微生物中心,保存编号为CGMCC5992。黄孢原毛平革菌CICC40719,购自中国工业微生物菌种保藏中心。
1.1.2培养基
玉米芯粉固体发酵培养基:称取一定量玉米芯粉和水,按照质量比1 ∶[KG-*3]3混合,分装在直径15 cm、无热力学应变性的塑料盘中,每盘60 g,并在121 ℃灭菌1 h。[HJ]
1.2方法
1.2.1玉米秸秆、玉米芯预处理
将同一批次、产地、采收季节的玉米秸秆、玉米芯,用小型药物粉碎机粉碎成粉末,并将粉末过100目筛,密封于塑料保鲜袋中,于背光、干燥处储藏备用。
1.2.2固态发酵
在无菌条件下,将试管斜面中的菌种接种到已灭菌的含15 g麦麸、20 mL水的250 mL三角瓶中,28 ℃培养4~7 d后转接到玉米芯粉的发酵培养基中,每盘接种 6 g,混匀后28 ℃培养30 d。为在发酵过程中能保持培养基湿度,所有塑料盘均用保鲜膜密封。
1.2.3粗酶液制备
发酵结束后,称取5 g固态发酵基质于250 mL三角瓶中,加入100 mL蒸馏水,28 ℃、150 r/min振荡提取1 h,-4 ℃冷冻离心后获得的上清液即为粗酶液,置于1.5 mL的离心管中-18 ℃保存备用。
1.2.4.3纤维素酶活性的测定
采用测定羧甲基纤维素酶活性(CMC)的方法测定纤维素酶活性。
葡萄糖标准曲线的制作:称取1 g于105 ℃烘至恒质量的葡萄糖,加水定容至1 L,得1 g/L的葡萄糖标准溶液。分别移取上述标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL,加水补至2 mL,加入2 mL DNS试剂,加塞后在沸水浴中加热 10 min,冷却后定容至15 mL,用分光光度计测550 nm波长下的吸光度,以浓度-吸光度绘制标准曲线。
测定步骤:取0.5 mL粗酶液,再分别吸取1.5 mL CMC溶液,50 ℃水浴保温30 min;对照样用0.5 mL稀释酶液,加入1.5 mL醋酸缓冲液,50 ℃水浴30 min,再吸取DNS试剂 2 mL,摇匀后具塞,沸水浴反应10 min,冷却后补加水至 15 mL,振荡混匀,用对照调零点,于550 nm下测吸光度[16]。1 min内由底物生成1 μmol葡萄糖所需的酶量定义为1个酶活性单位(U)。纤维素酶(CMC)活性计算方法如下:
[JZ(]CMC酶活性=[SX(]葡萄糖质量×2×1 00060[SX)](U/g)。[JZ)][JY](3)
1.2.4.4半纤维素(木聚糖酶)酶活性的测定
木糖标准曲线的制作:称取1 g于105 ℃烘至恒质量的木糖,加水定容至1 L,得1 g/L木糖标准溶液。分别移取上述标准溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL,加水补至2 mL,加入2 mL DNS试剂,加塞后在沸水浴中加热10 min,冷却后补水定容至 15 mL,用分光光度计在550 nm波长下测吸光度,以浓度-吸光度绘制标准曲线。
测定步骤:取粗酶液0.5 mL,再吸取1%木聚糖溶液 1.5 mL,摇匀,50 ℃水浴1 h,取出后,再吸取2 mL DNS试剂摇匀,加塞立即沸水浴反应10 min,冷却后补加水定容到 15 mL,轻轻上下摇匀,对照用0.5 mL稀释酶液加1.5 mL醋酸缓冲液,不加木聚糖溶液。按上述步骤,用对照调零点,于550 nm下测吸光度[17]。1 min内水解木聚糖生成相当于 1 μmol 木糖等还原物质的量为1个酶活性单位,以U/g表示。半纤维素(木聚糖酶)酶活性计算方法如下:
[HS2][JZ(]半纤维素酶活性=[SX(]木糖质量×2×1 00050[SX)](U/g)。[JZ)][JY](4)
1.2.5木质素降解率的测定
称取一定量(G)样品(过40目筛)置于圆底烧瓶中,加入2 mol/L盐酸100 mL,5~10 min内煮沸,并持续保持微沸60 min。趁热用已知质量的玻璃坩埚抽滤,并用沸水反复冲洗玻璃坩埚及残渣,至滤液呈中性。用少量丙酮冲洗残渣至抽下的丙酮液呈无色,并抽净丙酮。将玻璃坩埚置于105 ℃烘箱中烘2 h后,在干燥器中冷却 30 min 称质量G1,直至恒质量。将酸性洗涤纤维加入72%硫酸,在20 ℃消化3 h后过滤,并冲洗至中性。将残渣烘干称质量(G2),并灼烧灰化称质量(G3),G3与G2的差值即为木质素含量。木质素降解率计算方法如下:
[HT9.,6"][JP2]木质素降解率=[SX(]未发酵秸秆中木质素含量-发酵后秸秆中木质素含量未发酵秸秆中木质素含量[SX)]×100%。[HT][JY](5)[JP]
2结果与分析
[HTK]2.13株菌株产木质素降解酶、纤维素酶、半纤维素酶的比较[HT]
2.1.1葡萄糖和木糖标准曲线如图1所示,葡萄糖标准曲线方程为y=0.953 7x-0.090 3,r2为0.999 2;如图2所示,木糖标准曲线为y=1.026x-0.022 5,r2为0.999 0。说明其适合用于葡萄糖、木糖含量的测定。
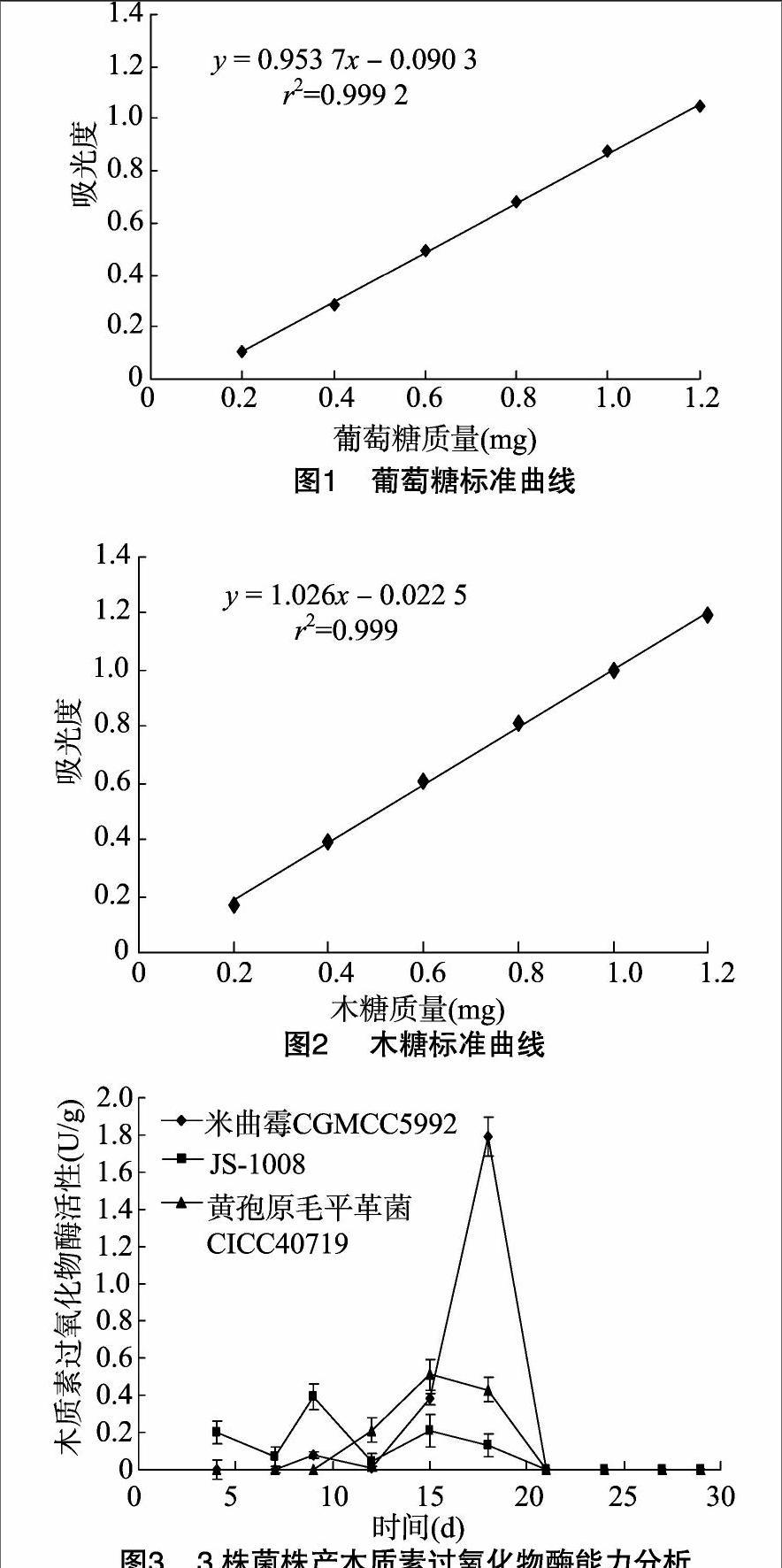
2.1.23株菌株产木质素过氧化物酶的分析
如图3所示,米曲霉在固态培养18 d时木质素过氧化物酶活性达到最大值,为1.79 U/g DS。JS-1008菌株产酶活性较低,在培养 9 d 时酶活性达到最大值,为0.39 U/g DS。黄孢原毛平革菌培养15 d时产酶活性最大, 为0.40 U/g DS。米曲霉产木质
素过氧化物酶能力高于菌株JS-1008、黄孢原毛平革菌,但是米曲霉产酶活性出现最大值的时间较JS-1008菌株、黄孢原毛平革菌明显滞后,这可能是因为木质素降解酶是次生代谢产物,米曲霉菌在生长后期限氮的条件下利于酶的产生,生长前期米曲霉菌体利用培养基中的氮等营养成分进行细胞快速生长,后期氮源消耗到一定程度才进入产酶期。而该培养基对于JS-1008菌株、黄孢原毛平革菌没有产生限制作用,产酶时期提前。
2.1.33株菌株产锰过氧化物酶的分析
如图4所示,米曲霉能产生较高的锰过氧化物酶活性,在发酵12 d时酶活性最高,为2.27 U/g DS,而菌株JS-1008、黄孢原毛平革菌产锰过氧化物酶活性相对较低,最高仅分别为0.52、0.51 U/g DS。JS-1008菌株不能促进产酶的原因可能是匍枝根霉能分泌大量淀粉酶,这种酶降解秸秆中的淀粉后产生部分β-环糊精,有研究表明β-环糊精对锰过氧化物酶的产生有一定抑制作用[18],此外淀粉酶会降解淀粉,产生大量葡萄糖,造成碳源过剩抑制菌体生长,从而也抑制了锰过氧化物酶的分泌。
2.1.43株菌株产纤维素酶的分析
纤维素酶是使纤维素
降解生成葡萄糖的酶的总称,主要有葡聚糖内切酶、葡聚糖外切酶、β-葡萄糖苷酶,这3种酶协同作用可将天然纤维素降解为葡萄糖。如图5所示,在发酵20 d时,黄孢原毛平革菌、米曲霉产纤维素酶活性都达到最大值,分别为2.54、1.69 U/g DS,JS-1008菌株在发酵8 d时酶活性最高,为218 U/g DS。黄孢原毛平革菌在发酵6 d时酶活性迅速上升,12~20 d时酶活性趋于稳定。米曲霉在发酵12 d后到达酶活性迅速增长期,16~20 d是酶的稳定生产期,但酶活性并不高,是3株菌株中产酶活最低且产酶时间最迟的菌株,这种现象可能是由于米曲霉能产生葡聚糖内切酶、外切酶,但产生β-葡萄糖苷酶能力弱,使纤维二糖积累造成产物抑制。JS-1008 菌株的产酶能力较米曲霉强,且产酶时间明显提前,但酶活性达到最高后很快降低,并没有出现产酶的稳定期。
2.1.53株菌株产半纤维素酶(木聚糖酶)的分析
微生物产生的半纤维素酶主要是指β-D-l,4-木聚糖酶、β-木糖苷酶,β-D-1,4-木聚糖酶的主要水解产物为木二糖及其以上的低木聚糖,β-木糖苷酶可以作用于低聚木糖的末端,释放木糖。如图6所示,与米曲霉、菌株JS-1008相比,黄孢原毛平革菌产半纤维素酶的酶活性最高,在固态发酵16 d产生高达10.86 U/g DS的木聚糖酶活性。菌株JS-1008在发酵8 d时即达到酶活性最大值,為5.64 U/g DS,但菌株 JS-1008 无产酶的稳定期;米曲霉酶活性最低,12~20 d是产酶较为稳定的时期,但酶活性最高时也仅为4.42 U/g DS。木聚糖酶是一种诱导酶,需要将秸秆中的淀粉降解为小分子物质后才能诱导菌株产生,3株菌株产木聚糖酶的趋势与产纤维素酶的趋势大致相同。
2.23株菌株降解木质素的比较
[CM(24]如图7所示,米曲霉木质素降解率达 7.23%;菌株
JS-1008 木质素降解率仅为4.14%;而黄孢原毛平革菌对木质素的降解率最高,达到11.00%。米曲霉能产生活性较高的与降解木质素有关的酶,因此降解率较高;而黄孢原毛平革菌能产生高活性的纤维素酶、半纤维素酶,破坏木质素与半纤维素之间紧密结合的化学键,使木质素游离被降解,所以木质素降解率最高,虽然黄孢原毛平革菌分泌锰过氧化物酶和木质素过氧化物酶的酶活性不高,但能分泌葡萄糖氧化酶和乙二醇氧化酶等产H2O2的酶,这可能也是造成黄孢原毛平革菌降解率最高的原因。
3结论
米曲霉CGMCC5992产木质素过氧化物酶、锰过氧化物酶等与降解木质素有关的酶的活性最高,但产纤维素酶、半纤维素酶的能力较弱,对木质素的降解率为7.17%,可认为米曲霉是产酶专一性较强的菌株,具有用于生产木质素降解酶的潜力,也可考虑与产纤维素酶、半纤维素酶活性高的菌株进行混菌发酵,降解秸秆木质素和纤维素。
菌株JS-1008虽然具有一定的降解木质素的能力,但与黄孢原毛平革菌、米曲霉CGMCC5992相比,产降解木质素相关的酶及纤维素酶、半纤维素酶的活性较低,且降解木质素的能力较差,对菌株JS-1008的应用范围需要进一步研究。
黄孢原毛平革菌产木质素过氧化物酶、锰过氧化物酶的水平低于米曲霉,但产纤维素酶、半纤维素酶的活性最高,且木质素降解率也最高。因此,黄孢原毛平革菌常被广泛应用于纤维素和木质素材料的降解中。
参考文献:
[1]范寰,梁军锋,赵润,等. 碳氮比对复合木质素降解菌产酶活力和木质素降解能力的影响[J]. 中国饲料,2010(14):23-25,29.
[2]张爱武,董斌,康伟. 白腐真菌对秸秆的降解效果及影响因素[J]. 饲料研究,2011(5):15-17.[HJ1.65mm]
[3]张力,邵喜霞,韩大勇. 白腐真菌木质素降解酶系研究进展[J]. 吉林畜牧兽医,2009,30(2):9-12.
[4]Iandolo D,Amore A,Birolo L,et al. Fungal solid state fermentation on agro-industrial wastes for acid wastewater decolorization in a continuous flow packed-bed bioreactor[J]. Bioresource Technology,2011,102(16):7603-7607.
[5]杨暖,张妙直,宋洪英. 木质素过氧化物酶应用研究进展[J]. 现代农业科学,2009,16(4):19-20.
[6]吴会广,Cai Y J,苑博华,等. 锰过氧化物酶产生菌的发酵优化及酶学性质研究[J]. 食品与机械,2008,24(4):17-21.
[7]张欢,柴立元,朱咏华,等. 3株细菌降解木质素的条件调控研究[J]. 中南大学学报(自然科学版),2011,42(10):2922-2928.
[8]Bermek H,Yazici H,Ozturk H,et al. Purification and characterization of manganese peroxidase from wood-degrading fungus Trichophyton rubrum LSK-27[J]. Enzyme and Microbial Technology,2004,35(1):87-92.
[9]Zouari-Mechichi H,Mechichi T,Dhouib A,et al. Laccase purification and characterization from Trametes trogii isolated in Tunisia:decolorization of textile dyes by the purified enzyme[J]. Enzyme and Microbial Technology,2006,39(1):141-148.[ZK)]
[10]Liu L H,Lin Z W,Zheng T,et al. Fermentation optimization and characterization of the laccase from Pleurotus ostreatus strain 10969[J]. Enzyme and Microbial Technology,2009,44(6/7):426-433.
[11]丁夢璇,刘炳梅,张国庆,等. 绿色糖单孢菌木质素过氧化物酶的分离纯化及鉴定[J]. 生物技术通报,2011(8):198-202.
[12]贺新生,杨朝惠,赵春花. 三种白腐菌对木质纤维素降解规律的初步研究[J]. 纤维素科学与技术,2013,20(1):33-38.
[13]荚荣,汤必奎,张晓宾,等. 藜芦醇和吐温80对白腐菌产木质素降解酶的影响及在偶氮染料脱色中的作用[J]. 生物工程学报,2004,20(2):302-305.
[14]Ramirez D A,Munoz S V,Atehortua L,et al. Effects of different wavelengths of light on lignin peroxidase production by the white-rot fungi Phanerochaete chrysosporium grown in submerged cultures[J]. Bioresource Technology,2010,101(23):9213-9220.
[15]Li N J,Zeng G M,Huang D L,et al. Oxalate production at different initial Pb2+ concentrations and the influence of oxalate during solid-state fermentation of straw with Phanerochaete chrysosporium[J]. Bioresource Technology,2011,102(17):8137-8142.
[16]Acharya B K,Mohana S,Jog R,et al. Utilization of anaerobically treated distillery spent wash for production of cellulases under solid-state fermentation[J]. Journal of Environmental Management,2010,91(10):2019-2027.
[17]Bailey M J,Biely P,Poutanen K. Interlaboratory testing of methods for assay of xylanase activity[J]. Journal of Biotechnology,1992,23(3):257-270.
[18]阮久莉,王勐,毛亮,等. 白腐菌锰过氧化物酶对2,2′,4,4′-四溴联苯醚的降解[J]. 环境科学与技术,2012,35(1):20-24.
