饲喂高精料日粮对泌乳期山羊泌乳性能及抗氧化能力的影响
2017-04-14田平孙利利董海波田靖端木永前陶诗煜倪迎冬南京农业大学农业部动物生理生化重点开放实验室江苏南京210095
田平,孙利利,董海波,田靖,端木永前,陶诗煜,倪迎冬(南京农业大学农业部动物生理生化重点开放实验室,江苏 南京 210095)
饲喂高精料日粮对泌乳期山羊泌乳性能及抗氧化能力的影响
田平,孙利利,董海波,田靖,端木永前,陶诗煜,倪迎冬*
(南京农业大学农业部动物生理生化重点开放实验室,江苏 南京 210095)
为了研究长期饲喂高精料日粮对泌乳期山羊泌乳性能和乳腺组织抗氧化能力的影响,实验选用12只健康经产泌乳中期关中奶山羊,随机分为两组,分别饲喂精粗比为35∶65(低精料组, LC,n=6)和65∶35(高精料组, HC,n=6)的日粮。实验期共10周,实验期间采集羊奶与血液;实验结束后采用静脉注射的方法对山羊进行安乐死,随后采集乳腺组织并迅速置于液氮中速冻后保存于-70 ℃待测。结果显示,HC组山羊乳产量显著高于LC组(P<0.01),同时乳中乳糖,乳蛋白的比例随着泌乳时间的增加而显著升高。与LC组山羊比较,HC组山羊乳腺组织中SREBP1和GLUT1 mRNA表达显著下降(P<0.05);磷酸化AKT1蛋白表达呈下降趋势(P=0.08);除此之外,HC组山羊乳腺组织的总抗氧化能力T-AOC(P=0.06)和GSH酶活均呈下降趋势(P=0.08)。这些结果表明,长期饲喂高精料日粮可降低乳腺组织的抗氧化能力,同时可降低乳中乳脂率以及乳腺组织中SREBP-1和P-AKT的表达。
高精料日粮;泌乳性能;抗氧化;乳腺;山羊
近年来,我国奶业得到了快速发展,为消费者提供了优质的营养来源。但奶业发展过程中也出现了较多的问题,尤其是乳品质较低的问题。为了满足奶牛高产奶的能量需求,通常在饲料里添加大量的精饲料,这在一定时期和一定程度上提高了奶产量,但高精料极易引发瘤胃酸中毒和肠道的异常发酵,引起代谢病的发生从而降低了奶牛的产奶性能。以往的资料表明,长期饲喂高精料日粮导致血液皮质醇的升高及胃肠道内毒素LPS(lipopolysaccharide LPS)含量的显著增加,后肠(结肠和盲肠)黏膜结构的完整性和屏障功能受损[1]。黏膜上皮组织尤其是后段肠道单层黏膜上皮细胞受损后,LPS易从消化道迁移到血液中,引起全身性的炎症反应[1]。
在较少的成型组织中,乳腺是仍能够在正常生长发育过程中强烈诱导脂肪合成的器官之一,乳腺内脂肪酸合成对乳脂含量和乳产量具有重要作用[2]。乳脂的合成主要受胆固醇调节元件结合蛋白(sterol-regulatory element binding proteins, SREBP)转录因子的调节。葡萄糖是乳糖合成的前体,通过维持乳的渗透压来控制乳产量。乳腺内的葡萄糖吸收对乳产量具有重要的调节作用。哺乳动物细胞膜的葡萄糖转运载体主要有葡萄糖运输载体家族蛋白(glucose transporters, GLUT)和钠离子依赖葡萄糖运输载体蛋白(sodium-dependent glucose transport carrier protein, SGLT),其中GLUT1是泌乳期乳腺细胞膜上主要的葡萄糖转运载体[3]。丝氨酸-苏氨酸激酶(serine-threonine kinase, AKT)是多种信号调节的下游信号分子,参与细胞增殖、细胞凋亡和物质代谢的调节。此外,AKT1还具有调节蛋白质[4-7]和脂质合成[8-11]的作用。AKT1在调节乳腺上皮细胞的葡萄糖转运和部分脂生成方面起着重要的作用[12]。已有研究表明,AKT蛋白激酶在乳腺发育阶段,尤其是在妊娠和泌乳期显著上调,参与泌乳期乳合成的调节[13]。
动物机体在正常生理状态下也会有自由基的产生,但体内同时存在着高效和完善的清除自由基系统。体内自由基的产生和消除处于一种动态平衡,若平衡被打破即会引起机体的氧化应激,导致内环境稳态的破坏。然而,长期饲喂高精料对泌乳期山羊乳腺组织抗氧化能力的影响却少有报道。本研究以泌乳中期奶山羊为动物模型,旨在研究长期饲喂高精料日粮对其泌乳性能、乳腺抗氧化能力、乳脂合成的影响及相关调节机制。
1 材料与方法
1.1 试剂与仪器
TRIzol Reagent购自上海英俊生物技术有限公司;Ex TaqTM购自Takara 公司;冷冻离心机(Allegra TM64R,BECKMAN COULTERTM,美国);组织匀浆器;PCR仪(STRATAGENE,美国);酶标仪(Synergy2,Biotek,美国);NanoDrop TM1000 (Thermo Scientific,美国)。
1.2 试验动物与饲养
本实验于2013年5月开始,选取12只2~3胎次的泌乳中期关中奶山羊,体重(49.7±5.5) kg,2周自由采食饮水过渡期。之后随机分为两组,饲喂精粗比为35∶65(低精料组,LC)和65∶35(高精料组,HC)的日粮[由羊草(Leymuschinensis)、苜蓿(Medicagosativa)和精料组成],自由饮水。饲喂10周后屠杀山羊,取样。饲料营养成分同以往的研究报道[1]。
1.3 样品处理与分析测定
1.3.1 样品总RNA提取和cDNA的制备 称取100 mg左右的乳腺组织,用Trizol方法提取总的RNA,每个样品每次取2 μL,用Nano Drop分光光度计检测RNA浓度(260/280=1.8~2.0),2%琼脂糖凝胶电泳验证RNA质量,-70 ℃保存备用。反转录酶体系及Tap酶为Promega产品,SYBR购自TaKaRa公司。引物采用Primer 5.0软件自行设计,由上海捷瑞生物工程有限公司合成,引物见表1。PCR的反应条件为95 ℃预变性3 min, 95 ℃变性30 s,64 ℃退火20 s,72 ℃延伸20 s,共40个循环。实时荧光定量分析采用2-ΔΔCT法,以内标基因GAPDH为参照,计算目的基因转录的相对量,通过以下公式计算出每一个样本的ΔΔCT值,最后每一个样本值以2-ΔΔCT 表示,X表示任意一个样本,公式如下:ΔΔCT=(CT·目的基因-CT·内参基因)x-(CT·目的基因-CT·内参基因)control。

表1 目的基因序列Table 1 The primer sequences of the target genes
F:上游引物 Forward primer; R:下游引物Reverse primer.GAPDH: 甘油醛-3-磷酸脱氢酶Glyceraldehyde-3-phosphate dehydrogenase;FASN:脂肪酸合酶Fatty acid synthase;FABP4:脂肪酸结合蛋白4 Fatty acid binding protein 4;SCD:硬脂酰脱氢酶 Stearoyl-CoA desaturase;PPARG:过氧化物酶增殖物激活受体-γ Peroxisome proliferator-activated receptor gamma;SREBP1:固醇调节元件结合蛋白1 Sterol regulatory element-binding protein 1;LPL:脂蛋白脂肪酶Lipoprotein lipase;GLUT1:葡萄糖转运蛋白1 Glucose transport 1;GLUT8:葡萄糖转运蛋白8 Glucose transport 8;SGLT1:钠-葡萄糖共转运载体1 Sodium-glucose cotransporter 1.
1.3.2 组织总蛋白提取 蛋白酶抑制剂混合片(Roche,4693132001),购于上海罗氏制药有限公司;BCA蛋白测定试剂盒(Thermo,23225),购于南京生兴生物技术有限公司,NC膜(PALL,T91375),购于巴傲得生物科技有限公司;Pierce发光检测试剂盒(Thermo,NC15080或34076),购于南京生兴生物技术有限公司。
从-80 ℃冰箱取出乳腺组织,称取100 mg左右,按1∶10(w∶v)加入冰浴的RIPA(radio immuno precipitation assay buffer,RIPA裂解液)总蛋白裂解液;用匀浆器匀浆组织冰上静置10 min后,12000 r/min离心,4 ℃,20 min,取上清。用BCA试剂盒测定蛋白浓度,将蛋白统一用蛋白裂解液稀释至合适的浓度,变性,-80 ℃冰箱储存。上样量60 μg,分离胶10%,浓缩胶4%,电泳,转印至硝酸纤维膜上,之后室温封闭2 h,接着一抗4 ℃孵育过夜,1×TBST洗膜5 min 6次,再用二抗室温孵育2 h,1×TBST洗膜5 min 6次,最后,用Pierce发光试剂盒和Versa DocTM imaging system成像系统,检测蛋白条带,并用Quantity One Software软件进行数据统计分析。
1.3.3 氧化应激酶活的测定 山羊总抗氧化能力(total antioxidant capacity,T-AOC),还原型谷胱甘肽(reduced glutathione tablets,GSH),超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)采用酶联免疫分析进行测定。
1.4 数据统计与分析
采用SPSS 17.0软件进行单变量双因素分析,主效应分别为日粮处理和泌乳时间;用ANOVA进行方差分析。
2 结果与分析
2.1 不同精料比日粮对乳产量及乳成分的影响
由表2可见,与LC组相比,高精料日粮极显著提高了奶山羊的产奶量(P<0.01),但对乳中乳糖、乳脂和乳蛋白的比例没有显著影响(P>0.05); 泌乳时间对奶山羊乳中乳糖和乳脂的比例有显著影响(P<0.05),但对乳产量及乳中乳蛋白的比例无显著影响(P>0.05)。在对乳产量及乳中乳糖、乳脂、乳蛋白比例的影响上,泌乳时间和饲喂日粮之间没有明显的互作效应(P>0.05)。

表2 不同精粗比日粮对乳成分含量的影响Table 2 Effect of different concentrate diet ratio on milk yields and milk components percentage
LC:低精料组Low concentrate; HC:高精料组 High concentrate;下同The same below.
2.2 不同精粗比日粮对乳腺乳脂和乳糖合成关键基因表达的影响
如图1所示,与LC组相比,HC组山羊乳腺组织中SREBP1 mRNA 的表达水平极显著降低(P<0.01),但FASN、FABP4、SCD、PPARG和LPL基因表达无显著变化(P>0.05)。此外,在HC组乳腺中GLUT1 mRNA表达显著降低(P<0.05), 但GLUT8和SGLT1基因表达无显著差异(P>0.05)。提示高精料日粮可通过影响SREBP1以及GLUT1的表达水平来调节乳脂和乳糖在乳中的百分比。

图1 不同精粗比日粮对乳脂及乳糖转运载体蛋白相关基因表达的影响Fig.1 Effect of different concentrate diet ration on genes expression involved milk fat synthesis and lactose transport *表示组间差异显著(P<0.05),**表示组间差异极显著(P<0.01)。 * means significant (P<0.05) and ** means markedly significant (P<0.01) difference between two groups.
2.3 不同精粗比日粮对乳腺脂代谢相关蛋白和AKT1蛋白表达的影响
如图2所示,与LC组相比,HC组山羊乳腺组织中SREBP1和SCD1的蛋白表达水平无显著差异(P>0.05),但磷酸化AKT1的蛋白表达水平(图3)呈现出下降的趋势(P=0.08)。
2.4 不同精粗比日粮对乳腺组织抗氧化能力的影响
如表3所示,与LC组相比,HC组山羊乳腺组织中T-AOC和GSH酶活均呈现下降的趋势(P>0.05),而SOD和MDA的含量没有明显的变化。说明高精料日粮的饲喂会使乳腺组织的抗氧化能力降低。

图2 不同精粗比日粮对乳腺组织SREBP1和SCD1蛋白表达的影响Fig.2 Effect of different concentrate diet ration on SREBP1 and SCD1 protein expression in mammary gland
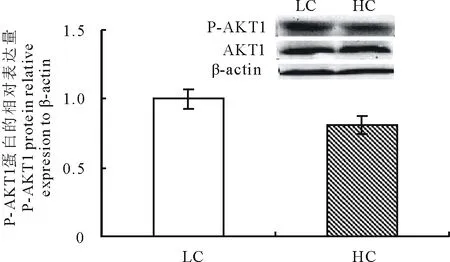
图3 不同精粗比日粮对乳腺组织中AKT1蛋白表达的影响Fig.3 Effect of different concentrate diet ration on AKT1 protein expression in mammary gland
3 讨论
3.1 不同精粗比日粮对乳产量及乳成分的影响
为了满足奶牛高产奶的需求,生产上常给泌乳期奶牛饲喂高精料日粮,高精料日粮的饲喂可以在短时间内提高泌乳期奶牛的产奶量,但对乳品质却会产生不利的影响。Khafipour等[14]报道含有50%的小麦和50%的大麦代替21%的干物质,用精粗比为50∶50的日粮饲喂泌乳期奶牛,结果导致乳产量和乳脂率下降。Dong等[15]的研究表明,用60∶40的高精料日粮饲喂泌乳期奶山羊可以使乳中的乳脂和乳蛋白的比例显著降低,乳糖的含量显著升高,且这种趋势随着饲喂高精料的时间而愈加明显。本实验结果表明,高精料日粮可使乳产量显著升高,对乳中的乳糖、乳脂、乳蛋白的比例没有太大影响,但是如果考虑到日粮和时间因素后,发现饲喂时间对乳成分有显著的影响,加入时间因素后,高精料组乳中乳脂的比例随时间的增加而显著降低,乳糖,乳蛋白的比例显著升高;说明高精料日粮的饲喂可以改变泌乳期奶山羊乳成分,使乳品质下降。
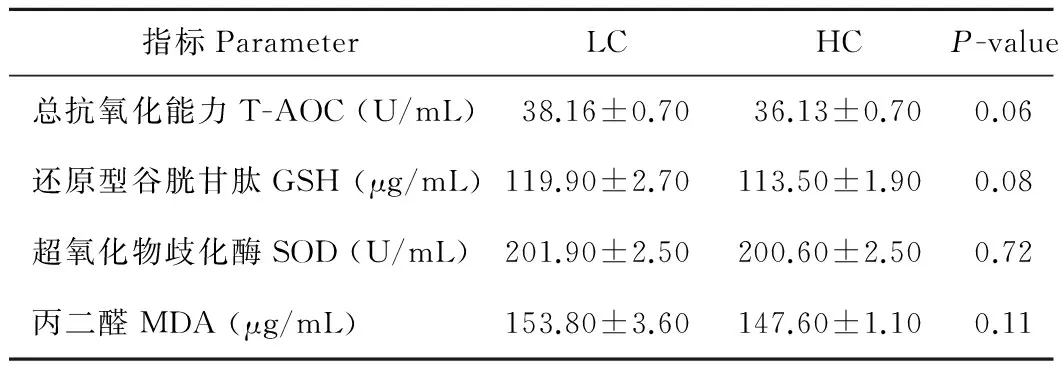
表3 不同精粗比日粮对乳腺组织抗氧化能力的影响Table 3 Effect of different concentrate diet ratio on the anti-oxidant capacity of mammary gland
3.2 不同精粗比日粮对乳腺乳脂与乳蛋白合成的影响
固醇调节元件结合蛋白(SREBP)是一种重要的核转录因子。它与动物体内的胆固醇和脂肪的代谢密切相关[16-17]。李楠[18]和许会芬等[19]采用乳腺上皮细胞SREBP1过表达的方法对其功能进行验证,结果表明,在SREBP1过表达后,乳脂合成相关基因的表达水平显著升高,说明SREBP1在乳脂合成过程中起重要的作用。本研究结果发现,在高精料组SREBP1的基因表达水平显著降低。另外,还发现乳腺中SREBP1和SCD1的蛋白表达水平也有所下降。这进一步解释了高精料日粮组乳中乳脂率降低的原因。
丝氨酸-苏氨酸激酶AKT1是乳腺上皮细胞在泌乳阶段新陈代谢反应中重要的激酶,能够促进GLUT1迁移到细胞膜从而上调葡萄糖的吸收,并能诱导乳腺泌乳的启动。在乳腺的泌乳阶段,AKT1是一个重要的代谢调节器[9]。在乳腺发育的妊娠和泌乳阶段AKT1显著上调。Lin等[20]采用siRNA干扰的方法发现,对奶牛乳腺上皮细胞中AKT1基因表达进行抑制之后,细胞中GLUT1,HK1等与乳糖合成相关的基因表达水平显著降低,表明AKT1与乳糖合成密切相关。本实验结果显示,在HC组,P-AKT1的蛋白表达水平呈下降趋势,而GLUT1的基因表达显著降低。说明高精料日粮通过抑制AKT1的表达,进而影响乳腺上皮细胞对葡萄糖的吸收,从而对乳糖合成产生影响。
3.3 不同精粗比日粮对乳腺组织抗氧化能力的影响
正常情况下,机体受到细胞内一些抗氧化酶的保护,如SOD(超氧化物歧化酶),GSH(谷胱甘肽过氧化物酶),CAT(过氧化氢酶),在与金属催化剂反应前能够形成更多的反应复合物来消除超氧化物和过氧化物这些有毒物质[21],维持体内内环境的稳态,从而保证机体不受自由基的破坏,保持生命活动的正常运行。Celi[22]报道,当体内H2O2产量增加时,抗氧化酶CAT,GPx和谷胱甘肽的活性就会同时增加,从而消除自由基对机体的损伤。目前的结果表明,在高精料日粮组,乳腺组织的T-AOC和GSH的含量有下降趋势,表明在高精料组乳腺组织的抗氧化能力要弱于对照组,进一步揭示了长期饲喂高精料日粮可能会降低乳腺组织的抗氧化能力。
综上所述,长期饲喂高精料日粮可以提高乳产量,长期饲喂高精料日粮可使乳腺组织乳脂,乳糖合成相关基因表达水平下降,可能是乳成分下降的原因之一;另外,长期饲喂高精料日粮使乳腺组织的抗氧化能力下降可能提示对机体健康的潜在威胁。
4 小结
长期饲喂高精料日粮在一定时期内可提高泌乳期奶山羊的奶产量,但会使其乳脂率降低,泌乳性能下降,乳品质降低;同时可能会使乳腺组织的抗氧化能力减弱。
References:
[1] Tao S, Duanmu Y, Dong H,etal. A high-concentrate diet induced colonic epithelial barrier disruption is associated with the activating of cell apoptosis in lactating goats. BMC Vet Res, 2014, 10: 235.
[2] Suburu J, Shi L, Wu J,etal. Fatty acid synthase is required for mammary gland development and milk production during lactation. American Journal of Physiology Endocrinology and Metabolism, 2014, 306(10): 1132-1143.
[3] Zhao F Q, Keating A F. Expression and regulation of glucose transporters in the bovine mammary gland. Journal of Dairy Science, 2007, 90: 76-86.
[4] Dan H C, Sun M, Yang L,etal. Phosphatidylinositol 3-kinase/Akt pathway regulates tuberous sclerosis tumor suppressor complex by phosphorylation of tuberin. The Journal of Biological Chemistry, 2002, 277(38): 35364-35370.
[5] Inoki K, Li Y, Zhu T,etal. TSC2 is phosphorylated and inhibited by Akt and suppresses mTOR signalling. Nature Cell Biology, 2002, 4(9): 648-657.
[6] Manning B D, Tee A R, Logsdon M N,etal. Identification of the tuberous sclerosis complex-2 tumor suppressor gene product tuberin as a target of the phosphoinositide 3-kinase/akt pathway. Molecular Cell, 2002, 10(1): 151-162.
[7] Potter C J, Pedraza L G, Xu T. Akt regulates growth by directly phosphorylating Tsc2. Nature Cell Biology, 2002, 4(9): 658-665.
[8] Berwick D C, Hers I, Heesom K J,etal. The identification of ATP-citrate lyase as a protein kinase B (Akt) substrate in primary adipocytes. The Journal of Biological Chemistry, 2002, 277(37): 33895-33900.
[9] Kohn A D, Summers S A, Birnbaum M J,etal. Expression of a constitutively active Akt Ser/Thr kinase in 3T3-L1 adipocytes stimulates glucose uptake and glucose transporter 4 translocation. The Journal of Biological Chemistry, 1996, 271(49): 31372-31378.
[10] Magun R, Burgering B M, Coffer P J,etal. Expression of a constitutively activated form of protein kinase B (c-Akt) in 3T3-L1 preadipose cells causes spontaneous differentiation. Endocrinology, 1996, 137(8): 3590-3593.
[11] Schwertfeger K L, McManaman J L, Palmer C A,etal. Expression of constitutively activated Akt in the mammary gland leads to excess lipid synthesis during pregnancy and lactation. Journal of Lipid Research, 2003, 44(6): 1100-1112.
[12] Boxer R B, Stairs D B, Dugan K D,etal. Isoform-specific requirement for Akt1 in the developmental regulation of cellular metabolism during lactation. Cell Metabolism, 2006, 4(6): 475-490.
[13] Chodosh L A, Gardner H P, Rajan J V,etal. Protein kinase expression during murine mammary development. Developmental Biology, 2000, 219(2): 259-276.
[14] Khafipour E, Krause D O, Plaizier J C. A grain-based subacute ruminal acidosis challenge causes translocation of lipopolysaccharide and triggers inflammation. Journal of Dairy Science, 2009, 92(3): 1060-1070.
[15] Dong H, Wang S, Jia Y,etal. Long-term effects of subacute ruminal acidosis (SARA) on milk quality and hepatic gene expression in lactating goats fed a high-concentrate diet. PloS One, 2013, 8(12): e82850.
[16] Anderson S M, Rudolph M C, McManaman J L,etal. Key stages in mammary gland development. Secretory activation in the mammary gland: it’s not just about milk protein synthesis. Breast Cancer Research, 2007, 9(1): 204.
[17] Rudolph M C, Monks J, Burns V,etal. Sterol regulatory element binding protein and dietary lipid regulation of fatty acid synthesis in the mammary epithelium. American Journal of Physiology Endocrinology and Metabolism, 2010, 299(6): 918-927.
[18] Li N. Function of SREBP1 in The Milk Synthesis of Dairy Cow Mammary Gland Epithelial Cell[D]. Harbin: Northeast Agricultural University, 2014. 李楠. SREBP1在奶牛乳腺上皮细胞乳脂合成中的功能研究[D]. 哈尔滨: 东北农业大学, 2014.
[19] Xu H F, Luo J, Li F,etal. Effects of SREBP-1 over-expression on fatty acid metabolism related genes expression in goats. Chinese Journal of Biotechnology, 2012, 28(11): 1306-1316. 许会芬, 罗军, 李芳,etal. 山羊SREBP-1基因的超表达对脂肪酸代谢相关基因表达的影响. 生物工程学报, 2012, 11: 1306-1316.
[20] Lin Y, Sun X, Hou X,etal. Effects of glucose on lactose synthesis in mammary epithelial cells from dairy cow. BMC Veterinary Research, 2016, 12(1): 81.
[21] Miller J K, Brzezinska-Slebodzinska E, Madsen F C. Oxidative stress, antioxidants, and animal function. Journal of Dairy Science, 1993, 76(9): 2812-2823.
[22] Celi P. The role of oxidative stress in small ruminants’ health and production. Revista Brasileira de Zootecnia, 2010, 39: 348-363.
Effects of feeding high concentrate diets on lactation indicators and antioxidant levels in the mammary glands of lactating goats
TIAN Ping, SUN Li-Li, DONG Hai-Bo, TIAN Jing, DUANMU Yong-Qian, TAO Shi-Yu, NI Ying-Dong*
KeyLaboratoryofAnimalPhysiologyandBiochemistry,MinistryofAgriculture,NanjingAgriculturalUniversity,Nanjing210095,China
The effect of feeding high concentrate diets for extended periods on lactation indicators and antioxidant potential in the mammary glands of lactating goats, 12 health multiparous guanzhong goats in mid lactation were randomly allocated to two groups; one group receiving diets with low concentrate (concentrate∶roughage 35∶65) as the LC group (n=6), and another receiving high concentrate diet (concentrate∶roughage 65∶35) as the HC group (n=6). The experimental lasted for 12 weeks. At the end of the experiment, goats were slaughtered after overnight fasting. All goats were killed with neck vein injections of xylazine and pentobarbital. Mammary glands and other tissues were sampled and quickly placed in liquid nitrogen and stored at -70 ℃ for gene and protein expressions analysis. The results showed that milk production was significantly increased by feeding a high-concentrate diet and the percentage of milk lactose, protein and fat was significantly increased with lactation time. The expression of sterol regulatory element-binding protein 1 (SREBP1) and Glucose transport 1 (GLUT1) mRNA was significantly decreased (P<0.05), and AKT1 protein levels tended to be lower (P=0.08) in the HC group compared to the LC group. The HC diet moderately reduced the activity of T-AOC the enzyme (P=0.06) and GSH (P=0.08). These results suggest that feeding high concentrate diets reduced the antioxidant ability and significantly decreased the percentage of milk fat as well as down-regulated SREBP1 and p-AKT expression in the mammary glands.
concentrate to roughage ratio; mammary gland; lactation indicators; antioxidant ability; goats
10.11686/cyxb2016283
http://cyxb.lzu.edu.cn
2016-07-14;改回日期:2016-10-09
国家重大基础研究发展计划973项目(No.2011CB100802)资助。
田平(1990-),男,河南南阳人,在读硕士。E-mail:634035259@qq.com*通信作者Corresponding author. E-mail: niyingdong@njau.edu.cn
田平, 孙利利, 董海波, 田靖, 端木永前, 陶诗煜, 倪迎冬. 饲喂高精料日粮对泌乳期山羊泌乳性能及抗氧化能力的影响. 草业学报, 2017, 26(4): 99-105.
TIAN Ping, SUN Li-Li, DONG Hai-Bo, TIAN Jing, DUANMU Yong-Qian, TAO Shi-Yu, NI Ying-Dong. Effects of feeding high concentrate diets on lactation indicators and antioxidant levels in the mammary glands of lactating goats. Acta Prataculturae Sinica, 2017, 26(4): 99-105.
