内蒙古典型草原生物量碳分配格局
2017-04-14胡飞龙闫妍刘立曹云马月陈萌萌刘志民环境保护部南京环境科学研究所江苏南京004北部湾环境演变与资源利用教育部重点实验室广西师范学院广西南宁53000南京大学生物系江苏南京0093中国科学院沈阳应用生态研究所辽宁沈阳006
胡飞龙,闫妍, 刘立,曹云,3,马月,陈萌萌,刘志民(.环境保护部南京环境科学研究所, 江苏 南京 004;.北部湾环境演变与资源利用教育部重点实验室,广西师范学院,广西 南宁 53000;3.南京大学生物系, 江苏 南京 0093;4.中国科学院沈阳应用生态研究所,辽宁 沈阳 006)
内蒙古典型草原生物量碳分配格局
胡飞龙1,2,闫妍2, 刘立1,曹云1,3,马月1,陈萌萌1,刘志民4*
(1.环境保护部南京环境科学研究所, 江苏 南京 210042;2.北部湾环境演变与资源利用教育部重点实验室,广西师范学院,广西 南宁 530001;3.南京大学生物系, 江苏 南京 210093;4.中国科学院沈阳应用生态研究所,辽宁 沈阳 110016)
以内蒙古呼伦贝尔草原、科尔沁草原、锡林郭勒草原等为研究区域,借助群落分层取样方法,科学估测内蒙古典型草原的生物量碳分配情况,主要结论如下:1)我国内蒙古典型草原的平均生物量碳密度为400.56 g C/m2,其中羊草-杂类草(585.18 g C/m2)、冷蒿-其他小禾草(505.68 g C/m2)以及克氏针茅群落(501.45 g C/m2)具有较高的地下生物量碳密度。2)内蒙古典型草原拥有32.26×106hm2的面积,贡献了112.76 Tg的生物量碳,其中地上生物量碳20.42 Tg,地下生物量碳92.34 Tg。3)根冠比(R∶S)分布上,内蒙古典型草原的平均根冠比数值为4.52,要大于一般草地类型。4)地下生物量碳(BGB)沿土壤深度的分布情况,糙隐子草、克氏针茅、羊草-杂类草、羊草-丛生禾草、大针茅、冰草等草本群落均属于“指数型”,即BGB沿深度分布符合指数函数,主要分布在0~10 cm土壤层;冷蒿-糙隐子草、冷蒿-其他小禾草、差巴嘎蒿群落等灌丛群落的BGB分布曲线为“抛物线形”,其地下生物量碳主要分布于20~40 cm土壤层,不符合指数函数但符合二次函数。
碳密度;生物量;根冠比;指数函数
一直以来,生物量碳分配是生态环境保护、植被恢复和固碳潜力研究的核心问题[1-2],在草地碳循环、草原生态保护和土壤潜力研究中得到广泛的应用[3-4]。受过度放牧、气候变化等影响,我国草地特别是牧草生产面临重大挑战,影响着草原畜牧业的可持续发展,而在影响牧草生物量碳分配的诸多因素中,环境异质性是影响植物生物量碳分配的重要因子[5-6],其通过影响群落结构的变化,进而影响整个碳库储量的变化(图1)。

图1 环境异质性与生物量碳分配Fig.1 The relationship between environmental heterogeneity and biomass distribution
草地生态系统占世界陆地总面积的1/5左右,不仅为人类提供食物、衣服材料、洁净空气等服务,同时具有涵养水源、保持水土、固碳释氧等功能,对畜牧业发展、生物多样性保护和生态系统平衡有着重要作用[7]。然而,受限于草地生态系统的内部异质性,以往研究多数考虑了草地相对于其他景观(如森林、农田等)的功能差异,往往忽视草原的内部群落组成以及群落生物多样性间的巨大差别,忽视这样的差别无疑会影响评估的最终效果[8]。
草地生物量碳的80%以上集中在地下,地上生物量碳则是土壤有机碳的最主要输入源,在草地生态系统碳循环中起着关键性作用。然而,受限于采样方法和监测技术,人们对地下生物量碳的认识比较有限。目前主要通过两种方法来估算地下生物量碳:一是模型方法,即通过引入一定的环境变量(如气候、土壤养分、水分等)来估算地下生物量碳。该方法虽然加入模型要素,但对于草地、灌丛等空间异质性较大的景观来说,环境因素的变动性太大,借助环境因素来解释地下生物量碳的可行性较低;二是采用根冠比(R∶S)估算地下生物量。这种方法简单实用,但前提是需要获得准确的根冠比数据,目前中国天然草地尚缺乏这样统一的数据。
为考察草原不同群落可能产生的生物量碳差异,本研究选取内蒙古典型草原为区域,基于不同群落的地上、地下生物量碳分配现状,分析各群落类型的根冠比数据,揭示地下生物量碳(below-ground biomass)沿不同土壤深度的变化与演变规律以及地上生物量碳与地下生物量碳的比例关系(root∶shoot),为系统认识我国天然草地的地上、地下生物量碳分配格局,科学估算我国温带草原的生物量碳储量提供可靠的技术支持。
1 材料与方法
1.1 群落类型选择
借助ArcGIS群落资料,宏观把握草地群落类型的比例,选择10个草原群落(图2),这些群落类型面积占内蒙古典型草原面积的90%以上,可以很好地代表整个草原特征。取样时间为2011年7-8月,自沈阳出发,经左翼中旗到扎鲁特旗,后至呼伦贝尔草原后横穿锡林郭勒盟,再经克什克腾旗返回通辽,完成典型草原的取样工作。

图2 温带典型草原取样群落分布Fig.2 The distribution of sampling communities in temperate typical steppe
1.2 样地布设
样地布设上,每个群落选择5个500 m×500 m典型区域作为取样样地(各样地的距离间隔原则上为2 km以上,但根据群落自身的分布特点,若某些群落分布比较集中的话,至少应有500 m的间隔),同时,每个样地中再随机设置2个1 m×1 m的样方,间隔100 m以上。因此,每个群落将设置有5(样地)×2(样方)=10个样方,温带典型草原共设置样方数为:10(群落)×5(样地)×2(样方)=100个。
1.3 样方取样
1.3.1 地上植被采集 将样方内植物地面以上的所有绿色部分用镰刀齐地面割下,称取总重后选取部分植物装入自封袋,该部分称取重量后用记号笔做好标记,带回实验室65 ℃烘干后称量干重。地上活体生物量(plant)的样本总数为10(群落)×5(样地)×2(样方)=100个。
1.3.2 地表凋落物采集 用钉耙收集样方内地表凋落物和立枯,小心去掉凋落物上附着的细土粒,按样方称重后分别装入自封袋内并编上样方号,带回实验室65 ℃烘干后称量干重。凋落物生物量(litter)的样本总数为10(群落)×5(样地)×2(样方)=100个。
1.3.3 地下根系采集 在取过地上生物量的样方内,将土壤表层的残留物和杂质清理干净,用直径5 cm土钻取3钻土,3钻合并在一起,分0~10 cm、10~20 cm、20~40 cm、40~60 cm、60~80 cm和80~100 cm计6层依次取样。 取好的样品, 此时是土样和根系的混合体,按层分装在自封袋中,并用标签写好样方编号, 放置于自封袋中,称重后带回室内挑选出根系,漂洗干净后65 ℃烘箱烘干称重。地下生物量(BGB)的样本总数为10(群落)×5(样地)×2(样方)×6(层)=600个。
1.4 数据处理
主要测量指标有:地上生物量碳(g C/m2)、地下生物量碳(g C/m2)、根冠比R∶S(地下生物量碳与地上生物量碳的比值)。
一般来说,国际通用生物量碳换算公式为:
B′=B×45%
式中:45%为国际通用换算比例,B′为生物量碳(g C/m2),B为植被的干物质量(g/m2)[9]。在本实验中,部分群落(大针茅、羊草-杂类草、糙隐子草、冷蒿-糙隐子草、冷蒿-其他小禾草、冰草及差巴嘎蒿群落)的生物量碳含量已通过重铬酸钾外烧法实测获得,因此这7个群落的换算以实测值为准(表1),其他群落数据的换算则以均值52%为换算标准。
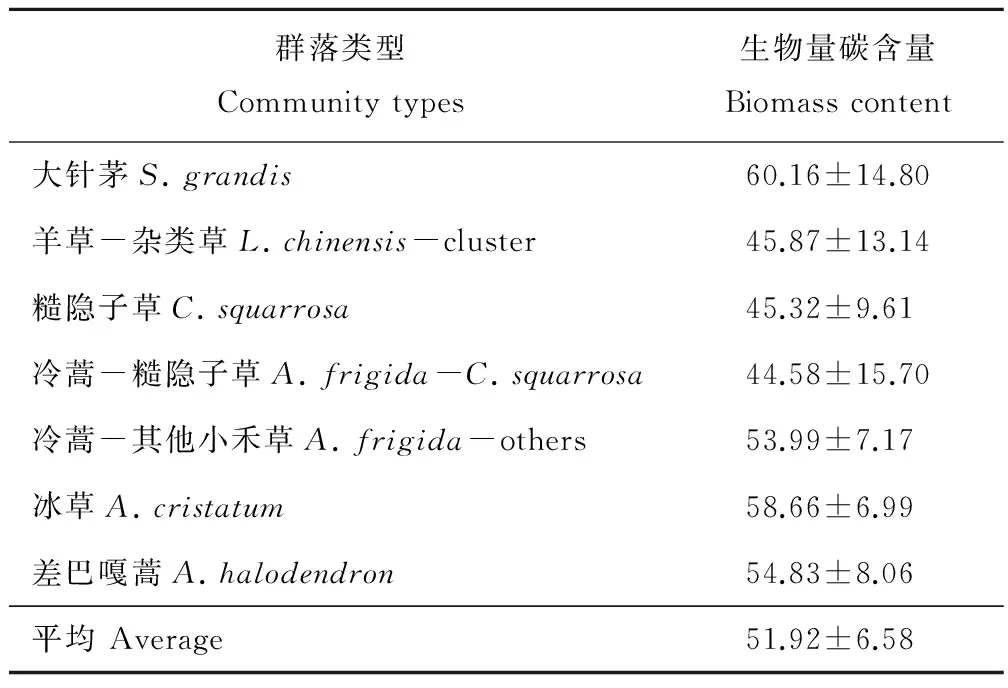
表1 部分群落生物量含量Table 1 Biomass content in several communities %
实验数据呈现为平均值±标准误的形式,采用SPSS 13.0统计软件进行方差分析,组间差异采取LSD检验。
2 结果与分析
2.1 生物量碳水平分配格局
地上生物量碳方面,温带典型草原各群落的地上生物量碳比较接近,平均贡献地上生物量碳密度为64.90 g C/m2,其中沙米群落的含量最低,仅有5.54 g C/m2,要显著低于除冷蒿-糙隐子草、差巴嘎蒿外的群落类型(P<0.05),其他群落均不存在显著性差异(表2)。
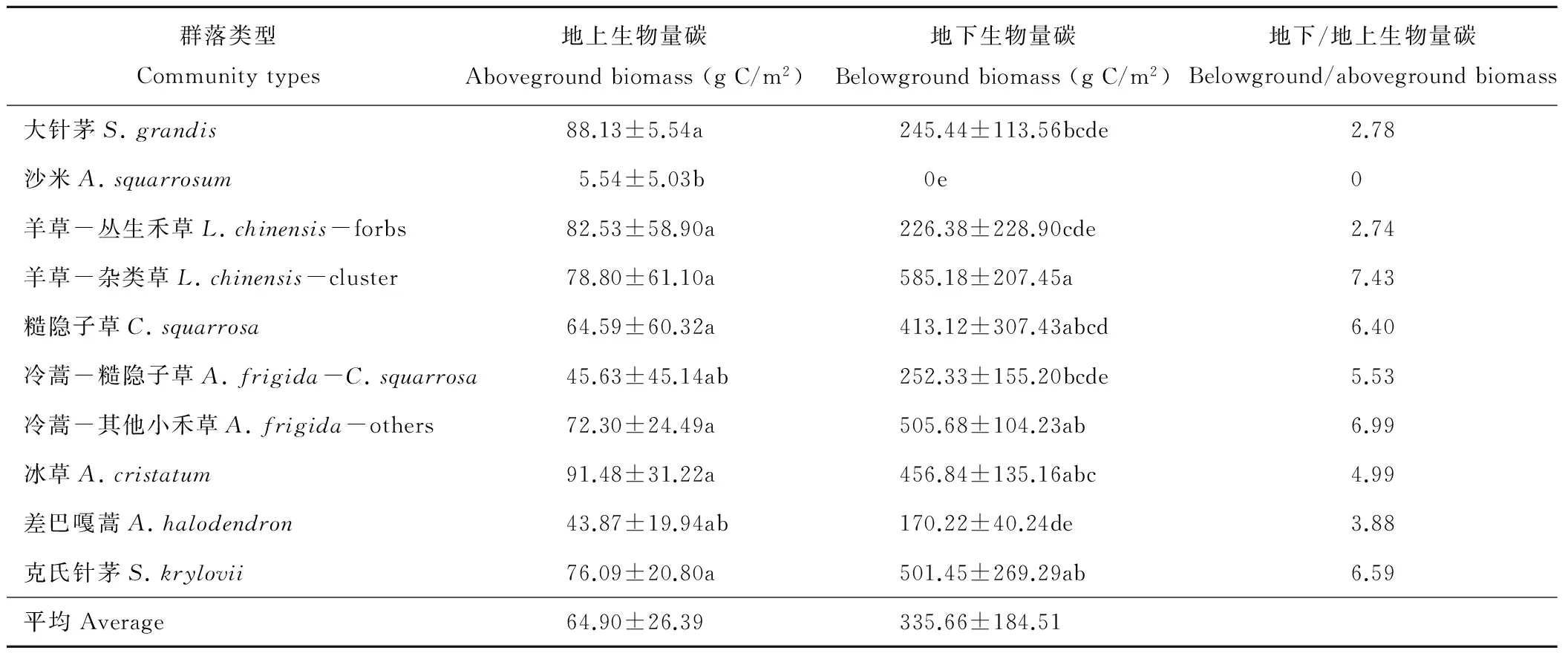
表2 温带典型草原主要群落类型地上、地下生物量碳分布情况Table 2 The distribution of AGB and BGB in temperate typical steppe
注:同列不同小写字母表示显著性差异(P<0.05),采用双侧检验。
Note: Different lowercase letters in the same column indicate significantly different at the level of 0.05 under bilateral inspection.
地下生物量碳方面,温带典型草原的均值为335.66 g C/m2,含量较高的3个群落为羊草-杂类草群落(585.18 g C/m2)、冷蒿-其他小禾草群落(505.68 g C/m2)以及克氏针茅群落(501.45 g C/m2),次之的如糙隐子草(413.12 g C/m2)和冰草群落(456.84 g C/m2),最低的则为沙米群落,因受限于取样尺度问题,所以未检测到其地下生物量。
不同群落之间,其地下与地上生物量碳的比值(根冠比)差异不大,大部分集中在数值7附近,如羊草-杂类草群落为7.43、糙隐子草群落为6.40、冷蒿-其他小禾草群落为6.99以及克氏针茅群落为6.59等。具体来看,温带典型草原根冠比的中位数为5.97;除沙米外,羊草-丛生禾草具有最低的R∶S值(其地下生物量仅是地上生物量的2.74倍);羊草-杂类草群落的地下生物量碳比例则最高,为地上生物量碳的7.43倍(R∶S值为7.43)。2.2 地下生物量碳垂直分配格局
从结果来看,温带典型草原的地下生物量碳沿着土壤分布基本遵循两种趋势:一是地下生物量碳主要分布在表层0~10 cm土层范围内,要显著高于其他土壤层次,沿土壤深度的分布基本遵循指数函数,称之为指数型;二是地下生物量碳在20~40 cm处也有所增加,拟合曲线遵循二次函数,称之为抛物线形。
所选取的草甸草原群落中,大部分群落符合“指数型”,如大针茅、羊草-丛生禾草、羊草-杂类草、糙隐子草群落、冰草以及克氏针茅群落等。这些草原群落在典型草原上分布甚广,占据典型草原区大部分范围,它们根系主要分布在0~10 cm的土壤深度。群落的地下生物量碳沿深度的分布遵循较好的指数函数,最低的羊草-丛生禾草群落拟合的r2也有0.85,最高的糙隐子草群落,其拟合后的指数函数r2甚至高达0.93,基本符合此类植物的生物量碳分布情况(图3)。
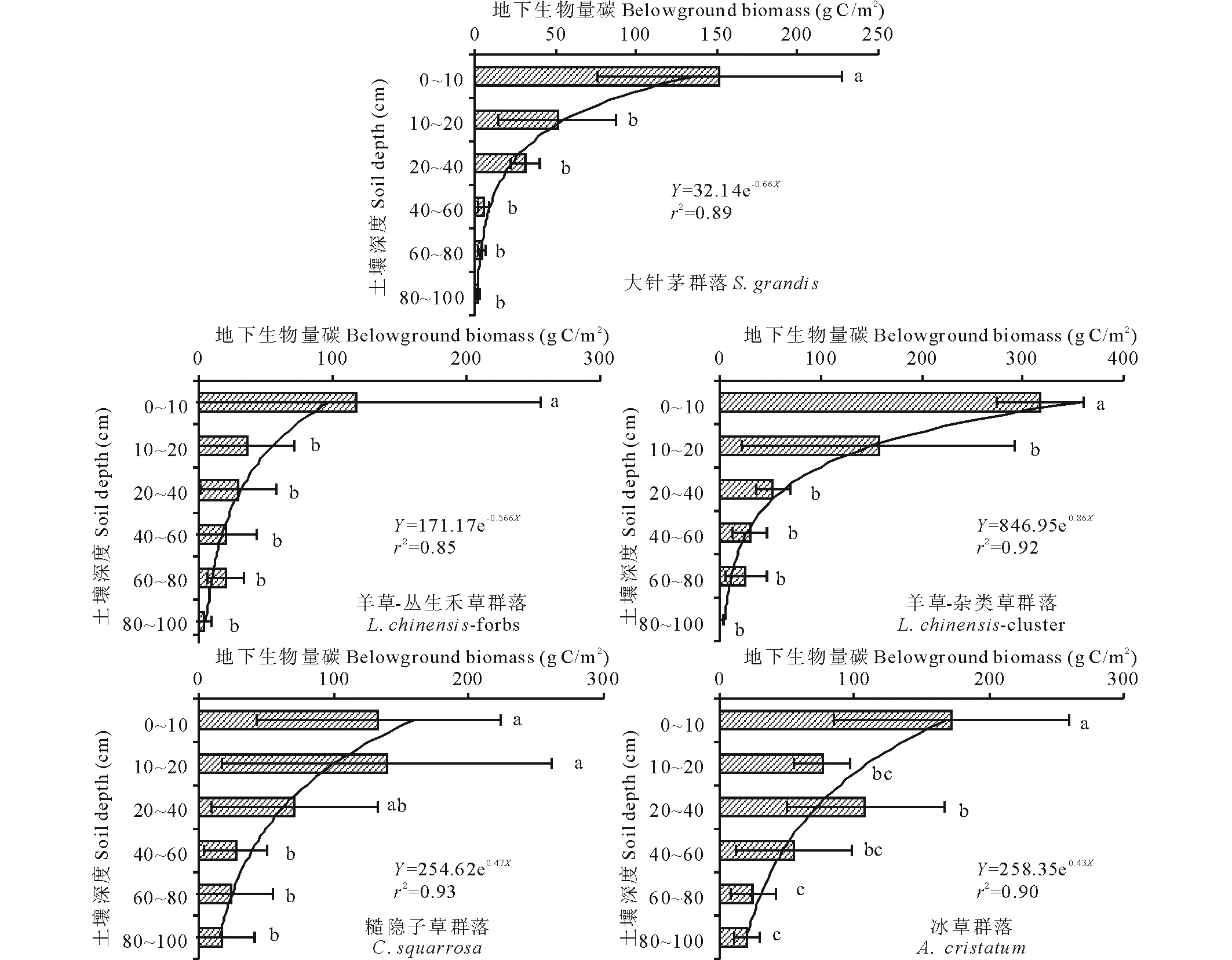
图3 温带典型草原(指数型)地下生物量碳分配情况Fig.3 Distribution of BGB in temperate typical steppe (exponential function type) 不同小写字母表示差异显著(P<0.05),采用双侧检验,下同。Different lowercase letters indicate significantly different at the level of 0.05 under bilateral inspection, the same below.
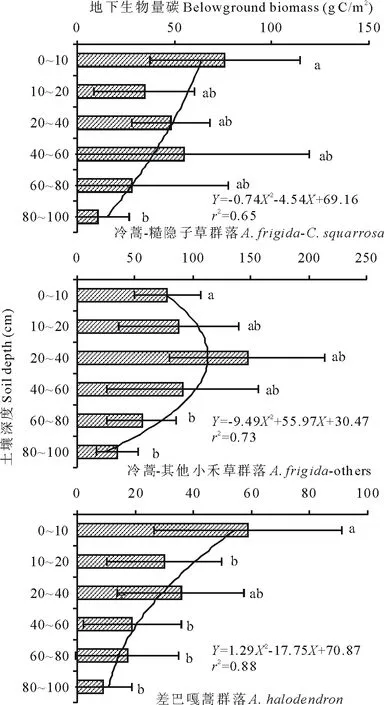
图4 温带典型草原(抛物线形)地下生物量碳分配情况Fig.4 Distribution of BGB in temperate typical steppe (quadratic function type)
符合“抛物线形”分布特征的典型草原群落有冷蒿-糙隐子草、冷蒿-其他小禾草群落以及差巴嘎蒿群落,此类群落在20~40 cm的土壤层也有较高的生物量碳含量,这两种群落地下生物量碳的数值拟合不符合指数函数,呈典型的二次抛物线形(图4)。“抛物线形”之间也呈现一些差别,如冷蒿-糙隐子草、冷蒿-其他小禾草群落基本呈现“凸”型抛物线,而差巴嘎蒿群落出现“凹”型抛物线。
2.3 生物量碳储量及GIS呈现
对温带典型草原生物量碳储量的计算方法,分为两个层面:1)对取样群落生物量碳的估算。针对大针茅草原、羊草-丛生禾草草原等已取群落类型,方法主要是基于该群落生物量碳的实测数值,借助GIS的群落类型属性对其进行赋值,进而换算出各群落类型的碳库储量。2)对取样群落之外的生物量碳估算。因为其他群落类型所占比例不高,不到典型草原面积的1/10,所以,现有的数值代换主要基于已取群落实测数据的均值换算,同时把GIS中典型草原的其他类型赋值。如此,即可得到温带典型草原地上、地下生物量碳分布图(图5,6)。
由图5,6可以看出,温带典型草原的地上生物量碳密度比较均匀,不仅有低于60 g C/m2的密度分布,同时还有70~80 g C/m2的生物量碳密度,且分布范围较为广泛,另外分布较为广泛的为50~60 g C/m2范围的生物量碳密度。地下生物量碳密度方面,400~500 g C/m2的密度范围只有零星分布,<400 g C/m2和500~600 g C/m2的碳密度分布则最为广泛,基本占据典型草原的主要分布区域。

图5 温带典型草原地上生物量碳分布Fig.5 Distribution of AGB in temperate typical steppe

图6 温带典型草原地下生物量碳分布Fig.6 Distribution of BGB in temperate typical steppe
从草地面积分布来看,内蒙古温带典型草原的总面积为32.26×106hm2,其中大针茅群落分布面积最广,约为6.29×106hm2,沙米群落和羊草-丛生禾草群落次之,分别为5.24×106和4.76×106hm2,其他诸如冷蒿-糙隐子草群落(0.70×106hm2)、冷蒿-其他小禾草群落(0.70×106hm2)、冰草群落(0.68×106hm2)等的面积较小,并非典型草原的广布群落(表3)。
由图5,6可以看出,此10个群落的分布面积占温带典型草原总面积的93%,因此,基于典型草原已选群落的实测数据,对温带典型草原的生物量碳进行估测,可以很好地表征温带典型草原的生物量碳储量现状。进一步分析可知,温带典型草原的生物量碳总量为112.76 Tg,其中地上生物量碳的总量为20.42 Tg,地下生物量碳总量达92.34 Tg,从而得出温带典型草原的最终根冠比R∶S=92.34/20.42=4.52。地上生物量碳方面,大针茅群落、羊草-丛生禾草群落以及克氏针茅群落分别贡献了5.55、3.93和3.25 Tg,是主要的地上生物量碳提供者,占整个AGB储量的62.34%;地下生物量碳方面,大针茅群落、克氏针茅群落、羊草-杂类草群落以及羊草-丛生禾草群落贡献最大,分别达到15.44、21.39、16.33和10.78 Tg,要占整个BGB储量的69.24%。
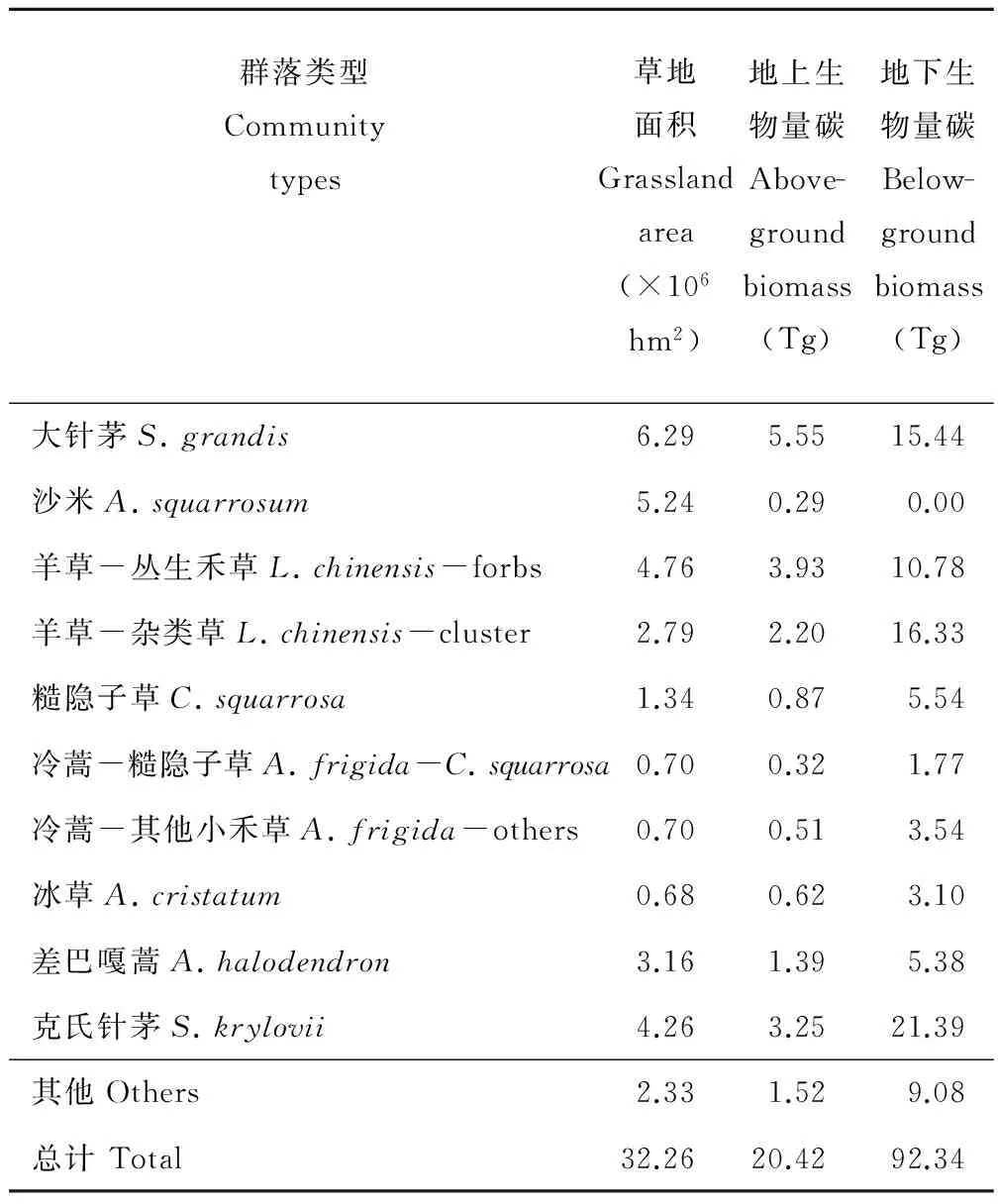
表3 温带典型草原主要群落类型分布面积及生物量碳储量Table 3 Above-ground biomass & below-ground biomass of main community types in temperate typical steppe
3 讨论
3.1 草原生物量碳及储量
草原生物量碳的研究方面,Ni[10]认为我国温带典型草原的生物量碳密度为1000 g C/m2。马文红等[11]也对我国内蒙古地区温带典型草原的地上、地下生物量进行了研究,按照国际通用的45%比例转换为生物量碳后(详见1.4生物量碳的换算公式),得出的地上生物量碳密度为60.03 g C/m2,地下生物量碳密度则为310.01 g C/m2,总生物量碳密度为370.04 g C/m2。此外,针对中国天然草地的生物量研究,李凌浩等[12]提出中国温带草原的地上、地下生物量碳密度分别为59.60和164.10 g C/m2(表4)。
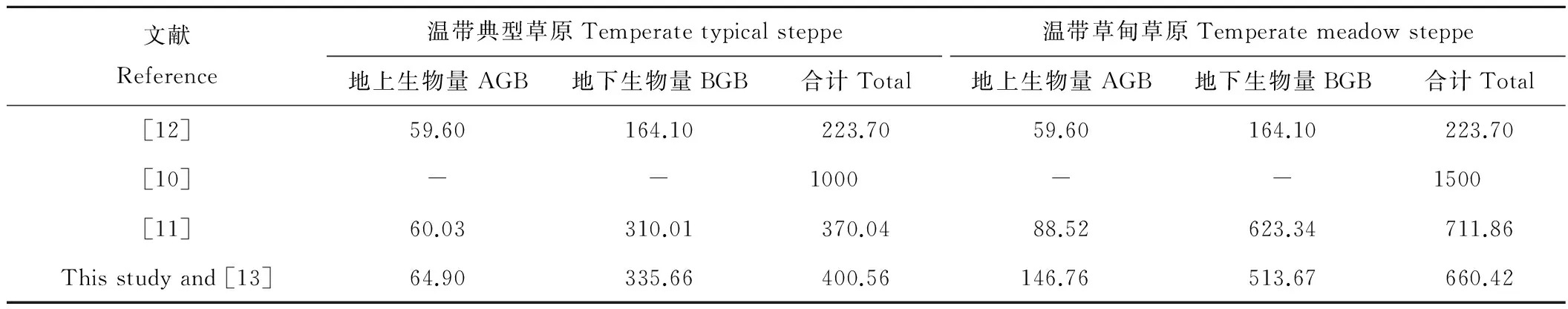
表4 已有草地生物量碳比较Table 4 Comparision of biomass carbon in different studies g C/m2
本研究中,温带典型草原的地上生物量碳密度为64.90 g C/m2,与前述研究(如李凌浩等[12]的59.60 g C/m2以及马文红等[11]的60.03 g C/m2)基本接近。地下生物量碳密度为335.66 g C/m2,要略高于马文红等[11]的310.01 g C/m2,明显高于李凌浩等[12]的164.10 g C/m2,但明显低于Ni[10]的1000 g C/m2。这与试验设计相关,本研究通过系统的群落取样,可以有效规避不合理样本的影响,从而得出更为科学的碳储量数据,因此,本研究得出的生物量碳总密度为400.56 g C/m2。
基于同样的实验设计或评估,虽然不同研究得到的生物量碳含量存在差异,但温带典型草原的生物量碳含量均要显著低于温带草甸草原。如Ni[10]的研究中,温带典型草原的生物量碳含量为1000 g C/m2,估算碳储量为190 Tg;温带草甸草原的含量为1500 g C/m2,碳储量为360 Tg。本研究中,温带典型草原面积为32.26×106hm2,总生物量碳储量则为112.76 Tg,其中地上生物量碳的总量为20.42 Tg,地下生物量碳总量达92.34 Tg;在同样的分层取样背景下,温带草甸草原因面积较小(16.60×106hm2),虽然其含量较高(660.42 g C/m2),但其总生物量碳储量仅为111.20 Tg,其中地上生物量碳的总量为27.57 Tg,地下生物量碳总量达83.63 Tg[13]。
3.2 地下生物量垂直分配格局
群体生物量的分配格局包括水平分配格局和垂直分配格局[14-15]。水平分布上,涉及不同地区、不同群落类型、不同草原类型或是不同管理措施等诸多差异,如齐玉春等[16]通过研究发现,不仅不同草原群落的地下生物量碳差异较大,即使是不同地区的同种植物群落地下生物量碳也存在较大差异。有关研究表明,我国北方温带草原不同类型草地群落初级生产力差异较大,呈现较大的时空变异性,生产力大小沿温带草甸草原—温带典型草原—温带荒漠草原的顺序递减[17]。
垂直分布上,地下生物量碳主要分布在表层,但不同群落也存在一定的差异性。黄德华等[18]对贝加尔针茅(Stipabaicalensis)草原、克氏针茅草原以及线叶菊(Filifoliumsibiricum)草原的研究表明,群落地下生物量碳主要分布于土壤表层,土壤0~30 cm土层的地下生物量碳分别占全剖面根系总量的74.4%、71.2%、68.7%。此外,高寒矮嵩草(Kobresiahumilis)草甸地下生物量碳亦主要分布在0~10 cm的表层土壤中,约占地下总生物量的90.43%,10 cm以下的土层中只占9.75%[19]。
随着研究的进一步深入,已有学者开始对地下生物量碳的垂直分布进行统计和模型模拟,以定量分析根系分布于土壤深度的关系[20-21]。本研究中,草本和灌木(半灌木)BGB分布函数存在较大差别。大针茅、羊草、糙隐子草等草本群落的BGB沿土壤深度的分布满足指数函数,如大针茅的拟合曲线为Y=32.14e-0.66X(r2=0.89)、羊草-杂类草的拟合曲线为Y=846.95e-0.86X(r2=0.92);冷蒿、差巴嘎蒿等灌木的BGB沿土壤深度的分布满足二次函数,如差巴嘎蒿群落的拟合曲线为Y=1.29X2-17.75X+70.87(r2=0.88)、冷蒿-糙隐子草群落的拟合曲线为Y=-0.74X2-4.54X+69.16(r2=0.65)。因此,基于不同群落的BGB分布差异,可以针对不同群落进行特定拟合,从而对草原生物量碳开展科学估测,为草原管理和草地科学的发展提供科学支持。
3.3 地上地下生物量分配——根冠比(R∶S)
草地生物量的80%以上集中在地下,地上生物量碳是土壤有机碳的最主要输入源,在草地生态系统碳循环中起着关键作用[3,22]。然而,受采样方法和技术的限制,人们对地下生物量碳的认识还比较薄弱,成为草地生态系统碳循环研究中的瓶颈[23]。目前主要通过以下两种方法间接估算区域地下生物量:一为模型方法,即通过地上生物量或简单的环境变量来估算地下生物量。但最近的研究表明,模型法对森林植被地下生物量的预测效果较好,对草地和灌丛而言,因环境因素的空间变异性较大,从而对地上生物量的解释较低。第二种方法是采用根冠比估算地下生物量,这种方法更具有实际应用价值,但受取样条件和实验方法的限制,目前中国天然草地尚缺乏统一的根冠比数据[24-25]。
我国天然草地分布广泛,植被总类丰富且变异性较大,群落生物量碳、地下和地上生物量碳受水热条件影响明显,一般在东南和西南地区生物量碳大,而在干冷的西部地区生物量碳则较小,这也导致各草原类型根冠比并不统一[26]。齐玉春等[16]对部分草原群落地下生物量碳(W1)与地上生物量碳(W2)数量关系比较,发现W1/W2的数值从2.76~21.59不等,中间相差近10倍。马文红等[11]利用内蒙古温带典型草原的生物量碳实测数据,得出温带典型草原的R∶S中值为5.3。本研究中,温带典型草原根冠比的中值为5.97,借助典型草原地上、地下生物量碳储量的比值得到的最终R∶S数值为4.52,远高于温带草甸草原的3.03。
4 结论
我国温带典型草原的生物量碳密度均值为400.56 g C/m2,其中羊草-杂类草群落、冷蒿-其他小禾草群落、克氏针茅群落具有最高的BGB碳密度。温带典型草原以32.26×106hm2的面积贡献了112.76 Tg的总生物量碳,其中大针茅群落、羊草-丛生禾草群落和克氏针茅群落贡献AGB储量的62.34%,大针茅群落、克氏针茅群落、羊草-丛生禾草群落以及羊草-杂类草群落贡献69.24%的BGB储量。内蒙古典型草原的根冠比数值为4.52,要高于一般草地类型。根据生物量的地下分布特点,温带典型草原各群落地下生物量碳的垂直分布可划分为“指数型”和“抛物线形”,前者的生物量碳主要分布在表层0~10 cm,符合指数函数,占据主要的草地类型;后者的群落生物量碳不仅分布在0~10 cm,也主要分布在20~40 cm的土壤层次,主要为灌木或半灌木,拟合曲线符合二次抛物线形。
References:
[1] Nishizuka Y. The molecular heterogeneity of protein kinase C and its implications for cellular regulation. Nature, 1988, 334: 661-665.
[2] Higgins J, Thompson S G. Quantifying heterogeneity in a meta-analysis. Statistics in Medicine, 2002, 21(11): 1539-1558.
[3] Bonan G B, Pollard D, Thompson S L. Effects of boreal forest vegetation on global climate. Nature, 1992, 359: 716-718.
[4] Carlyle C N, Fraser L H, Turkington R. Response of grassland biomass production to simulated climate change and clipping along an elevation gradient. Oecologia, 2014, 174(3): 1065-1073.
[5] Steiner C F. The effects of prey heterogeneity and consumer identity on the limitation of trophic-level biomass. Ecology, 2001, 82(9): 2495-2506.
[6] Hutchings M J, John E A. The effects of environmental heterogeneity on root growth and root/shoot partitioning. Annals of Botany, 2004, 94(1): 1-8.
[7] Lamarque P, Tappeiner U, Turner C,etal. Stakeholder perceptions of grassland ecosystem services in relation to knowledge on soil fertility and biodiversity. Regional Environmental Change, 2011, 11(4): 791-804.
[8] Gao Y, Lin H L. The prospects for rangeland ecosystem services evaluation. Acta Prataculturae Sinica, 2014, 23(3): 290-301. 高雅, 林慧龙. 草地生态系统服务价值估算前瞻. 草业学报, 2014, 23(3): 290-301.
[9] Field C B, Campbell J E, Lobell D B. Biomass energy: the scale of the potential resource. Trends in Ecology & Evolution, 2008, 23(2): 65-72.
[10] Ni J. Carbon storage in terrestrial ecosystems of China: estimates at different spatial resolutions and their responses to climate change. Climatic Change, 2001, 49(3): 339-358.
[11] Ma W H, Han M, Lin X,etal. Carbon storage in vegetation of grasslands in Inner Mongolia. Journal of Arid Land Resources and Environment, 2006, 20(3): 192-195. 马文红, 韩梅, 林鑫, 等. 内蒙古温带草地植被的碳储量. 干旱区资源与环境, 2006, 20(3): 192-195.
[12] Li L H, Chen Z Z. The global carbon cycle in grassland ecosystems and its responses to global change. Chinese Bulletin of Botany, 1998, 15(2): 14-22. 李凌浩, 陈佐忠. 草地生态系统碳循环及其对全球变化的响应. 植物生态学报, 1998, 15(2): 14-22.
[13] Hu F L, Yan Y, Lu X Q,etal. Biomass allocation patterns in the temperate meadow steppe in Inner Mongolia. Acta Prataculturae Sinica, 2016, 25(4): 36-44. 胡飞龙, 闫妍, 卢晓强, 等. 内蒙古草甸草原生物量碳分配格局. 草业学报, 2016, 25(4): 36-44.
[14] Verheye H, Hutchings L. Horizontal and vertical distribution of zooplankton biomass in the southern Benguela, May 1983. South African Journal of Marine Science, 1988, 6(1): 255-265.
[15] Yanai R D, Park B B, Hamburg S P. The vertical and horizontal distribution of roots in northern hardwood stands of varying age. Canadian Journal of Forest Research, 2006, 36(2): 450-459.
[16] Qi Y C, Dong Y S, Geng Y B,etal. The progress in the carbon cycle researches in grassland ecosystem in China. Progress in Geography, 2003, 22(4): 342-352. 齐玉春, 董云社, 耿元波, 等. 我国草地生态系统碳循环研究进展. 地理科学进展, 2003, 22(4): 342-352.
[17] Hu Z M, Fan J W, Zhong H P,etal. Progress on grassland underground biomass researches in China. Chinese Journal of Ecology, 2005, 24(9): 1095-1101. 胡中民, 樊江文, 钟华平, 等. 中国草地地下生物量研究进展. 生态学杂志, 2005, 24(9): 1095-1101.
[18] Huang D H, Chen Z Z, Zhang H F. Grassland Ecosystem Studies[M]. Beijing: Science Press, 1988. 黄德华, 陈佐忠, 张鸿芳. 草原生态系统研究[M]. 北京: 科学出版社, 1988.
[19] Wang Q J, Wang W Y, Deng Z F. The dynamics of biomass and the allocation of energy in alpineKobresiameadow communities, Haibei Region of Qinghai Province. Acta Phytoecologica Sinica, 1998, 22(3): 222-230. 王启基, 王文颖, 邓自发. 青海海北地区高山嵩草草甸植物群落生物量动态及能量分配. 植物生态学报, 1998, 22(3): 222-230.
[20] Chen Z, Shao Q, Liu J,etal. Analysis of net primary productivity of terrestrial vegetation on the Qinghai-Tibet Plateau, based on MODIS remote sensing data. Science China Earth Sciences, 2012, 55(8): 1306-1312.
[21] Augusto L, Achat D L, Bakker M R,etal. Biomass and nutrients in tree root systems-sustainable harvesting of an intensively managedPinuspinaster(Ait.) planted forest. GCB Bioenergy, 2014, 7(2): 231-243.
[22] Don A, Schumacher J, Freibauer A. Impact of tropical land-use change on soil organic carbon stocks-a meta-analysis. Global Change Biology, 2011, 17(4): 1658-1670.
[23] Bengough A G, McKenzie B, Hallett P,etal. Root elongation, water stress, and mechanical impedance: a review of limiting stresses and beneficial root tip traits. Journal of Experimental Botany, 2011, 62(1): 59-68.
[24] Scott N, Tate K R, Giltrap D J,etal. Monitoring land-use change effects on soil carbon in New Zealand: quantifying baseline soil carbon stocks. Environmental Pollution, 2002, 116: 167-186.
[25] Piao S, Fang J, Ciais P,etal. The carbon balance of terrestrial ecosystems in China. Nature, 2009, 458: 1009-1013.
[26] Huang M, Ji J J, Cao M K,etal. Modeling study of vegetation shoot and root biomass in China. Acta Ecologica Sinica, 2006, 26(12): 4156-4163. 黄玫, 季劲钧, 曹明奎, 等. 中国区域植被地上与地下生物量模拟. 生态学报, 2006, 26(12): 4156-4163.
Biomass allocation patterns in the temperate typical steppe of Inner Mongolia
HU Fei-Long1,2, YAN Yan2, LIU Li1, CAO Yun1,3, MA Yue1, CHEN Meng-Meng1, LIU Zhi-Min4*
1.NanjingInstituteofEnvironmentalSciences,MinistryofEnvironmentalProtection,Nanjing210042,China; 2.KeyLaboratoryofEnvironmentChangeandResourcesUseinBeibuGulf,GuangxiTeachersEducationUniversity,MinistryofEducation,Nanning530001,China; 3.DepartmentofBiology,NanjingUniversity,Nanjing210093,China; 4.InstituteofAppliedEcology,ChineseAcademyofSciences,Shenyang110016,China
Grasslands are one of the most widespread landscapes worldwide, covering approximately one-fifth of the world’s land surface. China’s grasslands cover only 6%-8% of total grassland area worldwide, but contain 9%-16% of the total carbon stored in the world’s grasslands. Although some progress has been made in monitoring and understanding the factors affecting carbon partitioning, the role of species composition in carbon partitioning is still not fully understood. In this study, we evaluated the biomass distribution patterns and other vegetation indexes in several different steppes, including the Hulunbuir, Horqin, and Xilinguole Steppes. Unlike the random sampling method used in other studies, our study used a stratified sampling method to sample different communities in the typical steppes of northern China. The average biomass carbon density was 400.56 g C/m2in the typical temperate steppe. Among the different plant communities,Leymuschinensis-cluster (585.18 g C/m2),Artemisiafrigida-others (505.68 g C/m2) andStipakrylovii(501.45 g C/m2) had the highest belowground biomass (BGB). The temperate typical steppe contributed 112.76 Tg biomass carbon with an area of 32.26×106hm2, where the aboveground biomass was 20.42 Tg and the BGB was 92.34 Tg. The root∶shoot ratio in the temperate typical steppe was 4.52, which was higher than those of other grassland types. There were two types of BGB distribution: the exponential function type, in which the BGB was mainly distributed at a soil depth of 0-10 cm; and the quadratic function type. The BGB distribution showed the exponential function type in theCleistogenessquarrosa,S.krylovii,L.chinensis-cluster,L.chinensis-forbs,S.grandis, andAgropyroncristatumcommunities. The BGB distribution showed the quadratic function type in theA.frigida-C.squarrosa,A.frigida-others, andA.halodendroncommunities. Evaluation of grassland biomass carbon storage in different grassland communities can clarify the dynamics of carbon storage. The results of this study provide a theoretical basis for developing management strategies and designing research on natural grasslands in northern China.
carbon density; biomass; root∶shoot; exponential function
10.11686/cyxb2016214
http://cyxb.lzu.edu.cn
2016-05-23;改回日期:2016-08-04
广西地表过程与智能模拟重点实验室开放基金(2015GXESPKF01),中央级公益性科研院所基本科研业务专项(20160404)和江苏省青年基金(BK20140116)资助。
胡飞龙(1985-), 男, 江苏连云港人, 博士。E-mail:hfl@nies.org*通信作者Corresponding author. E-mail: zmliu@iae.ac.cn
胡飞龙, 闫妍, 刘立, 曹云, 马月, 陈萌萌, 刘志民. 内蒙古典型草原生物量碳分配格局. 草业学报, 2017, 26(4): 33-42.
HU Fei-Long, YAN Yan, LIU Li, CAO Yun, MA Yue, CHEN Meng-Meng, LIU Zhi-Min. Biomass allocation patterns in the temperate typical steppe of Inner Mongolia. Acta Prataculturae Sinica, 2017, 26(4): 33-42.
