金属离子竞争结合钙调素的电化学行为研究
2017-04-14任聚杰李俊新
崔 敏,任聚杰,李俊新
(河北科技大学理学院,河北石家庄 050018)
金属离子竞争结合钙调素的电化学行为研究
崔 敏,任聚杰,李俊新
(河北科技大学理学院,河北石家庄 050018)
为了探讨金属离子与Ca2+对钙调素(CaM)的竞争结合作用,在pH值为6.5含2 mmol/L[Fe(CN)6]3-/4-的0.15 mol/L的NaCl溶液中,用交流阻抗法研究了金属离子如Ca2+,Cd2+,Al3+,Fe3+结合及竞争结合钙调素的电化学行为。结果表明:金属离子与CaM的结合能力可以通过溶液中[Fe(CN)6]3-/4-在钙调素自组装膜修饰金电极上的电化学反应电阻的变化来判断,Ca2+,Cd2+和Al3+都能与CaM结合,Fe3+不能与CaM结合,且Ca2+与CaM结合能力要比Al3+强;Ca2+在CaM上的结合位点与Cd2+相同,与Al3+不同。交流阻抗法为研究金属离子与CaM的竞争结合行为提供了一个新方法。
电化学;自组装膜;钙调素;交流阻抗法;电化学反应电阻;构象变化
钙调素(CaM)是普遍存在于真核细胞中的多功能钙依赖性调节蛋白,它由148个氨基酸组成,包括4个EF-手性区域,可以与4个Ca2+结合。钙调素只有和Ca2+结合后才有活性,才能在生物体中发挥作用。CaM与Ca2+结合后形成Ca2+·CaM复合物,构象发生变化,从而使CaM活化,活化的Ca2+·CaM复合物可以通过与靶酶作用方式调控代谢过程,参与很多生化反应,在生物体中发挥重要作用[1-5]。鉴于生命环境中同时存在许多金属离子(如K+,Na+,Mg2+,Ca2+,Zn2+,Cu2+,Fe3+)以及环境污染物(如Cd2+,Hg2+,Pb2+,Al3+等)浸入生物体,这些离子也可能会与CaM结合,与Ca2+产生竞争,影响CaM发挥作用。因此研究这些金属离子与Ca2+的竞争结合作用具有重要的生物学意义。
关于离子的竞争行为在生物领域已有广泛研究,但用电化学方法进行研究还鲜有报道[5-10]。由于低成本、高灵敏、易操作等优点,电化学方法已成为环境及生物领域较受欢迎的分析手段之一[11-13]。通过研究生物分子如蛋白质、酶、核糖核酸等修饰到电极上的电化学行为,可以模拟这些生物分子在生物体内的电化学过程,从而了解它们在生物体内的功能,揭示生物活动机理[14]。自组装技术可以很方便地把含有—SH 基团的分子修饰在金电极表面[15-19]。CaM中存在—S—,—SH,—S—S—等键,可以直接键合到Au基底上形成自组装修饰电极(CaM/Au)。在之前的工作中,笔者摸索了CaM在Au基底的成膜条件,讨论了电极电势、pH值对CaM/Au电化学行为的影响[20-22]。本研究利用交流阻抗方法研究了pH值为6.5的环境下,金属离子Ca2+,Cd2+,Al3+和Fe3+与CaM 结合后的电化学行为,讨论了这些离子与CaM的结合能力以及这些离子之间的竞争行为。
1 实验部分
1.1 主要材料和仪器
CaM,由河北师范大学生命科学学院从土豆中提取、纯化、脱钙而得,分子质量为16 670 D,质量浓度为0.7 g/L;所有试剂均为分析纯,水溶液均用二次水配制,pH值为 6.5。
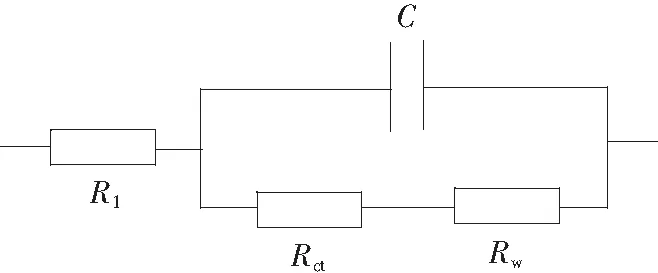
图1 拟合电路图Fig.1 Fitting circuit diagram
本实验采用常规的三电极体系,参比电极为饱和甘汞电极(SCE),辅助电极为大面积的Pt片电极(S=1 cm2),工作电极为CaM自组装修饰的Au电极(CaM/Au电极,Φ=0.15 cm)或结合了金属离子的CaM/Au电极;所有的电位均相对于SCE;电化学阻抗谱(EIS)是利用上海辰华公司生产的CHI 660D在开路电位下测定的,频率范围为0.03 Hz ~100 kHz,溶液为含2 mmol/L [Fe(CN)6]3-/4-的0.15 mol/L NaCl溶液。拟合电路图见图1。
1.2 工作电极的制备
工作电极的制作采用滴涂法,即将0.7 g/L的CaM滴涂到处理好的Au电极上[23],放进充满N2气的试管中,密封,在室温下放置24 h,然后浸入0.15 mol/L的 NaCl溶液中8 h,制得CaM/Au电极备用。
将在含Mx+(Mx+代表Ca2+,Cd2+,Al3+和Fe3+)的溶液中浸泡足够时间(1h)后的CaM/Au电极记作Mx+-CaM/Au电极(如Ca2+-CaM/Au,Al3+-CaM/Au等),浸泡溶液含Mx+的浓度不同(分别为10-9,10-8,10-7,10-6,10-5,10-4mol/L),得到的Mx+-CaM/Au电极含Mx+的量也不相同。将在含10-5mol/LCaCl2溶液浸泡1h得到的Ca2+-CaM/Au电极再在含10-5mol/LCd2+的溶液中浸泡1h,得到的电极记作Cd2+·Ca2+-CaM/Au;若再在含10-5mol/LAl3+的溶液中浸泡1h后,电极记作Al3+·Ca2+-CaM/Au。
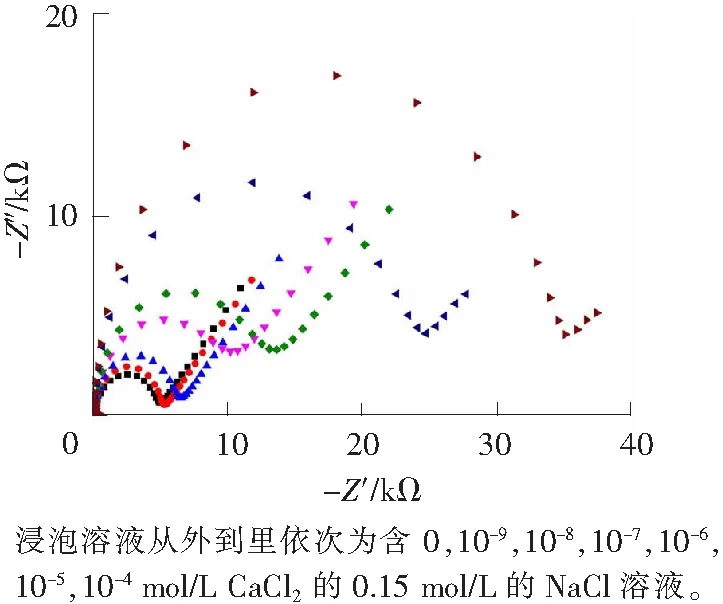
图2 Ca2+-CaM/Au的交流阻抗图Fig.2 Nyquist plots for Ca2+-CaM/Au
2 结果与讨论
2.1 Ca2+结合CaM/Au的电化学行为
电化学反应电阻(Rct) 可以反映电极表面的动力学性质。图2是在不同浓度的Ca2+溶液中浸泡得到的Ca2+-CaM/Au的交流阻抗图,表1为[Fe(CN)6]3-/4-发生电化学反应的电阻Rct与浸泡溶液中Ca2+浓度的关系。从图2及表1可以看出,在Ca2+-CaM/Au电极上的Rct明显小于在CaM/Au电极上的Rct,而且随着浸泡溶液中含Ca2+浓度的增大,Rct逐渐降低直到趋于平稳。这是由于结合了Ca2+的CaM空间构象会发生变化[24],使得[Fe(CN)6]3-/4-更易接近Au基底发生氧化还原反应,从而减小了Rct。因此,通过Rct的减小可以判断Ca2+与CaM的结合情况。刚开始在较稀溶液中浸泡时,Rct变化明显,说明少量Ca2+结合到CaM/Au上就会使CaM空间构象发生明显的变化。随着浸泡溶液中Ca2+的增加,结合的Ca2+也增加,CaM上的结合位点几乎被Ca2+占据,达到饱和状态,CaM空间构象不再发生变化,致使Rct几乎不变而趋于平稳。

表1 CaM/Au在含不同浓度Ca2+溶液中浸泡后得到的Rct值
2.2Al3+结合CaM的电化学行为
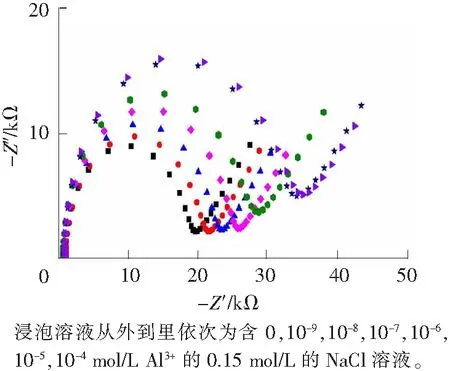
图3 Al3+-CaM/Au电极的交流阻抗图 Fig.3 Nyquist plots for Al3+-CaM/Au
图3是在含Al3+浓度不同的溶液中浸泡足够长的时间后Al3+-CaM/Au的交流阻抗图,表2显示了Rct与溶液中Al3+浓度关系。从图3、表2可以看出,与前面描述的结合Ca2+的Rct变化规律一样,[Fe(CN)6]3-/4-在Al3+-CaM/Au电极上的Rct比在CaM/Au电极上的Rct要小,随着浸泡溶液中Al3+的增多,在Al3+-CaM/Au电极上的Rct进一步降低并趋于平稳。这说明CaM也能和Al3+结合,而且结合了Al3+后的CaM的空间构象也会发生变化,致使[Fe(CN)6]3-/4-在电极上的电化学反应电阻减小。与Ca2+结合情况不同的是,在低浓度(10-9mol/L)时Rct并没有变化,而是在10-8mol/L时才有所减小,这说明Al3+含量低(10-9mol/L)时并不能与CaM结合(此浓度时Ca2+能与CaM结合),Al3+结合CaM的能力比Ca2+结合CaM的能力弱;且与Ca2+相比,Al3+结合了CaM后,Rct的变化也没有那么明显,预测这有可能是Al3+与Ca2+的结合位点不同所致。

表2 CaM/Au在含不同浓度Al3+ 溶液中浸泡后得到的Rct值
2.3 Cd2+与Fe3+结合CaM的电化学行为
同样的方法又研究了Cd2+与Fe3+结合CaM的电化学行为。将CaM/Au电极在含不同浓度(分别为0,10-9,10-8,10-7,10-6,10-5,10-4mol/L)CdCl2的0.15 mol/L NaCl溶液中浸泡足够时间后测定交流阻抗,得到的Rct与浸泡溶液中所含的Cd2+浓度之间的关系如表3所示。

表3 CaM/Au在含不同浓度Cd2+ 溶液中浸泡后得到的Rct值
从表3可以看出,与结合Ca2+后的变化规律一样,CaM结合Cd2+后,Rct减小,随着结合Cd2+的增多,Cd2+-CaM/Au的Rct进一步降低并趋于平稳。这说明CaM也能和Cd2+结合,结合后CaM的空间构象也会发生变化,从而使[Fe(CN)6]3-/4-在电极上的电化学反应电阻减小。
将CaM/Au电极分别依次在含浓度为0,10-9,10-8,10-7,10-6,10-5,10-4mol/LFeCl3的0.15mol/LNaCl溶液中浸泡足够时间后测定交流阻抗,得到的Rct与Fe3+浓度的关系如表4 所示。

表4 CaM/Au在含不同浓度Fe3+ 溶液中浸泡后得到的Rct值
从表4可以看出,随着Fe3+浓度的增加,[Fe(CN)6]3-/4-在修饰电极上的Rct几乎没有发生变化,这表明Fe3+不能引起CaM的空间构象改变,不能与CaM 结合。
2.4 金属离子与Ca2+竞争结合CaM的电化学行为
与Ca2+的离子半径相近的金属离子都有可能与CaM结合,从而与Ca2+产生竞争,影响CaM在生命体内发挥作用。所以研究金属离子与Ca2+竞争结合CaM的行为很有必要。同样利用交流阻抗法,研究了Al3+,Cd2+与Ca2+竞争结合CaM的电化学行为。
图4a)是Ca2+-CaM/Au和Al3+·Ca2+-CaM/Au的交流阻抗谱比较图。其中Ca2+-CaM/Au是CaM/Au在含10-5mol/LCa2+的0.15mol/LNaCl溶液中浸泡足够时间得到的;Al3+·Ca2+-CaM/Au是将得到的Ca2+-CaM/Au再在含10-5mol/LAl3+的0.15mol/LNaCl溶液中浸泡足够时间得到的。从图4a)可以看出,Al3+·Ca2+-CaM/Au的Rct比Ca2+-CaM/Au的还要小,说明有足够多的Ca2+结合了CaM后,CaM中的Ca2+结合位点被占据,依然可以再结合Al3+。若顺序反过来,CaM/Au先在含10-5mol/LAl3+的0.15mol/LNaCl溶液中浸泡足够时间得到Al3+-CaM/Au,然后再在含10-5mol/LCa2+的0.15mol/LNaCl溶液中浸泡足够时间得到Ca2+·Al3+-CaM/Au,比较Al3+-CaM/Au和Ca2+·Al3+-CaM/Au的交流阻抗谱,如图4b)所示。从图4b)可以看出,与Al3+-CaM/Au相比,Ca2+·Al3+-CaM/Au的Rct进一步减小。说明结合了足够多的Al3+后,CaM还可以与Ca2+进一步结合。图4 a)和图4 b)相互印证,从而可以推断在CaM中Al3+的结合位点与Ca2+结合位点不相同,这与生物领域关于CaM中的金属离子的结合位点的研究得到的结论是一致的[5]。

图4 交流阻抗谱比较图Fig.4 Nyquist plots comparison diagram
同样的方法,研究了Cd2+与Ca2+竞争结合CaM的电化学行为。图5所示是Ca2+-CaM/Au和Cd2+·Ca2+-CaM/Au的交流阻抗谱,同样Ca2+-CaM/Au是CaM /Au在含10-5mol/L Ca2+的0.15 mol/L NaCl溶液中浸泡足够时间得到的;Cd2+·Ca2+-CaM/Au是将得到的Ca2+-CaM /Au再在含10-5mol/L Cd2+的0.15 mol/L NaCl溶液中浸泡足够时间得到的。
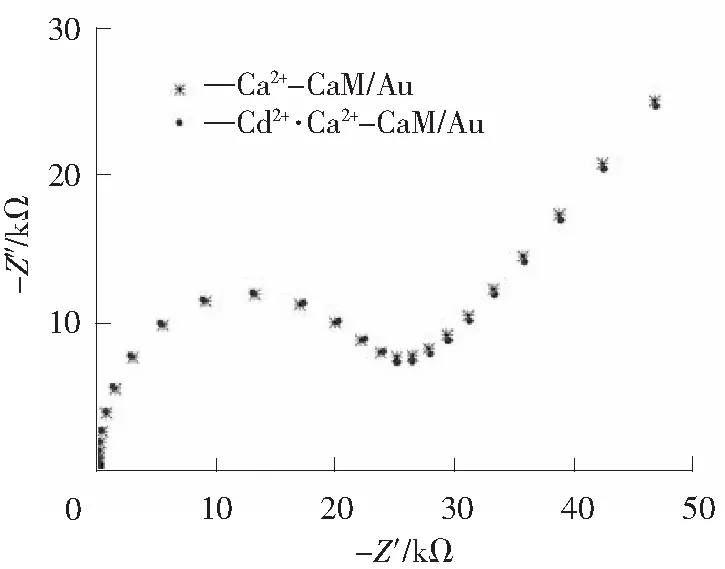
图5 Ca2+-CaM/Au与 Cd2+·Ca2+-CaM/Au 的交流阻抗谱比较图Fig.5 Nyquist plots of Ca2+-CaM/Au and Cd2+·Ca2+-CaM/Au
从图5可以看出,Cd2+·Ca2+-CaM/Au和Ca2+-CaM /Au两者的交流阻抗谱基本重合。这说明CaM中的Ca2+结合位点被Ca2+全部占据后,就不能再结合Cd2+,从而推断在CaM中Cd2+的结合位点与Ca2+结合位点相同,这与之前文献中得到的结论是一致的[25-26]。
3 结 语
金属离子与CaM结合会使CaM的空间构象发生变化,这一点可以通过电化学交流阻抗谱中电化学反应电阻Rct的减小体现出来。因此可以通过Rct的变化判断金属离子是否能与CaM结合,Rct变小,说明能结合,否则不能结合。CaM在含相同浓度的金属离子中浸泡足够时间后,能使Rct减小更为明显的金属离子的结合能力更强。金属离子占据了与CaM的结合位点后,再与其他离子结合,若能使Rct进一步减小,说明这2种金属离子的结合位点不同;若不能使Rct进一步减小,说明这2种金属离子的结合位点相同。Ca2+,Cd2+和Al3+都能与CaM结合,而Fe3+不能;Al3+与CaM的结合能力比Ca2+弱,且结合位点也不相同;Cd2+与CaM的结合位点与Ca2+相同。可见,交流阻抗法为研究离子与CaM的竞争结合行为提供了一个新方法。
/References:
[1] KRETSINGER R H, NOCKOLDS C E. Carp muscle calcium-binding protein[J]. Journal of Biological Chemistry, 1973, 248 (9): 3313-3326.
[2] ZHANG M, TANAKA T, IKURA M. Calcium-induced conformational transition revealed by the solution structure of apo calmodulin[J]. Nature Structural Biology, 1995, 2(9): 758-767.
[3] KUBONIWA H, TJANDRA N, GRZESIEK S. Solution structure of calcium-free calmodulin[J]. Nature Structural Biology, 1995, 2(9): 768-776.
[4] CARAFOLI E, KLEE C B. Calcium as a Cellular Regulator[M]. New York:Oxford University Press, 1999.
[5] KURITA H, NAKATOMI A, SHIMAHARA H, et al. Al3+interaction sites of calmodulin and the Al3+effect on target binding of calmodulin[J]. Biochemical and Biophysical Researcal Communication, 2005, 333(4): 1060-1065.
[6] OUYANG H, VOGEL H. Metal ion binding to calmodulin: NMR and fluorescence studies[J]. Biometals, 1998, 11(3): 213-222.
[7] OZAWA T, SASAKI K, UMEZAWA Y. Metal ion selectivity for formation of the calmodulin-metal-target peptide ternary complex studied by surface plasmon resonance spectroscopy[J]. Biochimicaet Biophysical Acta, 1999, 1434 (2): 211-220.
[8] LEVI R, WOLF T, FLEMINGER G, et al. Immuno-detection of aluminium induced conformational changes in calmodulin-implications in Alzheimer’s disease[J]. Molecular and Cellular Biochemistry, 1998, 189 (1/2): 41-46.
[9] SOLOMON B, KOPPEL R, JOSSIPHOV J. Immunostaining of calmodulin and aluminium in Alzheimer’s disease-affected brains[J]. Brain Researcal Bulletin, 2001, 55(55): 253-256.
[10] KIRBERGER M, WONG H C, JIANG J, et al. Metal toxicity and opportunistic binding of Pb2+in proteins[J]. Journal Inorganic Biochemistry, 2013,125(4): 40-49.
[11] 任聚杰,李柳佳,崔敏,等.萘酚电化学传感器的构建及其应用研究[J].河北科技大学学报,2016,37(1):39-46. REN Jujie, LI Liujia, CUI Min, et al. Construction and application of electrochemicalsensors for the detection of naphthol[J]. Journal of Hebei University of Science and Technology, 2016, 37(1): 39-46.
[12] RONG Q, FENG F, MA Z. Metal ions doped chitosan-poly(acrylicacid)nanospheres: Synthesis and their application in simultaneously electrochemical detection of four markers of pancreatic cancer[J]. Biosensors and Bioelectronics, 2016,75:148-154.
[13]TANG J, JIN B. Poly(crystal violet) -multi-walled carbon nanotubes modified electrode for electroanalytical determination of luteolin[J]. Journal of Electroanalytical Chemistry, 2016,780: 46-52.
[14] SHERVEDANI R K, FOROUSHANI M S. Comparative electrochemical behavior of proteins,cytochromec, agaricus bisporus laccase, and glucose oxidase, immobilized onto gold-thiol self-assembled monolayer via electrostatic, covalent, and covalent coordinate bond methods[J]. Electrochimica Acta, 2016,187: 646-654.
[15] LOFTUS A F, REIGHARD K P, KAPOURALES S A, et al. Monolayer-protected nanoparticle film assemblies as platforms for controlling interfacial and adsorption properties in protein monolayer electrochemistry[J]. Journal of America Chemistry Society, 2008, 130 (5): 1649-1661.
[16] SHAMSIPUR M, FARZIN L, TABRIZI M A.Ultrasensitive aptamer-based on-off assay for lysozyme using a glassy carbon electrode modified with gold nanoparticles and electrochemically reduced graphene oxide[J]. Microchimica Acta,2016,183(10):2733-2743.
[17] BAIN C D, TROUGHTON E B, TAO Y T, et al. Formation of monolayer films by the spontaneous assembly of organic thiols from solution onto gold[J]. Journal of America Chemistry Society, 1989, 20(15): 321-325.
[18]SHEN Q, FAN M, YANG Y, et al. Electrochemical DNA sensor-based strategy for sensitive detection of DNA demethylation and DNA demethylase activity[J]. Analytica Chimica Acta, 2016,934:66-71.
[19]赵忠奎,刘柬葳.离子液体中ATRP法合成MCC-g-PGMA分子及其组装研究[J].河北工业科技,2015,32(5):390-395. ZHAO Zhongkui, LIU Jianwei.Synthesis of MCC-g-PGMA by ATRP in ionic liquids and its self-assemble[J].Hebei Journal of Industrial Science and Technology,2015,32(5):390-395.
[20] DING K, JIA Z, WANG Q, et al. Electrochemical behavior of the self-assembled membrane formed by calmodulin (CaM) on a Au substrate[J]. Journal of Electroanalytical Chemistry, 2001, 513(1): 67-71.
[21] 崔敏,王庆飞,童汝亭.Au/CaM 自组装膜方波伏安法表征[J].河北科技大学学报,2006,27(1): 33-36. CUI Min, WANG Qingfei,TONG Ruting. Token of Au/CaM self-assembled film by square wave voltammetry[J]. Journal of Hebei University of Science and Technology, 2006, 27(1): 33-36.
[22] 崔敏,王庆飞,杨久义, 等.不同pH值对Au/CaM膜结合Ca2+的电化学行为研究[J].河北师范大学学报(自然科学版),2006, 30(4): 437-439. CUI Min, WANG Qingfei, YANG Jiuyi, et al. The investigation of the electrochemistry behaviors at the gold electrode modified with calmodulin self-assembled monolayer combination with metal ion[J]. Journal of Hebei Normal University(Natural Science Edition), 2006, 30(4): 437-439.
[23] RON H, MATLIS S, RUBINSTEIN I. Self-assembled monolayers on oxidized metals: Gold surface oxidative pretreatment, monolayer properties, and depression formation[J]. Langmuir, 1998, 14(5): 1116-1121.
[24] VIVIANO J, KRISHNAN A, WU H, et al. Electrophoretic mobility shift in native gels indicates calciumdependent structural changes of neuronal calcium sensor proteins[J]. Analytical Biochemistry, 2016, 494: 93-100.
[25] LINSE S, DRAKENBERG T, FORSEN S. Mastoparan binding induces a structural change affecting both the N-terminal and C-terminal domains of calmodulin: A 113Cd-NMR study[J]. FEBS Letters, 1986,199(1): 28-32.
[26] IKURA M, HASEGAWA N, AIMOTO S, et al. 113Cd-NMR evidence for cooperative interaction between amino- and carboxy-terminal domains of calmodulin[J]. Biochemical & Biophysical Research Communications, 1989,161(3): 1233-1238.
Study of the electrochemical behaviors of ion-binding to calmodulin
CUI Min, REN Jujie, LI Junxin
(School of Science, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
In order to research the competitive binding with CaM between metal ions and Ca2+, electrochemical impedance spectroscopy (EIS) of ion (such as Ca2+,Cd2+,Al3+,Fe3+) -loaded CaM self-assembled membrane on Au electrode in 0.15 mol/L NaCl solution containing 2 mmol/L [Fe(CN)6]3-/4-at pH 6.5 is investigated. The results indicate that the ion-binding property of CaM can be detected by the change of the electrochemical reaction resistance. Ca2+,Cd2+and Al3+can combine with CaM,and Fe3+can’t combine with CaM. The binding ability of Ca2+to CaM is stronger than that of Al3+. Ca2+binding site of CaM is different from that of Al3+and same as that of Cd2+. Electrochemical impedance spectroscopy provides a new method for the research of metal ions and CaM competition binding.
electrochemistry; self-assembled membrane; calmodulin; electrochemical impedance spectroscopy; electrochemical reaction resistance; conformational change
1008-1542(2017)02-0163-06
10.7535/hbkd.2017yx02010
2016-11-24;
2016-12-19;责任编辑:张士莹
河北科技大学校立基金(XL1181157, XL201253, XL201046)
崔 敏(1971—),女,河北石家庄人,讲师,博士,主要从事电化学分析方面的研究。
E-mail:1335322868@qq.com
O657.1
A
崔 敏,任聚杰,李俊新.金属离子竞争结合钙调素的电化学行为研究[J].河北科技大学学报,2017,38(2):163-168.
CUI Min, REN Jujie, LI Junxin.Study of the electrochemical behaviors of ion-binding to calmodulin[J].Journal of Hebei University of Science and Technology,2017,38(2):163-168.
