Ⅱ型胶原蛋白的结构、功能及其最新研究进展
2017-04-14周晓辉常亚南何晓亮张晋弘
周晓辉,常亚南,何晓亮,张晋弘
(河北科技大学生物科学与工程学院, 河北石家庄 050018)
Ⅱ型胶原蛋白的结构、功能及其最新研究进展
周晓辉,常亚南,何晓亮,张晋弘
(河北科技大学生物科学与工程学院, 河北石家庄 050018)
Ⅱ型胶原蛋白是动物体内透明软骨的主要成分,具有良好的生物相容性、可降解性、可促进细胞生长和再分化等生物学特性,可作为人体组织工程材料,也可应用于食品、日化、包装等领域。利用基因工程技术生产重组Ⅱ型胶原蛋白是该领域的研究热点。综述了Ⅱ型胶原蛋白的结构、功能及应用,阐述了基因工程技术生产重组Ⅱ型胶原蛋白的最新研究进展,对未来羟化胶原蛋白在大肠杆菌中的大规模生产进行了展望,以期为Ⅱ型胶原蛋白的进一步开发和同行研究提供指导和帮助。
蛋白质工程;Ⅱ型胶原蛋白;透明软骨;组织工程;基因重组
胶原蛋白(collagen)又称胶原,是由动物细胞合成的一种生物大分子蛋白质,广泛存在于动物体内,含量丰富,种类繁多,对细胞、组织乃至器官行使正常功能以及损伤修复都有重大影响[1]。
目前已发现了至少49种不同的胶原蛋白多肽链,可以形成的胶原蛋白类型已增加至28种[2]。根据胶原原纤维的特征,胶原蛋白可分为带有周期性横纹的原纤胶原蛋白和没有周期性横纹的非原纤胶原蛋白两大类,其中原纤胶原蛋白约占胶原蛋白总数的90%,包括Ⅰ,Ⅱ,Ⅲ,Ⅴ,Ⅵ,ⅩⅩⅣ 和ⅩⅩⅦ 型胶原蛋白,其余种类均为非原纤胶原蛋白,非原纤胶原蛋白又可进一步分为FACIT族、网状、念珠状等6种,具体详见表1[3-4]。根据在体内的分布,胶原蛋白又可分为间质胶原、基底膜胶原和细胞外周胶原,由于胶原蛋白多存在于细胞间质中,故间质胶原蛋白占整个机体胶原的绝大部分,包括Ⅰ,Ⅱ和Ⅲ型胶原蛋白分子[5]。

表1 胶原蛋白的类型及其在组织中的分布
注:“—”表示目前尚未确定。
典型的胶原蛋白分子,是由3条左手螺旋且为聚脯氨酸Ⅱ型(PPⅡ)的α肽链,相互咬合缠绕,形成长且坚韧的右手超螺旋结构,这是胶原蛋白特有的结构区域,称为“三螺旋域”,一级结构分析表明三螺旋域的最大特点是氨基酸呈现(Gly-X-Y)n周期性重复排列,其中X位置通常为脯氨酸(Pro),Y通常为羟脯氨酸(Hyp)和羟赖氨酸(Hyl),而后两种氨基酸在其他蛋白质中很少见。所有类型的胶原蛋白都有这种重复序列,只是非原纤胶原的三螺旋域中该重复序列在某些特定位置被破坏[2]。这种三肽重复序列对胶原蛋白结构的形成起着很大作用,甘氨酸是唯一适合肽链内部空间位置折叠且能优化折叠构象的氨基酸,羟脯氨酸的羟基参与链间氢键的形成,用于稳定胶原蛋白的三螺旋结构且保持其热稳定性,而羟赖氨酸参与分子内和分子间的共价交联,同时也作为胶原蛋白特定多糖附着的受体,对原纤维的形成有作用[6]。
在胶原家族的众多成员里,Ⅱ型胶原蛋白主要分布在软骨、玻璃体中,占成人软骨基质胶原蛋白总量的90%以上[7]。Ⅱ型胶原蛋白基因的表达是骨型形成、软骨形成、骨骼生长和成熟软骨维持等所必需的。许多软骨性疾病的发生发展,都与Ⅱ型胶原蛋白的结构或功能异常密切相关[8-10]。本文着重对Ⅱ型胶原蛋白的结构、功能及其发展现状进行了论述,为Ⅱ型胶原蛋白的进一步研究开发奠定了理论基础。
1 Ⅱ型胶原蛋白的结构及理化性质
1.1 Ⅱ型胶原蛋白的结构
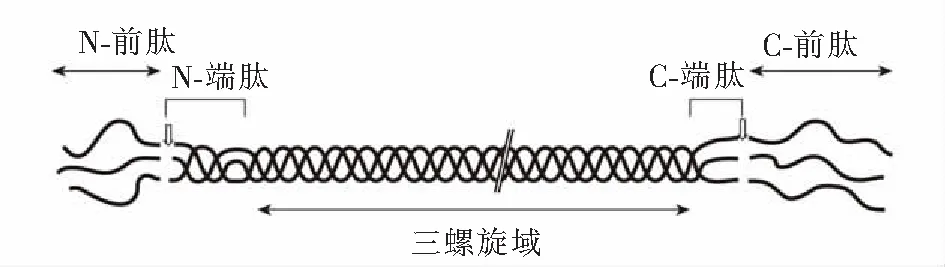
图1 Ⅱ型胶原蛋白的分子结构Fig.1 Molecular structure of procollagen type Ⅱ
早在20世纪70年代初,MILLER[11]就从鸡软骨组织中分离出一种新型的胶原蛋白,称之为Ⅱ型胶原蛋白(collagen type Ⅱ,简称CⅡ)。Ⅱ型胶原蛋白,是由3条相同的α1(Ⅱ)链构成的同型三聚体超螺旋结构[12],见图1。人类Ⅱ型胶原蛋白的基因COL2A1位于12号染色体12q13.11位点上,全长约33 kb,由54个外显子组成,所编码的成熟α1肽链包含1 487个氨基酸。利用光镊技术,发现在pH值呈中性的溶液中Ⅱ型胶原单分子的长度为295.8 nm,具有柔性,而非刚性[13]。
在软骨结缔组织中,Ⅱ型胶原蛋白最初是由软骨细胞合成其前体形式即前Ⅱ型胶原,由于Ⅱ型胶原蛋白的编码基因在不同阶段会受到mRNA可变拼接的调控,主要集中于编码N-端半胱氨酸富集区的外显子2上,故前胶原形成3种不同形式,分别为ⅡA,ⅡD和ⅡB形式[14],见图2。前胶原ⅡA/D的N-端含有半胱氨酸富集区,而ⅡB形式则没有。相对于ⅡA形式,ⅡD形式在N-端多一个色氨酸,由于ⅡD至今都没有特定抗体,和ⅡA又没有严格区分,故人们主要关注ⅡA,ⅡB形式的研究。在人体内,ⅡA形式主要在胚胎外骨骼组织、前软骨间质和不成熟的软骨细胞中表达,而ⅡB形式主要存在于成熟软骨内,因此ⅡA形式与ⅡB形式的转换可作为监测软骨细胞分化的标志。然后,前胶原分泌到细胞外,经细胞基质中的ADAMTS(a disintegrin and metalloproteinase with thrombospondin motifs)-3和BMP(bone morphogenetic protein)-1分别将其N-端和C-端的前肽水解掉[15-16],进而通过聚合、二硫键等共价交联成胶原纤维,成为软骨基质的骨架。
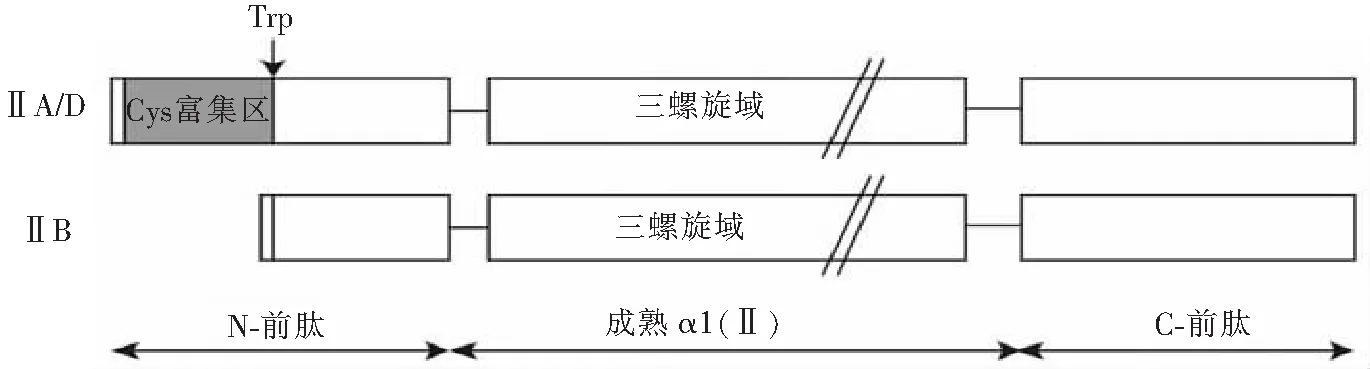
图2 Ⅱ型前胶原可变拼接ⅡA/D,ⅡB的结构Fig.2 Structure of procollagen type Ⅱ A/D and B splice variants
Ⅱ型胶原蛋白自组装形成的纤维直径较细小,在软骨中构成纤细的网状结构,更容易结合蛋白聚糖以及一些其他成分,赋予了软骨良好的弹性、拉伸强度和减震特性,软骨的大多数生理特征都依赖于Ⅱ型胶原蛋白网络的完整性。成熟的Ⅱ型胶原蛋白不含色氨酸[17],与另外2个成纤胶原蛋白Ⅰ型和Ⅲ型在氨基酸组成上也有一个主要区别,即Ⅱ型胶原蛋白中羟赖氨酸的含量是后两者的2~4倍,且大部分羟赖氨酸都被糖基化[18]。
1.2 Ⅱ型胶原蛋白的理化性质
目前,Ⅱ型胶原蛋白的生产主要是利用传统提取法获得,即选取不同种类的动物软骨组织(例如猪、牛、鱼等),经氯仿脱脂、盐酸胍去多糖、胃蛋白酶消化等处理,然后经过透析、离心浓缩等方法纯化得到可溶的Ⅱ型胶原蛋白[9-20]。
尽管来源种类不同,但所得到的Ⅱ型胶原蛋白具有一些基本的物理化学性质[21]。Ⅱ型胶原蛋白的主链主要为β-折叠、无规则卷曲结构,不包含α-螺旋;甘氨酸残基占氨基酸总数的30%左右,是羟脯氨酸含量的4~5倍;不含有色氨酸,且芳香族氨基酸含量较少;在220~230 nm近紫外区出现最大吸收峰;水解的α1肽链分子质量均在110~130 kDa之间;变性温度均在34 ℃以上,比较稳定;是典型的纤维状蛋白质。
然而,对于不同物种、不同来源的Ⅱ型胶原蛋白,其DNA以及mRNA序列具有独特性,表现为氨基酸的组成和比例上存在差异,也直接体现在Ⅱ型胶原蛋白的物化性质上。例如,猪Ⅱ型胶原蛋白α1链的分子质量为120 kDa[22-23],而牛的则在130 kDa以上[24]。同是鲨鱼,蓝鲨的软骨Ⅱ型胶原蛋白,分子质量为130 kDa,在226 nm处有最大紫外吸收峰,变性温度为41 ℃[25],而斑竹鲨的Ⅱ型胶原蛋白分子质量约为116 kDa,变性温度为34.56 ℃[26]。甚至来自不同组织(如鸡胸和鸡胸箭突软骨)的Ⅱ型胶原蛋白,前者分子质量为110 kDa,最大紫外吸收峰在220 nm处,变性温度为44 ℃[27],而后者则为120 kDa,最大吸收峰在230 nm处[28]。从Ⅱ型胶原蛋白的变性温度也可推测海洋生物要明显低于陆地生物,而不同生长环境的海洋生物变性温度也有差异。所有这些均充分体现了不同生物甚至不同组织间Ⅱ型胶原蛋白的独特性,推测Ⅱ型胶原蛋白的理化性质与其生物本身的生活环境很可能息息相关[21]。
2 Ⅱ型胶原蛋白的生物学功能及应用
2.1 Ⅱ型胶原蛋白的生物学功能
Ⅱ型胶原蛋白除了具备胶原蛋白基本的生物学功能,如止血性能、生物相容性、生物可降解性、低免疫原性等,它还具备一些独特的生物学功能。
1) 维持软骨组织的完整性 在软骨形成和生长成熟过程中,软骨细胞主要分泌蛋白聚糖和Ⅱ型胶原蛋白。因此,Ⅱ型胶原蛋白是透明软骨细胞外基质中表达最丰富的蛋白质,同时也是软骨细胞表达的特征性蛋白[29]。Ⅱ型胶原蛋白形成的网状纤维结构,可以和蛋白聚糖以及其他成分紧密结合,维持基质成分平衡,使关节可以灵活运动且具有减震特性和弹性。
2) 刺激软骨细胞生长和再分化 ANNAMALAI等[30]采用琼脂糖混合Ⅱ型胶原蛋白的微体系能明显激活人骨髓间充质干细胞向软骨细胞的分化,并且Ⅱ型胶原蛋白的加入可促进软骨细胞的增殖。同时蒋萍等[29]发现Ⅱ型胶原蛋白还可以延长去分化现象出现的时间,有利于细胞再分化。
3) 诱导免疫耐受 类风湿性关节炎是一种自身免疫性疾病,而Ⅱ型胶原蛋白是类风湿性关节炎最主要的自身抗原之一[31-32],以适宜浓度的Ⅱ型胶原蛋白诱导人体免疫耐受,可预防或缓解类风湿性关节炎病症。LUGO等[33]将未变性的鸡Ⅱ型胶原蛋白对膝关节炎患者给药,结果发现Ⅱ型胶原蛋白可使患者症状明显改善,且耐受性良好。
2.2 Ⅱ型胶原蛋白的应用
在临床医学上,由于软骨组织的自愈能力极低,一旦发生损伤或病变,必须进行修复甚至替换。但是软骨的修复和再生始终是骨科上的一大难题[12]。基于Ⅱ型胶原蛋白的生物相容性、可降解性、低免疫原性,以及可促进软骨细胞的生长和再分化等能力,Ⅱ型胶原蛋白成为软骨组织工程中极具潜力的支架材料。许多学者纷纷利用Ⅱ型胶原蛋白或者与其他成分(例如透明质酸等)按一定比例结合,构建成支架或者水凝胶,这为临床上软骨缺损修复奠定了实验基础[34-35]。
在医药方面,由于Ⅱ型胶原蛋白可以诱导人体免疫耐受,口服或经鼻给药Ⅱ型胶原蛋白,会使患者的关节炎症状明显改善[36]。故Ⅱ型胶原蛋白可以作为疫苗预防关节炎的发生[37],并且补给来自同物种Ⅱ型胶原蛋白的治疗效果最佳[18]。虽然目前的研究仍停留在实验室阶段,相信不久的将来,随着技术的不断发展,Ⅱ型胶原蛋白的疗效将进一步提升。
此外,Ⅱ型胶原蛋白可以作为澄清剂、乳化剂、发泡剂等应用于食品领域,可以添加到洗发水、唇膏等日化品中,还可以作为微型胶囊、片剂包衣等应用在制药行业[12]。
3 重组Ⅱ型胶原蛋白的研究进展
随着基因工程技术的发展,传统提取法根本无法满足市场需求,利用基因重组表达外源蛋白成为目前的研究热点。重组人胶原蛋白是通过生物工程技术将人胶原蛋白的一段cDNA或重新优化设计合成的一段基因序列,构建到表达载体进而在宿主细胞内经诱导表达出的具有人胶原蛋白特征的高分子蛋白质[38]。作为一种新型材料,除了具有动物胶原蛋白的基本生物特性外,还具有可加工、无病毒隐患、变性温度高、酸碱度呈中性等优势,具有极其广阔的应用前景。目前,已广泛应用在止血材料以及人造骨头、人造皮肤和血管支架等人造生物材料上[39]。
早在1991年,ALAKOKKO等[40]就在小鼠3T3细胞中表达出人软骨Ⅱ型前胶原蛋白。1998年,NOKELAINEN等[18]利用杆状病毒系统将分别含有人Ⅱ型前胶原α链基因和脯氨酸-4-羟化酶α,β亚基基因的2个病毒共转染,在昆虫细胞内成功生产出具有稳定三螺旋结构的软骨特异性Ⅱ型胶原蛋白。2000年,MYLLYHARJU等[41]利用甲基毕赤酵母,将人Ⅰ,Ⅱ和Ⅲ型胶原蛋白与脯氨酸-4-羟化酶α,β亚基共表达,获得全长且具有稳定三螺旋结构的人Ⅰ,Ⅱ和Ⅲ型胶原蛋白。事实上,将胶原蛋白基因与脯氨酸羟化酶在宿主细胞内共表达,可显著促进胶原蛋白三螺旋结构的形成。相对于汉逊酵母,将目的胶原的自身信号序列用酿酒酵母α-交配因子取代后,在毕赤酵母中的表达量约是前者的5倍,故大多选用毕赤酵母作为宿主细胞[42]。
然而,由于动物细胞、昆虫细胞的培养难度大,成本高,周期长,目前只限于实验室规模[43]。而使用酵母生产重组胶原蛋白,产量也相对比较低,无法满足市场的大量需求。所以人们开始转向利用原核生物表达系统来生产重组类人胶原蛋白。
在国内,研究重组Ⅱ型胶原蛋白较为深入的是西北大学的范代娣等[44-46],他们利用PCR技术体外扩增获得数段人Ⅱ型胶原蛋白的基因片段,进行拼接重复后,转入大肠杆菌中,成功生产出重组类人Ⅱ型胶原蛋白肽,经过发酵优化,通过补料分批培养,蛋白产量(质量浓度)可达10.8 g/L。
然而,由于胶原蛋白的正确折叠至少得需要8个翻译后修饰酶的加工处理,大肠杆菌则缺乏相应的修饰酶,故至今在大肠杆菌表达系统中无法获得全长且具有稳定三螺旋结构的胶原蛋白。
4 展 望
近年来,国内外市场对胶原蛋白的需求日益增加,但是由于动物胶原蛋白在性能和来源方面的固有缺陷,如因刚性强而难以再加工、异体排斥反应明显,以及存在病毒、传染病等安全隐患,直接限制了其开发利用。而重组类人胶原蛋白弥补了动物胶原蛋白的诸多缺陷,重组类人Ⅱ型胶原蛋白的开发会给组织工程、医药领域带来极大的影响,其应用前景极其广阔。
目前,由于大肠杆菌遗传背景极其清楚,且具有遗传稳定、易于人工改造、生长周期短、繁殖能力强、生产成本低、易于大规模培养、可调控性强,以及下游蛋白提取工艺简单、易于操作等诸多优势,以大肠杆菌E.coli为代表的原核表达体系已成为表达外源蛋白的首选,“安全的基因工程表达系统”已获得美国FDA批准。
尽管Ⅱ型胶原蛋白的基因序列较为复杂、空间构型独特,且原核细胞缺乏相应的修饰酶类等诸多因素影响,限制了重组胶原蛋白在原核系统中的大规模生产。随着2014年,RUTSCHMANN等[47]将人Ⅲ型胶原蛋白基因与巨病毒的脯氨酰和赖氨酰羟化酶基因在大肠杆菌中实现重组转化并共表达,生产出的90mg/L重组胶原蛋白可实现羟基化,且羟基化水平可与天然胶原相媲美,其三螺旋结构类似于天然胶原。这种通过大型巨病毒编码的脯氨酰、赖氨酸羟化酶在原核生物内的共表达揭示了一种生产羟基化胶原蛋白的新方法。这为利用大肠杆菌系统生产羟基化类人Ⅱ型胶原蛋白提供了实验依据。
在大肠杆菌中,如果能够实现重组胶原蛋白的过表达以及脯氨酰、赖氨酰的羟基化,大规模生产重组羟基化胶原蛋白将指日可待。而且随着科学技术的不断发展,具有天然胶原机械性能和结构性质的重组胶原蛋白,将更为广泛地应用在社会各个领域,服务于人类。
/
:
[1] 张波, 乔磊, 杨玉波, 等. 胶原蛋白的研究进展[J]. 中国甜菜糖业, 2015(1): 45-48.ZHANGBo,QIAOLei,YANGYubo,etal.Progressinresearchoncollagens[J].ChinaBeet&Sugar, 2015(1): 45-48.
[2] GORDON M K, HAHN R A. Collagens[J]. Cell and Tissue Research, 2010, 339(1): 247-257.
[3] SHOULDERS M D, RAINES R T. Collagen structure and stability[J]. Annual Review of Biochemistry, 2009, 78(1): 929-958.
[4] 陈静涛, 徐政, 顾其胜. 胶原蛋白研发的最新进展[J]. 上海生物医学工程, 2004, 25(2): 52-55. CHEN Jingtao, XU Zheng, GU Qisheng. Progress in research and development on collagens[J]. Shanghai Journal of Biomedical Engineering, 2004, 25(2): 52-55.
[5] 宋芹, 陈封政, 颜军, 等. 胶原蛋白研究进展[J]. 成都大学学报(自然科学版), 2012,31(1): 35-38. SONG Qin, CHEN Fengzheng, YAN Jun, et al. Research progress in collagens[J]. Journal of Chengdu University (Natural Science Edition), 2012,31(1): 35-38.
[6] KOTCH F W, RAINES R T. Self-assembly of synthetic collagen triple helices[J]. Proceedings of the National Academy of Sciences, 2006, 103(9): 3028-3033.
[7] RAYNAULD J P, MARTEL-PELLETIER J, BERTHIAUME M J, et al. Correlation between bone lesion changes and cartilage volume loss in patients with osteoarthritis of the knee as assessed by quantitative magnetic resonance imaging over a 24-month period[J]. Annals of the Rheumatic Diseases, 2008, 22(67): 683-688.
[8] ROUSSEAU J C, CHEVREL G, SCHOTT A M, et al. Increased cartilage type Ⅱcollagen degradation in patients with osteogenesis imperfecta used as a human model of bone typeⅠcollagen alterations[J]. Bone, 2009, 46(4): 897-900.
[9] BARATHOUARI M, SARRABAY G, GATINOIS V, et al. Mutation update for COL2A1 gene variants associated with type Ⅱ collagenopathies[J]. Human Mutation, 2015, 37(1): 7-15.
[10]KANNU P, BATEMAN J, SAVARIRAYAN R. Clinical phenotypes associated with type Ⅱ collagen mutations[J]. Journal of Paediatrics & Child Health, 2012, 48(2): 38-43.
[11]MILLER E J. Isolation and characterization of a collagen from chick cartilage containing three identical alpha chains[J]. Biochemistry, 1971, 10(9): 1652-1659.
[12]刘浩, 徐乐, 常亚南, 等. 构建软骨支架的天然生物材料[J]. 河北科技大学学报, 2015, 36(5): 539-545. LIU Hao, XU Le, CHANG Yanan, et al. Natural biomaterials for construction of cartilage scallfold[J]. Journal of Hebei University of Science and Technology, 2015, 36(5): 539-545.
[13]SUN Y L, LUO Z P, FERTALA A, et al. Stretching type Ⅱ collagen with optical tweezers[J]. Journal of Biomechanics, 2004, 37(11): 1665-1669.
[14]AUBERTFOUCHER E, MAYER N, PASDELOUP M, et al. A unique tool to selectively detect the chondrogenic ⅡB form of human type Ⅱ procollagen protein[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 2014, 20(4): 80-88.
[15]FERNANDES R J, HIROHATA S, ENGLE J M, et al. Procollagen Ⅱ amino propeptide processing by ADAMTS-3 insights on dermatosparaxis[J]. Journal of Biological Chemistry, 2001, 276(34): 31502-31509.
[16]LI S W, SIERON A L, FERTALA A. The C-proteinase that processes procollagens to fibrillar collagens is identical to the protein previously identified as bone morphogenetic protein-1[J]. Proceedings of National Academy of Sciences, 1996, 93(10): 5127-5130.
[17]徐珍珍. 人胶原蛋白原核表达载体的构建及在大肠杆菌中的表达[D]. 长春: 吉林农业大学, 2011. XU Zhenzhen. Construct Prokaryotic Expression Vector of Human Collagen and Expression inE.coli[D]. Changchun: Jilin Agricultural University, 2011.
[18]NOKELAINEN M, HELAAKOSKI T, MYLLYHARJU J, et al. Expression and characterization of recombinant human type Ⅱ collagens with low and high contents of hydroxylysine and its glycosylated forms[J]. Matrix Biology: Journal of the International Society for Matrix Biology, 1998, 16(6): 329-338.
[19]石服鑫, 曹慧, 徐斐, 等. 不同来源Ⅱ型胶原结构及其免疫活性[J]. 食品与发酵工业, 2014, 40(2): 22-26. SHI Fuxin, CAO Hui, XU Fei, et al. Study on structure and immunological activities of type Ⅱ collagen from different cartilage[J]. Food and Fermentation Industries, 2014, 40(2): 22-26.
[20]莎丽娜, 李振飞, 韩天翔. 羊软骨Ⅱ型胶原蛋白提取中脱钙、脱脂工艺的改进[J]. 内蒙古农业大学学报(自然科学版), 2012, 33(4): 136-139. SHA Lina, LI Zhenfei, HAN Tianxiang. Lmproved process for degreasing and decalcification of collagen type Ⅱ from sheep cartilage[J]. Journal of Inner Mongolia Agricultural University(Natural Science Edition), 2012, 33(4): 136-139.
[21]宋瑞瑞, 包斌, 卜永士, 等. 蓝鲨软骨II型胶原蛋白的物理化学特性[J]. 食品科学, 2013, 34(9): 24-27. SONG Ruirui, BAO Bin, BU Yongshi, et al. Physico-chemical characteristics of type Ⅱ collagen isolated from prionace glauca cartilage[J]. Food Science, 2013, 34(9): 24-27.
[22]宁志刚, 王富友, 崔运利, 等. 可溶性猪软骨Ⅱ型胶原蛋白的提取与鉴定[J]. 重庆医学, 2011, 40(10): 954-955. NING Zhigang, WANG Fuyou, CUI Yunli, et al. Isolation and identification of soluable collagen type Ⅱ from procine articular cartilage[J]. Chongqing Medical, 2011, 40(10): 954-955.
[23]李斯明, 叶春婷, 邹海燕, 等. 高纯度猪软骨Ⅱ型胶原的制备与检测[J]. 生物医学工程学杂志, 2001, 18(4): 592-594. LI Siming, YE Chunting, ZOU Haiyan, et al. Preparation and analysis of pure type Ⅱ collagen from porcine articular cartilage[J]. Journal of Biomedical Engineering, 2001, 18(4): 592-594.
[24]刘志勤, 刘浩, 冯成宝, 等. 从牛软骨中提取II型胶原蛋白及初步构建软骨支架[J]. 黑龙江大学自然科学学报, 2016, 33(3): 386-391. LIU Zhiqin, LIU Hao, FENG Chengbao, et al. Extracting collagen type Ⅱ from bovine cartilage and preliminary construction of cartilage scaffolds[J]. Journal of Natural Science of Heilongjiang University, 2016, 33(3): 386-391.
[25]宋瑞瑞, 包斌, 卜永士, 等. Ⅱ型胶原蛋白的热稳定性、圆二色性和红外光谱研究[J]. 中国海洋药物, 2013,32(1): 55-62. SONG Ruirui, BAO Bin, BU Yongshi, et al. Studies on thermostability, circular dichroism and infrared spectral characteristics of type Ⅱ collagen[J]. Chinese Journal of Marine Drugs, 2013,32(1): 55-62.
[26]KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Isolation and characterization of collagen from the cartilages of brownbanded bamboo shark (Chiloscylliumpunctatum) and blacktip shark (Carcharhinuslimbatus)[J]. LWT-Food Science and Technology, 2010, 43(5): 792-800.
[27]程媛, 曹慧, 徐斐, 等. 鸡胸软骨中Ⅱ型胶原的制备工艺优化[J]. 食品科学, 2015, 36(6): 24-28. CHENG Yuan, CAO Hui, XU Fei, et al. Preparation technology of collagen type Ⅱ from chicken sternal cartilage[J]. Food Science, 2015, 36(6): 24-28.
[28]姜旭淦, 陈盛霞, 王卉放, 等. 可溶性Ⅱ型胶原蛋白提取纯化条件的研究[J]. 临床检验杂志, 2006, 24(6): 418-421. JIANG Xugan, CHEN Shengxia, WANG Huifang, et al. Study on optimizing preparative procedure for isolating and purifying the soluble collagen type Ⅱ[J]. Chinese Journal of Clinical Laboratory Science, 2006, 24(6): 418-421.
[29]蒋萍, 蔚芃, 赵明才, 等.Ⅰ、Ⅱ型胶原蛋白对人软骨细胞生物学特性的影响[J]. 中国组织工程研究, 2014, 18(30): 4845-4850. JIANG Ping, WEI Peng, ZHAO Mingcai, et al. Effect of type Ⅰ or type Ⅱ collagen on biological characteristics of human chondrocytes[J]. Chinese Journal of Tissue Engineering Research, 2014, 18(30): 4845-4850.
[30]ANNAMALAI R T, MERTZ D R, DALEY E L, et al. Collagen type Ⅱ enhances chondrogenic differentiation in agarose-based modular microtissues[J]. Cytotherapy, 2016, 18(2): 263-277.
[31]XU Meihong, GUO Qianying, WANG Shuangjia, et al. Anti-rheumatoid arthritic effects ofSaussureainvolucrataon type Ⅱ collagen-induced arthritis in rats[J]. Food & Function, 2015,7(2): 763-770.
[32]CHO Y G, CHO M L, MIN S Y, et al. Type Ⅱ collagen autoimmunity in a mouse model of human rheumatoid arthritis[J]. Autoimmunity Reviews, 2007, 7(1): 65-70.
[33]LUGO J P, SAIYED Z M, LANE N E. Efficacy and tolerability of an undenatured type Ⅱ collagen supplement in modulating knee osteoarthritis symptoms: A multicenter randomized, double-blind, placebo-controlled study[J]. Nutrition Journal, 2016, 15(1): 1-15.
[34]KUO S M, CHIANG M Y, LAN C W, et al. Evaluation of nanoarchitectured collagen type Ⅱ molecules on cartilage engineering[J]. Journal of Biomedical Materials Research Part A, 2013, 101A(2): 368-377.
[35]崔运利, 王富友, 谭洪波, 等. 应用高浓度Ⅱ型胶原蛋白构建组织工程软骨支架[J]. 第三军医大学学报, 2011, 33(14): 1511-1513. CUI Yunli, WANG Fuyou, TAN Hongbo, et al. Construction of scaffold for treatment of articular cartilage defect using high-concentration collagen Ⅱ[J].Journal of Third Military Medical University, 2011, 33(14): 1511-1513.
[36]TRENTHAM D E, DYNESIUS-TRENTHAM R A, ORAV E J, et al. Effects of oral administration of type Ⅱ collagen on rheumatoid arthritis[J]. Science, 1993,261(5129): 1727-1730.
[37]王安宇, 魏良纲, 乔艺杰, 等.Ⅱ型胶原蛋白基因cDNA序列分析及其真核表达载体的构建[J]. 山东医药, 2012, 52(28): 35-37. WANG Anyu, WEI Lianggang, QIAO Yijie, et al. Sequence analysis of type Ⅱ collagen protein cDNA and construction of its' eukaryotic expression vector[J]. Shandong Medical Journal, 2012, 52(28): 35-37.
[38]唐云平, 郑强, 胡斌, 等. 重组胶原蛋白制备及其应用研究进展[J]. 食品工业科技, 2016, 37(18): 384-386. TANG Yunping, ZHENG Qiang, HU Bin, et al. Research progress on preparation and application of recombinant collagens[J]. Science and Technology of Food Industry, 2016, 37(18): 384-386.
[39]GUO Jiaqing, LUO Yane, FAN Daidi, et al.. Analysis of metabolic products by response surface methodology for production of human-like collagen Ⅱ[J]. Chinese Journal of Chemical Engineering, 2010, 18(5): 830-836.
[40]ALAKOKKO L, HYLAND J, SMITH C, et al. Expression of a human cartilage procollagen gene (COL2A1) in mouse 3T3 cells[J]. Journal of Biological Chemistry, 1991, 266(22): 14175-14178.
[41]MYLLYHARJU J, NOKELAINEN M, VUORELA A, et al. Expression of recombinant human type Ⅰ-Ⅲ collagens in the yeast pichia pastoris[J]. Biochemical Society Transactions, 2000, 28(4): 353-357.
[42]de BRUIN E C, de WOLF F A, LAANE N C M. Expression and secretion of human α1(Ⅰ) procollagen fragment byHansenulapolymorphaas compared toPichiapastoris[J]. Enzyme & Microbial Technology, 2000, 26(9/10): 640-644.
[43]高力虎. 重复序列类人胶原蛋白表达载体的构建及在毕赤酵母中的分泌表达[D]. 南京: 南京理工大学, 2007. GAO Lihu. Construction of Recombinant Human Collagen Expression Vector and Secreted Expression in Pichia Pastoris[D]. Nanjing: Nanjing University of Science and Technology, 2007.
[44]范代娣, 段明瑞, 米钰, 等. 重组E.coli工程菌高密度培养生产人源型胶原蛋白[J]. 化工学报, 2002, 53(7): 752-754. FAN Daidi, DUAN Mingrui, MI Yu, et al. High density fermentation of recomninantE.colifor production of human-like collagen[J]. Journal of Chemical Industry and Engineering(China), 2002, 53(7): 752-754.
[45]王维卓. 重组大肠杆菌高密度发酵生产类人胶原蛋白Ⅱ发酵过程优化[D]. 西安: 西北大学, 2010. WANG Weizhuo. Optimization of RecombinantEscherichiaColiHigh-Density Fermentation Process to Produce Human Collagen[D]. Xi’an: Northwest University, 2010.
[46]GUO Jiaqing, LUO Yane, FAN Daidi, et al. Medium optimization based on the metabolic-flux spectrum of recombinantEscherichiacolifor high expression of human-like collagen Ⅱ[J]. Biotechnology & Applied Biochemistry, 2010, 57(2): 55-62.
[47]RUTSCHMANN C, BAUMANN S, CABALZAR J, et al. Recombinant expression of hydroxylated human collagen inEscherichiacoli[J]. Applied Microbiology & Biotechnology, 2014, 98(10): 4445-4455.
Structure, function and latest research development of collagen of type Ⅱ
ZHOU Xiaohui, CHANG Yanan, HE Xiaoliang, ZHANG Jinhong
(School of Bioscience and Bioengineering, Hebei University of Science and Technology, Shijiazhuang, Hebei 050018, China)
Collagen of type Ⅱ is the major component of hyaline cartilage in animals. Based on its biocompatibility, biodegradability and many other biological properties, for example promoting cell growth and differentiation, collagen of type Ⅱ has been widely applied in various fields, such as tissue engineering material, food, cosmetic, packaging, etc.. In recent years, using genetic engineering to produce recombinant collagen of type Ⅱ is popular. The structure, function and application of collagen of type Ⅱ are described, the latest research progress for producing recombinant collagen of type Ⅱ by genetic engineering is put forward, and the large-scale production of hydroxylated collagen inE.coliin the future is previewed, which would be helpful for the further development and study of collagen of type Ⅱ.
protein engineering; collagen of type Ⅱ; hyaline cartilage; tissue engineering; gene recombination
1008-1542(2017)02-0202-07
10.7535/hbkd.2017yx02016
2016-09-23;
2016-12-16;责任编辑:王海云
河北省“百人计划”资助项目(E2012100005);教育部留学回国人员科研启动基金(4720131792)
周晓辉(1975—),女, 黑龙江齐齐哈尔人,教授,博士,主要从事蛋白质工程方面的研究。
E-mail:zhouxh2003@aliyun.com
Q816
A
周晓辉,常亚南,何晓亮,等.Ⅱ型胶原蛋白的结构、功能及其最新研究进展[J].河北科技大学学报,2017,38(2):202-208.
ZHOU Xiaohui, CHANG Yanan, HE Xiaoliang, et al.Structure, function and latest research development of collagen of type Ⅱ[J].Journal of Hebei University of Science and Technology,2017,38(2):202-208.
