从多角度探究NH4HCO3与少量NaOH溶液反应的实质
2017-04-14吴家军朱梅丽
吴家军+朱梅丽


摘要:向NH4HCO3溶液中逐滴加入少量NaOH溶液涉及多个反应,这些反应间是存在绝对的先后顺序,还是同时进行,反应程度是否不同?经过实验探究与微观理论辨析可以得出确定的结论:OH-与HCO3-、NH4+同时反应,但与NH4+反应程度更大一些。
关键词:NH4HCO3溶液;少量NaOH溶液;反应实质;实验探究;微观辨析
文章编号:1008-0546(2017)04-0093-03 中图分类号:G633.8 文献标识码:B
doi:10.3969/j.issn.1008-0546.2017.04.032
在近两年的高三备考复习中,有关“向NH4HCO3中滴入少量NaOH溶液”的离子方程式书写或正误判断的题目在不同的辅导书和考题中反复出现,所给出的参考答案都是:HCO3-+OH-[=]CO32-+H2O, 百度百科给出的答案也是如此。向NH4HCO3溶液中逐滴加入少量NaOH溶液主要涉及两个反应:NH4++OH-[=]NH3·H2O、HCO3-+OH-[=]CO32-+H2O,这两个反应间是存在绝对的先后顺序,还是同时进行,反应程度是否不同?本文将从实验探究与微观理论探析两个角度展开,以期得出确定的结论。
一、实验探究的角度
1. 定性实验探究
(1)实验操作过程及实验现象
(2)实验结果
结论1:0.1mol·L-1 的NH4HCO3溶液在室温下没有分解生成氨气。
结论2:0.1mol·L-1 的NH4HCO3溶液与0.1mol·L-1 BaCl2没有反应生成BaCO3。
结论3:0.1mol·L-1 的NH4HCO3溶液与0.1mol·L-1 Ba(OH)2发生反应了,生成BaCO3和少量氨气。
2. 定量实验探究
(1)实验操作过程
取10.00mL 0.10mol·L-1 的NH4HCO3溶液于小烧杯中,测pH值,再向其中滴入0.10mol·L-1的NaOH溶液,每增加1.00mL NaOH溶液并振荡,充分反应后测定溶液pH值,平行实验三次,然后推算溶液中HCO3-、NH4+的浓度。
(2)实验用品
氢氧化钠(分析纯,天津滨海科迪化学试剂有限公司)、碳酸氢钠(分析纯,天津致远化学试剂有限公司)、电子天平、250mL容量瓶、碱式滴定管、小烧杯、数显笔式酸度计(型号pH-2011,精确度±0.05,自动补温)。
(3)实验数据(表1)
(4)HCO3-、NH4+的浓度的推算
实验测得0.10mol·L-1的NH4HCO3溶液的pH=9.057,是因为以HCO3-的水解为主,NH4+的水解为辅,且HCO3-的水解程度远远大于NH4+的。经过计算,溶液中c(NH4+)近似等于0.10mol·L-1,c(HCO3-)约为0.0954mol·L-1。
向10.00mL 0.10mol·L-1 的NH4HCO3溶液中滴入0.10mol·L-1 的NaOH溶液VmL。假设下列两个反应都发生:NH4++OH-[=]NH3·H2O(K1)、HCO3-+OH-[=]CO32-+ H2O(K2),根据NH3·H2O的电离常数 (Kb=1.8×10-5)、H2CO3的电离常数(Ka1=4.5×10-7,Ka2=4.7×10-11)和水的离子积(Kw=1.0×10-14)[1]推算出两个反应的平衡常数(K1和K2)表达式为(1)和(2),又因为溶液中的氮原子和碳原子是恒定的,得出物料守恒表达式(3)和(4)。
K1==(1)
K2==(2)
c(NH4+)+c(NH3·H2O)+c(NH3)=
=(3)
c(HCO3-)+c(CO32-)+c(H2CO3)=
=(4)
由于在稀溶液中反應,c(NH3)和c(H2CO3)的值极小,所以它们在(3)和(4)式中可以忽略,再将(1)和(3)、(2)和(4)分别结合整理得到下列表达式(5)和(6):
c(NH4+)·[1+]=(5)
c(CO32-)·[1+·c(OH-)]=(6)
然后,将实验测得pH值转换成c(OH-)代入(5)和(6),得出反应后溶液的c(NH4+)和c(HCO3-),其数值(单位为mol·L-1)如表2,并将测量数据绘制成浓度-体积曲线图,如图1。
(5)实验结果
结论1:0.1mol·L-1 的NH4HCO3溶液呈弱碱性。
结论2:向0.1mol·L-1 的NH4HCO3溶液逐渐滴入0.10mol·L-1 的NaOH溶液,c(NH4+)和c(HCO3-)均在减小,前期阶段c(NH4+)减小幅度远大于c(HCO3-)的,NH4+大量被消耗,随着NaOH量的增加,c(NH4+)减小幅度就没有c(HCO3-)的显著了。
3. 实验探究的结论
通过定性和定量实验探究,可以清楚准确的得出如下结论:向NH4HCO3溶液中滴入少量的NaOH溶液,OH-与HCO3-、NH4+同时发生反应,但OH-与NH4+反应程度更大一些,不存在反应的先后顺序问题。
二、微观探析的角度
宏观的实验结果一定是微观原理的直接反映。溶液中的离子反应也必然是离子间接触性碰撞后才能反应,向NH4HCO3溶液中滴入少量的NaOH时,数目巨大的OH-与HCO3-、NH4+相接触的机会是均等的,反应的机会也是均等的,这样就不存在反应的先后顺序,必然是同时进行反应。那么,为什么又会出现OH-与NH4+反应程度更大一些的实验结果呢?
1. 从粒子立体结构的角度
路易斯碰撞理论认为:反应物分子间的互相碰撞是反应进行的必要条件,当分子以合适的取向碰撞才能发生反应[2]。也將能使化学反应发生的碰撞称为有效碰撞。
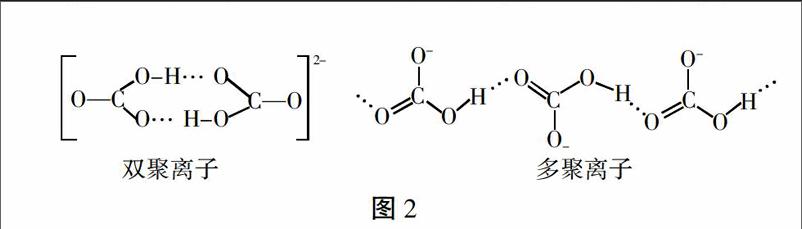
NH4+是由四个等同的s-sp3 σ键形成的正四面体结构。HCO3- 中的碳原子以sp2杂化轨道与三个氧原子的p轨道形成σ键,碳原子的另一个未参与杂化的p轨道与氧原子的p轨道形成π键,分子呈平面三角形[3]。NH4HCO3溶液中的NH4+和HCO3-自由无规则运动着,当与NaOH溶液混合时,OH-与NH4+和HCO3-分别发生碰撞,NH4+的正四面体结构决定它有四个几率均等的方向与OH-发生有效碰撞,但平面三角形的HCO3-只有连有羟基的一端可以与OH-发生有效碰撞,OH-与NH4+发生有效碰撞的空间选择性要比和HCO3-的大很多。另外,HCO3-在溶液中通过氢键形成双聚(HCO3)22- 和多聚链状(HCO3)nn- 离子[4],如图2,这样更加减少了能与OH-发生有效碰撞的HCO3-离子数目,使得反应HCO3-+OH-[=]CO32-+H2O的反应程度下降。
基于此,可以推理出“向NH4HCO3溶液中滴入少量的NaOH溶液,OH-与HCO3-、NH4+同时反应,但与NH4+反应程度更大一些。”的论点。
2. 从静电作用的角度
静电作用是物质组成和物质变化过程中普遍的作用力。OH-与NH4+和HCO3-的反应过程也必然与静电作用力有关。
(1)离子间的静电
NH4+是带一个正电荷的原子团,OH-和HCO3-都带一个负电荷。当NH4HCO3溶液与NaOH溶液混合时,NH4+与OH-之间的静电吸引力就能使其较大程度地“亲密”接触,而HCO3-与OH-之间的静电排斥力就会使其无法接触“亲密”。这种因素也会使OH-与NH4+反应程度提高,与HCO3-的反应程度降低。
(2)化学键和氢键
化学反应是旧键断裂与新键形成的过程。由表3 [5]可知:NH4+中N-H的键能接近389kJ·mol-1,HCO3-中O-H的键能接近465kJ·mol-1,发生化学反应时,NH4+中N-H比HCO3-中O-H更容易断裂,这也说明了OH-与NH4+反应程度比与HCO3-的大。
氢键常用X-H···Y的形式表示,是分子间作用力的一种,成键时X、H和Y尽可能三原子共线,当X、Y的电负性越大,原子半径越小时,形成的氢键越强。H、N和O原子的电负性大小关系为:O>N>H,它们产生的氢键键能如表4[6]所示。
NH4HCO3溶液与NaOH溶液混合时,HCO3-、NH4+分别与OH-的反应过程必然有通过氢键作用形成反应的中间状态(如图3),氢键的强弱也会影响NH4+、HCO3-在反应中断键的难易程度。由表4可知:NH4+与OH-之间的氢键键能约为20.9kJ·mol-1,HCO3-与OH-之间的氢键键能约为18.8kJ·mol-1,这就使得NH4+中H原子比HCO3-中H原子更容易脱离离子体,形成水分子。氢键的作用也使得OH-与NH4+ 反应程度比与HCO3-的大。
3. 微观探析的结论
离子是自由运动、自由接触而反应的,HCO3-、NH4+分别与OH-的反应是同时发生的,不存在先后顺序。而HCO3-、NH4+的结构不同,又决定了二者与OH-反应的程度不同,从各种角度分析得出:NH4+与OH-反应的程度更大一些。
三、结论
综上所述,向NH4HCO3溶液中滴入少量的NaOH溶液,会同时发生两个反应:NH4++OH-[=]NH3·H2O、HCO3-+OH-[=]CO32-+H2O ,第一个反应的程度更大一些,不存在二者反应的先后顺序问题。
另外,“向NH4HCO3溶液中滴入少量NaOH溶液”的离子方程式不能写成:HCO3-+OH-[=]CO32-+H2O,也不能写成:NH4++OH-[=]NH3·H2O,这两种书写都是与实验结果不吻合的,而应该把两个离子反应方程式都分别分开书写出来,这样才与实验结果吻合。
在实际教学中,关于“向NH4HCO3溶液中滴入少量NaOH溶液”的问题要么绕开,要么给学生一个准确的解释,不能给予不确定的结果或错误的答案。当然,“向NH4HCO3溶液中滴入过量NaOH溶液”的反应离子方程式为:NH4++HCO3-+2OH-[=]NH3·H2O+CO32- + H2O ,它是确定的,可以用来考查学生。
参考文献
[1] 华彤文,卞江等.普通化学原理(第4版)[M].北京:北京大学出版社,2013:471
[2] 北京师范大学等,无机化学考研室.无机化学(上册第四版)[M].北京:高等教育出版社,2002:285-288
[3][4]北京师范大学等.无机化学(下册第四版)[M].北京:高等教育出版社,2002:567-568
[5] 周公度,段连运.结构化学基础(第4版)[M].北京:北京大学出版社,2008:184
[6] 华彤文,卞江等.普通化学原理(第4版)[M].北京:北京大学出版社,2013:304
[7] 季慧.利用数字化实验验证稀NH4HCO3溶液中滴入少量稀NaOH溶液的反应顺序[J].科学大众(科学教育),2014,9
