不同食用油脂对大鼠胰岛素抵抗和糖异生的影响
2017-04-13卜文婕杨建课
卜文婕,李 艳,童 丽,杨建课,孙 敏,*
(1.皖南医学院医学生物学教研室,安徽芜湖 241002;2.安徽大学生命科学学院,安徽合肥 230601;3.青海大学医学院中藏药研究中心,青海西宁 810001)
不同食用油脂对大鼠胰岛素抵抗和糖异生的影响
卜文婕1,2,李 艳2,童 丽3,杨建课1,孙 敏2,*
(1.皖南医学院医学生物学教研室,安徽芜湖 241002;2.安徽大学生命科学学院,安徽合肥 230601;3.青海大学医学院中藏药研究中心,青海西宁 810001)
目的:比较不同油脂对SD大鼠胰岛素抵抗和糖异生的影响。方法:将雄性SD大鼠以7只为一组分为4组,对照组食用基础饲料,猪油、橄榄油和油茶籽油组大鼠食用含相应油脂高脂饲料,连续喂养17周,处死前进行口服葡萄糖耐量(OGTT)和胰岛素耐量实验(ITT),大鼠取血处死后,取血清检测空腹血糖(FPG)、空腹胰岛素(FINS)和脂联素的水平,计算胰岛素抵抗指数(HOMA-IR),并采用Real time PCR技术检测大鼠肝脏中糖异生相关基因磷酸烯醇丙酮酸羧激酶(PEPCK)、葡萄糖6-磷酸酶(G6Pase)的mRNA表达。结果:各油脂组大鼠表现出不同程度的胰岛素抵抗(IR),猪油组大鼠FPG、FINS和HOMA-IL均显著升高(p<0.05),OGTT和ITT异常,血清脂联素明显降低(p<0.05),而橄榄油和油茶籽油组大鼠IR程度显著低于猪油组(p<0.05),油茶籽油组脂联素水平明显高于猪油组(p<0.05)。糖异生相关基因中,各油脂组大鼠PEPCK和G6P表达量均升高(p<0.05),其中猪油组明显高于其他组(p<0.05),橄榄油组和油茶籽油组与正常组间差异较小,但存在统计学意义(p<0.05)。结论:富含饱和脂肪酸(SFA)的猪油可增加产生IR的风险,而不饱和脂肪酸(UFA)丰富的橄榄油和油茶籽油诱导大鼠IR程度明显低于猪油组,有统计学意义(p<0.05),其中油茶籽油作为我国特产油脂,可作为优质油脂进行食用。
食用油,胰岛素抵抗,脂联素,糖异生
《中国居民营养与慢性病状况报告》表明,我国城市居民超重肥胖问题凸显,脂肪摄入量过多,平均膳食脂肪供能比超过30%[1],机体脂肪酸的摄取主要依靠人们日常生活中的食用油脂满足的,但是过食和不适当食用油脂会导致肥胖,从而导致胰岛素抵抗(IR)的发生。目前对IR发生的机制研究众多,但其具体机制尚无明确定论,其中脂肪细胞因子脂联素越来越受人们重视,其影响胰岛素敏感性的分子机制非常复杂,本文通过对不同的食用油脂(富含饱和脂肪酸的猪油以及富含不饱和脂肪酸的橄榄油和油茶籽油[2])引起大鼠IR程度的比较,从脂联素与糖异生关系的角度出发,来探究产生IR的原因,同时为食用油的选择提供一定的依据。其中油茶籽油作为我国特产油脂,其保健作用越来越受人们重视,文章从IR水平探讨了油茶籽油作为优质食用油的可能性。

表1 Real time PCR引物序列Table 1 The primers of real time PCR
1 材料与方法
1.1 材料与仪器
食用油 猪油,临沂新程金锣肉制品集团有限公司;橄榄油 益海嘉里投资有限公司;油茶籽油 安徽龙眠山食品有限公司;基础饲料 安徽医科大学实验动物中心;胰岛素 诺和诺德制药有限公司;葡萄糖、超灵敏胰岛素ELISA试剂盒 瑞典Mercodia公司;脂联素ELISA试剂盒 EMD 美国Millipore公司;总RNA提取试剂盒 上海赛百盛公司;Real Time PCR试剂盒 北京全式金公司;稳豪型血糖试纸 强生(上海)医疗器械有限公司;SPF级雄性SD大鼠,4周龄,体重(70±10) g 安徽医科大学实验动物中心,实验动物合格证号:皖医动准字01号;本次实验所用高脂饲料的配方比例 基础饲料占71.95%,食用油占10%,奶粉占2.5%,糖占5%,蛋黄占10%,胆固醇占0.5%,胆酸钠占0.05%。
One Touch血糖仪 美国强生Lifescan公司;多功能酶标仪 瑞士Tecan公司;电动匀浆器 宁波新芝生物科技股份有限公司;全自动生化分析仪 德国西门子公司;PCR扩增仪 美国伯乐公司;荧光定量PCR仪器 美国ABI公司。
1.2 实验方法
1.2.1 动物饲养方法 大鼠在光/暗周期12 h/12 h,室内温度(25±0.5) ℃适应性饲养7 d,适应期后随机进行分组,分别是:对照组、猪油组、橄榄油组和油茶籽油组,自由饮食饮水,对照组喂食基础饲料,各油脂组喂食相应油脂的高脂饲料,持续饲养17周。
1.2.2 口服葡萄糖耐量(OGTT)和胰岛素耐量(ITT)实验 在大鼠处死前一周内进行OGTT和ITT实验,方法如下:
OGTT实验:将饲养大鼠饥饿10 h后,用血糖仪进行血糖检测。然后以2.5 g/kg剂量的葡萄糖溶液进行灌胃,以空腹血糖作为0 min血糖值,分别测30、60、120和180 min处血糖值。ITT实验:取OGTT实验2 d后的大鼠进行胰岛素耐量实验,用血糖仪进行血糖检测,接着对大鼠进行腹腔注射胰岛素,剂量为0.75 U/kg,以空腹血糖作为0 min血糖值,测定30、60、90和120 min处的血糖值。
1.2.3 胰岛素抵抗相关指标 大鼠饥饿过夜后麻醉,腹主动脉取血处死,分离血清,并取肝脏组织于液氮中保存待用。使用全自动生化分析仪检测血清中空腹血糖(FPG)含量,使用超灵敏胰岛素ELISA试剂盒检测大鼠血清的胰岛素水平,相关检测方法参考试剂盒说明书。
胰岛素抵抗指数[3](HOMA-IR指数)=[空腹胰岛素(国际单位/升)×空腹血糖(mmol/L)]/22.5
1.2.4 血清中脂肪细胞因子脂联素的检测 使用脂联素ELISA试剂盒检测大鼠血清脂联素水平,相关检测方法参考试剂盒说明书。
1.2.5 肝脏糖异生相关基因的检测 依照总RNA提取试剂盒(提供的试剂和方法提取大鼠肝脏组织总RNA,取总RNA进行DNA酶解纯化后反转录成cDNA(20 μL体系),以cDNA为模板进行real time PCR检测,PCR扩增条件:预变性95 ℃ 10 min,变性95 ℃ 15 s,退火60 ℃ 1 min,所有基因均为40个循环。使用ABI实时定量PCR仪检测糖异生相关代谢基因,基因及内参的上下游引物见表1。
1.3 统计学分析
采用SPSS 8.0统计软件进行数据分析,数据用平均值±标准差表示,作图工具为Graphpad 5.0软件。
2 结果与分析
2.1 不同油脂对SD大鼠OGTT和ITT的影响
如图1所示,在口服葡萄糖30 min后各组血糖均升高,其中猪油组上升最高,但各组间差异性较小(p>0.05),60 min后,猪油处理组大鼠血糖值显著高于其他组(p<0.05),橄榄油处理组大鼠60 min后基本恢复血糖,油茶籽油处理组大鼠与对照组间无明显差异(p>0.05)。图2所示,ITT实验中,各组在注射胰岛素后血糖均下降,其中对照组大鼠血糖下降最快,其次是油茶籽油组,猪油与橄榄油组大鼠血糖降低缓慢。对照组和油茶籽油组大鼠均在60 min时降到最低,60 min时对照组显著高于猪油处理组(p<0.05),橄榄油和油茶籽油组大鼠与对照组间无显著性差异(p>0.05)。橄榄油组和猪油组大鼠在90 min时下降到最低,其他组血糖值均有所回升,各组间在90 min和120 min时无显著差异(p>0.05),结果提示猪油组胰岛素耐量异常,胰岛素不敏感,表明有IR产生,橄榄油组IR程度比猪油组低,油茶籽油组与对照组大鼠的血糖值在各时间点都差异不显著(p>0.05)。
表3 不同油脂对SD大鼠血清脂联素的影响

图1 不同油脂对SD大鼠OGTT的影响Fig.1 The influence of different oils
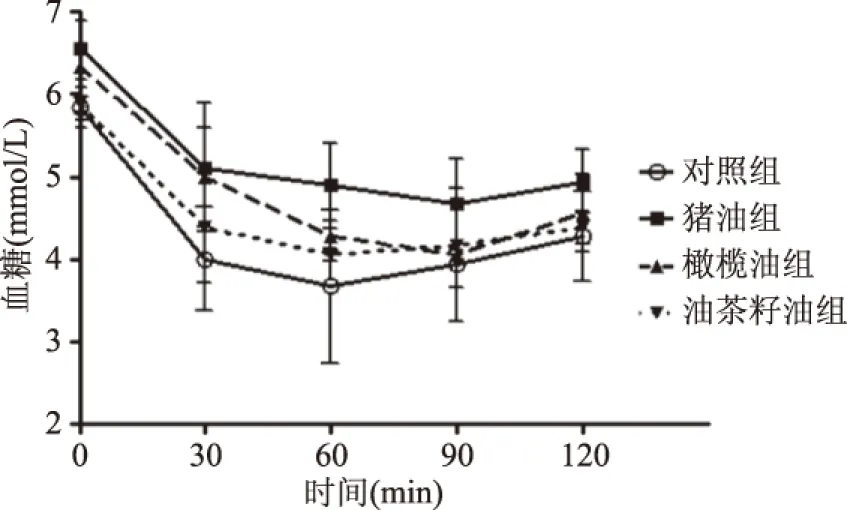
图2 不同油脂对SD大鼠ITT的影响Fig.2 The influence of different oils
2.2 不同油脂对SD大鼠IR相关指标的影响
由表2可知,猪油组大鼠血糖值最高,与正常对照组有显著差异(p<0.05),橄榄油组与油茶籽油组大鼠与对照组间均无显著差异(p>0.05);喂食油脂的各组大鼠的胰岛素水平显著高于对照组(p<0.05),其中橄榄油组与油茶籽油组低于猪油组,有统计学意义(p<0.05);各油脂组HOMA-IR水平均上升,橄榄油和油茶籽油组大鼠显著低于猪油组(p<0.05),但高于对照组大鼠水平,有统计学差异(p<0.05),其中油茶籽油组的HOMA-IR水平与对照组水平最接近。


组别FPG(mmol/L)FINS(μg/L)HOMA-IR对照组561±040050±005##309±022##猪油组661±074∗271±021∗∗1966±221∗∗橄榄油组617±059068±006∗##462±044∗∗∗##油茶籽油组567±033065±015∗##398±023∗∗##
注:*:与对照组比较,p<0.05;**:与对照组比较,p<0.01;#:与猪油组比较,p<0.05;##:与猪油组比较,p<0.01;表3、图3同。
2.3 不同油脂对SD大鼠血清脂联素的影响
由表3可知,与对照组相比,各组大鼠血清脂联素水平较对照组均降低(p<0.05),橄榄油组和油茶籽油组水平相对猪油组有一定升高,其中油茶籽油组显著高于猪油组(p<0.05),有统计学意义。
2.4 不同油脂对SD大鼠糖异生相关基因表达的影响
如图3所示,猪油组大鼠肝组织中PEPCK水平相较于其他各组,表达量最高(p<0.05);橄榄油和油茶籽油组相对较低,均显著高于对照组(p<0.05)。各油脂组大鼠的G6Pase水平均显著高于对照组(p<0.05),其中橄榄油和油茶籽油组表达量低于猪油组大鼠,有统计学意义(p<0.05)。

图3 不同油脂对SD大鼠糖异生相关基因表达的影响Fig.3 The influence of different oils
3 讨论与结论
IR是指使正常剂量的胰岛素所产生的效应降低,机体对胰岛素的反应性降低,从而引起β细胞代偿性分泌增加的一种现象[4]。研究表明,长期的高脂饮食可导致IR产生,表现为靶组织对胰岛素敏感性降低,空腹胰岛素水平增加[5]。本实验中各油脂处理组大鼠已经存在不同程度的IR,FIN上升,HOMA-IR值相应升高,证明过度食用油脂可引起IR,但FPG水平只在猪油组大鼠中升高,OGTT和ITT实验也表明猪油组大鼠胰岛素敏感性最低,说明长期食用高SFA的油脂比食用高UFA的食用油脂更易诱导IR产生。不同的脂肪酸对IR的影响机制尚不明确,可能是通过结合到胰岛素敏感组织(如肝脏),脂肪酸再进一步影响细胞膜的离子通透性以及相关信号传导改变胰岛素受体的亲和力,从而改变胰岛素敏感性。
肝脏是糖脂代谢的主要脏器,也是IR最先发生的外周靶器官,肝脏IR主要是指胰岛素抑制肝脏葡萄糖输出的能力减弱,肝脏葡萄糖输出主要包括糖异生和糖原分解[6]。因此肝脏糖异生紊乱是IR产生的重要诱因。其中PEPCK和G-6-Pase是糖异生的限速酶,其转录的多少,决定着糖异生的速度。脂联素被认为是一种抗糖尿病的脂肪细胞因子,对肝脏糖脂代谢起调控作用[7]。有研究指出[8],脂联素能够发挥抗糖尿病的作用是由于能够抑制糖异生,但抑制糖异生的机制目前尚不明确。本实验结果表明,食用富含SFA油脂的大鼠相较于食用UFA油脂大鼠更能引起机体IR产生,可能是由于降低了机体脂联素水平,从而增加了糖异生程度,表现为糖异生相关基因的表达量改变,IR程度的加深进一步降低脂联素水平,这二者间的互为因果关系也被相关文章提起过[9]。
综上所述,长期食用SFA丰富的油脂,更易引起胰岛素敏感性的降低,导致IR增加和脂联素水平的下降,二者相平行。IR的增加降低脂联素水平,脂联素水平的降低可增加糖异生,从而进一步导致IR的产生,而食用富含UFA的橄榄油和油茶籽油能够改善上述代谢紊乱现象,特别是油茶籽油,是中国特有的食用油脂,更加适合作为日常油为人们食用。
[1]国家卫生计生委. 中国居民营养与慢性病状况报告(2015年)[R]. 北京:国务院新闻办公室,2015.
[2]卜文婕,朱建梁,李艳,等. 不同食用油脂对大鼠血脂代谢及脂肪肝的影响[J]. 食品工业科技,2014,35(11):337-340.
[3]郝宝珺. 妊娠期胰岛素降解酶活性与胰岛素抵抗的相关性研究[D]. 广州:南方医科大学,2014.
[4]李翰卿,宋微微. 游离脂肪酸与胰岛素抵抗关系的研究进展[J]. 医学研究生学报,2012,25(9):981-983.
[5]Coelho DF,Pereira-Lancha LO,Chaves DS,et al. Effect of high-fat diets on body composition,lipid metabolism and insulin sensitivity,and the role of exercise on these parameters[J]. Braz J Med Biol Res,2011,44(10):966-972.
[6]苏静. JAZF1过表达改善db/db小鼠肝脏糖异生及胰岛素抵抗的机制研究[D]. 重庆:重庆医科大学,2013.
[7]杜春红,刘德敏,李红学,等. 一种新的转录因子TORC2在脂联素抑制肝糖异生过程中的作用及机制研究[J]. 临床血液学杂志,2016,29(8):609-612.
[8]Ghoshal K,Bhattacharyya M. Adiponectin:Probe of the molecular paradigm associating diabetes and obesity[J]. World J Diabetes,2015,6:151-166.
[9]赵荷珺,李兴. 脂联素与胰岛素抵抗的研究进展[J]. 综述与进展,2010,39(9):126-129.
[10]Wree A,Kahraman A,Gerken G,et al. Obesity affects the liver-the link between adipocytes and hepatocytes[J]. Digestion. 2011,83:124-133.
[11]罗明娟,陈璐璐,郑涓,等. 热卡限制对高脂饲养大鼠肝脏糖异生相关基因表达的影响[J]. 中华肝脏病杂志,2008,16(2):125-128.
[12]Stefanovski D,Richey JM,Woolcott O,et al. Consistency of the disposition index in the face of diet induced insulin resistance:Potential role of FFA[J]. PLoS One,2011,6(3):e18134.
[13]程梦婕. 肝脏内质网应激与饮食诱导肥胖大鼠胰岛素抵抗和肝脏脂肪变性的关系研究[D]. 武汉:华中科技大学,2012.
[14]赵文惠,萧建中,杨文英,等. 肝脏胰岛素抵抗与肝糖输出调控基因表达的关系[J]. 中华肝脏病杂志,2006,14:45-48.
[15]Massiera F,Barbry P,Guesnet P,et al. A Western-like fat diet is sufficient to induce a gradual enhancement in fat mass over generations[J]. J Lipid Res,2010,51(8):2352-2361.
[16]周淑娴,雷娟,张玉玲,等. 高血压患者胰岛素抵抗与血清脂联素及炎症标志物水平[J]. 中华高血压杂志,2008,16(2):166-170.
Effect of different oil on insulin resistance and gluconeogenesis in rats
BU Wen-jie1,2,LI Yan2,TONG Li3,YANG Jian-ke1,SUN Min2,*
(1.Department of Medical Biology,Wannan Medical College,Wuhu 241002,China;2.School of Life Science,Anhui University,Hefei 230601,China;3.Traditional Chinese Medicine and Tibetan Medicine Research Center ofMedical College of Qinghai University,Xining 810001,China)
Objective:To compare the effects of different oil on insulin resistance and gluconeogenesis in SD rats. Methods:Male SD rats were divided into four groups(n=7). Rats in the control group were fed normal diet and the high fat diet groups were fed with diet containing different oil(lard,olive,and camellia seeds oil). Rats were fed for 17 weeks. Oral glucose tolerance test(OGTT)and insulin tolerance test(ITT)were performed before sacrificed. The artery blood samples were collected after anesthesia,then serum were separarted to detect the levels of fasting plasma glucose(FPG),fasting serum insulin(FINS)and adiponectin. The mRNA expression of phosphoenolpyruvate carboxykinas(PEPCK)and glucose-6-phosphatase(G6P)related to gluconeogenesis in liver,were analyzed by real time PCR. Results:Rats in each oil-fed group showed different levels of insulin resistance. Lard-fed rats led to the significantly increased in levels of FPG,FINS and HOMA-IR(p<0.05),impaired OGTT and ITT performance. The level of serum adiponectin was decreased in lard-fed rats compared with others(p<0.05). The expression of gluconeogenesis-related genes(PEPCK and G6Pase)in all oil-fed rats were higher than those in control group(p<0.05). The mRNA expression in lard-fed rats were significantly higher than other groups(p<0.05). Olive oil and camellia seeds oil-fed rats showed little difference compared with the normal group,but there was statistical significance(p<0.05). Conclusion:Lard riched in saturated fatty acids(SFA)may increase the risk of IR. The olive and camellia seeds oil,which have great amount of unsaturated fatty acids(UFA),induced significantly lower degree of IR than lard(p<0.05).Camellia seed oil as a characteristic oil in China,can be used as a high quality oil.
oil;insulin resistance;adiponectin;gluconeogenesis
2016-09-09
卜文婕(1989-),女,助理实验师,主要从事功能油脂与代谢疾病和细胞生物学相关研究,E-mail:buwj611@163.com。
*通讯作者:孙敏(1970-),女,博士,副教授,主要从事代谢相关疾病研究,E-mail:sm3216@126.com。
青海省重点研发与转化计划项目(2016-SF-126);国家自然基金面上项目(31670361);皖南医学院重点科研项目培育基金(WK2015Z04)。
TS201.4
A
1002-0306(2017)07-0361-04
10.13386/j.issn1002-0306.2017.07.061
