κ卡拉胶寡糖酶解制备工艺优化
2017-04-13张雪芳吴昌正朱艳冰肖安风
张雪芳,余 倩,吴昌正,2,3,4,肖 琼,2,3,4,朱艳冰,2,3,4,肖安风,2,3,4,*
(1.集美大学食品与生物工程学院,福建厦门 361021; 2.福建省食品微生物与酶工程重点实验室,福建厦门 361021; 3.福建省海洋功能食品工程技术研究中心,福建厦门 361021; 4.厦门市海洋功能食品重点实验室,福建厦门 361021)

张雪芳1,余 倩1,吴昌正1,2,3,4,肖 琼1,2,3,4,朱艳冰1,2,3,4,肖安风1,2,3,4,*
(1.集美大学食品与生物工程学院,福建厦门 361021; 2.福建省食品微生物与酶工程重点实验室,福建厦门 361021; 3.福建省海洋功能食品工程技术研究中心,福建厦门 361021; 4.厦门市海洋功能食品重点实验室,福建厦门 361021)
为改进卡拉胶寡糖的制备工艺,本研究以κ-卡拉胶为底物,采用酶法制备κ-卡拉胶寡糖,以还原糖生成量为评价指标,对酶解条件进行优化,并采用薄层色谱法及质谱对酶解产物进行分析。结果显示酶解反应最优工艺条件为:底物浓度12 g/L、pH7.0、反应温度40 ℃、振荡速率100 r/min,经优化后的酶解反应更完全,还原糖生成量由0.91 mg/mL提高至1.61 mg/mL,提高了77%,酶解卡拉胶反应的Km值为171.96 mg/mL,最大反应速度Vmax为0.925 mg·mL-1·min-1。最优工艺验证实验和20 L放大实验结果一致,经薄层色谱及质谱分析酶解24 h后的反应主产物为二糖和四糖。
卡拉胶,卡拉胶寡糖,酶水解
卡拉胶(Carrageenan)是从红藻细胞壁中提取的一种水溶性线性硫酸半乳聚糖,具有以1,3-β-D-半乳糖和1,4-α-D-半乳糖交替连接形成的骨架结构,其分子量为105~106u。根据是否含有3,6-内醚半乳糖、硫酸根含量及硫酸根所在位置,主要将卡拉胶分为κ-、λ-、τ-三族[1-2]。
卡拉胶作为一种天然海藻多糖,因其安全、无毒,可生物降解、自然界存在量大,及特殊的理化特性而在食品、药品和化妆品等行业大量应用[3]。然而,由于卡拉胶分子量大,溶解性及吸收性差,从而影响卡拉胶的生物活性并限制了卡拉胶的进一步应用。研究表明,经降解或改性得到的卡拉胶寡糖或低聚糖及衍生物具有抗溃疡、抗病毒、抗肿瘤、抗凝血[4-7]等多种作用,生物活性与利用率得到更大提高[8]。
由于对寡糖、低聚糖的制备技术研究还不够成熟,制备成本高,限制了寡糖、低聚糖规模化应用生产[9]。因此,研究或改进生产制备工艺、降低成本、提高得率是寡糖、低聚糖扩大应用的关键。目前,卡拉胶的降解方式主要有化学降解法,如:氧化降解[10]、酸降解[11]等;物理降解法,如:辐照降解[12]、微波降解[13]等;菌解法[14]或酶法降解[15],酶法降解具有底物专一性强、反应条件温和、反应过程易于控制等优点,具有更强的应用优势[16]。本文利用产κ-卡拉胶酶的食鹿角菜假交替单胞菌(Pseudoalteromonascarrageenovora)ASY5发酵获得κ-卡拉胶酶,利用κ-卡拉胶酶酶解κ-卡拉胶,通过控制反应条件,改进κ-卡拉胶寡糖的制备工艺并对其进行定性分析从而实现快速、高效地制备不同平均聚合度的κ-卡拉胶寡糖。
1 材料与方法
1.1 材料与仪器
卡拉胶 绿新(福建)食品有限公司;半乳糖、硫酸、盐酸、苯酚、磷酸氢二钠、磷酸二氢钠、3,5-二硝基水杨酸(DNS)、三羟基氨基甲烷(Tris) 中国医药集团上海试剂公司。
UV-2600A型紫外可见分光光度计 尤尼柯(上海)仪器有限公司;TD5M-WS台式离心机 湖南赛特湘仪离心机仪器有限公司;pH211C酸度计 北京哈纳科仪科技有限公司;HH-6数显恒温水浴锅 金坛市富华仪器有限公司;20L酶反应罐 镇江东方生物工程设备技术有限责任公司。
1.2 实验方法
1.2.1 卡拉胶粗酶液的制备 卡拉胶粗酶液:由实验室能产卡拉胶酶的食鹿角菜假交替单胞菌(Pseudoalteromonascarrageenovora)ASY5菌株发酵制备。取卡拉胶降解菌纯培养物接种到发酵培养基中,20 ℃振荡培养72 h。发酵液9800×g离心10 min,取上清作为粗酶液。
1.2.2 单因素实验 称取一定质量的卡拉胶溶于pH7.0的磷酸盐缓冲液(0.05 mol/L)中,配制成8 g/L的卡拉胶溶液,从中取18 mL溶液,加入2 mL酶活为3.0 U/mL的粗酶液(以加入2 mL灭活酶液做空白对照),在一定温度下水解反应60 min,每10 min取1 mL酶解液,立即沸水浴10 min灭酶活终止反应,测定还原糖含量,并计算反应过程中平均聚合度的变化。在酶解液pH7.0、反应温度40 ℃、振荡速率100 r/min的条件下,考察不同底物浓度(4、6、8、10、12、14 g/L)在卡拉胶酶水解过程中对还原糖生成量的影响;在底物浓度12 g/L、反应温度40 ℃、振荡速率100 r/min的条件下,考察不同酶解液pH(6.5、7.5、8.0、8.5、9.0、9.5)在卡拉胶酶水解过程中对还原糖生成量的影响;在底物浓度12 g/L、pH7.0、振荡速率100 r/min的条件下,考察不同反应温度(35、40、45、50、55、60 ℃)在卡拉胶酶水解过程中对还原糖生成量的影响;在底物浓度12 g/L、pH7.0、反应温度40 ℃的条件下,考察不同振荡速率(0、80、100、140、160 r/min)在卡拉胶酶水解过程中对还原糖生成量的影响。进行单因素实验,考察各因素对κ-卡拉胶寡糖生成量的影响。
1.2.3 卡拉胶酶水解卡拉胶动力学实验 分别配制底物浓度为4~14 g/L的卡拉胶溶液,以卡拉胶溶液为底物,卡拉胶酶为催化剂,在最优反应条件下进行水解反应。从加入酶液开始计时每2 min取样一次,立即于100 ℃水浴10 min灭酶活终止反应。按照标准曲线的方法测定水解液中还原糖的生成量。运用Lineweaver-Burk双倒数作图法求出Km值和Vmax值[17]。
1.3 检测方法
1.3.1 卡拉胶酶活力的测定 参考文献[18]的方法,取0.05 mL酶液加入到0.45 mL 0.5%卡拉胶溶液(0.05 g卡拉胶溶于10 mL浓度0.05 mol/L、pH7.0的磷酸盐缓冲液)中,60 ℃反应20 min,100 ℃灭酶活10 min终止反应,采用3,5-二硝基水杨酸法测定还原糖生成量。以灭活的酶液作为空白对照。在本实验条件下,每分钟催化产生1 μmol还原糖所需的酶量定义为一个酶活力单位(U)。
1.3.2 还原糖含量和总糖含量测定 采用DNS法测还原糖含量[17]。精确称取葡萄糖0.1 g放入100 mL容量瓶中配制成0.1 mg/mL标准摩尔浓度溶液,分别吸取0.0、0.05、0.1、0.15、0.2、0.25、0.3 mL置于具塞试管中,每组做三个平行,加DNS溶液混匀后于100 ℃显色5 min,冷却后加蒸馏水补足体积至5 mL,于波长520 nm处测吸光度值。以标准糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。根据标准曲线计算得到卡拉胶还原糖含量。
采用苯酚-硫酸法测总糖含量[19]。配制0.1 mg/mL半乳糖溶液,分别吸取0.0、0.2、0.4、0.6、0.8、1.0 mL置于具塞试管中,并加入蒸馏水保持每支试管体积相同。然后加入6%苯酚0.5 mL,混匀后快速加入浓硫酸2.5 mL,混匀,室温条件下静置30 min,每组做三个平行,于波长590 nm处测吸光度。以标准糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。根据标准曲线计算即可得到卡拉胶总糖含量。
1.3.3 平均聚合度测定 平均聚合度=总糖含量/还原糖含量[20]。
1.3.4 卡拉胶降解产物的组成和结构分析 薄层层析(TLC)分析[20]:硅胶板于110 ℃活化1 h,将寡糖样品进行毛细管点样,展开剂为:正丁醇∶冰醋酸∶水=2∶2∶1,显色剂:浓度为10%(v/v)的乙醇-硫酸溶液。
质谱(ESI-MS)分析[21]:寡糖样品采用以电喷雾作离子源的质谱仪在负离子模式下测定寡糖的相对分子质量,1.0 mg/mL样品溶于1∶1的乙腈/水,经LC注射环直接进样5 μL,用Maslynk 4. 0软件采集和处理数据。
1.4 数据统计分析
实验结果均以3次平行测定的均值表示,数据使用软件SPSS 17.0进行显著性差异分析。
2 结果与讨论
2.1 底物浓度对酶解过程的影响
分别测定不同底物浓度、不同时间下还原糖的生成量,考察卡拉胶酶水解过程中还原糖生成量的变化,结果如图1所示。
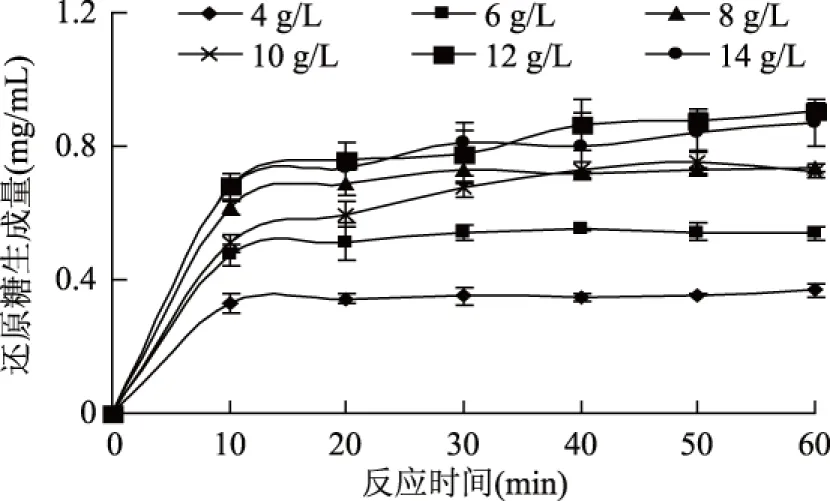
图1 底物浓度对卡拉胶酶解过程的影响Fig.1 Effect of substrate concentration on the hydrolysis of carrageenan
由图1可以看出当底物浓度小于12 g/L时,还原糖的生成量以及反应速度随着底物浓度的增加逐渐增大。这是因为在酶浓度一定的情况下,当底物浓度较低时,酶能够充分饱和地与底物接触反应,随着底物浓度的增加,酶与底物的接触面积越来越大,反应速度也越来越快,水解产物的生成量也越来越大,但由于受到底物浓度的限制,反应产物的生成量达到一定量后不再增加。但当底物浓度达到一定程度时酶与底物的接触达到饱和,没有多余的酶参与催化反应,因此反应速度不再增加。另一方面,由于卡拉胶溶液存在一定的粘度,阻碍了酶与底物的接触,尤其是在高浓度条件下,酶不易均匀扩散到溶液中,从而降低反应速度,延缓了酶解反应达到平衡的时间。因此,当底物浓度为14 g/L时与底物浓度为12 g/L时相比,还原糖的生成量相当且不再显著增加,即12 g/L为卡拉胶酶解反应的最佳底物浓度。
2.2 pH对酶解过程的影响
溶液pH对酶解效果的影响较大,一般只有在最适pH条件下酶才表现出最强催化效率,过酸或过碱条件下,酶解效果会有所降低,甚至使酶失活。另一方面,卡拉胶的稳定性对酶解反应会存在影响,由于卡拉胶在酸性条件下不稳定容易发生降解,而在中性和碱性条件下较稳定,在pH为9时稳定性最好[18,23]。按照1.3.2的实验方法,分别测定不同pH条件下卡拉胶酶解反应的还原糖生成量,实验结果如图2所示。
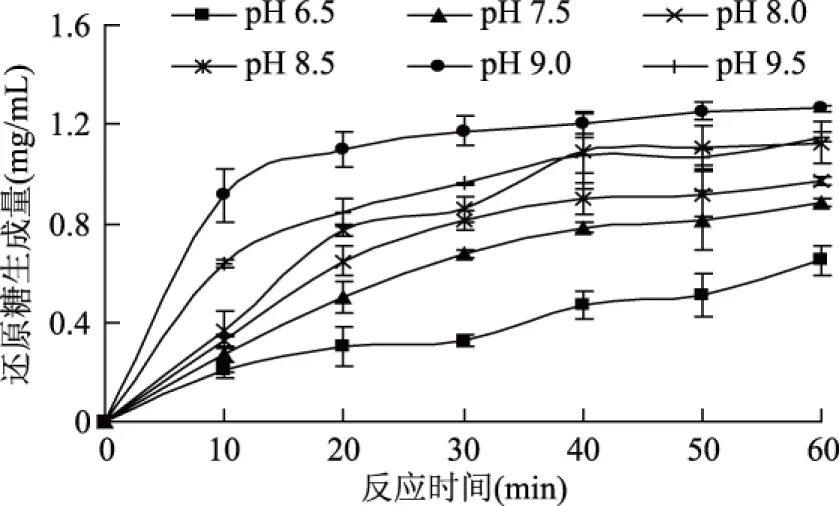
图2 pH对卡拉胶酶解反应过程的影响Fig.2 Effect of pH on the hydrolysis of carrageenan
由图2可知,当pH为9.0时还原糖的生成量、反应速率达到最大,反应达到平衡的时间最短,因此确定pH9.0为卡拉胶酶的最适pH。在酸性条件下,还原糖的生成量明显低于碱性条件,即卡拉胶酶在碱性条件下的酶解效果要明显强于酸性条件下的酶解效果。根据pH6.5条件下还原糖生成量的变化趋势,推测在酸性条件下卡拉胶酶活力可能受到抑制。
2.3 温度对酶解过程的影响
温度一方面可以影响酶的催化特性,另一方面影响溶液的流变特性,从而影响酶解效果。在一定温度范围内,酶催化速率随温度的升高而升高,当温度升高到一定范围时,酶蛋白发生变性,减少有效酶量,导致降低酶促反应速率,因此一般酶解反应条件比较温和。随着温度的升高,增加溶液中各成分的热能,底物分子和酶运动加快,增加了两者的接触机会,改变反应平衡常数,从而改变底物的生成量。
在不改变其他条件的情况下,在不同温度下酶解反应还原糖的生成量如图3所示。
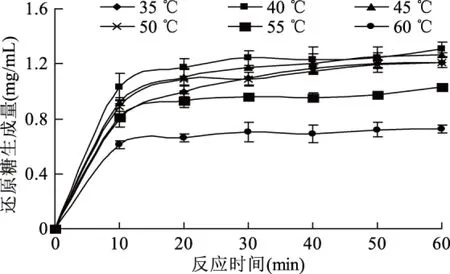
图3 反应温度对酶解卡拉胶反应过程的影响Fig.3 Effect of reaction temperature on the hydrolysis of carrageenan
由图3可知,反应温度为40 ℃时还原糖的生成量达到最大,且反应速率最快,在35~50 ℃在反应后期差异不大。当温度大于40 ℃时,随温度的升高还原糖的生成量逐渐降低,因此确定卡拉胶酶解反应的最适温度为40 ℃。
对比35 ℃与55 ℃水解曲线,在反应初期酶解反应速率基本相同,随着反应时间的延长55 ℃条件下还原糖的生成量基本不再增加,由此反映出温度相对较高的55 ℃条件下,酶逐渐失活。但由于酶蛋白的变性失活需要一定时间才能被表现出来,因此在反应初期酶依然能够作用于卡拉胶生成部分还原糖。在60 ℃时,反应初期的速率相对较低,进一步说明了卡拉胶酶的高温不耐受性。
2.4 振荡速率对酶解过程的影响
在振荡条件下,可能会增加酶与底物的接触机会,从而加快反应的进行。卡拉胶溶液具有较高的粘度,添加适当的振荡,对反应过程的传质、传热会产生有利的影响。考察不同振荡速率下还原糖的生成量,结果如图4所示。
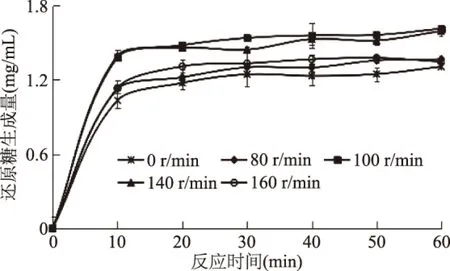
图4 振荡速率对酶解卡拉胶反应过程的影响Fig.4 Effect of oscillation rate on the hydrolysis of carrageenan
由图4所示,振荡速率为100 r/min的条件下,还原糖的生成量达到最大,振荡速率过高或过低均不利于还原糖的生成。由此说明适宜的振荡环境有助于酶与底物的充分接触,使酶促反应的催化效率及底物转化率更高、更彻底,但对比于其他因素条件(底物浓度、pH、反应温度),振荡速率对还原糖的改变量相对变化不大。
2.5 不同反应温度和pH条件下的平均聚合度
基于不同反应温度和不同pH条件下还原糖生成量的较大差异,将这两种条件下的平均聚合度进行对比。结果如图5所示。
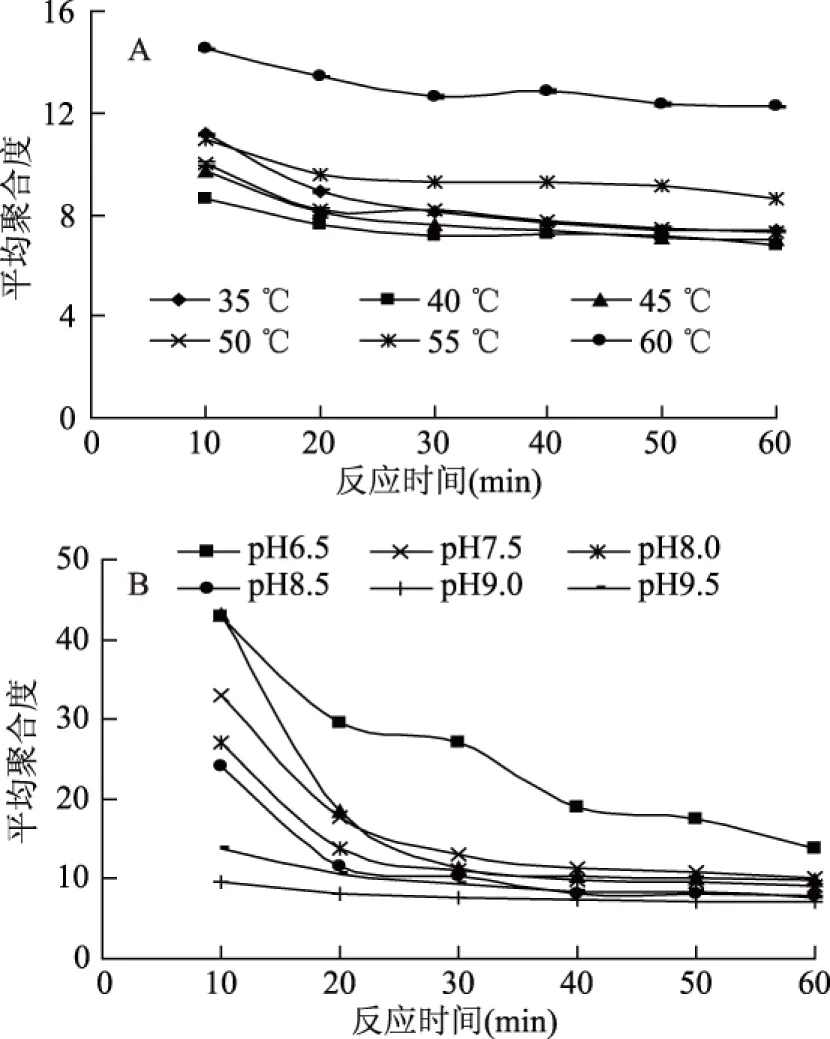
图5 不同反应温度(A)和不同pH(B)条件下的平均聚合度变化曲线Fig.5 Average polymerization degrees of reaction products under different temperature(A)and different pH(B)conditions
图5A中随着反应时间的进行,在35~50 ℃范围的平均聚合度的变化差异基本不大,不同温度下平均聚合度范围为7~14。由图5B可明显观察到随着反应时间的进行,不同pH条件下平均聚合度变化差异较大,平均聚合度变化范围为7~45,因此可主要通过改变pH控制反应条件制得不同平均聚合度的卡拉胶寡糖。
2.6 酶促反应动力学结果及分析
根据上述实验结果在pH9.0,反应温度40 ℃,振荡速率100 r/min条件下,分别测得不同底物浓度下的反应初速度,以1/[S]为横坐标,1/[V]为纵坐标绘制底物浓度与反应初速度的Lineweaver-Burk双倒数拟合曲线,结果如图6所示:
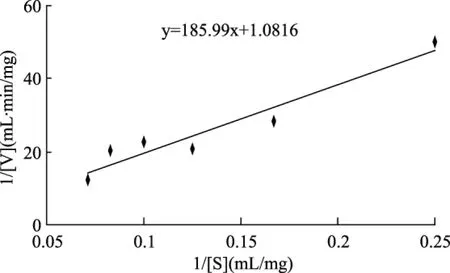
图6 底物浓度与反应初速度的Lineweaver-Burk双倒数拟合曲线Fig.6 Fit curve of Lineweaver-Burk plot between initial reaction rate and substrate concentration
由图6可知在最适反应条件下底物浓度与反应初速度的Lineweaver-Burk双倒数拟合方程为:y=185.99x+1.0816,得卡拉胶酶的Km值为171.96 mg/mL,最大反应速度Vmax为0.925 mg·mL-1·min-1。
2.7 最优工艺验证实验及20 L放大实验
在最佳酶解工艺条件下酶解反应60 min,进行验证实验,并按照上述条件进行20 L放大实验,结果如图7所示:
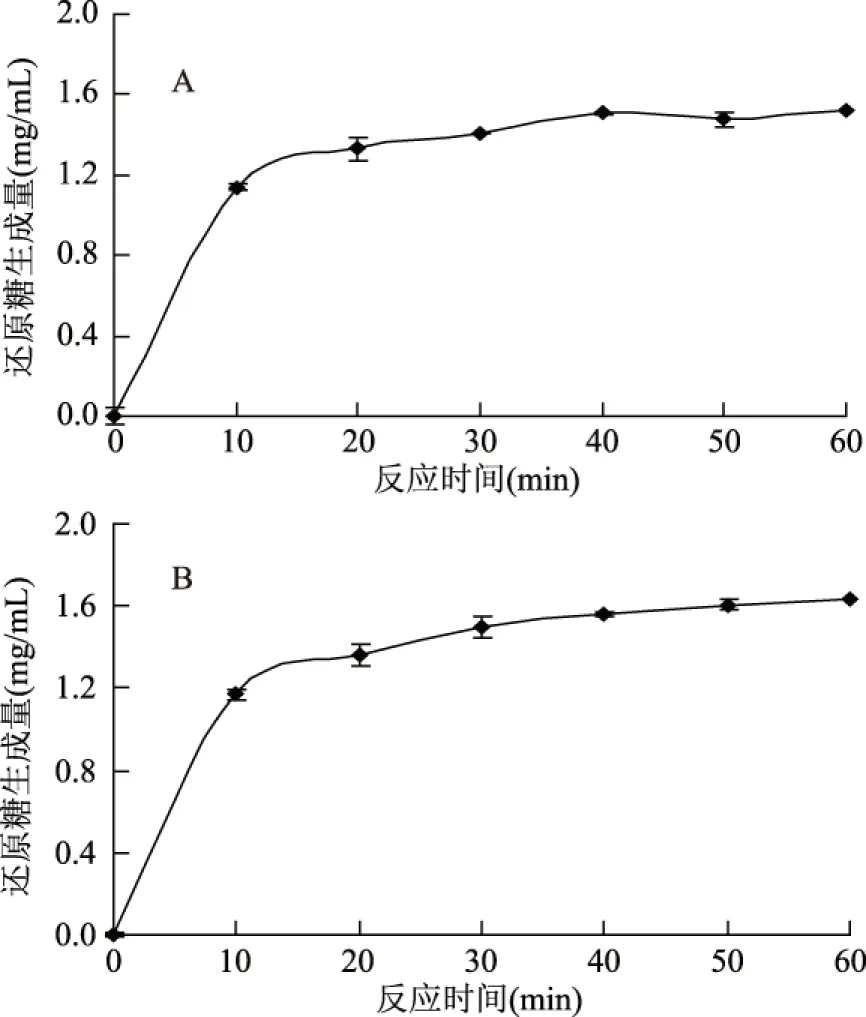
图7 最优工艺验证实验(A)与20 L放大实验(B)水解曲线Fig.7 Verification test of optimum technology(A) and enlarging experiment of 20 L scale(B)
由图7可知,随着反应时间的延长,还原糖的含量逐渐增加,并在20 min基本达到平衡。最优工艺验证实验和放大实验结果趋势一致。
2.8 水解产物的组成与结构分析
2.8.1 薄层层析(TLC)检测 在最优条件下,对不同反应时间下的酶解产物,点样上清液,采用TLC法进行分析,结果如图8所示。
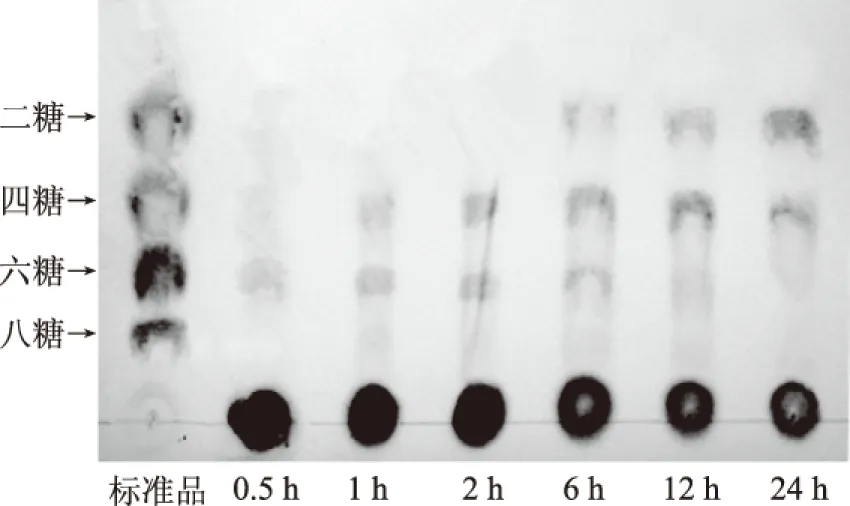
图8 TLC检测不同时间下卡拉胶酶解反应产物Fig.8 TLC analysis of the products of carrageenan enzymatic hydrolysis under different reaction time
根据TLC结果显示,反应0.5 h时,酶解产物主要为六糖;反应1、2 h可观察到有四糖、六糖生成;在反应6 h时除了四糖、六糖还可观察到有二糖产生;在反应12、24 h时,产物主要为二糖、部分为四糖。由此说明在最优条件下短时间(0.5~2 h)内,酶解反应的主要产物为四糖和六糖。随着反应时间的延长,反应底物逐渐被降解分子量更小的六糖、四糖、二糖,还原糖的生成量也随之逐渐增加。因此可以根据需要调整酶解反应时间,制备适合的卡拉胶寡糖。
2.8.2 质谱(ESI-MS)分析 根据TLC分析结果,对酶解24 h的产物进行醇沉分级,直接通过MS分析酶解产物分子量。
根据TLC分析结果,对酶解24 h的产物进行醇沉分级,直接通过MS分析酶解产物分子量。由图9中可看出质谱图上形成两个主要的峰,对应的质核比分别为394.0和403.0,结合相关文献[18]及质谱结果可知质核比394.0、403.0、709.0、789.0分别对应[(An-G4S)]2-、[(An-G4S)]-、[(An-G4S)2]-和[(An-G4S)(An-G)]-,表明酶解主产物为κ-卡拉胶二糖,即均含有1个3,6-内醚-α-D-半乳糖残基和1个4-硫酸-β-D半乳糖残基。结合TLC结果与质谱结果共同验证,酶解反应终产物为卡拉胶二糖。因此可得出随着水解时间的推移,卡拉胶依次被分解成小分子量的κ-卡拉胶六糖、四糖、二糖,而酶解反应终产物为κ-卡拉胶二糖。
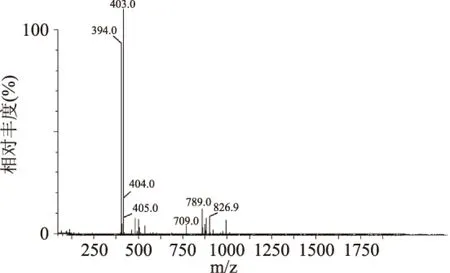
图9 卡拉胶酶解产物ESI-MS谱图Fig.9 ESI-MS spectrum of the enzymatic hydrolysis products of carrageenan
3 结论
本研究利用食鹿角菜假交替单胞菌ASY5发酵生产κ-卡拉胶酶酶解κ-卡拉胶制备κ-卡拉胶寡糖,通过单因素实验确定了较佳反应条件为:底物浓度12 g/L、pH9.0、反应温度40 ℃、振荡速率100 r/min。在该条件下还原糖生成量可达1.61 mg/mL,在不同pH条件下可制得平均聚合度范围为7~45的卡拉胶寡糖。结合TLC和质谱方法对κ-卡拉胶寡糖的组成和结构分析,结果表明酶解反应终产物为κ-卡拉胶二糖。相对于传统酶解卡拉胶制备卡拉胶寡糖的方法,本研究为改进κ-卡拉胶寡糖的制备工艺从而提高卡拉胶寡糖的得率提供了实验依据。
[1]Liu G L,Li Y,Zhe C,et al. Purification and characterization of κ-carrageenase from the marine bacterium Pseudoalteromonas porphyrae for hydrolysis of κ-carrageenan[J]. Process Biochemistry,2011,46:265-271.
[2]胡亚芹,竺美. 卡拉胶及其结构研究进展[J]. 海洋湖沼通报,2005(1):94-102.
[3]Vipul D P,Pankaj M M,Girish K J,et al. Carrageenan:A natural seaweed polysaccharide and its applications[J]. Carbohydrate Polymers,2014,105:97-112.
[4]Sun Y J,Yang B Y,Wu Y M,et al. Structural characterization and antioxidant activities of κ-carrageenase oligosaccharides degraded by different methods[J]. Food Chemistry,2015,178:311-318.
[5]Wang W,Zhang P,Yu G L,et al. Preparation and anti-influenza a virus activity of κ-carrageenase oligosaccharide and its sulphated Derivatives[J]. Food Chemistry,2012,133:880-888.
[6]Mou H,Jiang X,Guan H. A κ-carrageenan derived oligosaccharide prepared by enzymatic degradation containing anti-tumor activity[J]. Appl Phycol,2003,15(4):297-303.
[7]Yu Z Y,Wu H,Zhang S X,et al. Enzymatic preparation of κ-carrageenase oligosaccharides and their anti-angiogenic activity[J]. Carbohydrate Polymers,2014,10:359-367.
[8]袁华茂. 卡拉胶寡糖与衍生物的制备及生物活性研究[D]. 青岛:中国科学院海洋研究所,2005.
[9]黄菊,丁晨,谢超,等. 海藻胶低聚寡糖的酶法制备纯化技术及保水理化性质分析[J]. 海洋与湖沼,2015,3(46):595-602.
[10]Zhang H M,Xiao J Y,Wang F,et al. Assessment of the oxidative cellular toxicity of a κ-carrageenan oxidative degradation product towards Caco-2 cells[J]. Food Research International,2010,43:2390-2401.
[11]王伟,管华诗,李春霞,等. 一种低分子量卡拉胶寡糖及其制备方法和应用[P].中国:102516323B,2014-05-07[2015-05-13].中华人民共和国国家知识产权局.
[12]Rellevea L,Nagasawab N,Luanc L Q,et al. Degradation of carrageenan by radiation[J]. Polymer Degradation and Stability,2005,87:403-410.
[13]Zhou G F,Yao W H,Wang C H. Kinetics of microwave degradation of λ-carrageenan from Chondrus ocellatus[J]. Carbohydrate Polymers,2006,64:73-77.
[14]上官巧灵,陈海敏,严小军. 一种λ-卡拉胶寡糖的制备方法[P].中国:103290079A,2013-09-11[2016-05-15].中华人民共和国国家知识产权局.
[15]Dlane J,Patrick B,Jacques M,et al. Enzymatic degradation of hybrid τ-/ν-carrageenan by Alteromonas fortis τ-carrageenase[J]. Carbohydrate Research,2010,345:934-940.
[16]拜晶晶. 海洋细菌 Cellulophaga sp. QY201 的卡拉胶酶研究[D]. 青岛:中国海洋大学,2005.
[17]古铮. 海洋卡拉胶降解菌Cellulophaga sp. KL-A的筛选优化及卡拉胶酶研究[D]. 厦门:厦门大学,2014.
[18]李尚勇. 海洋交替假单胞菌QY203的κ-卡拉胶酶研究[D]. 青岛:中国海洋大学,2012.
[19]An Q D,Zhang G L,Wu H T,et al. Alginate-deriving oligosaccharide production by alginase from newly isolated Flavobacterium sp. LXA and its potential application in protection against pathogens[J].Journal of Applied Microbiology,2008,106(2009):161-170.
[20]马素. 海洋细菌 Cellulophaga sp. QY3 τ-卡拉胶酶的研究[D]. 青岛:中国海洋大学,2013.
[21]吴海歌,王艳预,姚子昂. 卡拉胶寡糖的制备及其生物活性的研究[J]. 化学与生物工程,2010,6(27):37-40.
[22]马悦欣,董双林,牟海津,等. 卡拉胶寡糖的酶解制备及其体外抗病毒活性[J]. 中山大学学报,2009,48(6):105-108.
[23]许彩云,朱艳冰,倪辉,等. 一株产卡拉胶酶细菌的分离鉴定及其酶学性质[J]. 微生物学报,2015,55(2):141-148.
Technology optimization for enzymatic preparation of κ-carrageenan oligosaccharides
ZHANG Xue-fang1,YU Qian1,WU Chang-zheng1,2,3,4, XIAO Qiong1,2,3,4,ZHU Yan-bing1,2,3,4,XIAO An-feng1,2,3,4,*
(1.College of Food and Biological Engineering,Jimei University,Xiamen 361021,China; 2.Key Laboratory of Food Microbiology and Enzyme Engineering of Fujian Province,Xiamen 361021,China; 3.Fujian Provincial Engineering Technology Research Center of Marine Functional Food,Xiamen 361021,China; 4. Xiamen Key Laboratory of Marine Functional Food,Xiamen 361021,China)
In this study,κ-carrageenan oligosaccharides were prepared by enzymatic hyrolysis method to improve the technology. Hydrolysis conditions were optimized with the characteristic signs of reducing sugars content,and the optimal conditions for κ-carrageenan oligosaccharides preparation were obtained as substrate concentration 12 g/L,pH7.0,reaction temperature 40 ℃ and shaking speed 100 r/min,respectively. Compared with the reducing sugars yield of the initial conditions,the yield of the optimal conditions increased from 0.91 mg/mL to 1.61 mg/mL,which was increased by 77%. The Kmand Vmaxvalues of the enzyme hydrolysis reaction was 171.96 mg/mL and 0.925 mg·mL-1·min-1,respectively. Then,the result of optimal process validation test could consistent with that of 20 L enlarge experiment. At last,the enzymatic hydrolysis products were analyzed by thin-layer chromatography and mass spectrometry,the result showed that the main products included tetrasaccharide and hexasaccharides in 24 h reaction.
carrageenan;carrageenan oligosaccharides,;enzymolysis
2016-07-28
张雪芳(1992-),女,硕士研究生,研究方向:食品生物技术,E-mail:1546095135@qq.com。
*通讯作者:肖安风(1973-),男,博士,教授,研究方向:食品生物技术,E-mail:xxaaffeng@jmu.edu.cn。
福建省高校产学合作项目(2016N5008);福建省科技重大专项/专题(2015NZ0001-1);福建省海洋高新产业发展专项项目(闽海洋高新[2016]08号);国家海洋公益行业科研专项(201505033)。
TS201.2
B
1002-0306(2017)07-0171-06
10.13386/j.issn1002-0306.2017.07.025
