不同浓度Aβ25-35蛋白模拟阿尔茨海默病模型学习记忆的差异
2017-04-13孙伟明徐家淳
王 凯,李 强,孙伟明,徐家淳,郭 威,曹 杨,周 震*
(1.天津中医药大学,天津 300193;2.天津中医药大学第二附属医院,天津 300150)
研究报告
不同浓度Aβ25-35蛋白模拟阿尔茨海默病模型学习记忆的差异
王 凯1,李 强2,孙伟明1,徐家淳1,郭 威1,曹 杨1,周 震2*
(1.天津中医药大学,天津 300193;2.天津中医药大学第二附属医院,天津 300150)
目的 不同浓度的淀粉样蛋白Aβ25-35侧脑室注射后,观察大鼠Morris水迷宫学习记忆能力的变化,探讨制备AD模型大鼠时Aβ25-35注射的最佳浓度。方法 雄性SD大鼠随机分为假手术组和模型组,模型组Aβ25-35注射浓度分别为2、4和8 μg/μL。参照《大鼠脑立体定位图谱》,选取右侧侧脑室注射聚集态的Aβ25- 35,制备AD大鼠模型。造模成功后7 d采用Morris水迷宫测试各组大鼠学习记忆能力的变化。结果 平均游泳速度比较,各组大鼠间差异无显著性(P> 0.05)。逃避潜伏期结果显示,与假手术组比较,模型组大鼠逃避潜伏期时间明显增加,差异有显著性(P< 0.05);模型组中,与注射2 μg/μL的大鼠比较,注射4 μg/μL与8 μg/μL后大鼠逃避潜伏期时间明显增加,差异有显著性(P< 0.05);4 μg/μL与8 μg/μL组间比较,差异无显著性(P> 0.05)。目标象限的活动时间与路程显示,与假手术组比较,模型组注射不同剂量Aβ25-35的大鼠目标象限活动时间和路程均显著减少,差异有显著性(P< 0.05),但模型组不同浓度间比较差异无显著性(P> 0.05)。空间探索结果显示,与假手术组比较,模型组注射不同剂量Aβ25-35的大鼠穿越平台次数均显著减少,差异有显著性(P< 0.05);模型组中,与注射2 μg/μL的大鼠比较,注射4 μg/μL和8 μg/μL后大鼠穿台次数明显减少,差异有显著性(P< 0.05)。4 μg/μL与8 μg/μL组间比较,差异无显著性(P> 0.05)。结论 单侧侧脑室注射Aβ25-35蛋白制备大鼠AD模型时,注射Aβ25-35的推荐浓度为4μg/μL。
Aβ25-35;阿尔茨海默病;Morris水迷宫;行为学;学习记忆能力
阿尔茨海默病(Alzheimer’s disease,AD)是一种以学习记忆障碍为主的常见中枢神经系统退行性疾病。其主要病理特征包括β淀粉样蛋白(β-amyloid protein,Aβ)沉积形成的老年斑、Tau蛋白异常磷酸化形成的神经纤维缠结以及神经元的丢失[1]。研究发现Aβ是AD病理改变的核心与启动因素[2, 3]。故近10多年来,大量关于AD的基础研究都采用了脑内注射Aβ建立动物模型[4]。然而在众多报道中Aβ的配置浓度多样,参考实验时存在较难取舍的问题。因此,本研究拟通过大鼠侧脑室注射不同浓度的Aβ25-35制备AD模型,采用Morris水迷宫观察其学习记忆能力的变化,通过行为学比较得到注射建模时Aβ25-35的最佳浓度。
1 材料和方法
1.1 动物
雄性SD大鼠36只,SPF级,体重200 g左右,购自维通利华实验动物技术有限公司【SCXK(京)2012-0001】。
1.2 药物及试剂
Aβ25-35(sigma公司,规格1mg,纯度 > 97%,批号:053M4804V)溶于生理盐水配制成浓度为2、4和8 μg/μL,置于37℃无菌恒温箱内孵育96 h,凝聚后4℃存用[5]。
1.3 仪器
脑立体定位仪(深圳瑞沃德生命科技有限公司);Morris水迷宫(北京硕林苑科技有限公司);Topscanlite动物运动轨迹记录分析系统(北京吉安得尔科技有限公司);10 μL微量进样器(上海高鸽工贸有限公司)。
1.4 方法
1.4.1 分组及模型制备
将36只大鼠随机分为假手术组和模型组,假手术组6只,模型组注射Aβ25-35浓度分别为2、4和8 μg/μL,每组各10只。
10%的水合氯醛3 mL/kg腹腔注射麻醉,将大鼠头部固定在脑立体定位仪上,保持前后囱同一水平,备皮,碘伏消毒,头顶部正中切口,暴露前囟,按大鼠脑立体定位图谱进行定位,在前囟点后1.5 mm,中线右侧旁开1.0 mm,用三棱针钻一小孔,垂直插入微量注射器,深度为4.0 mm(可达侧脑室)。缓慢注射5 μL(1μL/min)聚集态的Aβ25-35溶液,注射持续约5 min,留针5 min,使Aβ充分弥散,缓慢出针(耗时5 min)。骨科蜡封堵钻孔,双氧水消毒皮缘,常规缝皮。假手术组经同样操作,仅向侧脑室注入5 μL生理盐水。术后各组大鼠再连续予腹腔注射青霉素,每只4万U,连续3d,预防感染,7 d后进行行为学检测。
1.4.2 Morris 水迷宫检测
水迷宫装置由一黑色圆柱型水池和一可移动位置的站台组成。水池高60 cm,直径150 cm,站台直径10 cm,水池上空通过一个数字摄相机与计算机相连接。在水池中注入清水,水深23 cm,加入食用黑色素使池水变为不透明的黑色,站台表面为黑色,水面高出站台表面2 cm。水温控制在(25±1)℃。
定向航行实验:检测持续5 d,每天4次,每次分别随机从不同象限将大鼠腹侧朝向桶壁放入水,每次入水间隔1 min。设定时间为90 s,若动物在90 s内找到站台,让其在站台上停留10 s,若动物未找到站台,将其引导至站台上,使其停留10 s,摄像头追踪大鼠至其上隐藏跳台或耗时90 s终止记录。
空间探索实验:检测第6 天撤除隐藏跳台,选择同一象限放入各组大鼠,记录越平台区域次数。
1.4.3 统计学方法
2 结果
2.1 一般情况
实验注射过程中,模型组中8 μg/μL组共有3只动物死亡,解剖后死因未明,考虑与注射浓度过高有关。实验结束醒转后,各组大鼠活动自如,至水迷宫检测前模型组4 μg/μL组共有2只动物死亡,解剖后发现死于肺炎或肠梗阻,详见表1。

表1 各组动物死亡情况
2.2 平均游泳速度
水迷宫检测不同组间大鼠平均游泳速度比较,各组间差异无显著性(P> 0.05)。说明各组大鼠间体质无明显差异,详见表2。

表2 各组大鼠平均游泳速度比较
2.3 定位航行试验
2.3.1 逃避潜伏期
随着训练时间的延长,各组大鼠逃避潜伏期在不断缩短。假手术组大鼠第1 天时间稍少于其他组,从第2天开始,逃避潜伏期时间明显减少,第4 ~ 5 天逃避潜伏期趋向于平稳。注射不同剂量Aβ的大鼠第1 天逃避潜伏期时间要高于假手术组,且随着注射剂量的增加,逃避潜伏期有明显的延长,从第2 ~ 5 天,逃避潜伏期逐渐减少。
各组大鼠逃避潜伏期时间进行广义估计方程分析,组别之间存在差异(P= 0.015),组别×时间未见交互效应。从各组大鼠逃避潜伏期时间边界均值来看,其逃避潜伏期时间假手术组 < 2 μg/μL组 < 4 μg/μL组 < 8 μg/μL组,表明随着注射Aβ剂量的增加,大鼠的空间学习记忆能力明显减低。与假手术组比较,其他组大鼠逃避潜伏期时间明显增加,差异有显著性(P< 0.05);与2 μg/μL组大鼠比较,4 μg/μL组与8 μg/μL组逃避潜伏期时间明显增加,差异有显著性(P< 0.05);与4 μg/μL组比较,8 μg/μL组逃避潜伏期时间虽然有增加,但是差异无显著性(P> 0.05),详见表3、表4,表5。
2.3.2 目标象限活动时间
不同组别目标象限活动时间比较。与假手术组相比,注射2、4、8 μg/μL组大鼠目标象限活动时间有明显的降低(P< 0.05);2 μg/μL组、4 μg/μL组、8 μg/μL组之间比较,组间差异无显著性(P> 0.05),详表6。
2.3.3 目标象限路程
不同组别目标象限路程比较。与假手术组相比,2、4、8 μg/μL组大鼠目标象限路程显著减少(P< 0.05);2 μg/μL组、4 μg/μL组、8 μg/μL组之间比较,组间差异无统计学意义(P> 0.05),详表7。
2.4 空间探索试验
不同组别Morris水迷宫穿越平台次数比较,与假手术组比较,2、4、8 μg/μL组穿越平台次数均有显著减少(P< 0.05);与2 μg/μL组比较,4、8 μg/μL组穿越平台次数显著减少(P< 0.05);而4 μg/μL组与8 μg/μL组比较,差异无显著性(P> 0.05),详见表8。

表3 各组大鼠逃避潜伏期时间比较
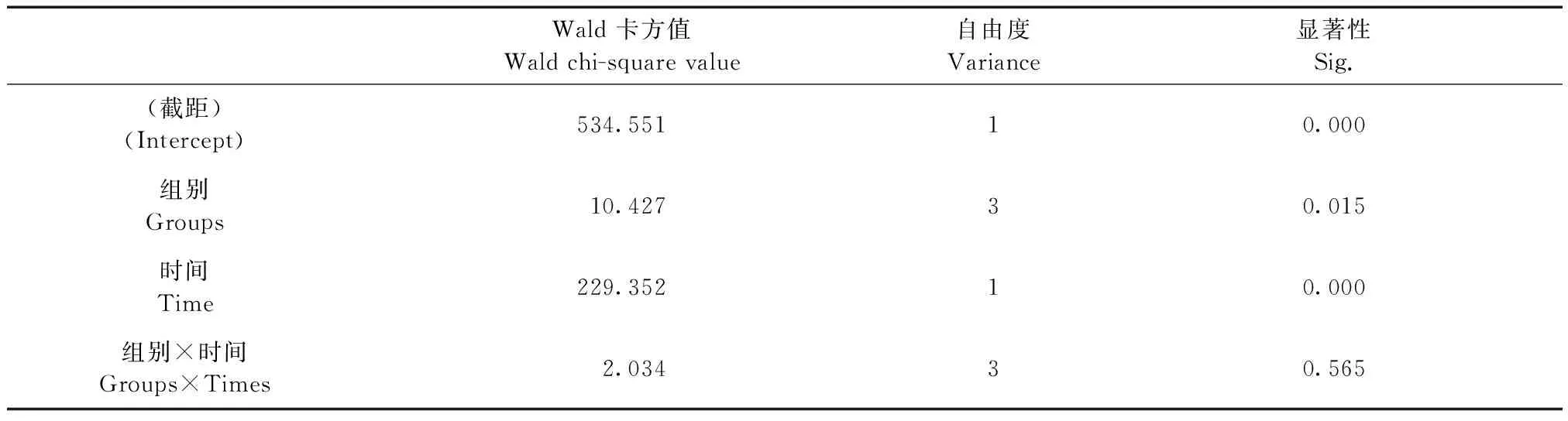
表4 广义估计方程模型效应检验

表5 各组逃避潜伏期时间边界均值

表6 各组大鼠目标象限活动时间比较
注:vs假手术组,*P< 0.05。
Note.*P< 0.05, vs. the sham operation group.

表7 各组大鼠目标象限路程比较
注:vs假手术组,*P< 0.05。
Note.*P< 0.05, vs. the sham operated group.

表8 各组大鼠穿越平台次数比较
注:vs 假手术组,*P< 0.05;vs 2 μg/μL组,#P< 0.05。
Note.*P< 0.05, vs. the sham operated group.#P< 0.05,vs. the 2 μg/μL group.
3 讨论
随着人口老龄化速度的加快,AD的患病人数逐年上升,其发病进程与临床症状给社会和家庭均带来了极大的经济及救治负担。因此,防治AD已成为我国亟待解决的公共和卫生问题。为了更好的研究AD的发病机制和有效治疗药物的作用机制,良好的模型制备是必不可少的。虽然AD的发病机制目前尚不明确,但Aβ的聚集是AD发生和发展的关键因素[6]。脑内发挥毒性作用的Aβ主要分为Aβ1-40和Aβ1-42两种。本研究中所用的Aβ25-35为人工合成,但代表了体内蛋白酶分解APP(amyloid precursor protein,APP)产生Aβ蛋白过程中的最短Aβ片段,且几乎与Aβ1-42具有同等的毒性作用[7]。目前围绕Aβ的毒性作用,转基因动物模型是研究AD的热点,但同样也存在造模程序复杂,制备费用昂贵和传代缺乏稳定性[8,9]的不足。因而采用具有神经毒性的Aβ片段注射到大鼠侧脑室、基底核或海马等部位以模拟AD发病的动物模型同样得到广泛应用。本团队既往研究发现,采用侧脑室注射Aβ25-35可造成大鼠学习记忆能力减退,海马神经元丢失和突触超微结构损伤[10, 11],其中配置合理浓度的注射用Aβ是实验成功的先决条件。
Morris水迷宫是目前公认的评价大鼠行为学的方法。该实验原理表明:大鼠可在短时间训练后出于本能在水箱中搜寻到藏匿于水下的逃避平台。利用水迷宫以外的结构线索找到平台所在位置的过程,需要海马体主要负责学习和记忆存储。整个过程涉及到空间定位相关的视觉信息的收集,处理加工再整理,记忆和取出等复杂环节。该检测方法主要用来考察大鼠的空间记忆、工作记忆和空间鉴别能力。针对水迷宫的统计方法一般多选用重复测量方差分析,但是重复测量方差分析要求数据格式比较严格,一般情况下,数据离散度较大,正态性比较差,本次实验研究应用GEE(广义估计方程)统计方法进行数据处理,GEE为半参数估计方法,适用于存在缺失值且正态性差的数据,能够更好的评估数据的error(标准误)和灵活的选取协方差结构,因此本次数据分析选用GEE进行分析。
本次实验研究结果表明:手术后各组间大鼠平均游泳速度比较,组间无显著差异,说明注射对各组间大鼠的体质无显著影响。定位航行试验显示,随着训练时间的延长,各组大鼠逃避潜伏期不断缩短。注射不同剂量Aβ25-35的大鼠逃避潜伏期时间明显高于假手术组,且随着注射剂量的增加,逃避潜伏期有明显的延长,其中4 μg/μL组效果更为明显。目标象限活动时间和路程显示,与假手术组比较,注射不同剂量Aβ25-35的大鼠目标象限活动时间和路程均显著减少。空间探索试验发现,与假手术组比较,注射不同剂量Aβ25-35的大鼠穿越平台次数显著减少,且较2 μg/μL组,4 μg/μL和8 μg/μL组减少更为显著。提示单侧侧脑室注射Aβ25-35能够成功制备大鼠AD模型,综合上述实验结果并结合模型的稳定性和死亡率考虑,注射Aβ25-35的推荐浓度与体积为4 μg/μL和5μL。
[1] Ramirez-Bermudez J. Alzheimer’s disease: critical notes on the history of a medical concept[J]. Arch Med Res, 2012, 43(8): 595-599.
[2] Hardy J, SelkoeDJ. The amyloid hypothesis Alzheimer’s disease: progress and problems on the road to therapeutics[J]. Science, 2002, 297(5580): 353-356.
[3] Masters CL, SelkoeDJ. Biochemistry of amyloid β-protein and amyloid deposits in Alzheimer disease [J]. Cold Spring HarbPerspect Med, 2012, 2(6): a006262.
[4] 苏芮,韩振蕴,范吉平. 脑内注射β-淀粉样蛋白致痴呆动物模型的效度评价及中医内涵的探索[J]. 中华中医药杂志, 2015, 30(8): 2741-2743.
[5] Maurice T, Su TP, Privat A. Sigma 1 (σ1) receptor agonists and neurosteroids attenuate β25-35-amyloid peptide-induced amnesia in mice through a common mechanism[J]. Neuroscience, 1998, 83(2): 413-428.
[6] 徐萌,杨延莲,王琛. Beta 淀粉样多肽的高分辨结构解析[J]. 东南大学学报: 医学版, 2011, 30(1): 228-240.
[7] Frozza RL, Horn AP, Hoppe JB, et al. A comparative study of beta-amyloid peptides Abeta1-42 and Abeta25-35 toxicity in organotypic hippocampal slice cultures[J]. Neurochem Res, 2009, 34(2): 295-303.
[8] Mao P, Reddy PH. Aging and amyloid beta-induced oxidative DNA damage and mitochondrial dysfunction in Alzheimer’s disease: implications for early intervention and therapeutics[J]. BiochimBiophysActa (BBA)-Mol Basis Dis, 2011, 1812(11): 1359-1370.
[9] Xu SP, Yang YY, Xue D, et al. Cognitive-enhancing effects of polygalasaponinhydrolysate in Aβ(25-35) induced amnesic mice[J]. Evidence-based ComplAltern Med, 2010, 2011: 839720-839720.
[10] 王凯,张琳琳,宋宛珊,等. 益肾化浊方对阿尔茨海默病模型大鼠海马区BDNF及其受体TrkB蛋白表达的影响[J].中国实验方剂学杂志, 2015, 21(5): 111-114.
[11] 宋宛珊,王红秀,张玉莲,等. 益肾化浊方对AD大鼠海马突触形态及Ca2+相关激酶表达的影响[J]. 中国实验方剂学杂志, 2015, 21(15): 97-101.
Aβ25-35protein in different concentrations to create a rat model resembling Alzheimer’s disease and the differences in their learning and memory ability
WANG Kai1, LI Qiang2, SUN Wei-ming1, XU Jia-chun1, GUO Wei1, CAO Yang1, ZHOU Zhen2*
(1. Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China;2. The Second Affiliated Hospital of Tianjin University of Traditional Chinese Medicine, Tianjin 300150)
Objective To observe the learning and memory ability of rats after injection of Aβ25-35protein in different concentrations into the lateral ventricle assessed by Morris water maze test, and to explore the optimal concentration of Aβ25-35in the preparation of AD model rats. Methods Male SD rats were randomly divided into sham operated group and model group. The rats of model group received Aβ25-35injection in concentrations of 2 μg/μL, 4 μg/μL and 8 μg/μL, respectively. According to theRatBrainStereotaxicAtlas, 5 μL of aggregation of Aβ25-35was injected into the right lateral ventricle to establish the AD rat model. 7 days after successful modeling, Morris water maze was used to test thechanges of learning and memory ability of the rats. Results There was no significant difference in the average swimming speed between the two groups (P> 0.05).The escape latency time of rats in the model group was significantly increasedcompared with the sham group (P< 0.05).In the model group, the escape latency time of rats treated with 4 μg/μL and 8 μg/μL Aβ25-35was significantly increased compared with the rats injected with 2 μg/μL (P< 0.05), while there was no significant difference between rats treated with 4 μg/μL and 8 μg/μL Aβ25-35(P> 0.05). The activity time and distance of target quadrant of the rats injected with different concentration of Aβ25-35in the model group were significantly reduced compared with the sham group (P< 0.05), but no significant difference amongthe rats treated with different Aβ25-35concentrations (P> 0.05). Compared with the sham-operated group, the number of platform-crossing of rats injected with different doses of Aβ25-35in the model group were significantly reduced (P< 0.05). In the model group, the rats treated with 4 μg/μL and 8 μg/μL was significantly reduced compared with the group with 2 μg/μL injection (P< 0.05). There was no significant difference between the rats injected with 4 μg/μL and 8 μg/μL (P> 0.05). Conclusions The recommended dose and concentration of Aβ25-35to be injected into the unilateral ventricle to establisha rat model of Alzheimer’s disease is 4 μg/μL in a volume of 5 μL.
Aβ25-35protein; Alzheimer’s disease; Morris water maze test; Behavior; Learning and memory ability
高等学校博士学科点专项科研基金(20131210110012);国家自然基金(81273940)。
王凯,博士研究生,研究方向:中医脑病方向。E-mail:wangkai19881023@163.com
周震,医学博士,主任医师,硕士研究生导师,从事中西医结合防治脑病工作。E-mail:zhouzhen7681@126.com
R-33
A
1671-7856(2017) 03-0014-06
10.3969.j.issn.1671-7856. 2017.03.003
2016-08-19
