利用实时细胞分析技术检测胰腺癌细胞的药物敏感性
2017-04-13靳亚西孙彩显张连峰
靳亚西,孙彩显,高 虹,张连峰,张 丽
(中国医学科学院,北京协和医学院,医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
研究报告
利用实时细胞分析技术检测胰腺癌细胞的药物敏感性
靳亚西,孙彩显,高 虹,张连峰,张 丽*
(中国医学科学院,北京协和医学院,医学实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
目的 基于实时细胞分析技术评估胰腺癌细胞的药物敏感性,为胰腺癌个体化诊疗提供参考。方法 选取SW1900、Capan-2、PANC-1三株人胰腺癌细胞系,选用盐酸吉西他滨和替吉奥胶囊两种胰腺癌治疗药物,接种24 h后分别梯度浓度给药,实时细胞分析技术监测给药前后细胞生长曲线,计算药物对胰腺癌细胞的生长抑制率(IC50)。同时,细胞培养板内给药,进行AO/EB染色和激光共聚焦观察。结果 药物作用72 h,同一药物对不同细胞抑制率不同。盐酸吉西他滨对SW1900、Capan-2、PANC-1细胞的IC50分别为1.69、10.05、12.74 μmol/L。替吉奥胶囊对SW1900、Capan-2、PANC-1细胞的IC50分别为180.29、765.70、95.57 μmol/L。AO/EB染色验证IC50真实可靠。结论 SW1900及Capan-2细胞可作为盐酸吉西他滨及替吉奥的对照,建立细胞模型,对药物进行体外筛选,为临床利用该技术进行病人肿瘤药物筛选提供一个参考,具有一定的借鉴意义。
胰腺癌;化疗药物;实时细胞分析;药物敏感性
胰腺癌(pancreatic carcinoma)是一种消化系统性恶性肿瘤,40~70岁多见,男性多于女性,已成为我国人口死亡的十大恶性肿瘤之一。近年来,年轻的胰腺癌病人也较10年前有明显增加的趋势,而且恶性度更高,预后更差。大多数胰腺癌病人在早期可无明显症状,确诊时已到中晚期,治疗效果较差,5年生存率低于6%[1],死亡率与发病率相近[2]。胰腺癌常见的治疗方式包括切除手术、放射治疗、化学治疗以及姑息治疗等。手术治疗和放射治疗仅针对早期未转移患者,因此,化学治疗是治疗中晚期胰腺癌的重要手段[3]。而化疗药物的正确选择将直接影响疗效。
不同病人对不同药物敏感性不同,治疗前对药物敏感性进行评估,可以为临床治疗提供参考,提高治疗效果,减少毒副作用。药敏试验还可调整和优化个体化诊疗方案[4,5],但化疗敏感性评估目前还没有一种较为理想的方法[6,7]。因此,发展简便稳定的药敏评估方法是对临床患者药物敏感性评估和保证个体化治疗的关键。
近年发展起来的实时细胞分析系统(RTCA)是一种通过检测培养环境中阻抗的变化而动态监测细胞生长情况的技术,与传统方法相比有细胞用量少、高通量快速和操作简单等优点,是一种新型的适合靶点药物评估和中高通量的药物筛查的理想方法[8]。本实验室在之前的研究中已经成功利用RTCA法比较5种前列腺癌细胞系对三种化疗药物的敏感性,证实了该方法用于前列腺癌药敏研究的可行性[9]。本研究再次将RTCA技术推广应用到胰腺癌细胞药敏评价研究当中,验证该技术在不同类型肿瘤,不同药物的药敏研究中的应用价值,并可为胰腺癌个体化治疗和临床推广提供细胞模型与参考。
1 材料和方法
1.1 细胞培养
SW1900人胰腺癌脾转移细胞、Capan-2人胰腺导管癌细胞、PANC-1人胰腺导管癌细胞,采用含10%胎牛血清和1%青霉素/链霉素的DMEM培养基(Gbico),于5%CO2,37℃细胞培养箱内常规培养。实验前一天进行细胞传代,细胞满度在60%~80%之间,收集细胞制备细胞悬液,浓度为5×105cells/mL,接种在E-plate 16检测板(艾森生物)上用于RTCA分析。
1.2 药物配制
盐酸吉西他滨(北京百灵威科技有限公司)溶于DPBS中,DMEM培养基稀释成100 μmol/L的储液;替吉奥(江苏恒瑞医药股份有限公司)溶于DMSO中,DMEM培养基稀释成成1 mmol/L的储液, 均分装,-20℃冰箱冻存备用。
1.3 RTCA实时细胞生长分析
RTCA实时细胞分析仪(real-time cell analyzer,RTCA)采用xCELLigence细胞功能分析仪DP系统,购自艾森生物(杭州)有限公司,用于细胞增殖分析。检测板E-Plate 16 的底部整合有微金电子传感器芯片,当贴壁生长在微电极表面的细胞引起电极界面阻抗的改变时,该阻抗值的变化直接反映细胞的生物学状态。其主要分析参数为细胞指数(cell index),与细胞覆盖面积成正比。
检测板每孔加入50 μL培养基,放入RTCA Station(艾森生物)中测定基线,保证每孔接触正常并且细胞指数在正常值之内。取制备好的胰腺癌细胞悬液,分别以每孔5×103、1×104、2×104个细胞量接种于E-Plate 16检测板中,在超净台中静置30 min后,置于培养箱中的RTCA工作站中,每隔15 min记录细胞指数,总时长96 h。
1.4 RTCA实时药物敏感性评价
取对数生长期的胰腺癌细胞,分别以每孔1×104个接种于检测板E-Plate 16中,放到培养箱中的RTCA Station中培养并检测,24 h后添加药物。实验组分别加入0.1、0.5、1、10、50、100 μmol/L的盐酸吉西他滨,0.031 25、0.0625、0.125、0.25、0.5、1 mmol/L的替吉奥;对照组中加入无药物的溶解液,空白组中加入DMEM培养基。给药后继续在RTCA Station中进行培养并检测。
1.5 吖啶橙/溴化乙啶(AO/EB)双荧光染色
取对数生长期的胰腺癌细胞,分别以每孔1×105个接种于6孔板中,置于培养箱中培养。24 h后分别加入半数致死浓度的盐酸吉西他滨或者替吉奥药物溶液,每组3孔重复。给药后继续培养72 h后进行吖啶橙/溴化乙啶(AO/EB染色。染色方法:弃去带药物培养基,PBS 冲洗两遍,加入AO/EB混合液(各100 μg/mL),室温20 min染色[10],用温PBS冲洗两遍,激光共聚焦显微镜(Leica)下观察拍照。
1.6 统计学分析
使用RTCA Software 2.0系统软件和Student’st-tests分析处理数据,实验数据以平均数±标准差表示,*P< 0.05为差异有显著性。
2 结果
2.1 细胞最佳接种量确定

注:a,SW1900细胞增殖曲线;b,Capan-2细胞增殖曲线; c,PANC-1细胞增殖曲线。图1 三种胰腺癌细胞96 h增殖曲线Note. a, SW1990 cells; b, Capan-2 cells; c, PANC-1 cells. Fig.1 Proliferation curves of the three pancreatic cancer cell lines cultured for 96 hours
SW1900、Capan-2 和 PANC-1等三株胰腺癌细胞,均制备细胞悬液,梯度稀释,采用每孔5×103、1×104、2×104个不同接种量,接种于检测板E-plate 16中,检测96 h内细胞指数变化,观察细胞的生长增殖过程系统软件生成细胞生长曲线(图1)。如图1所示,以96 h内形成最佳S型增值曲线为标准,确定三株胰腺癌细胞的最佳接种量均为每孔1×104个/孔。
2.2 不同胰腺癌细胞系对盐酸吉西他宾敏感性对比分析
取对数生长期的胰腺癌细胞,按上述实验确定的最佳接种浓度,以1×104个细胞/孔接种于检测板E-Plate 16 中,培养24 h后给药,RTCA分析细胞增殖曲线。盐酸吉西他滨药物剂量分别为0.1、0.5、1、10、50、100 μmol/L。另设药物溶剂对照和空白对照。给药后继续培养并检测CI变化(图2a-c)。结果表明盐酸吉西他滨对SW1990、Capan-2、PANC-1三种细胞系72 h的IC50分别为(1.69±0.21)μmol/L,(10.05±0.24)μmol/L,(12.74±1.17)μmol/L。其中SW1990对盐酸吉西他滨最敏感,而PANC-1最不敏感。

注:a,盐酸吉西他滨对SW1990的IC50为1.69 μmol/L; b,盐酸吉西他滨对Capan-2的IC50为10.05 μmol/L; c,盐酸吉西他滨对PANC-1的IC50为12.74 μmol/L;d,盐酸吉西他滨对三株细胞的IC50统计学比较。n=6,*P < 0.05。图2 3种胰腺癌细胞对盐酸吉西他滨剂量反应曲线(变斜率)Note. a, The IC50 of gemcitabine hydrochloride for SW1990 cells was 1.69 μmol/L; b, The IC50 of gemcitabine hydrochloride for Capan-2 cells was 10.05 μmol/L; c, The IC50 of gemcitabine hydrochloride for PANC-1 cells was 12.74 μmol/L; d, Statistical comparison of the IC50 of gemcitabine hydrochloride for the three cell lines. n=6, *P<0.05.Fig.2 The dose-response (variable slope) curves of gemcitabine hydrochloride for the three pancreatic cancer cell lines

注:a,替吉奥对SW1990的IC50为180.29 μmol/L; b,替吉奥对Capan-2的IC50为760.70 μmol/L; c,替吉奥对PANC-1的IC50为95.57 μmol/L;d,替吉奥对三株细胞的IC50统计学比较。n=6, *P < 0.05。图3 胰腺癌3种细胞对替吉奥剂量反应曲线(变斜率)Note. a, The IC50 of compound tegafur capsule for SW1990 cells was 1.69 μM; b, The IC50 of compound tegafur capsule for Capan-2 cells was 10.05 μmol/L; c, The IC50 of compound tegafur capsule for PANC-1 cells was 12.74 μmol/L; d, Comparison of IC50 of compound tegafur capsule for the three cell lines. n=6, *P < 0.05.Fig.3 The dose-response (variable slope) curves of gemcitabine hydrochloride for the three pancreatic cancer cell lines
2.3 不同胰腺癌细胞系对替吉奥敏感性对比分析
取对数生长期的胰腺癌细胞,按上述实验确定的最佳接种浓度,以1×104个细胞/孔接种于检测板E-Plate 16 中,培养24 h后给药,RTCA分析细胞增殖曲线。替吉奥药物剂量分别为0.03125、0.0625、0.125、0.25、0.5、1 mmol/L。另设药物溶剂对照和空白对照。给药后继续培养并检测CI变化(图3a-c)。结果表明替吉奥对SW1990、Capan-2、PANC-1三种细胞系72 h的IC50分别为(180.29±17.06)μmol/L,(765.70±11.72)μmol/L,(95.57±5.11)μmol/L。其中PANC-1细胞对替吉奥最敏感,而Capan-2细胞最不敏感。
2.4 AO/EB染色验证胰腺癌细胞对盐酸吉西他宾和替吉奥敏感性
取对数生长期的胰腺癌细胞,每孔1×105个接种于6孔板中,培养24 h后,根据上述实验计算得到的IC50 分别加入半数致死浓度的盐酸吉西他滨及替吉奥药物溶液。72 h后AO/EB荧光染色,激光共聚焦显微镜观察拍照(图4a-i)。吖啶橙可透过正常细胞膜,使细胞呈绿色荧光,溴化乙锭只能透过破损细胞膜,嵌入DNA产生红色荧光,由此可区分出正常细胞和坏死细胞。结果显示,使用RTCA法计算的半数致死药物浓度作用SW1990、Capan-2、PANC-1细胞72 h后,约半数细胞死亡,直观证实该法所得IC50值真实可信。
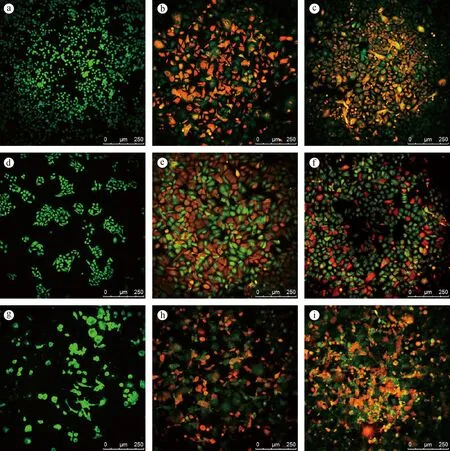
注:a,SW1990细胞给药前;b,盐酸吉西他滨作用于SW1990细胞;c,替吉奥胶囊作用于SW1990细胞; d,Capan-2细胞给药前;e,盐酸吉西他滨作用于Capan-2细胞;f,替吉奥胶囊作用于Capan-2细胞;g,PANC-1细胞给药前;h, 盐酸吉西他滨作用于PANC-1细胞;i,替吉奥胶囊作用于PANC-1细胞。图4 AO/EB双荧光染色Note. a, Pre-administration of SW1990; b, Gemcitabine hydrochloride (IC50) treatment on SW1990; c, Compound tegafur capsule (IC50) treatment on SW1990; d, pre-administration of Capan-2; e, Gemcitabine hydrochloride (IC50) treatment on Capan-2; f, Compound tegafur capsule (IC50) treatment on Capan-2; g, Pre-administration of PANC-1; h, Gemcitabine hydrochloride (IC50) treatment on PANC-1; i, Compound tegafur capsule (IC50) treatment on PANC-1. Scale=250 um.Fig.4 AO/EB double staining of the three pancreatic cancer cell lines
3 讨论
目前,在常规胰腺癌化疗中,所有患者往往只采用一种以全体通用和常用剂量为基础的药物诊疗方式。这种诊疗方式治疗效果不佳甚至无效,目前认为主要原因与肿瘤的异质性与耐药性的形成有关[11],因此,单一治疗方案根本无法满足临床化疗的实际需要,个体化治疗势在必行[12,13]。
而肿瘤个体化治疗评估,除了采用对肿瘤细胞的DNA、RNA及生物标记物进行鉴定外,就是对肿瘤细胞进行药物敏感性及耐药性实验[14]。鉴于肿瘤的复杂性、异质性,整合患者样本建立体外模型以对体内药物反应进行预测是个体化医疗的发展趋势[15]。这些模型可以用于药物敏感性及耐药性检测,避免盲目无效用药,提高肿瘤化疗疗效[16-19]。
本研究将RTCA实时细胞分析技术应用于胰腺癌细胞药物敏感性实验当中,检测2种临床常用化疗药物盐酸吉西他滨和替吉奥胶囊对3株胰腺癌细胞的体外抑制率。结果证明,SW1990细胞对盐酸吉西他滨敏感性最强,而PANC-1细胞敏感性最差;PANC-1细胞对替吉奥敏感性最强,而Capan-2细胞敏感性最差。可将SW1990细胞作为高度敏感对照,PANC-1细胞作为不敏感对照,建立对盐酸吉西他滨的体外药物筛选体系;可将PANC-1细胞作为高度敏感对照,Canpan-2细胞作为不敏感对照,建立对替吉奥的体外药物筛选体系,具有向临床推广,进行个体化药物敏感性实验的价值。且本实验结果与已有研究具有一致性[20]。
而且,本研究还采用经典的AO/EB双荧光染色结合激光共聚焦对RTCA法计算得到的两种药物对细胞的IC50进行二次验证,证实了RTCA法的真实性。另有其他多项研究证明,RTCA在药物敏感性实验中具有可靠性,与传统的MTT等方法测定的结果吻合[21-25]。证明该方法真实有效且更加简单灵敏,可以应用于临床患者药物敏感性评价。
综上所述,本研究将RTCA技术应用到胰腺癌细胞对临床治疗药物的药敏研究当中,实验验证了该技术并可用于更多类型肿瘤细胞,更多药物的药敏研究。证实了其在高通量快速药物筛查和药敏评估中的重要应用价值,可为个体化治疗和临床推广提供胰腺癌细胞模型与参考。
[1] Gillen S, Schuster T, Meyer Zum Büschenfelde C, et al. Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages[J]. PLoS Med, 2010, 7(4): e1000267.
[2] Siegel R, Ma J, Zou Z, et al. Cancer statistics[J]. CA Cancer J Clin, 2014, 64(1): 9-29.
[3] Kamisawa T, Wood LD, Itoi T, et al. Pancreatic cancer[J]. Lancet, 2016, 388(10039): 73-85.
[4] 喻卫红,孙涛,刘文中,等. 374例恶性肿瘤患者化疗药物敏感性研究[J]. 肿瘤学杂志,2014, 20(5): 393-397
[5] 颜克兰,唐东平,张传珉,等. 肿瘤药敏试验与临床病理及疗效的关系[J]. 中国癌症防治杂志, 2011, 03(1): 23-27
[6] 乔建梁,孟兴凯,张俊晶,等. 评估肿瘤化疗敏感性方法的研究进展[J]. 现代肿瘤医学, 2008, 16(05): 873-875.
[7] 陈娟,程国华,陈历排,等. 恶性肿瘤药物敏感性试验方法及其临床应用研究进展[J]. 中国药房, 2013, 25: 2394-2397.
[8] Kho D, MacDonald C, Johnson R, et al. Application of xCELLigence RTCA biosensor technology for revealing the profile and window of drug responsiveness in real time[J]. Biosensors, 2015, 5(2): 199-222.
[9] 靳亚西,孙彩显,高虹,等. 基于实时细胞分析技术检测前列腺癌细胞药物敏感性[J]. 中国比较医学杂志,2016, 26(4): 46-52.
[10] Kasibhatla S, Amarante-Mendes GP, Finucane D, et al. Acridine orange/ethidium bromide (AO/EB) staining to detect apoptosis [J]. Cold Spring Harb Protoc 2006. 2006: pdb.prot4493.
[11] Leonard RC, Williams S, Tulpule A, et al. Improving the therapeutic index of anthracycline chemotherapy: focus on liposomal doxorubicin (Myocet) [J]. Breast, 2009, 18(4): 218-224.
[12] Burrell RA, McGranahan N, Bartek J, et al. The causes and consequences of genetic heterogeneity in cancer evolution [J]. Nature, 2013, 501(7467): 338-345.
[13] van’t Veer LJ, Bernards R. Enabling personalized cancer medicine through analysis of gene-expression patterns [J]. Nature, 2008, 452(7187): 564-570.
[14] Marchionni L, Wilson RF, Marinopoulos SS, et al. Impact of gene expression profiling tests on breast cancer outcomes [J]. Evid Rep Technol Assess (Full Rep), 2007, (160): 1-105.
[15] Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing [J]. N Engl J Med, 2012, 366(10): 883-892.
[16] 杨宗华,金逸,李晓诗. MTT法研究肿瘤细胞对化疗药物敏感性的临床意义[J]. 实用肿瘤杂志, 2002, 17(2): 131-133.[17] Tsimberidou AM, Iskander NG, Hong DS, et al. Personalized medicine in a phase i clinical trials program: The MD Anderson Cancer Center Initiative[J]. Clin Cancer Res, 2012, 18(22): 6373-6383.
[18] Bartlett R, Everett W, Lim S, et al. Personalized in vitro cancer modeling — fantasy or reality?[J]. Transl Oncol, 2014, 7(6): 657-664.
[19] Mercer SJ, Somers SS, Kinght LA, et al. Heterogeneity of chemosensitivity of esophageal and gastric carcinoma[J]. Anticancer Drugs, 2003, 14(6): 397-403.
[20] Chen J, Ouyang ZG, Zhang SH, et al. Down-regulation of the nuclear factor-kappaB by lidamycin in association with inducing apoptosis in human pancreatic cancer cells and inhibiting xenograft growth [J]. Oncol Rep, 2007, 17(6): 1445-1451.
[21] Quereda JJ, Martínez-Alarcón L, Mendoça L, et al. Validation of xCELLigence real-time cell analyzer to assess compatibility in xenotransplantation with pig-to-baboon model [J]. Transplant Proc, 2010, 42(8): 3239-3243.
[22] Dürr S, Lyer S, Mann J, et al. Real-time cell analysis of human cancer cell lines after chemotherapy with functionalized magnetic nanoparticles [J]. Anticancer Res, 2012, 32(5): 1983-1989.
[23] Xing JZ, Zhu L, Jackson JA, et al. Dynamic monitoring of cytotoxicity on microelectronic sensors [J]. Chem Res Toxicol, 2005, 18(2): 154-161.
[24] Atienzar FA, Tilmant K, Gerets HH, et al. The use of real-time cell analyzer technology in drug discovery: defining optimal cell culture conditions and assay reproducibility with different adherent cellular models [J]. J Biomol Screen, 2011, 16(6): 575-587.
[25] Cheah SC, Appleton DR, Lee ST, et al. Panduratin A inhibits the growth of A549 cells through induction of apoptosis and inhibition of NF-kappaB translocation [J]. Molecules, 2011, 16(3): 2583-2598.
Drug sensitivity assessment of pancreatic cancer cells by real-time cell analysis
JIN Ya-xi, SUN Cai-xian, GAO Hong, ZHANG Lian-feng, ZHANG Li*
(Key Laboratory of Human Disease Comparative Medicine, Ministry of Health, Institute of Laboratory Animal Science, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100021,China)
Objective To assess the drug sensitivity of pancreatic cancer cells based on real-time cell analysis and provide a reference for individualized diagnosis and treatment of pancreatic cancer.Methods Three human pancreatic cancer cells lines SW1900, Capan-2 and PANC-1 were selected and treated with gemcitabine hydrochloride and tegafur gimeracil oteracil potassium capsules, respectively. After 24 hours of culture, the cells were treated with the two drugs in gradient concentration. The cell growth curves before and after the drug administration was monitored using a real-time cells analyzer and the growth inhibition rates (IC50) of the drugs of the pancreatic cancer cells were calculated. At the same time, the cells in the cell culture plate were treated with the drug, and acridine orange/ethidium bromide (AO/EB) staining and laser scanning confocal microscopy were performed to observe the changes of cells after the drug administration. Results 72 hours after the drug administration, IC50 values for the three cell lines were different. The IC50 values of gemcitabine hydrochloride for SW1900, Capan-2 and PANC-1 cells were 1.69 μmol/L, 10.05 μmol/L and 12.74 μmol/L, respectively. The IC50 values of tegafur capsule for SW1900, Capan-2 and PANC-1 cells were 180.29 μmol/L, 765.70 μmol/L and 95.57μmol/L, respectively. AO/EB staining confirmed the reliability of IC50. Conclusions SW1900 and Capan-2 cells can be used as the control for gemcitabine hydrochloride and tegafur gimeracil oteracil potassium capsules to establish cell models for drug screeninginvitro, which provides a reference for the application of the technology in anticancer drugs screening.
Pancreatic cancer; Chemotherapeutic drugs; Real-time cell analysis; Drug sensitivity
卫生行业科研专项 (201402001)。
靳亚西,女,硕士生,研究方向:比较医学。E-mail: Jinyaxi@yeah.net
张丽(1981-),女,助理研究员,研究方向:比较医学。E-mail: zhangl@cnilas.org
R-33
A
1671-7856(2017) 03-0025-06
10.3969.j.issn.1671-7856. 2017.03.005
2016-07-27
