尤瑞克林对大鼠局灶性脑缺血再灌注损伤后炎性反应的影响
2017-04-13崔小丽王晓辉
蒋 锋, 山 媛, 王 莉, 崔小丽, 王晓辉, 王 乐
尤瑞克林对大鼠局灶性脑缺血再灌注损伤后炎性反应的影响
蒋 锋, 山 媛, 王 莉, 崔小丽, 王晓辉, 王 乐
目的 研究尤瑞克林对大鼠局灶性脑缺血再灌注损伤后炎性反应的影响。方法 将90只SD大鼠随机分为3组:假手术组,对照组,治疗组。采用线栓法建立大鼠大脑中动脉闭塞再灌注模型,缺血2 h后,拔出线栓,恢复灌注24 h,观察大鼠神经功能缺损症状、脑梗死体积、脑组织中白细胞浸润、MPO活性、IL-1和ICAM-1的表达。结果 (1)假手术组大鼠在神经功能缺损评分、脑梗死体积均低于对照组,有显著的统计学差异(P<0.01);脑组织中白细胞浸润程度、髓过氧化物酶(MPO)活性、ICAM-1和IL-1的表达均较对照组低,统计学差异明显(P<0.01);(2)治疗组与对照组相比,大鼠的神经功能缺损评分低、脑梗死体积小,有显著统计学差异(P<0.01);白细胞浸润程度、MPO活性、ICAM-1和IL-1的表达均较对照组减少(P<0.01)。 结论 尤瑞克林可通过抑制大鼠脑缺血再灌注损伤后的炎性反应来实现其神经保护作用。
脑缺血; 尤瑞克林; 髓过氧化物酶; 白介素-1; 细胞间粘附分子-1
脑缺血再灌注损伤,是指脑组织缺血一定时间后再恢复血液灌注,脑组织细胞损伤反而进一步加重,成为临床治疗的重点,发生机制非常复杂,目前认为存在多种因素[1,2],在缺血缺氧情况下脑组织过度炎症反应,产生大量代谢毒素,进一步加重脑组织损伤[3,4]。本实验通过观察大鼠脑缺血再灌注损伤后的炎性反应,探讨尤瑞克林在脑缺血再灌注损伤中的脑保护机制。
1 材料与方法
1.1 动物分组及给药方式 选择健康雄性SD大鼠90只,体重250~300 g(西安交通大学医学院动物中心提供),随机分为3组,每组30只:假手术组,对照组,治疗组。治疗组于造模成功后30 min舌下静脉一次性注射用灭菌0.9%氯化钠溶液稀释的尤瑞克林8.75×10-3PNAU/kg,给药体积1 ml/kg[5]。假手术组和对照组分别以相同的方法给予0.9%氯化钠溶液1 ml/kg。
1.2 动物模型制作 大脑中动脉闭塞再灌注(MCAO/R)模型制作采用改良的Longa法。即解剖分离暴露颈部血管,采用线栓法短时间栓塞左侧大脑中动脉,2 h后拔出栓线,恢复缺血脑区的血液灌注,建立MCAO/R模型,再灌注24 h后取脑组织。假手术组只解剖分离暴露颈部血管,不插入栓线。
1.3 大鼠神经神经功能缺损评分 参考Longa FZ 等5级评分法,0分:无神经功能缺损症状;1分:提尾时对侧前肢不能完全伸直;2分:向病灶对侧转圈征象;3分:向病灶对侧倾倒;4分:不能自发行走及意识丧失。
1.4 TTC染色、脑梗死体积计算 各组随机选10只大鼠,10%水合氯醛深度麻醉后断头处死,完整取出鼠脑,将脑组织切片,行TTC染色,后将脑片转至100 g/L甲醛液中,冰箱冷藏固定24 h。取出后数码相机照相,将染色结果输入计算机,利用图像处理软件Image-Pro Plus 6.0计算:梗死区体积(%)=梗死区体积/缺血侧的总体积。
1.5 免疫组化和生化检测 每组随机各选10只大鼠,10%的水合氯醛过量腹腔注射麻醉,迅速剪开胸腔,暴露心脏,经升主动脉插管后,先用200 ml的生理盐水快速冲洗,然后用4 ℃ 4%多聚甲醛500 ml(先快后慢)继续灌注内固定至少1.5 h。断头取脑,4%多聚甲醛固定,包埋成蜡片,免疫组化染色后,在高倍镜下观察脑组织中白细胞数、细胞间粘附分子-1(ICAM-1)阳性血管数、白介素-1(IL-1)阳性细胞数。
每组剩余10只,取脑组织后用生理盐水制成20%的脑组织匀浆,取0.45 ml 20%的组织匀浆,按照试剂说明书,采用紫外分光光度计比色法用于测定髓过氧化物酶(MPO)。
2 结 果
2.1 大鼠神经功能缺损评分 在大鼠处死时间点前评分,除假手术组,其他两组均出现了不同程度的神经功能缺损症状。治疗组大鼠神经功能缺损评分均低于对照组(P<0.01)(见表1)。
2.2 大鼠脑梗死体积 由TTC染色结果可见,假手术组脑片全部呈红色,对照组和治疗组大鼠缺血侧额顶叶皮质及纹状体区可见明显的白色梗死灶,治疗组梗死体积明显小于对照组(P<0.01)(见表2,图1)。
2.3 大鼠脑组织中MPO的活性 用比色法检测脑组织MPO活性,对照组明显高于假手术组(P<0.01);治疗组中MPO的活性明显下降,与对照组相比差异显著(P<0.01)(见表3)。
2.4 大鼠脑组织中白细胞浸润,ICAM-1和IL-1表达 脑组织中的白细胞数、ICAM-1阳性血管数、IL-1阳性细胞数,对照组明显高于假手术组(P<0.01),治疗组与对照组相比明显减少,有显著统计学差异(P<0.01)(见表4)。
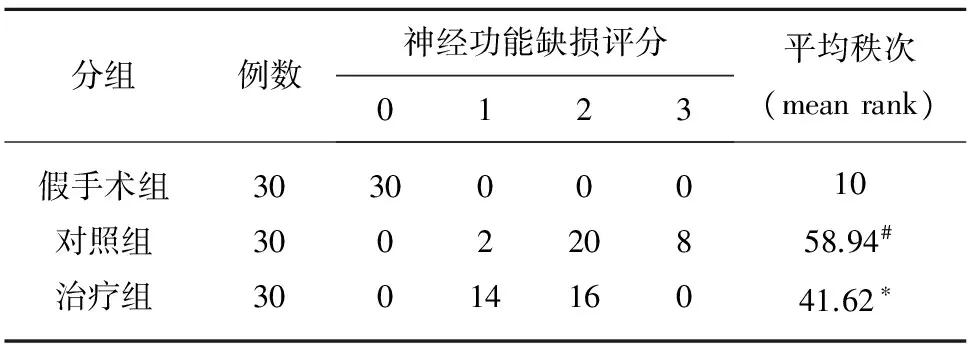
表1 各组大鼠神经功能缺损评分(mean rank)
#P<0.01 vs假手术组;*P<0.01 vs对照组

表2 各组大鼠脑梗死体积±s)
#P<0.01 vs假手术组;*P<0.01 vs对照组

表3 各组大鼠脑组织MPO的活性±s)
#P<0.01vs假手术组;*P<0.01vs对照组
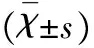
表4 大鼠脑组织中白细胞、ICAM-1、IL-1的含量
#P<0.01 vs假手术组;*P<0.01 vs对照组

假手术组 对照组 治疗组
图1 各组大鼠脑梗死病灶(TTC染色)
3 讨 论
脑梗死是神经系统常见疾病,具有发病率、致死率、致残率、复发率高的特点,主要由于血管堵塞导致脑血流减少而引起脑损伤,脑缺血时间越长,脑损伤越重,预后越差,如果脑血流很快恢复,则损伤可逆,缺血半暗带内的神经细胞仍可恢复正常[6,7],尽早恢复脑血流,挽救缺血半暗带是早期治疗的关键,但改善血流后所引起的缺血再灌注损伤常是治疗的重点,也是临床研究的热点。其发生机制与炎症反应、氧自由基增多、钙超载、神经元凋亡等有关,其中炎症反应在促进缺血半暗带转为梗死区的过程中发挥着重要作用[8],炎性反应的标志是白细胞浸润和小胶质细胞、星型胶质细胞的激活[9,10],胶质细胞主要引起细胞免疫,可诱导大量炎性介质释放[11],其中主要包括IL-1、肿瘤坏死因子(TNF)等。白细胞的浸润、迁移、聚集是炎症反应的重要环节,炎症反应的主要细胞是中性粒细胞和单核巨噬细胞,MPO存在于中性粒细胞的嗜天青颗粒中,其活性是判断中性粒细胞浸润程度的可靠指标[12]。在脑缺血发生后,白细胞被活化,活化的白细胞向缺血区域迁移,并释放多种炎性介质和炎性趋化因子,加速了白细胞的聚集、迁移。其中微血管内皮细胞受到损伤,ICAM-1表达增强,引起白细胞和内皮细胞相互反应,促使白细胞粘附于内皮细胞,然后穿越内皮,浸润缺血脑组织[13]。IL-1对白细胞有趋化作用,中枢神经系统内细胞均可表达IL-1[14],但过量的IL-1表达,促使大量的白细胞向缺血区浸润,聚集,放大了炎症级联反应,并可通过钙离子超载、NO、上调细胞凋亡基因加重脑损伤。
尤瑞克林是国家一类新药,治疗急性期脑梗死的用药,成份为人尿激肽原酶,是激肽释放酶-激肽系统的一个正向调节物质,能选择性扩张脑缺血部位细小动脉,增加缺血脑组织血流量,促进缺血区新生血管生成,减轻炎症反应,有减少神经细胞和神经胶质细胞凋亡等神经保护作用[15]。在本研究发现,脑缺血再灌注后,脑组织的炎性反应明显加重,治疗组给与尤瑞克林干预后,明显抑制了白细胞浸润程度、MPO活性、ICAM-1和IL-1表达,减少了脑梗死的体积,改善神经功能缺损症状,由此推测尤瑞克林发挥其神经保护作用的部分机制是通过抑制脑缺血再灌注损伤后的炎性反应来实现的。
[1]Guo MF,Yu JZ,Ma CG. Mechanisms related to neuron injury and death in cerebral hypoxic ischaemia[J]. Folia Neuropathol,2011,49(2):78 -87.
[2]Dziedzic T. Systemic inflammation as a therapeutic target in acute ischemic stroke[J]. Expert Rev Neurother,2015,15(5):523 -531.
[3]赵伟金,付钟果. 尤瑞克林注射液对急性脑梗死患者疗效及血清基质金属蛋白酶9的影响[J]. 中药药理与临床,2015,31(1):279-280.
[4]谭 盛,陈 健,刘 卉,等. 尤瑞克林治疗急性前循环脑梗死的近期疗效和安全性研究[J]. 中华神经医学杂志,2011,10(6):622 -625.
[5]丁德云. 新药临床研究之路-凯力康(注射用尤瑞克林)临床研究简介[J]. 中国处方药,2005,(11):63- 65.
[6]贾建平. 神经病学[M]. 北京:人民卫生出版社,2013.130.
[7]Venketasubramanian N,Chan BP,Chang HM,et al. Brain attack:needing resuscitation[J]. Singapore Med J,2011,52(8):620 -630.
[8]Peng B,Guo QL,He ZJ,et al. Remote ischemic post conditioning protects the brain from global cerebral ischemia/reperfusion injury by up-endothelial nitric oxide synthase through the PI3K/Akt pathway[J]. Brain Res,2012,28(1445):92-102.
[9]Zaleska MM,Mercado ML,Chavez J,et al. The development of stroke therapeutics:promising mechanisms and translational challenges[J]. Neuropharmacology,2009,56(2):329-341.
[10]Ekdahl CT,Kokaia Z,Lindval O. Brain inflammation and adult neurogenesis:the dual role of microglia[J]. Neuroscience,2009,158(3):1021-1029.
[11]Pei J,You X,Fu Q. Inflammation in the pathogenesis of ischemic stroke[J]. Front Biosci(Landmark Ed),2015,(20):772-783
[12]贾 栋. 贝前列素钠对脑缺血再灌注损伤大鼠血清IL-6、TNF-α水平及MPO活性影响[J]. 中国医院药学杂志,2015,35(20):1874-1875.
[13]郭春宣,陈伟荣,高元杰. 尤瑞克林对急性脑梗死的IL-1、CRP和ICAM-1表达的临床研究[J]. 中国实验诊断学,2013,17(7):1270-1271.
[14]吕 洋,沈维高,刘国辉. 脑缺血再灌注损伤中IL-1β的作用及机制[J]. 北京大学学报(自然科学版),2004,5(6):524 -528.
[15]李国前,杨小霞,王杰华,等. 尤瑞克林对脑缺血再灌注后促血管生长因子的影响[J]. 中国临床药理学杂志,2014,30(12):1098-1100.
Influence of inflammatory response from Urinary Kallidinogenase after focal cerebral ischemia-reperfusion injury in rats
JIANGFeng,SHANYuan,WANGLi,etal.
(NeurologyDepartmentⅠofShaanxiProvincePeople’sHospital,Xi’an710061,China)
Objective To investigate influence of inflammatory response from Urinary Kallidinogenase after focal cerebral ischemia-reperfusion injury in rats. Methods 90 SD rats were randomly divided into three groups:sham operation group,control group and treatment group. The middle cerebral artery occlusion reperfusion model was established by thread embolism method. After 2 h,the plug was pulled out of the 24 h,to observe the symptoms of neurological deficits,infarct volume,leukocyte infiltration,MPO activity,IL-1 and ICAM-1 expression in brain tissue of rats. Results First,The the volume of cerebral infarction and the neurological deficit scores in sham operation group were lower than the control group. There was a statistically significant difference(P<0.01). The degree of leukocyte infiltration,MPO activity,ICAM-1 and IL-1 expression in brain tissue were lower than those in control group,statistically significant difference(P<0.01). Second,Comparing comparing with the control group,the neurological deficit scores of rats and the cerebral infarction volume were smaller in the treatment group,with significant difference(P<0.01). In the treatment group,the degree of leukocyte infiltration and the activity of MPO,ICAM-1 and IL-1 expression decreased compared with the control group(P<0.01). Conclusion The neuroprotective effect of Urinary Kallidinogenase can be achieved by inhibiting the inflammatory response after cerebral ischemia reperfusion injury in rats.
Cerebral ischemia; Urinary Kallidinogenase; MPO; ICAM -1; IL -1
2016-11-05;
2017-02-26
(陕西省人民医院神经内一科,陕西 西安 710061)
蒋 锋,E-mail:docjiangfeng@163.com
1003-2754(2017)03-0262-03
R743
A
