赤水河两种荷马条鳅属鱼类的遗传多样性及谱系生物地理学过程分析
2017-04-12雪唐琼英刘飞刘焕章
王 雪唐琼英刘 飞刘焕章
(1. 中国科学院水生生物研究所, 水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
赤水河两种荷马条鳅属鱼类的遗传多样性及谱系生物地理学过程分析
王 雪1,2唐琼英1刘 飞1刘焕章1
(1. 中国科学院水生生物研究所, 水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
研究以线粒体Cyt b基因为分子标记, 对赤水河两种荷马条鳅属(Homatula)鱼类(红尾荷马条鳅和短体荷马条鳅)的遗传多样性及种群结构进行了分析; 同时, 结合了对在长江上游其他几个水系分布的同种鱼类进行比较, 分析其生物地理学过程。遗传多样性分析结果表明, 5个水系135尾红尾荷马条鳅Cyt b基因序列共检测出42个单倍型, 单倍型多样性和核苷酸多样性分别为0.936和0.00493; 其中, 赤水河种群的分别为0.891和0.00208。3个水系52尾短体荷马条鳅Cyt b基因序列共检测出12个单倍型, 单倍型多样性和核苷酸多样性分别0.821和0.01105; 赤水河种群的分别为0.646和0.00390。基于ML和BI法构建的单倍型分子系统发育树结果表明, 两物种各自构成单系, 且得到较强支持。红尾荷马条鳅各种群地理格局分布明显, 赤水河种群为并系类群位于分支基部。在短体荷马条鳅支系中, 岷江与沱江两个水系的个体相互聚类在一起, 而赤水河群体聚成一个分支。赤水河与其他水系不存在共享单倍型, 表现了明显的隔离和差异性的地理分布格局。由于这些水系之间地理位置相距较远, 推测这种格局的形成不是地质运动造成的水系隔离, 而是历史时期水位的高低变化造成鱼类种群的扩散和隔离。错配分析支持赤水河两物种种群扩张的推断, 但中性检验却并非全部支持, 显示种群历史相对复杂。
赤水河; 荷马条鳅属; Cyt b; 遗传多样性; 谱系生物地理学; 种群历史
赤水河是长江上游南岸较大的一条干流未建坝的一级支流, 流域地形地貌特征独特, 水域环境具有高度的异质性, 是长江上游珍稀特有鱼类国家级自然保护区的重要组成部分[1]。在三峡建成蓄水后, 因水文条件变更而受到威胁的约40种溪流鱼类可以在赤水河找到其栖息地或产卵场[2]。赤水河流域内丰富的生物多样性造就了其庞大且重要的基因库, 因此也决定了赤水河在生物多样性保护中不可替代的重要地位。
荷马条鳅属(Homatula)隶属于鲤形目(Cypriniformes)条鳅科(Nemacheilidae), 目前中国记录的有效种共13种[3]。多数中国学者将这些种类归为副鳅属(Paracobitis), 但欧洲学者则认为中国的副鳅属鱼类应为荷马条鳅属(Homatula)[4,5]。Paracobitis属实际是西亚(West Asia)特有类群, 它与中国Homatula属鱼类是具有地理隔离的两个不同类群。故本研究使用荷马条鳅属作为中国种类的有效名称。我们前期的鱼类资源调查发现, 赤水河存在两种荷马条鳅属鱼类, 红尾荷马条鳅(Homatula variegata Sauvage et Dabry)和短体荷马条鳅(Homatula potanini Günther)。红尾荷马条鳅广泛分布于长江中上游水系[6]。目前对红尾荷马条鳅的生物学及分类学已有一定的研究[7—9], 但未见关于其遗传多样性及谱系生物地理学研究的报道。短体荷马条鳅分布于长江中、上游及其附属水体[10,11], 为该水域的特有物种。目前对短体荷马条鳅的研究甚少, 仅见少量个体生物学描述、组织学及生殖学研究[12,13]。
近年来, 母系遗传的线粒体DNA被大量应用于谱系生物地理学、群体遗传学及分子系统学研究[14],成为具有代表性的分子标记之一[15]。本研究采用线粒体Cyt b基因对分布在赤水河的荷马条鳅属鱼类的遗传多样性及生物地理学过程进行研究, 分析其现有分布格局的形成及种群动态, 以期为赤水河鱼类的生物多样性研究及其资源保护提供科学的理论依据。
1 材料与方法
1.1 研究材料
本研究共分析了红尾荷马条鳅135尾, 短体荷马条鳅52尾, 并以多鳞荷马条鳅(Homatula pycnolepis)、拟鳗荷马条鳅(Homatula anguillioides)为外类群。外类群序列来自GenBank, 登录号为HM010501和HM010506。供分析的两种荷马条鳅属鱼类的采集地、所属水系等具体信息见表 1和图 1。赤水河流域的101尾红尾荷马条鳅和36尾短体荷马条鳅为本研究于2013年7月和2014年6月新采集并新测的序列, 大宁河样本序列来自未发表数据[16], 其余的包括金沙江、横江等水系的样本序列源于GenBank。野外样本采集时依据其形态进行初步鉴定, 带回实验室后依据谷金辉[6]的分类标准进行进一步确定。实验所用样本为95%酒精固定, 保存于中国科学院水生生物研究所淡水鱼类博物馆。
1.2 基因组DNA的提取、PCR扩增及测序
基因组DNA的提取采用高盐抽提法[17]。Cyt b基因扩增和测序引物为L14724 (5′-GACTTGAA AAACCACCGTTG-3′)和H15915 (5′-CTCCGATC TCCGGATTACAAGAC-3′), 退火温度56℃。PCR产物用0.8%琼脂糖凝胶电泳检测, 送生物公司完成纯化和序列测定。
1.3 数据处理及分析
DNA序列的比对使用Clustal X软件, 在SEAVIEW程序中进行手工校正。采用MEGA6.0软件分析序列中各碱基含量及变异情况, 并采用Kimura双参数模型计算转换/颠换比率与遗传距离。系统发育分析分别采用最大似然法(ML)和Bayesian法(BI)。采用Modeltest3.06程序进行AIC检验选择最适合的进化模型。ML分析采用PAUP*4.0b10软件,系统树各分支的置信度采用自引导法(Bootstrap analysis)重复检测。BI法采用MrBayes v.3.1.2软件,各分支的置信度以后验概率(Posterior probability)来表示。利用Network软件以中接法(Median-joining)构建单倍型的网络关系图, 分析单倍型之间的进化关系。使用DnaSP软件统计种群遗传多样性参数。利用Arlequin3.5进行错配分析及Tajima’s D和Fu’s Fs的中性检验计算。

表 1 两种荷马条鳅属鱼类样本采集信息及遗传多样性信息Tab. 1 The detailed information of sample locations, sample size and genetic diversity for two Homatula species
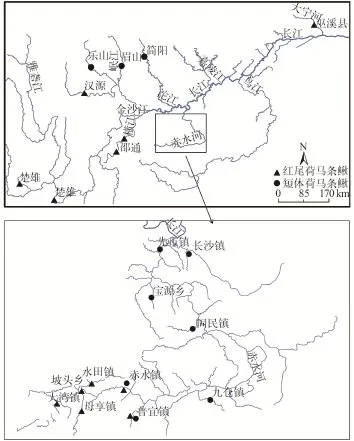
图 1 两种荷马条鳅属鱼类样本采集地点Fig. 1 Sample locations for two Homatula species
2 结果
2.1 序列变异与遗传多样性
对序列进行拼接和校对后, 得到荷马条鳅属线粒体Cyt b基因全长1140 bp。135尾红尾荷马条鳅Cyt b基因序列中, A、T、C、G四种碱基平均含量分别为28.2%、28.2%、27.7%和15.9%, 变异位点58个, 其中含简约信息位点34个, 所有序列转换颠换比(Ts/Tv)的平均值为5.01。52尾短体荷马条鳅Cyt b基因序列中, A、T、C、G四种碱基平均含量分别为28.6%、29.2%、27.0%和15.2%, 变异位点48个, 其中含简约信息位点46个, 所有序列转换颠换比(Ts/Tv)的平均值为6.86。两物种中A+T的含量都明显高于C+G的含量, 这与其他鱼类线粒体基因A、T含量高, G、C含量低的特点相似, 同时表现出强烈的低G碱基含量的碱基组成偏向性。
两种荷马条鳅属鱼类所有Cyt b基因序列共检测到54个单倍型。红尾荷马条鳅单倍型42个, 总体单倍型多样性为0.936, 核苷酸多样性为0.00493, 其中, 赤水河种群的单倍型多样性和核苷酸多样性分别为0.891和0.00208。所有单倍型之间的遗传距离为0.001—0.019, 平均遗传距离为0.007。短体荷马条鳅单倍型12个, 总体单倍型多样性为0.821, 核苷酸多样性为0.01105, 其中, 赤水河种群的单倍型多样性和核苷酸多样性分别为0.646和0.00390。所有单倍型之间的遗传距离为0.001—0.025, 平均遗传距离为0.015。单倍型分布情况及遗传多样性参数见表 1。在红尾荷马条鳅样本中, 除岷江因个体太少, 仅存在一个单倍型, 且与来自大宁河的个体为共享单倍型(Hap8)外, 所有水系都为各自独有的单倍型。其中在赤水河样本中, 除母享镇只含独有单倍型外, 其余5个地点均含有共享单倍型。在短体荷马条鳅样本中, 除来自岷江和沱江的样本存在共享单倍型(Hap49)外, 所有水系都为各自独有的单倍型。其中在赤水河样本中, 来自普宜镇、同民镇、赤水镇、先市镇个体有且只有一个单倍型, 为共享单倍型(Hap51), 其他3个地点各自有且只有一个独有单倍型。总体上, 赤水河与其他水系没有共享单倍型。
2.2 分子系统发育关系
采用ML法和贝叶斯法分别构建荷马条鳅属单倍型分子系统发育树, 所得结果基本一致, 只在单倍型的分支顺序上存在差异(图 2)。结果显示, 荷马条鳅属两种鱼类各自构成一个单系, 且得到较强的支持(ML树中两节点的自展支持率均为100, BI树中的后验概率均为1.00)。在红尾荷马条鳅中, 赤水河群体位于更基部的位置, 不能聚为一个单系,为并系类群; 来自横江与金沙江的样本分别按水系聚为两个分支, 二者形成姐妹群, 位于中间位置; 来自岷江和大宁河的共享单倍型(Hap8)及来自大宁河群体其他独有单倍型构成一个分支, 与(横江+金沙江)分支构成姐妹群关系。在短体荷马条鳅中,来自赤水河的所有样本构成一个分支, 位于更进化的位置, 来自岷江和沱江的个体交互聚在一起, 未能构成各自的单系。

图 2 基于Cyt b基因的两种荷马条鳅属鱼类单倍型BI树(节点处数值为ML/BI方法得到的支持率)Fig. 2 Phylogenetic relationships of haplotypes derived from BI analyses based on Cyt b gene sequences (the values at nodes represent support values of ML/BI)
单倍型进化网络图(图 3)与单倍型系统树所反映的进化关系大体一致。红尾荷马条鳅中, 存在显著的地理分布格局, 各单倍型大致按照采集水系而聚类为一个网络; 来自赤水河的单倍型构成星状网络结构, 单倍型Hap11和Hap25位于星状结构的中央, 推测这两个单倍型可能为赤水河红尾荷马条鳅的原始单倍型, 其他单倍型均由其直接或间接演化而来。而在短体荷马条鳅中, 单倍型地理分布格局不明显, 也不存在进化网络中心, 多个单倍型通过缺失的中间单倍型连接。
2.3 赤水河两种荷马条鳅属鱼类种群动态
将赤水河各采样点视为一个赤水河种群, 对两种荷马条鳅属鱼类分别进行种群错配分析及中性检验(表 2)。错配分析发现, 赤水河荷马条鳅属两种鱼类Hri和SSD检验均不显著, 表明两个群体均未偏离原假设(种群扩张模型), 即赤水河荷马条鳅属鱼类可能经历过种群的近期扩张。两种鱼类的Tajima’s D检验均符合中性进化的假设, 未检测到种群扩张。在Fu’s FS检验中, 支持红尾荷马条鳅经历过种群扩张, 但不支持短体荷马条鳅的种群扩张假设。
3 讨论
3.1 两种荷马条鳅属鱼类种群遗传多样性

图 3 两种荷马条鳅属鱼类单倍型的进化网络图Fig. 3 The network of haplotypesA. 红尾荷马条鳅; B. 短体荷马条鳅; “H”表示单倍型, 其后的序号为单倍型的序号。圆圈大小表示单倍型包含的个体数多少。节点间的小点代表缺失的单倍型A. H. variegata; B. H. potanini; “H” denotes Haplotype, subsequent numbers mean haplotype number. The circle size represents the number of individual haplotypes included. The dot represents lacked haplotype
生物的遗传多样性水平是长期进化的产物, 是评估生物资源现状的一个重要参数, 遗传多样性越高, 即遗传变异越丰富, 则对环境的适应能力就越强, 其生存竞争力就越强[20]。核苷酸多样性指数(π)和单倍型多样性指数(h)是衡量一个物种群体遗传多样的重要指标[21]。Grant等[22]对h值和π值大小变化情况进行了分析, 提出了4种模式(表 3)。与其他鳅类相类似[23—25], 荷马条鳅属总体具有高的单倍型多样性(红尾荷马条鳅h=0.936, 短体荷马条鳅h= 0.821), 符合小型鱼类种群数量大、分布广, 且遗传多样性丰富的特点。总体核苷酸多样性表现为红尾荷马条鳅低, 而短体荷马条鳅较高(π>0.5%)(红尾荷马条鳅π=0.00493; 短体荷马条鳅π=0.01105), 说明短体荷马条鳅数量较为庞大而且比较稳定[26]。由表 3可知, 出现红尾荷马条鳅这种单倍型多样性高,核苷酸多样性低的模式, 可能是群体受到瓶颈效应后种群迅速扩张所导致的结果, 因为核苷酸多样性的积累时间比单倍型多样性的积累时间要漫长的多, 亦有可能是种群进化历史很短的原因[22,26,27]。
3.2 两种荷马条鳅属鱼类生物地理学过程
在生物地理分布上, 利用基因谱系重建, 可以追溯近缘物种间或同种族群间等位基因的演化关系[26]。单倍型系统发育树显示, 荷马条鳅属这两物种各自构成单系。红尾荷马条鳅支系中, 识别出明显的谱系(Lineage), 系统树清楚的展示了不同进化谱系的地理分布格局。来自赤水河群体的所有单倍型虽然未构成单系, 但是总体位于所有研究种群的基部位置。由于赤水河与横江、岷江及金沙江等在地理位置上相对距离较远, 且红尾荷马条鳅产卵方式为受精卵粘附在河底的鹅卵石上孵化[28], 个体小, 迁移范围狭窄, 自主扩散能力相对较弱, 其种群分化应该不是地质运动导致水系的分化造成的,而可能是水位的变动形成扩散和隔离。受冰期与间冰期气候交替的控制, 第四纪时期全球海面发生过多次较大幅度的升降变化, 大面积冰川活动均与海面升降相对应, 冰川消长引起的海面升降幅度可达100—200 m[29]。推测地质历史上曾经有一个水位较低的时期, 红尾荷马条鳅的祖先种群混杂在一起, 后来, 祖先群随着水位上升及回水区域的扩大,扩散到不同水系的中上游, 经过长时间隔离, 累积变异进而逐渐演化成具有差异的不同种群。

表 2 种群错配分析与中性检验Tab. 2 Statistical test for neutrality and mismatch analysis

表 3 鱼类单倍型多样性和核苷酸多样性Tab. 3 Haplotype and nucleotide diversities for fishes
在短体荷马条鳅支系中, 岷江与沱江两个水系的个体相互聚类在一起, 位于更基部的位置, 而所有来自赤水河的样本聚成一个分支, 处于相对进化的位置。由于赤水河与岷江及沱江在地理位置相对较远, 存在一定的隔离, 因此, 短体荷马条鳅种群的分化原因应与红尾荷马条鳅相类似, 是由历史时期水位的高低变化造成的鱼类种群的扩散和隔离。然而, 沱江与岷江具有共享单倍型, 表明两水系的短体荷马条鳅种群的亲缘关系较近, 可能与两水系支流存在一定的连通有关。
3.3 赤水河荷马条鳅属鱼类种群历史与保护
赤水河101尾红尾荷马条鳅样本平均单倍型多样性处于较高水平, 而36尾短体荷马条鳅样本的平均单倍型多样性则处于中等偏上水平, 二者核苷酸多样性值偏低, 表明两个物种都是由一个较小的种群快速扩张而来的[22]。对赤水河两种荷马条鳅的错配分析支持两物种种群扩张的推断, 但中性检验却并非全部支持, 显示种群历史相对复杂。由于赤水河种群与其他水系的种群间的遗传分化很大, 在遗传资源保护管理中应作为进化显著单元分别加以保护[30], 防止遗传资源的丧失。
致谢:
中国科学院水生生物研究所俞丹助理研究员在数据分析方面给予的帮助,苗志国助理研究员、但胜国高级实验师、李小兵和张富斌同学给予了野外采样工作上的帮助,华中农业大学的郭志强提供的数据支持,在此一并表示衷心感谢!
[1]Gao X, Liu F, Wang J, et al. Characteristics and Conservation of Fish Habitats in the Chuishui River [A]. In: Department of Environment Impact Assessment, Ministry of Environment Protection of the People’s Republic of China, Institute of Hydropower and Environment Research, Research and Practice of Fish Protection Techno-logy (Habit Specifically) for Assessment on Environmental Impacts of Construction Projects [C]. Beijing: China Environmental Press. 2015, 92—100 [高欣, 刘飞,王俊, 等. 赤水河栖息地特征与保护现状. 见: 环境保护部环境工程评价中心, 水电环境研究院, 环境影响评价:鱼类保护(栖息地专题)技术研究与实践. 北京: 环境出版社. 2015, 92—100]
[2]Cao W X. The construction of the rare and endemic fishes nature reserve in the upper reaches of the yangtze river and the thought on related issues [J]. Resources and Environment in the Yangtze Basin, 2000, 9(2): 131—132 [曹文宣. 长江上游特有鱼类自然保护区的建设及相关问题的思考. 长江流域资源与环境, 2000, 9(2): 131—132]
[3]Min R, Yang J X, Chen X Y. Homatula disparizona, a new species of loach from the Red River drainage in China (Teleostei: Nemacheilidae) [J]. Ichthyological Exploration of Freshwaters, 2013, 23(4): 351—355
[4]Banarescu P, Nalbant T T. A generic classification of Nemacheilinae with description of two new genera (Teleostei: Cypriniformes: Cobitidae) [J]. Travauxdu Museum d’Histoire Naturelle Grigore Antipa’v, 1995, 35: 429—495
[5]Nalbant T T, Bianco P G. The loaches of Iran and adjacent regions with description of six new species (Cobitoidea) [J]. The Italian Journal of Zoology, 1998, 65: 109—125
[6]Gu J H. Systematic taxonomy of species of the nemacheiline genus Homatula Nichols, 1925 (Teleost: Balitoridae) [D]. Thesis for Master of Science. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2012 [谷金辉. 荷马条鳅属鱼类系统分类学研究. 硕士学位论文, 中国科学院水生生物研究所, 武汉. 2012]
[7]Zhou Z Y, Yan T M, Ma H D. The preliminary Study on the Biology of Paracobitis variegates [J]. Journal of Sichuan Agricultural University, 2007, 25(3): 352—356 [周中艳, 严太明, 马恒东. 红尾副鳅生物学初步研究. 四川农业大学学报, 2007, 25(3): 352—356]
[8]Guo Z Q, Liu S P, Duan X B, et al. The age and growth of Paracobitis variegates in Daning River [J]. Freshwater Fisheries, 2008, 38(6): 14—18 [郭志强, 刘绍平, 段辛斌, 等. 大宁河红尾副鳅年龄与生长的研究. 淡水渔业, 2008, 38(6): 14—18]
[9]Zeng Y, Zhang E, Gu J H, et al. Morphological variation in the loach species Homatula variegate (Balitoridae), with notes on its taxonomic status [J]. Hubei Agricultural Science, 2012, 51(5): 972—976 [曾元, 张鹗, 谷金辉, 等.红尾荷马条鳅形态差异及其分类地位的研究. 湖北农业科学, 2012, 51(5): 972—976]
[10]Zhu S Q. The Loaches of the Subfamily Nemacheilinae in China (Cypriniformes: Cobitidae) [M]. Nanjing: Jiangsu Science and Technology Press. 1989, 31—37 [朱松泉. 中国条鳅志. 南京: 江苏科学技术出版社. 1989, 31—37]
[11]Ding R H. The Fishes of Sichuan, China [M]. Chengdu: Sichuan Science and Technology Press. 1994, 50—57 [丁瑞华, 四川鱼类志. 成都: 四川科学技术出版社. 1994, 50—57]
[12]Wen L L, Wang Z J, Feng X W, et al. Histological Studies on the Urinary System of Paracobitis potanini [J]. Journal of Southwest China Normal University (Natural Science), 2007, 32(5): 59—64 [温龙岚, 王志坚, 冯兴无,等. 短体副鳅泌尿系统的组织学研究. 西南师范大学学报:自然科学版, 2007, 32(5): 59—64]
[13]Wang B S, Yao Y H, Wang Z J. Embryonic Development of Paracobitis potanini [J]. Freshwater Fisheries, 2008, 38(2): 70—73 [王宝森, 姚艳红, 王志坚. 短体副鳅的胚胎发育观察. 淡水渔业, 2008, 38(2): 70—73]
[14]Avise J C. Molecular Markers, Natural History and Evolution [M]. New York: Chapman & Hall. 1994, 141—397
[15]Hewitt G M. Genetic consequences of climatic oscillations in the Quaternary [J]. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 2004, 359: 183—195
[16]Guo Z Q. Study on biology and heredity of Paracobitis variegates in Daning River [D]. Thesis for Master of Science. Huazhong Agricultural University, Wuhan. 2009 [郭志强. 大宁河红尾副鳅生物学及遗传特征分析. 硕士学位论文, 华中农业大学, 武汉. 2009]
[17]Aljanabi S M, Martinez I. Universal and rapid salt-extraction of high quality genomic DNA for PCR-based techniques [J]. Nucleic Acids Research, 1997, 25: 4692—4693
[18]Rui Min, X Y Chen, J X Yang, et al. Phylogenetic relationships of the genus Homatula (Cypriniformes: Nemacheilidae), with special reference to the biogeographic history around the Yunnan-Guizhou Plateau [J]. Zootaxa, 2012, 3586: 78—94
[19]Tang Q Y. Molecular phylogeny of the Cobitoidea (Teleostei: Cypriniformes) [D]. Thesis for Doctoral of Science, Huazhong Agricultural University, Wuhan. 2005 [唐琼英. 鳅超科鱼类分子系统发育研究. 博士学位论文, 华中农业大学, 武汉. 2005]
[20]Wang J J, Tong J G, Zhang Y G, et al. Study on the genetic diversity of two wild populations of Megalobrama pellegrini (Teleostei, Cyprinidae) [J]. Aca Hydrobiologica Sinica, 2014, 38(5): 975—979 [王瑾瑾, 童金苟, 张耀光, 等. 厚颌鲂两个野生群体遗传多样性分析. 水生生物学报, 2014, 38(5): 975—979]
[21]Vrijenhoek R C. Genetic diversity and fitness in small population [J]. Conservation Genetics, 1994, 68: 37—53
[22]Grant W A S, Bowen B W. Shallow population histories in deep evolutionary lineages of marine fishes: insights from sardines and anchovies and lessons for conservation [J]. Journal of Heredity, 1998, 89: 415—426
[23]Qiu C F, Lin Y G, Qing N, et al. Genetic variation and phylogeography of Micronoemacheilus pulcher population among drainage systems between western SouthChina and Hainan Island [J]. Acta Zoologica Sinica, 2008, 54(5): 805—813 [邱城锋, 林岳光, 庆宁, 等. 华南西部及海南岛美丽小条鳅种群遗传变异与亲缘地理. 动物学报, 2008, 54(5): 805—813]
[24]Yang C, Shen Z X, Wang G J, et al. Study on genetic diversity of Triplophysa pseudoscleroptera based on Cyt b gene sequence [J]. Journal of Anhui Agricultural Science, 2011, 39(25): 15395—15396 [杨成, 申志新, 王国杰, 等.基于Cyt b基因序列的拟硬刺高原鳅遗传多样性研究.安徽农业科学, 2011, 39(25): 15395—15396]
[25]Tian H W, Duan X B, Wang D Q, et al. Sequence variability of cytochrome b and genetic structure of Leptobotia elongate in the upper Yangtze River [J]. Freshwater Fisheries, 2013, 43(6): 13—18 [田辉伍, 段辛斌, 汪登强,等. 长江上游长薄鳅Cyt b基因的序列变异鱼遗传结构分析. 淡水渔业, 2013, 43(6): 13—18]
[26]Frankham R. Relationship of genetic variation to population size in wildlife [J]. Conservation Biology, 1996, 10: 1500—1508
[27]Fan Q, He S P. The pattern of upper and middle Yangtze drainages shapes the genetic structure and diversity of Hemiculter leucisculus revealed by mitochondrial DNA locus [J]. Aca Hydrobiologica Sinica, 2014, 38(4): 627—635 [范启, 何舜平. 长江流域种群遗传多样性和遗传结构分析. 水生生物学报, 2014, 38(4): 627—635]
[28]Zhou Z Y. Preliminary study on Biology of Loach (Paracobitis variegates) in middle of Qingyijiang River [D]. Thesis for Master of Science, Sichuan Agricultural University, Ya’an. 2007 [周中艳. 青衣江中游红尾副鳅生物学初步研究. 硕士学位论文, 四川农业大学, 雅安. 2007]
[29]Xia Z K. Quaternary Environmental Studies [M]. Beijing: Peking University Press. 1997, 110—120 [夏正楷. 第四季环境学. 北京: 北京大学出版社. 1997, 110—120]
[30]Moritz C. Defining “evolutionary significant units” for conservation [J]. Trends in Ecology & Evolution, 1994, 9(10): 373—375
GENETIC DIVERSITY AND PHYLOGEOGRAPHY OF TWO HOMATULA SPECIES (TELEOSTEI: NEMACHEILIDAE) IN THE CHISHUI RIVER
WANG Xue1,2, TANG Qiong-Ying1, LIU Fei1and LIU Huan-Zhang1
(1. The Key Laboratory of Aquatic Biodiversity and Conservation, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
The Chishui River, the important part of the Rare and Endemic Fishes Nature Reserve in the upper Yangtze River basin, plays an irreplaceable role in biodiversity conservation. The present study used mitochondrial DNA (mtDNA) Cyt b gene as molecular maker to perform the genetic diversity and phylogeographic analyses of two species of Homatula (H. variegata and H. potanini) from the Chishui River and nearby rivers. 42 haplotypes were identified for 135 individuals of H. variegata from 5 rivers, and 12 haplotypes for 52 individuals of H. potanini from 3 rivers. Relatively high haplotype diversity were detected (hH.variegata=0.936, hH.potanini=0.821) with low nucleotide diversity in H. variegates (π=0.00493) and high nucleotide diversity in H. potanini (π=0.01105). Haplotype diversity and nucleotide diversity of H. variegates in the Chishui River were 0.891 and 0.00208, respectively, and their values were 0.64 and 0.00390 for H. potanini from the same river. Phylogenetic analyses for all haplotypes based on ML and BI methods revealed that H. variegata and H. potanini were separately clustered as their own monophy. The phylogeny of H. variegates clad showed the population from the Chishui River as paraphy located at the basal position of this clad, and all samples were separately clustered together according to their drainages with an obvious pattern of geographic distribution, while this pattern was not observed in samples of H. potanini. No haplotypes from the Chishui River were shared with other rivers, showing a significant isolation and difference in geographic distribution patterns. Because of the far distance between these rivers, it is speculated that the formation of this pattern was not caused by geological movement, but maybe resulted from the fluctuation of water level in the ancient time. Mismatch distribution analysis indicted the recent demographic expansions of Homatula populations in the Chishui River, but not all neutrality tests supported this hypothesis. These results suggest the relatively complex demographic history of Homatula species in the Chishui River.
Chishui River; Homatula; Cyt b; Genetic diversity; Phylogeography; Demographic history
Q346+.5
A
1000-3207(2017)02-0356-07
10.7541/2017.43
2016-01-31;
2016-06-17
国家自然科学基金项目(31272306, 31400359); 中国长江三峡集团公司科研项目(0799533); 长江上游珍稀特有鱼类及保护区项目(0714097)资助 [Supported by the National Natural Science Foundation of China (No. 31272306, 31400359); the Science and Technology Research Project of China Three Gorges Corporation (No. 0799533); the Project of the Rare and Endemic Fishes Nature Reserve in the Upper Yangtze River Basin (No. 0714097)]
王雪(1990—), 女, 吉林延边朝鲜族自治州人; 博士研究生; 主要从事鱼类分子生态学研究。E-mail: wangxue@ihb.ac.cn
刘焕章, E-mail: hzliu@ihb.ac.cn
