应用生物膜干涉技术检测鱼腥藻HetR结合靶DNA的亲和力
2017-04-12张良林王帅高
张良林王 帅高 宏
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
应用生物膜干涉技术检测鱼腥藻HetR结合靶DNA的亲和力
张良林1,2王 帅1,2高 宏1
(1. 中国科学院水生生物研究所, 中国科学院藻类生物学重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
鱼腥藻PCC7120是一种固氮丝状蓝藻, 当环境中化合态氮源充足时, 其藻丝只有进行光合作用的营养细胞;在环境中缺乏可利用的氮源时, 部分营养细胞会在藻丝上以一种半规律的格式分化成异形胞(异形胞间隔约10个营养细胞), 从而进行固氮作用。早在1984年, Wolk实验室通过与大肠杆菌接合转移的方式, 成功地将穿梭质粒转入鱼腥藻PCC7120, 建立了遗传转移系统[1]。在2001年, 日本Kazusa研究中心完成了对鱼腥藻PCC7120全基因组测序[2]。有规律的细胞分化格式, 成熟的遗传转移系统以及完整可用的基因组序列使得鱼腥藻PCC7120成为了研究原核细胞分化的模式生物。
鱼腥藻PCC7120异形胞的分化是一个复杂的过程,涉及多个基因的协调参与。根据目前的研究, HetR被公认为是异形胞分化的主调控因子。文献报道, HetR是一个具有双链DNA结合活性的同源二聚体[3], 通过结合基因启动子区域(包括其自身启动子)从而调控基因的转录表达[4,5]。对于HetR蛋白和靶DNA的结合力的研究, 研究者主要采用的经典的EMSA方法[4—6], 该方法通过观察DNA条带的迁移能直观的反应蛋白与DNA的结合情况。然而, 该方法局限性是不能对蛋白结合靶DNA亲和力进行准确地定量。因而研究者们正试图尝试一些新的方法, 探究HetR结合靶DNA的奥秘。
生物膜干涉技术(Bio-Layer Interferometry, BLI))是一种快速检测分子间相互作用的方法, 该方法由ForteBio公司开发设计, 在Octet系统中可完成实验操作。其基本原理是, 在光纤制成的生物传感器底端覆盖生物分子相容层, 偶联配体后形成生物膜层, 进而用配体与靶分子反应。大分子结合传感器底端偶联的配体时会导致生物膜层厚度增加, 反射光干涉光谱曲线将产生迁移, 仪器可以实时监测相位移的变化, 并将其转化为可衡量分子间相互作用大小的参数。BLI技术对于研究蛋白与DNA结合有着广泛的应用前景[7,8]。
本研究利用BLI技术, 研究了鱼腥藻PCC7120异形胞分化主调控因子HetR与其靶DNA(PhetP与PhetZ)的结合情况, 并对其亲和力进行了定量分析。本文也是BLI技术在鱼腥藻异形胞发育研究领域应用的首次报道, 为该领域的研究提供了新的研究方法。
1 材料与方法
1.1 EF-Ts-HetR蛋白的表达纯化及定量
本研究使用的蛋白是EF-Ts-HetR, 在HetR的N-端融合了一个EF-Ts标签。表达菌株由本实验室杜野博士构建[5]。蛋白C-端含有6His标签, 因而利用Ni2+柱亲和层析的方法, 具体方法按照His·Bind Purification Kit (Novagen)进行。纯化后的蛋白用20 mmol/L Tris-HCl pH 8.0缓冲液在超滤管(Millipore, 截留分子量3 K)中脱盐纯化。蛋白定量采用康维世纪的Super-Bradford Protein Assay Kit试剂盒。
1.2 Biotin-DNA的制备
本研究中使用DNA片段为鱼腥藻PCC7120中hetP和hetZ基因的启动子区域50/40 bp片段, 均采用5′-biotin标记的方法。其中, biotin-ssDNA直接由公司合成标记; biotin-dsDNA需要将其中的一条biotin-ssDNA与另一条非标记的ssDNA退火形成, 退火缓冲液采用碧云天公司的Annealing Buffer for DNA Oligos (5X)。退火体系总体积100 μL, 各组分及用量如下: Annealing Buffer for DNA Oligos (5×), 20 μL; DNA oligo A (50 μmol/L), 20 μL; DNA oligo B (50 μmol/L) 20 μL; Nuclease-free water, 40 μL。反应程序如下: step1 95℃, 2min, 1 cycle; step2 -0.1 ℃/ cycle, 8s, 700 cycles; Step3 4℃ forever。
1.3 BLI实验
生物膜干涉实验(Bio-Layer Interferometry, BLI)在Octet RED96系统中完成。实验采用与仪器匹配的96孔板(Fluotrace 600, LOT E110103S), 反应体积为200 μL, 反应温度为28℃。实验具体方法参考相关文献[7,8]并有相应改进。方法如下: 将Streptavidin (SA)标记的探针于超纯水中浸湿5min, 进而转移入A Buffer (20 mmol/L Tris-HCl pH 8.0, 200 mmol/L NaCl, 1 mmol/L MgCl2, 1 mmol/ L DTT, 0.5 mmol/L EDTA)中进行第一次基线(Baseline)步骤, 时间100s; 探针转移入含有500 nmol/L biotin标记的DNA的A Buffer中进行DNA固定, 时间200s; 将固定有DNA的探针重新转移到B Buffer中进行第二次基线(Baseline)步骤(B Buffer为含有 6 mg/ mL BSA、1.2% Tween20、10 μg/mL超声后鲑鱼精DNA的A Buffer),时间200s; 将探针转移至含有终浓度为C buffer中进行蛋白和DNA的结合步骤(C buffer为含有10 μmol/L EF-TSHetR的B Buffer), 时间300s; 最后将探针转移至B Buffer中进行解离步骤, 时间300s。
结合动力学参数利用Data analysis (ForteBio, version 7.1)进行数据分析。KD值根据结合和解离曲线, 利用nonlinear global fitting model模拟计算。计算KD值的实验设置蛋白浓度梯度为10、5、2.5和1.25 μmol/L。最终KD值计算取3次独立实验的平均值。
2 结果
2.1 BLI对HetR结合PhetP50与PhetZ50的差异比较
文献已报道HetR可以结合hetP和hetZ启动子的识别位点, 从而可以调控hetP与hetZ的表达[4,5]。我们利用BLI技术对EF-Ts-HetR与包含识别位点的双链DNA片段PhetP50 (5′-AAATGCACAGTAGGCGGGGGTCTAA CCCCTCATTACCTAGTAGAAAATG-3′)和PhetZ50 (5′-TCTGCCCACTAATGTGAGGGTCTAGCCCAGCAGGT GGGATTAGAGAAACA-3′)的结合进行了检测。结果显示, HetR与靶DNA结合在Octet系统中有明显的信号(图1)。HetR与不同靶DNA的结合解离曲线已在图中标出(PhetP和PhetZ), control代表不固定DNA的探针与HetR反应的阴性对照。曲线纵坐标为相位移变化, 反映了结合信号强弱; 横坐标为结合解离持续时间。
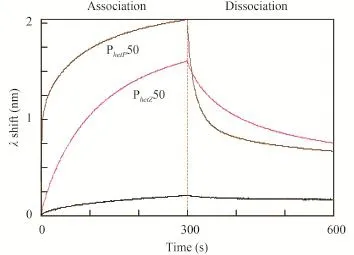
图 1 HetR与PhetP50和PhetZ50的结合Fig. 1 Binding of HetR with PhetP50 and PhetZ50
2.2 HetR结合PhetP50与PhetZ50亲和力(KD)计算
图 1显示EF-Ts-HetR与PhetP50和PhetZ50有着不同的结合解离曲线, 进而我们同样利用BLI技术对HetR与PhetP50和PhetZ50的结合进行了定量。Octet系统中给出的KD值反映了分子相互作用力的大小。KD值是根据结合解离曲线算出的解离常数(Kd)与结合常数(Ka)的比值, 反映了分子间亲和力的大小。
为准确计算KD值, 我们设置了EF-Ts-HetR浓度梯度,如图 2、图 3中标注所示, 曲线分别代表10、5、2.5和1.25 μmol/L的EF-Ts-HetR结合靶DNA。根据曲线计算出, HetR与PhetP50和PhetZ50结合的KD值分别为0.29±0.07和1.48±0.29。
3 讨论
HetR作为有特异位点的DNA结合蛋白, 在鱼腥藻PCC7120基因组中有着多个靶标位点。文献报道HetR可以结合hetP、hetZ、patA、hetR、hepA、alr0202和alr3234的启动子序列, 并且由于这些基因启动子包含的HetR结合位点完整性的差异, HetR对于不同片段有着不同的亲和力[9]; 经典的EMSA实验多次证明HetR对hetP和hetZ启动子片段有着相对较强的结合力。因而在本研究中, 我们选取了PhetP和PhetZ50 bp片段, 利用BLI技术对HetR结合靶DNA进行了定量和定性的分析。
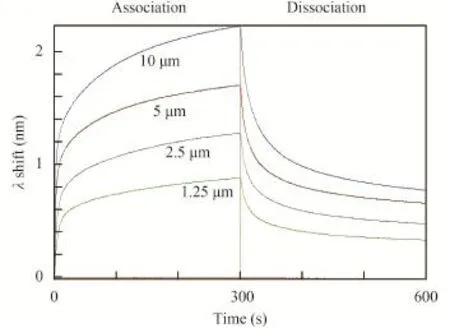
图 2 不同浓度的EF-Ts-HetR与PhetP50的结合Fig. 2 Binding of HetR at different concentration with PhetP50
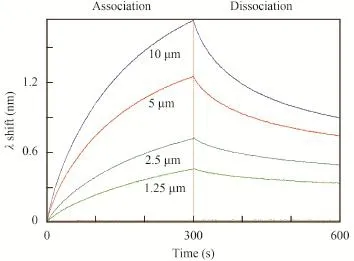
图 3 不同浓度的EF-Ts-HetR与PhetZ50的结合Fig. 3 Binding of HetR at different concentration with PhetZ50
通过对HetR与PhetP50和PhetZ50片段结合解离曲线(图 1)的比较我们可以看出, HetR与PhetP50的结合和解离速率都明显快于PhetZ50; 在300s内, HetR与PhetP50的结合信号(λ shift)要强于HetR与PhetZ50的结合信号。但BLI的原理, 结合信号的大小并不能直接反应亲和力的强弱, 为了对HetR与PhetP50和PhetZ50片段的亲和力进行定量, 我们利用HetR浓度梯度进行了KD值精确计算; KD值即为亲和力常数, 它只与分子间相互作用大小有关, 与分子浓度无关, 其数值越小代表的分子间亲和力越强。通过KD值的比较我们看出, HetR与PhetP50片段的亲和力要明显强于HetR与PhetZ50片段的亲和力, 在数值上前者约是后者的1/5, 因而我们可以判断HetR与hetP启动子片段的亲和力约是与hetZ片段亲和力的5倍。
研究者曾利用EMSA手段, 定性分析了HetR对不同片段的结合[9], 发现HetR在0.125 μmol的时候即可与hetP启动子片段结合, 而当HetR浓度提高到0.5 μmol/L的时候才可以和hetZ启动子片段结合。通过EMSA简单的定量分析, 我们可以看出HetR与hetP启动子片段的亲和力约是hetZ启动子片段亲和力的4倍左右, 与本研究报道的5倍十分接近。BLI技术在蛋白-DNA相互作用研究中将会发挥越来越大的作用。
[1]Wolk C P, Vonshak A, Kehoe P, et al. Construction of shuttle vectors capable of conjugative transfer from Escherichia coli to nitrogen-fixing filamentous cyanobacteria [J]. Proceedings of the National Academy of Sciences of the USA, 1984, 81(5): 1561—1565
[2]Kaneko T, Nakamura Y, Wolk C P, et al. Complete genomic sequence of the filamentous nitrogen-fixing cyanobacterium Anabaena sp. Strain PCC 7120 [J]. DNA Research, 2001, 8(5): 205—213
[3]Kim Y C, Ye Z, Joachimiak G, et al. Structures of complexes comprised of Fischerella transcription factor HetR with Anabaena DNA targets [J]. Proceedings of the National Academy of Sciences of the USA, 2013, 110(19): 1716—1723
[4]Higa K C, Callahan S M. Ectopic expression of hetP can partially bypass the need for hetR in heterocyst differentiation by Anabaena sp. Strain PCC 7120 [J]. Molecular Microbiology, 2010, 77(3): 562—574
[5]Du Y, Cai Y, Hou S, et al. Identification of the HetR recognition sequence upstream of hetZ in Anabaena sp. strain PCC 7120 [J]. Journal of Bacteriology, 2012, 194(9): 2297—2306
[6]Hou S W, Zhou F, Peng S, et al. The HetR-binding site that activates expression of patA in vegetative cells is required for normal heterocyst patterning in Anabaena sp. PCC 7120 [J]. Science Bulletin, 2015, 60(2): 192—201
[7]Adams C J, Pike A C, Maniam S, et al. The p53 cofactor strap exhibits an unexpected TPR motif and oligonucleotide-binding (OB)-fold structure [J]. Proceedings of the National Academy of Sciences of the USA, 2012, 109(10): 3778—3783
[8]Cukier C D, Hollingworth D, Martin S R, et al. Molecular basis of FIR-mediated c-myc transcriptional control [J]. Nature Structural & Molecular Biology, 2010, 17(9): 1058—1064
[9]Hou S W. The recognition sequence of HetR, the master regulator of heterocyst differentiation, in Anabaena sp. PCC 7120 [D]. Thesis for Master of Science. Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan. 2013 [侯圣伟. 鱼腥藻PCC7120异形胞分化主调控因子HetR的识别序列. 硕士学位论文, 中国科学院水生生物研究所, 武汉. 2013]
DETECTION OF THE AFFINITY OF HETR, THE KEY REGULATOR OF HETEROCYST DIFFERENTIATION, WITH ITS TARGET DNA IN ANABAENA BY BIOLAYER INTERFEROMETRY
ZHANG Liang-Lin1,2, WANG Shuai1,2and GAO Hong1
(1. Key Laboratory of Algal Biology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
生物膜干涉技术; PCC7120; HetR; DNA结合能力
Biolayer interferometry; PCC7120; HetR; DNA binding ability
Q344+.1
A
1000-3207(2017)02-0483-03
10.7541/2017.61
2016-03-21;
2016-06-12
国家自然科学基金(31270132)资助 [Supported by the National Natural Science Foundation of China (31270132)]
张良林(1986—), 男, 安徽亳州人; 硕士研究生; 研究方向为藻类遗传学。E-mail: 409663786@qq.com
高宏, E-mail: gaoh@ihb.ac.cn
