RNAi在甲壳动物中的研究进展
2017-04-12李法君付春鹏李明爽李群峰傅洪拓
李法君付春鹏李明爽李群峰傅洪拓
(1. 潍坊科技学院,寿光 262700; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,无锡 214081; 3. 全国水产技术推广总站,北京 100125)
RNAi在甲壳动物中的研究进展
李法君1,2付春鹏1李明爽3李群峰1傅洪拓2
(1. 潍坊科技学院,寿光 262700; 2. 中国水产科学研究院淡水渔业研究中心,农业部淡水渔业和种质资源利用重点实验室,无锡 214081; 3. 全国水产技术推广总站,北京 100125)
RNA干扰(RNA interference, RNAi)是一类在真核生物中广泛存在的, 由双链RNA介导的转录后基因沉默机制。作为一项研究基因功能的有力工具, RNAi技术已经被广泛应用在线虫、果蝇、斑马鱼和小鼠等生物的基因组学研究中。近来在甲壳动物中, 通过RNAi技术取得了众多的科研成果。文章从免疫、生长发育、蜕皮、生殖、性别调控、渗透压调节和代谢等几个方面进行了综述。进而对RNAi技术在甲壳动物中的研究前景进行了展望, 旨在为以后更好地研究甲壳动物的基因功能和调控网络提供参考。
RNA干扰; 基因沉默; 甲壳动物; 基因功能; 调控机制
甲壳动物种类繁多, 其中的许多物种, 特别是十足目虾蟹类是我国乃至世界范围内重要的养殖对象。近年来在甲壳动物的养殖过程中出现了疾病频发的问题; 而且多数甲壳动物雌雄之间存在明显的生长差异现象, 因此单性化养殖一直是甲壳动物养殖领域极具吸引力的研究方向。解决上述问题的关键在于阐明其内在基因的功能及调控机制。随着测序技术的发展, 不但甲壳动物不同组织、不同发育时期的mRNA序列得以明确, 而且像中华绒螯蟹(Eriocheir sinensis)这样重要经济种类的全基因组DNA序列也已经测序完成[1]。如何有效利用这些基因序列, 阐明甲壳动物诸如免疫、生长、蜕皮和性别分化等生理过程的分子机制, 从而更好地解决甲壳动物养殖过程中出现诸多问题, 就成为当前亟待解决的课题。
双链RNA (Double-stranded RNA, dsRNA)介导的RNA干扰(RNA interference, RNAi)现象是普遍存在线虫、果蝇、斑马鱼和小鼠等真核生物中的转录后调控机制, 在生物体的生长发育、稳定转座子和抵御外来病毒的入侵等方面发挥重要作用。RNAi技术于2001年被《Science》杂志评为十大科学进展之一, 2002年更是位居十大科学进展之首。作为研究基因功能的重要工具, 近年来RNAi技术也在甲壳动物中得以广泛应用, 并取得了众多研究成果。鉴于此, 本文对RNAi在甲壳动物中的研究进展进行了综述, 旨在为应用此技术解析甲壳动物重要基因的功能及调控机制提供理论参考。
1 RNAi简介
RNAi是指在进化过程中高度保守的、由dsRNA诱发的同源mRNA高效特异性降解的现象。因此, RNAi技术又被形象地称为基因敲除(Knock-down)或基因沉默(Gene silencing)。1995年, Guo和Kemphues[2]利用反义RNA阻断线虫 (Caenorhabditis ele-gans) 的part-1基因表达时, 意外发现作为对照组的正义RNA也可以抑制part-1基因的表达; 1998年, Fire等[3]分别将part-1基因的正义、反义和dsRNA导入线虫, 发现dsRNA的沉默效果明显高于单链RNA。于是将这种由dsRNA抑制特定基因表达的现象称为RNAi。随后, RNAi以其独有的高效性、特异性、稳定性和可传播性迅速成为研究基因功能的重要工具。
研究表明, 由dsRNA引发的RNAi作用机制分两步进行: 起始阶段和效应阶段。起始阶段: 外源或内源的dsRNA进入细胞后, 被Dicer酶劈成21—23个碱基的小片段, 称为小分子干扰RNA (Small interfering RNA, siRNA); 效应阶段: siRNA和RNA诱导沉默复合物(RNA Induced Silencing Complex, RISC)相结合, 结合后的复合物具有核酸酶的作用,能识别并降解目标RNA。
2 RNAi技术在甲壳动物中的研究
甲壳动物隶属节肢动物门, 处在由无脊椎动物向脊椎动物进化的特殊阶段, 独特的进化地位也决定了发育过程和组织构造的特殊性。RNAi作为真核生物普遍存在的机制, 也在甲壳动物中调控多个生物学过程。
2.1 免疫
病毒病已经给对虾养殖业造成重大损失, 对虾白斑综合症病毒(White spot syndrome virus, WSSV)、黄头病毒(Yellow head virus, YHV)和桃拉病毒(Taura syndrome virus, TSV)是危害我国对虾养殖业的三种主要病毒。其中以WSSV的危害最为严重, 已经给对虾养殖业造成巨大的经济损失。RNAi被认为是一种古老的抗病毒机制, 是生物体中先天性存在的免疫因子, 甲壳动物也不例外。研究表明,免疫系统是后生动物普遍存在的抵抗外来病原入侵的防御体系, 分为先天性免疫和获得性免疫。甲壳动物体内不能产生免疫球蛋白, 缺乏获得性免疫,因此仅具有先天性免疫[4,5]。RNAi技术最早应用在甲壳动物也是在此方面。Kim等[6]首次在感染WSSV和TSV的凡纳滨对虾(Litopenaeus vannamei)中分别注射绿头鸭(Anas platyrhynchos)、鲶(Ictalurus punctatus)和野猪(Sus scrofa)的免疫球蛋白基因dsRNA。结果显示, 注射异源物种dsRNA的实验组死亡率下降到对照组的50%—70%, 由于凡纳滨对虾体内不存在上述脊椎动物的免疫球蛋白基因, 所以脊椎动物的dsRNA分子不可能参与到凡纳滨对虾的抗病毒干扰体系中去。引起染病凡纳滨对虾死亡率降低的原因在于, 脊椎动物免疫球蛋白基因dsRNA作为外源性物质注射到凡纳滨对虾体内, 从而激活了凡纳滨对虾先天性的免疫反应。
WSSV是具有双层囊膜的杆状型病毒, 目前已确定VP19、VP24、VP26、VP28等10余种膜蛋白[7,8], 这些膜蛋白通常参与WSSV病毒粒子的吸附、入侵、包装和释放等过程, 对病毒的感染起着至关重要的作用[9,10]。由于WSSV属于双链DNA病毒, 因此科研人员通常利用RNAi技术定向沉默编码上述蛋白的mRNA来抑制WSSV的繁殖。Kim等[11]将VP28和VP281的长链dsRNA注射到感染WSSV的中国对虾(Fenneropenaeus chinensis)体内, 有效提高存活率。Xu等[12]将短链VP28的dsRNA注射到日本囊对虾(Penaeus japonicus)体内, 也发现有类似的结果。近来Thammasorn等[13]在凡纳滨对虾中利用基因重组技术, 将VP28和WSSV051 (WSSV的极早期基因之一)两个基因干扰位点构建到同一条dsRNA中, 并将其饲喂凡纳滨对虾。7d后此实验组的死亡率为40%, 显著低于VP28和WSSV051的单独干扰组,表现出良好的治疗效果。RNAi在甲壳动物不同WSSV结构基因方面的具体研究在表 1中列出。
与WSSV不同, TSV和YHV都是单链RNA病毒[14,15], RNAi对其结构基因的研究仅限于YHV的gp116和gp64两个功能基因, 而且是在体外细胞中进行的[16]。有关RNAi在YHV和TSV中的研究多体现在阻断其传输途径中的相关基因方面。Rab是GTP结合蛋白家族中最大的亚家族, Rab7蛋白作为Rab家族一员, 能特异识别晚期胞内体等囊泡, 介导晚期胞内体与溶酶体的膜融合, 以完成溶酶体转运过程。当病毒、菌病体等进入宿主细胞后会与Rab7蛋白结合, 避开溶酶体的消化, 导致宿主感染。因此, Rab7在病原体入侵宿主过程中起着重要的作用。例如, 斑节对虾的Rab7可以与VP28结合, 在WSSV侵染对虾的过程中发挥作用[17]。Ongvarrasopone等[18]在斑节对虾中通过注射Rab7-dsRNA降低 Rab7基因的表达量, 从而有效抑制YHV和WSSV感染对虾, 推测Rab7蛋白可能是参与了病毒复制过程中的内吞运输。在TSV侵染虾体的研究中也获得了相似的结果, Ongvarrasopone等[19]在TSV侵染凡纳滨对虾48h之后注射Rab7-dsRNA, 有效地抑制TSV的复制, 提高了虾的成活率。RNAi在YHV和TSV传播途径中其他相关基因的研究在表 1中列出。
上述研究表明, RNAi作为广泛存在的抗病毒机制在甲壳动物抵御外来病毒的侵染过程中发挥重要作用。近年来, 有关甲壳动物RNAi抗病毒的分子机制也取得了较大进展。现在公认的观点为:病毒侵染甲壳动物有机体, 并将外源基因整合到寄主的基因组内。当宿主细胞进行转录时, 会产生相应的dsRNA。宿主细胞内的核酸内切酶Dicer (DCR2)[41,42]与Arsenite resistance蛋白2(Ars2)[43]和HIV-1反式激活应答元件RNA结合蛋白(HIV-1 transactivating response (TAR) RNA-binding protein, TRBP)[44]组成三者复合物, 将上述dsRNA分割成siRNA, siRNA与宿主细胞内的核酸内切酶Argonautes 2(Ago2)结合组成沉默复合物, 从而对病毒的mRNA进行切割降解[45], 从而抑制病毒基因的表达,起到防御病毒侵染的目的。
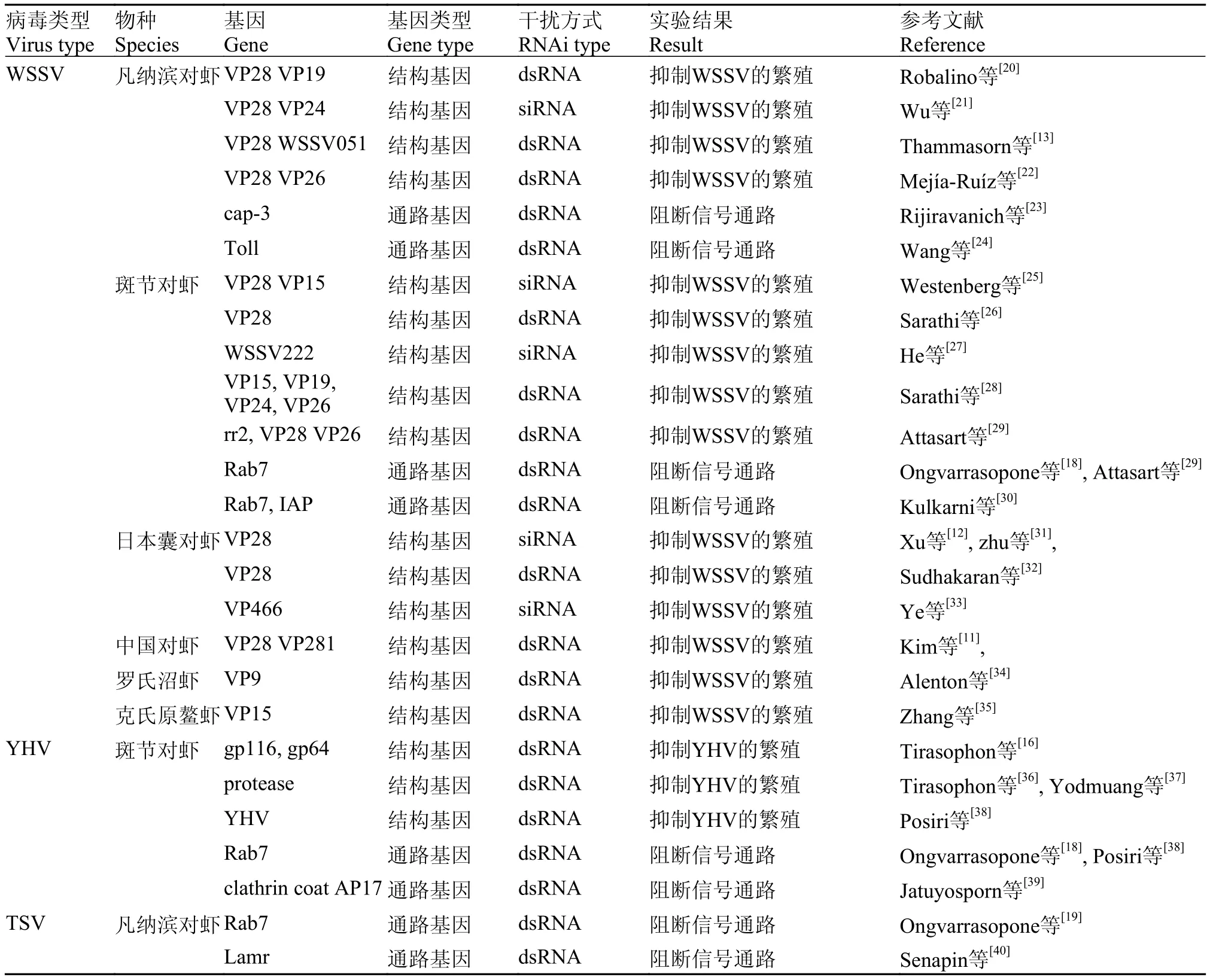
表 1 RNAi在三种病毒中的研究Tab. 1 Studies examining three viruses using RNAi in shrimp
综上所述, RNAi作为一种对抗病毒入侵的新技术手段, 具有高效、完全、无毒的特点, 在治疗甲壳动物病毒病的过程中发挥积极作用。但现有的研究尚处在理论阶段, 如何针对不同的病毒开发长期性表达的特异RNAi体系, 并大规模应用到甲壳动物养殖中是当务之急。
2.2 生长发育
作为有力的分子生物学工具, RNAi技术被广泛应用在研究线虫、昆虫和脊椎动物的生长发育方面[46,47]。近来RNAi也在研究甲壳动物生长发育方面取得了长足进步。
肌肉生成抑制素(Myostatin, MSTN), 在无脊椎动物中又称生长分化因子(Growth differentiation factor 11, GDF-11), 属于转化生长因子-β(Ttransforming growth factor-β, TGF-β)家族, 是控制肌肉生长的调控因子[48]。在日本沼虾(Macrobrachium nipponense)中, MSTN/GDF-11基因在蜕皮的早期阶段高丰度表达, 而在随后的蜕皮期表达量则逐渐下降, 表明MSTN/GDF-11基因参与了日本沼虾的生长发育过程[49]。在斑节对虾中, 通过45d的长期干扰MSTN/GDF-11基因, 结果显示干扰组斑节对虾的增重仅为对照组的32%[50]。在凡纳滨对虾中, 经过8周的干扰, 增重率显著低于对照组, 且出现较高的死亡率(71%)[51]。上述结果揭示MSTN/GDF-11基因可以促进甲壳动物的生长发育。
表皮生长因子受体(Epidermal Growth Factor Receptor, EGFR)是具有酪氨酸激酶活性的跨膜蛋白分子, 可以和配体结合启动胞内信号传导途径,促进细胞的分裂增殖, 从而调控生长发育。罗氏沼虾(Macrobrachium rosenbergii)的研究表明, 干扰Mr-EGFR基因可使罗氏沼虾生长变缓, 13周之后干扰实验组体重仅为对照组的37%[52], 表明Mr-EGFR是罗氏沼虾重要的生长调控因子。
Hox基因(Omeobox genes)在节肢动物躯体发育过程发挥重要作用, 其表达具有严格的组织特异性和胚胎发育的程序性[53]。Spalt在不同的Hox同源异型盒充当辅酶因子和受体的角色, 在不同的物种中, Spalt基因所体现的功能各不相同。Copf等[54]在卤虫(Artemia saline)中用RNAi方法研究了Spalt基因的功能。结果显示, 降低Spalt基因的表达可以导致卤虫体节发育异常, 据此推测Spalt基因可能是Hox的调节因子之一。Hox同源异型盒中的Ubx基因在明钩虾(Parhyale hawaiensis)附肢的发育过程中发挥作用, 通过干扰减少Ubx基因的表达量可以导致附肢的表型发生变化[55], 表明Ubx基因很可能参与了明钩虾附肢的发育过程。另一个参与附肢发育的基因是Distal-less (Dll), Kato等[56]在水溞(Daphnia magna) Dll基因的不同位置构建了两条dsRNA, 分别注射这两条dsRNA到水蚤的受精卵中,结果都导致Dll基因的表达量明显下降, 并且孵化后的幼体都发现触角变得更为钝平。表明Dll基因参与了水蚤触角的发育过程。RNAi在其他生长发育相关基因的研究在表 2中列出。
动物体的生长发育是一个严谨而复杂的生物学过程, 多个基因和调控通路涉及其中。有关甲壳动物生长发育的分子机制, 虽然取得了一定的研究成果, 但已经明显落后于同属节肢动物门的昆虫纲。生长发育作为甲壳动物最基本的生物学过程,其中尚有许多关键环节等待研究人员借助RNAi和其他技术对其进行解读。
2.3 蜕皮
甲壳动物由于独特的身体构造, 在个体发育过程中存在蜕皮现象。研究表明, 甲壳动物的蜕皮受多种因素的参与, 蜕皮抑制激素(Molt Inhibiting Hormone, MIH)、蜕皮激素受体(Ecdysone receptor, EcR)、维甲酸X受体(Retinoid X receptor, RXR)及转录因子调控蜕壳响应基因E75、几丁质酶均在其中发挥用[57,58]。
Pamuru等[59]在红螯螯虾(Cherax quadricarinatus)用dsRNA沉默Cq-MIH基因, 结果导致蜕皮周期加快, 蜕皮的间隔期也相应缩短到原来的32%。江丰伟[60]通过连续6周干扰日本沼虾的Mn-MIH基因, 显著增加日本沼虾的蜕皮频次, 实验组雄虾和雌虾分别蜕皮17次、12次, 而对照组雄、雌虾则仅为2次、5次。表明MIH是甲壳动物蜕皮周期中的负调控因子。最近在蓝蟹(Callinectes sapidus)中的研究表明, EcR正调控MIH基因的表达, 是MIH基因上游调控因子[61]。Techa[62]在蓝蟹中通过RNAi证实, 蜕皮激素(Ecdysteroids, E)通过EcR刺激MIH基因的表达, 证实甲壳动物的蜕皮机制中存在“E→EcR→MIH”的信号通路。
RXR是节肢动物在蜕皮过程中重要调控基因之一, RXR与EcR形成二聚体结构, 调控下游基因E75的表达。Priya等[63]注射RXR-dsRNA到中国对虾幼虾体内导致下游的两种几丁质酶(Chi和Chi-1)基因和E75基因的表达丰度下调, 表明RXR也参与了甲壳动物的蜕皮信号途径。接着Priya等[64]通过持续注射沉默E75基因, 严重阻碍中国对虾的蜕皮并最终导致其死亡, 说明 E75基因与甲壳动物的蜕皮调控密切相关且是其生长过程中必需基因。最近在凡纳滨对虾中的研究表明, 干扰RXR、EcR和E75基因中任意一个都会引起其他两个基因的表达量发生变化, 进而会影响一系列的蜕皮和生长相关基因的变化[65]。上述结果进一步证实了RXR、EcR和E75基因调控甲壳动物的蜕皮过程。
甲基法尼酯(Methyl farnesoate, MF)是甲壳动物一种重要的生长调控激素, 主要负责调节体节发育、生长和生殖[66,67]。法尼酸甲基转移酶(Farnesoic acid O-methyltransferase, FAMeT)在MF的形成过程中起着重要作用, 负责把法尼酸(Farnesoic acid, FA)转化为MF。在凡纳滨对虾中, Hui等[68]研究了FAMeT基因在蜕皮中的作用, 通过注射dsRNA降低了FAMeT基因的表达量, 从而推迟了蜕皮, 而且与蜕皮相关的血蓝蛋白基因和组织蛋白酶基因的表达量也会下降。最后注射dsRNA的实验组(因蜕皮阻滞)全部死亡, 而与之相对应的对照组则无一死亡。这些结果表明, FAMeT基因在甲壳动物的生长和蜕皮周期中发挥作用。RNAi在其他蜕皮相关基因的研究在表 2中列出。
蜕皮是甲壳动物生长和发育的标志性特征, 是一个复杂有序的生物学过程。它贯穿于甲壳动物个体发育的始终, 受MIH信号通路、Ca2+信号通路以及NO信号通路的共同调节[57]。目前对蜕皮机制的认识还相当有限, 各信号通路直接是否存在关联,以及每条信号通路都存在哪些具体的调控因子, 这些都需要进一步研究。
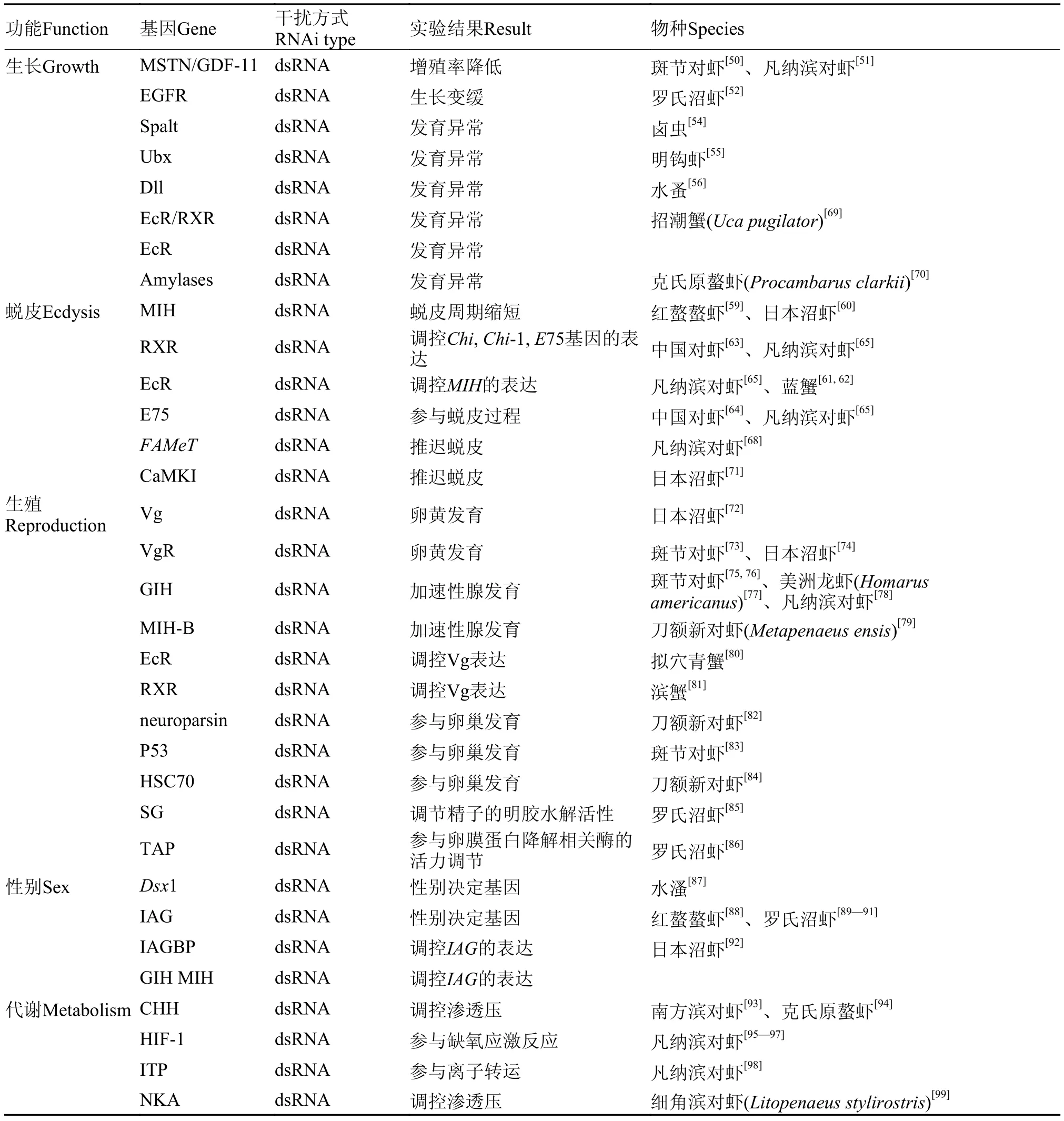
表 2 RNAi在三种病毒中的研究Tab. 2 Studies examining three viruses using RNAi in shrimp
2.4 生殖
甲壳动物的生殖发育是神经多肽、激素及多种环境因子综合调控的结果。涉及性腺的发育、生殖细胞的发生和受精等多个过程。卵黄蛋白原(Vitellogenin, Vg)是卵生动物雌性卵黄蛋白的前体, Vg的合成和积累对于雌性个体卵母细胞的发育和卵子的数量和质量至关重要[100]; 卵黄蛋白原受体(Vitellogenin receptor, VgR)是低脂蛋白受体超家族中的一员, 在卵巢发育过程中与Vg结合, 起到受体介导的作用, 在胚胎成熟的过程中发挥作用。因此Vg和VgR就成为研究雌性水产动物卵巢发育的重要靶标基因。
甲壳动物Vg的合成部位一直存在内源性(卵巢)和外源性(肝脏)两种观点。Tiu等[73]在斑节对虾和Bai等[74]在日本沼虾中通过干扰VgR基因, 推测Vg可能是在肝脏中合成后运输到卵巢中的卵母细胞内。而且Bai等[72,74]进一步干扰了日本沼虾的Vg和VgR基因发现, 日本沼虾的性腺指数明显低于对照组, 表明Vg和VgR参与了甲壳动物的性腺发育过程。
甲壳动物眼柄中的X-器窦腺复合体(X-organsinus gland, XO-SG)合成并分泌甲壳动物高血糖激素(Crustacean hyplyeemic hormone, CHH)家族激素,包括性腺抑制激素(Gonad inhibiting hormones, GIH)、CHH和MIH等多种神经多肽激素, 调控甲壳动物的糖代谢、蜕皮及生殖等多个生理过程[101,102]。Treerattrakool等[76]通过向驯养和野生的雌性斑节对虾注射GIH-dsRNA, 结果导致卵巢发育提前, 干扰的驯养组和野生组产卵率分别为14%和63%, 而作为对照的驯养组和野生组产卵率则分别6%和20%,表明GIH抑制斑节对虾卵巢的发育。已有多个研究证实(表 2), 沉默GIH[75,77,78]和MIH-B[79]可以提高Vg基因的表达水平, 表明GIH和MIH-B是卵巢发育的负调控因子。
此外, 核受体RXR和EcR作为信号通路的重要成员也在甲壳动物性腺的发育过程中起调控作用。Gong等[80]在拟穴青蟹(Scylla paramamosain)中沉默EcR基因, Nagaraju等[81]在滨蟹(Carcinus maenas)中沉默RXR基因均发现Vg基因的表达量显著下降, 表明EcR和RXR参与了卵巢的发育过程, 并且后者的研究进一步表明MF和RXR组成复合物, 调控卵巢的发育。另有研究表明, 蝗抗利尿肽(Neuroparsin)基因[82]、肿瘤抑制因子P53基因[83]和热激蛋白(Heat Shock Cognate 70, HSC70)[84]也在卵巢发育过程中发挥作用。
精子明胶酶(Spermgelatinase, SG)最先发现于雄性罗氏沼虾的生殖道中, 是一种可以水解明胶的蛋白, 在受精过程中发挥作用。Yang等[85]在罗氏沼虾中通过沉默SG基因, 发现罗氏沼虾的精子在外形上未见异常, 但其明胶的水解活性明显下降, 并推测SG在精子的蛋白水解活性方面起到了很重要的作用。Ma等[86]通过干扰壶腹多肽(Terminal ampullae peptide, TAP)降低了SG的活性, 进一步的研究表明, TAP参与卵膜蛋白降解相关酶的活力调节,但不影响精子入卵和受精过程。
迄今有关甲壳动物生殖方面的研究主要集中在生殖细胞的发生、成熟及受精机制的形态观察和生理生化分析水平上, 在分子水平上探讨上述机制的报道还为数不多[103]。众所周知, 甲壳动物在养殖过程中会出现“性早熟”现象, 其中的分子调控机制还不甚明了。RNAi技术的应用将有助于揭示甲壳动物“性早熟”的发生机制, 进而丰富甲壳动物的生殖生物学, 为建立高产、稳产的甲壳动物养殖体系奠定理论基础。
2.5 性别调控
动物的性别决定存在多种机制, 例如高等哺乳动物的性别由性染色体决定, 而甲壳动物缺乏相应的性染色体, 与脊椎动物相比, 其性别决定机制具有原始性和可塑性的特点。研究表明, 相关基因在甲壳动物的性别分化过程中起决定作用。
Dmrt (Doble-sex and Mab-3 Relatated Transcription factor)是参与性别决定最古老的基因家族, Doublesex基因就属于此家族。Kato等[87]在水溞中克隆得到两种Dsx 基因DapmaDsx1和DapmaDsx2,其中DapmaDsx1编码两种不同的亚型DapmaDsx1-α和DapmaDsx1-β。DapmaDsx1展现出明显的性别二态性表达, 在雄性胚胎的形成过程中, DapmaD-sx1表达量明显升高, 而在雌性胚胎中则没有这种现象。进一步在雄性胚胎中沉默DapmaDsx1, 可诱导其卵巢成熟, 产生雌性特征; 相反, 在雌性胚胎中异位表达DapmaDsx1, 可使其产生雄性特性。表明DapmaDsx1雄性性别决定中起着关键作用。因此, DapmaDsx1被认为是水溞的性别决定基因[104]。
促雄腺(Androgenic gland, AG)是雄性甲壳动物特有的内分泌器官, 其分泌的胰岛素样促雄腺激素(Insulin-like androgenic gland hormone, IAG)迄今为止是唯一被证明直接参与了甲壳动物性别分化的蛋白类激素。Ventura等[89]在成体罗氏沼虾(变态后70—80天, 体重为0.25—1.6 g)中, 通过长期(55d)干扰IAG基因抑制了雄性性征的发展。Rosen等[88]在红螯螯虾中, 通过干扰沉默IAG基因, 使雄性个体出现了雌性化特征、精子发生受到抑制、Vg基因开始表达、卵母细胞中的卵黄大量积累等现象。以上结果表明, IAG基因在甲壳动物的性别分化方面发挥重要作用。2012年在甲壳动物性别分化方面取得了突破性进展, Ventura等[90]通过长时间干扰雄性罗氏沼虾幼体(变态后30d, 体重30—70 mg), 获得了完全性逆转的“新雌虾”。随后应用“新雌虾”与正常的雄虾交配产生了全雄的后代[91], 从而实现了罗氏沼虾的单性化养殖。
近来RNAi技术也用在研究IAG基因的调控机制方面。我们前期通过RNAi技术在日本沼虾中论证了IAG和胰岛素样促雄腺激素结合蛋白(Insulinlike androgenic gland hormone binding protein, IAGBP)存在彼此的调控关系[92]; 而且我们进一步确认MIH和GIH是IAG基因的负调控因子[105]。在罗氏沼虾中, Yu等[106]通过RNAi确认Dmrt11E基因是IAG基因的正调控因子。
罗氏沼虾的干扰实验标志着第一次通过沉默一个基因而实现甲壳动物的单性化养殖。在此过程中没有改变机体的基因序列, 因此具有广阔的应用前景[107]。
2.6 渗透压调节
甲壳动物多广盐性物种, 盐度的变化必然会引起血糖浓度、渗透压发生改变等一系列生理调控过程, 神经多肽激素便在其中发挥作用。Lugo等[93]将CHH-dsRNA通过腹部淋巴腺注射进入南方滨对虾(Litopenaeus schmitti)体内, 24h之内没有检测到CHH-mRNA, 其血淋巴内的血糖水平也发生了下降, 表明CHH可使血糖升高, 从而调节甲壳动物的渗透压。Manfrin等[94]在克氏原螯虾中通过长时间干扰CHH基因, 实验组克氏原螯虾的死亡率达到47%, 并且死亡个体呈现明显的渗透压失调症状(头胸甲和腹部出现明显的分离)。此外大剂量干扰离子转运肽(Ion transport peptide, ITP)[98]和Na+/K+-ATPase (NKA)[99]基因可使实验虾出现死亡, 表明上述两个基因也在调控渗透压方面发挥各自的作用。
我国幅员辽阔, 盐碱地区众多, 这些地区多不适宜农作物种植, 因此荒废。对盐碱地的水质、离子成分进行分析, 针对具体物种的渗透压调节机制,必要时补充相关离子, 进行水产养殖可以提高盐碱地区的经济效益。因此阐明甲壳动物的渗透压调节机制, 就显得尤为关键。
2.7 代谢
缺氧诱导因子-1 (Hypoxia inducible factor 1, HIF-1)是由α和β两个亚基组成的异源蛋白二聚体,作为转录因子, HIF-1调控缺氧应激下的多种生理活动。Soñanez等[95]在缺氧条件下分别干扰凡纳滨对虾HIF-1-α和HIF-1-β, 结果显示血淋巴中葡萄糖的浓度出现明显变化; 继续干扰发现, HIF-1通过己糖激酶(Hexokinase, HK)[96]、磷酸果糖激酶(Phosphofructokinase, PFK)和果糖-1, 6-二磷酸酶(Fructose -1, 6-bisphosphatase, FBP)[97]途径来调控葡萄糖的变化。
目前为止, 有关甲壳动物代谢途径中相关基因的研究还偏少, 作为基础的代谢过程, 应用RNAi技术开展此方面的研究有助于全面解析甲壳动物的营养代谢途径。
3 展望
技术优势: 基因组编辑技术(ZFN, TALEN, CRISPR/Cas9h)和RNAi作为研究基因功能的两种有力工具, 已经在水产动物中得以广泛运用。基因组编辑技术的操作对象是基因组DNA, 且主要是通过显微注射对细胞系或胚胎进行操作。而目前为止, 甲壳动物还缺乏成熟的细胞系构建体系, 且卵壳较硬易碎。因此, 有关应用基因组编辑技术研究甲壳动物基因功能的文章还鲜见报道。虽然基因组编辑技术有望成为研究基因功能的主流方法, 但在上述问题未解决之前, RNAi仍然在甲壳动物中发挥自己独特的技术优势。从技术层面分析, RNAi在甲壳动物中也存在脱靶和效应剂量等方面的问题。但这些问题可以通过对不同靶点和不同剂量dsRNA的筛选来解决。而且相比脊椎动物, 甲壳动物体型较小, dsRNA注射用量也较小, 现有成熟的RNAi试剂盒完全可以满足实验要求, 因此成本较低。作为内生性的调控机制, 人工合成的dsRNA可以持续在甲壳动物体内发挥作用, 如研究人员发现GIH-dsRNA在斑节对虾体内发挥作用的有效时间最少可以达到30天[76]。注射法是目前甲壳动物RNAi的主要转染方式, 近来在探索RNAi的其他转染途径方面也取得了突破性进展。在斑节对虾中, 研究人员将GIH-dsRNA构建到大肠杆菌中, 然后用卤虫滤食大肠杆菌从而“富集”GIH-dsRNA, 最后将卤虫饲喂斑节对虾可有效降低GIH基因的表达水平[108]。这种方法简单有效, 更为重要的是, 对于不适用注射法的甲壳动物幼体来说, 卤虫饲喂法介导的RNAi为研究甲壳动物幼体阶段相关基因的功能开辟了一条新路。因此可以肯定的是, RNAi作为一项成熟的技术, 在未来一段时间内还将是研究甲壳动物基因功能的热门工具。
免疫机制研究: RNAi作为一种抵抗外源病毒的重要天然免疫反应, 迄今为止, 甲壳动物在免疫过程中的具体分子机制还不完全清楚。在昆虫中,病毒诱导的siRNA和miRNA是独立生成的, 各自在免疫系统中发挥作用[45,109]。已有研究表明, 甲壳动物的miRNA也在抵御病毒入侵的过程发挥作用[110,111]。那么, 甲壳动物是否和昆虫一样也存在类似的独立作用机制, 还需进一步探索。上述问题的阐明, 将有助于揭开当下危害甲壳动物养殖过程中出现的病毒性疾病的发病原理, 进而开发高效实用的防治药物, 服务于水产养殖业。
基因功能与信号通路: 甲壳动物的各个生物学过程从来都不是独立存在的, 如甲壳动物的生长和蜕皮总是相辅相成的, 甲壳动物有机体的生长导致蜕皮, 蜕皮又可以促进甲壳动物的生长; 再如, 甲壳动物“性早熟”也与蜕皮密切相关, 原因在于早期幼体性腺发育过快, 蜕皮次数过频。因此, 性腺的发育与蜕皮机制必然存在交叉点。换而言之, 甲壳动物的各个基因调控通路相互连接, 形成一个复杂的调控网络。因此有关甲壳动物基因组学的研究势必将从单个基因功能的确定过渡到信号通路的研究。如前文所述, 基因测序技术的发展为我们获取大规模的基因信息提供了有力的技术保障。RNAi的技术特点使它可以精确地靶向敲降目的基因, 进而可以检测出下游基因表达量的变化, 在转录水平为信号通路的研究提供基本的数据, 进而通过相关的技术手段解读其调控网络。
综上所述, 作为一项快速发展并取得广泛应用的技术, RNAi在甲壳动物研究中已经展示了广阔的用途和前景, 由此我们相信随着对甲壳动物RNAi信号传递机制的深入研究, 必将有助于全面阐释甲壳动物的基因功能及其调控网络, 进而推动甲壳动物基因组学的研究, 同时也可为甲壳动物的健康养殖提供更多的理论指导, 从而实现理论研究和生产应用的统一。
[1]Song L, Bian C, Luo Y, et al. Draft genome of the Chinese mitten crab, Eriocheir sinensis [J]. Giga Science, 2016, 5(1): 1—3
[2]Guo S, Kemphues K J. par-1, a gene required for establishing polarity in C. elegans embryos, encodes a putative Ser/Thr kinase that is asymmetrically distributed [J]. Cell, 1995, 81(4): 611—620
[3]Fire A, Xu S, Montgomery M K, et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans [J]. Nature, 1998, 391(6669): 806—811
[4]Wang P H, Weng S P, He J G. Nucleic acid-induced antiviral immunity in invertebrates: An evolutionary perspective [J]. Developmental & Comparative Immunology, 2015, 48(2): 291—296
[5]He Y, Ju C, Zhang X. Roles of small RNAs in the immune defense mechanisms of crustaceans [J]. Molecular Immunology, 2015, 68(2): 399—403
[6]Robalino J, Browdy C L, Prior S, et al. Induction of antiviral immunity by double-stranded RNA in a marine invertebrate [J]. Journal of Virology, 2004, 78(19): 10442—10448
[7]Escobedo Bonilla C M. Application of RNA interference (RNAi) against viral infections in shrimp: A review [J]. Journal of Antivirals & Antiretrovirals, 2013, 5(3): 1—12
[8]Seok S H, Park J H, Cho S A, et al. Cloning and sequencing of envelope proteins (VP19, VP28) and nucleocapsid proteins (VP15, VP35) of a white spot syndrome virus isolate from Korean shrimp [J]. Diseases of Aquatic Organisms, 2004, 60(1): 85—88
[9]Sindhupriya M, Saravanan P, Otta S, et al. White spot syndrome virus (WSSV) genome stability maintained over six passages through three different penaeid shrimp species [J]. Diseases of Aquatic Organisms, 2014, 111(1): 23—29
[10]Kulkarni A, Rombout J, Singh I, et al. Truncated VP28 as oral vaccine candidate against WSSV infection in shrimp: an uptake and processing study in the midgut of Penaeus monodon [J]. Fish & Shellfish Immunology, 2013, 34(1): 159—166
[11]Kim C S, Kosuke Z, Nam Y K, et al. Protection of shrimp (Penaeus chinensis) against white spot syndrome virus (WSSV) challenge by double-stranded RNA [J]. Fish & Shellfish Immunology, 2007, 23(1): 242—246
[12]Xu J, Han F, Zhang X. Silencing shrimp white spot syndrome virus (WSSV) genes by siRNA [J]. Antiviral Research, 2007, 73(2): 126—131
[13]Thammasorn T, Sangsuriya P, Meemetta W, et al. Large-scale production and antiviral efficacy of multi target double stranded RNA for the prevention of white spot syndrome virus (WSSV) in shrimp [J]. Bmc Biotechnology, 2015, 15(1): 1—7
[14]Mouillesseaux K P, Klimpel K R, Dhar A K. Improvement in the specificity and sensitivity of detection for the Taura syndrome virus and yellow head virus of penaeid shrimp by increasing the amplicon size in SYBR Green real time RT-PCR [J]. Journal of Virological Methods, 2003, 111(2): 121—127
[15]Weili Y, Sihua Z, Zhiqin Y, et al. Development of a Liquid Chip Technique to Simultaneously Detect Taura Syndrome Virus (TSV) and Yellow Head Disease Virus (YHDV) [J]. Animal Husbandry and Feed Science, 2014, 6(5): 256—260
[16]Tirasophon W, Roshorm Y, Panyim S. Silencing of yellow head virus replication in penaeid shrimp cells by dsRNA q [J]. Biochemical and Biophysical Research Communications, 2005, 334(1): 102—107
[17]Sritunyalucksana K, Wannapapho W, Lo C F, et al. PmRab7 is a VP28-binding protein involved in white spot syndrome virus infection in shrimp [J]. Journal of Virology, 2006, 80(21): 10734—10742
[18]Ongvarrasopone C, Chanasakulniyom M, Sritunyalucksana K, et al. Suppression of PmRab7 by dsRNA inhibits WSSV or YHV infection in shrimp [J]. Marine Biotechnology, 2008, 10(4): 374—381
[19]Ongvarrasopone C, Saejia P, Chanasakulniyom M, et al. Inhibition of Taura syndrome virus replication in Litopenaeus vannamei through silencing the LvRab7 gene using double-stranded RNA [J]. Archives of Virology, 2011, 156(7): 1117—1123
[20]Robalino J, Bartlett T, Shepard E, et al. Double-stranded RNA induces sequence-specific antiviral silencing in addition to nonspecific immunity in a marine shrimp: convergence of RNA interference and innate immunity in the invertebrate antiviral response [J]?Journal of Virology, 2005, 79(21): 13561—13571
[21]Yue W, Ling L, Yang L S, et al. Inhibition of white spot syndrome virus in Litopenaeus vannamei shrimp by sequence-specific siRNA [J]. Aquaculture, 2007, 271(4): 21—30
[22]Mejía C H, Vega S, Alvarez P, et al. Double-stranded RNA against white spot syndrome virus (WSSV) vp28 or vp26 reduced susceptibility of Litopenaeus vannamei to WSSV, and survivors exhibited decreased susceptibility in subsequent reinfections [J]. Journal of Invertebrate Pathology, 2011, 107(1): 65—68
[23]Rijiravanich A, Browdy C L, Withyachumnarnkul B. Knocking down caspase-3 by RNAi reduces mortality in Pacific white shrimp Penaeus Litopenaeus vannamei challenged with a low dose of white spot syndrome virus [J]. Fish & Shellfish Immunology, 2008, 24(3): 308—313
[24]Wang K H C, Tseng C W, Lin H Y, et al. RNAi knock down of the Litopenaeus vannamei Toll gene (LvToll) significantly increases mortality and reduces bacterial clearance after challenge with Vibrio harveyi [J]. Developmental & Comparative Immunology, 2010, 34(1): 49—58
[25]Westenberg M, Heinhuis B, Zuidema D, et al. siRNA injection induces sequence-independent protection in Penaeus monodon against white spot syndrome virus [J]. Virus Research, 2005, 114(1): 133—139
[26]Sarathi M, Simon M C, Venkatesan C, et al. Oral administration of bacterially expressed VP28dsRNA to protect Penaeus monodon from white spot syndrome virus [J]. Marine Biotechnology, 2008, 10(3): 242—249
[27]He F, Syed S M, Hameed A S, et al. Viral ubiquitin ligase WSSV222 is required for efficient white spot syndrome virus replication in shrimp [J]. Journal of General Virology, 2009, 90(6): 1483—1490
[28]Sarathi M, Simon M, Venkatesan C, et al. Efficacy of bacterially expressed dsRNA specific to different structural genes of white spot syndrome virus (WSSV) in protection of shrimp from WSSV infection [J]. Journal of Fish Diseases, 2010, 33(7): 603—607
[29]Attasart P, Kaewkhaw R, Chimwai C, et al. Inhibition of white spot syndrome virus replication in Penaeus monodon by combined silencing of viral rr2 and shrimp PmRab7 [J]. Virus Research, 2009, 145(1): 127—133
[30]Kulkarni A D, Caipang C M, Kiron V, et al. Evaluation of immune and apoptosis related gene responses using an RNAi approach in vaccinated Penaeus monodon during oral WSSV infection [J]. Marine Genomics, 2014, 18: 55—65
[31]Zhu F, Zhang X. The antiviral vp28-siRNA expressed in bacteria protects shrimp against white spot syndrome virus (WSSV) [J]. Aquaculture, 2011, 319(3): 311—314
[32]Sudhakaran R, Mekata T, Kono T, et al. Double stranded RNA mediated silencing of the white spot syndrome virus VP28 gene in kuruma shrimp, Marsupenaeus japonicus [J]. Aquaculture Research, 2011, 42(8): 1153—1162
[33]Ye T, Zong R, Zhang X. Involvement of interaction between viral VP466 and host tropomyosin proteins in virus infection in shrimp [J]. Gene, 2012, 505(2): 254—258
[34]Alenton R R R, Kondo H, Hirono I, et al. Gene silencing of VP9 gene impairs WSSV infectivity on Macrobrachium rosenbergii [J]. Virus Research, 2016, 214: 65—70
[35]Heng Z, Li G, Feng Y. RNA interference on vp15 gene of shrimp white spot syndrome virus (WSSV) [J]. Journal of Oceanography in Taiwan Strait, 2012, 31(1): 47—52
[36]Tirasophona W, Yodmuanga S, Chinnirunvonga W, et al. Therapeutic inhibition of yellow head virus multiplication in infected shrimps by YHV-protease dsRNA [J]. Antiviral Research, 2007, 74: 150—155
[37]Yodmuang S, Tirasophon W, Roshorm Y, et al. YHV-protease dsRNA inhibits YHV replication in Penaeus monodon and prevents mortality [J]. Biochemical and Biophysical Research Communications, 2006, 341(2): 351—356
[38]Posiri P, Ongvarrasopone C, Panyim S. Improved preventive and curative effects of YHV infection in Penaeus monodon by a combination of two double stranded RNAs [J]. Aquaculture, 2011, 314(1): 34—38
[39]Jatuyosporn T, Supungul P, Tassanakajon A, et al. The essential role of clathrin mediated endocytosis in yellow head virus propagation in the black tiger shrimp Penaeus monodon [J]. Developmental & Comparative Immunology, 2014, 44(1): 100—110
[40]Senapin S, Phiwsaiya K, Anantasomboon G, et al. Knocking down a Taura syndrome virus (TSV) binding protein Lamr is lethal for the whiteleg shrimp Penaeus vannamei [J]. Fish & Shellfish Immunology, 2010, 29(3): 422—429
[41]Yao X, Wang L, Song L, et al. A Dicer-1 gene from white shrimp Litopenaeus vannamei: expression pattern in the processes of immune response and larval development [J]. Fish & Shellfish Immunology, 2010, 29(4): 565—570
[42]Chen Y H, Jia X T, Zhao L, et al. Identification and functional characterization of Dicer2 and five single VWC domain proteins of Litopenaeus vannamei [J]. Developmental & Comparative Immunology, 2011,35(6): 661—671
[43]Chen Y H, Zhao L, Jia X T, et al. Isolation and characterization of cDNAs encoding Ars2 and Pasha homologues, two components of the RNA interference pathway in Litopenaeus vannamei [J]. Fish & Shellfish Immunology, 2012, 32(2): 373—380
[44]Wang S, Chen A J, Shi L J, et al. TRBP and eIF6 homologue in Marsupenaeus japonicus play crucial roles in antiviral response [J]. Plos One, 2012, 7(1): e30057
[45]Labreuche Y, Warr G W. Insights into the antiviral functions of the RNAi machinery in penaeid shrimp [J]. Fish & Shellfish Immunology, 2013, 34(4): 1002—1010
[46]Xiao R, Chun L, Ronan E A, et al. RNAi interrogation of dietary modulation of development, metabolism, behavior, and aging in C. elegans [J]. Cell Reports, 2015, 11(7): 1123—1133
[47]Chikate Y R, Dawkar V V, Barbole R S, et al. RNAi of selected candidate genes interrupts growth and development of Helicoverpa armigera [J]. Pesticide Biochemistry and Physiology, 2016, DOI: 10.1016/j.pestbp. 2016.03.006
[48]Bhassu S, Maningas M B, Othman R Y. Myostatin: a potential growth regulating gene in giant river prawn, Macrobrachium rosenbergii [J]. Journal of the World Aquaculture Society, 2015, 46(6): 624—634
[49]Shen W, Ren G, Zhu Y, et al. Characterization of MSTN/GDF11 gene from shrimp Macrobrachium nipponense and its expression profiles during molt cycle and after eyestalk ablation [J]. Genes & Genomics, 2015, 37(5): 441—449
[50]De Santis C, Wade N M, Jerry D R, et al. Growing backwards: an inverted role for the shrimp ortholog of vertebrate myostatin and GDF11 [J]. Journal of Experimental Biology, 2011, 214(16): 2671—2677
[51]Lee J H, Momani J, Kim Y M, et al. Effective RNA silencing strategy of Lv-MSTN/GDF11 gene and its effects on the growth in shrimp, Litopenaeus vannamei [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2015, 179: 9—16
[52]Sharabi O, Ventura T, Manor R, et al. Epidermal growth factor receptor in the prawn Macrobrachium rosenbergii: Function and putative signaling cascade [J]. Endocrinology, 2013, 154(9): 3188—3196
[53]Hughes C L, Kaufman T C. Hox genes and the evolution of the arthropod body plan [J]. Evolution & Development, 2002, 4(6): 459—499
[54]Copf T, Rabet N, Averof M. Knockdown of spalt function by RNAi causes derepression of Hox genes and homeotic transformations in the crustacean Artemia franciscana [J]. Developmental Biology, 2006, 298(1): 87—94
[55]Liubicich D M, Serano J M, Pavlopoulos A, et al. Knockdown of Parhyale Ultrabithorax recapitulates evolutionary changes in crustacean appendage morphology [J]. Proceedings of the National Academy of Sciences, 2009, 106(33): 13892—13896
[56]Kato Y, Shiga Y, Kobayashi K, et al. Development of an RNA interference method in the cladoceran crustacean Daphnia magna [J]. Development Genes and Evolution, 2011, 220(12): 337—345
[57]Chang E S, Mykles D L. Regulation of crustacean molting: a review and our perspectives [J]. General and Comparative Endocrinology, 2011, 172(3): 323—330
[58]Shen H, Zhou X, Bai A, et al. Ecdysone receptor gene from the freshwater prawn Macrobrachium nipponense: identification of different splice variants and sexually dimorphic expression, fluctuation of expression in the molt cycle and effect of eyestalk ablation [J]. General and Comparative Endocrinology, 2013, 193(1): 86—94
[59]Pamuru R R, Rosen O, Manor R, et al. Stimulation of molt by RNA interference of the molt inhibiting hormone in the crayfish Cherax quadricarinatus [J]. General and Comparative Endocrinology, 2012, 178(2): 227—236
[60]Jiang F W. The study of RNAi technology and its application in function study of molt-inhibiting hormone gene (MIH) in Macrobrachium nipponense [D]. Nanjing Agriculture University. Nanjing. 2014 [江丰伟. 青虾RNAi技术的研究及其在蜕皮抑制激素(MIH)基因功能研究中的应用. 南京农业大学, 南京. 2014]
[61]Techa S, Chung J S. Ecdysteroids regulate the levels of molt inhibiting hormone (MIH) expression in the Blue Crab, Callinectes sapidus [J]. Plos One, 2015, 10(4): e0117278
[62]Techa S. The functional importance and significance of ecdysteroids in molt cycle regulation of the blue crab, Callinectes sapidus [D]. Maryland, The University of Maryland. 2014
[63]Priya T J, Li F, Zhang J, et al. Molecular characterization and effect of RNA interference of retinoid X receptor (RXR) on E75 and chitinase gene expression in Chinese shrimp Fenneropenaeus chinensis [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2009, 153(1): 121—129
[64]Priya T, Li F, Zhang J, et al. Molecular characterization of an ecdysone inducible gene E75 of Chinese shrimp Fenneropenaeus chinensis and elucidation of its role in molting by RNA interference [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2010, 156(3): 149—157
[65]Qian Z, He S, Liu T, et al. Identification of ecdysteroid signaling late response genes from different tissues of the Pacific white shrimp, Litopenaeus vannamei [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2014, 172(6): 10—30
[66]Wen D, Rivera-Perez C, Abdou M, et al. Methyl farnesoate plays a dual role in regulating Drosophila metamorphosis [J]. Plos Genet, 2015, 11(3): e1005038
[67]Xie X, Tao T, Liu M, et al. The potential role of juvenile hormone acid methyltransferase in methyl farnesoate (MF) biosynthesis in the swimming crab, Portunus trituberculatus [J]. Animal Reproduction Science, 2016, 168: 40—49
[68]Hui J H L, Tobe S S, Chan S M. Characterization of the putative farnesoic acid methyltransferase (Lv-FAMeT) cDNA from white shrimp, Litopenaeus vannamei: Evidence for its role in molting [J]. Peptides, 2008, 29(2): 252—260
[69]Das S, Durica D S. Ecdysteroid receptor signaling disruption obstructs blastemal cell proliferation during limb regeneration in the fiddler crab, Uca pugilator [J]. Molecular and Cellular Endocrinology, 2013, 365(2): 249—259
[70]Peng T, Wang D, Yu Y, et al. Identification and expression of an ecdysteroid-responsive amylase from red crayfish Procambarus clarkii [J]. Fisheries science, 2015, 81(2): 345—352
[71]Shen H, Hu Y, Zhang Y, et al. Calcium calmodulin dependent protein kinase I from Macrobrachium nipponense: cDNA cloning and involvement in molting [J]. Gene, 2014, 538(2): 235—243
[72]Bai H, Qiao H, Li F, et al. Molecular characterization and developmental expression of vitellogenin in the oriental river prawn Macrobrachium nipponense and the effects of RNA interference and eyestalk ablation on ovarian maturation [J]. Gene, 2015, 562(1): 22—31
[73]Tiu S H K, Benzie J, Chan S M. From hepatopancreas to ovary: molecular characterization of a shrimp vitellogenin receptor involved in the processing of vitellogenin [J]. Biology of Reproduction, 2008, 79(1): 66—74
[74]Bai H, Qiao H, Li F, et al. Molecular and functional characterization of the vitellogenin receptor in oriental river prawn, Macrobrachium nipponense [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2016, 194: 45—55
[75]Treerattrakool S, Panyim S, Chan S M, et al. Molecular characterization of gonad-inhibiting hormone of Penaeus monodon and elucidation of its inhibitory role in vitellogenin expression by RNA interference [J]. FEBS Journal, 2008, 275(5): 970—980
[76]Treerattrakool S, Panyim S, Udomkit A. Induction of ovarian maturation and spawning in Penaeus monodon broodstock by double-stranded RNA [J]. Marine Biotechnology, 2011, 13(2): 163—169
[77]So K Y. Gene organization of the lobster (Homarus americanus) Gonad inhibiting hormone, and its functional analysis in relation to vitellogenesis byRNA interference [D]. the University of Hong Kong, Hong Kong. 2008
[78]Feijó R G, Braga A L, Lanes C F, et al. Silencing of gonad inhibiting hormone transcripts in Litopenaeus vannamei females by use of the RNA interference technology [J]. Marine Biotechnology, 2016, 18(1): 117—123
[79]Tiu S H K, Chan S M. The use of recombinant protein and RNA interference approaches to study the reproductive functions of a gonad stimulating hormone from the shrimp Metapenaeus ensis [J]. FEBS Journal, 2007, 274(17): 4385—4395
[80]Gong J, Ye H, Xie Y, et al. Ecdysone receptor in the mud crab Scylla paramamosain: a possible role in promoting ovarian development [J]. Journal of Endocrinology, 2015, 224(3): 273—287
[81]Nagaraju G P C, Rajitha B, Borst D W. Molecular cloning and sequence of retinoid X receptor in the green crab Carcinus maenas: a possible role in female reproduction [J]. Journal of Endocrinology, 2011, 210(3): 379—390
[82]Yang S P, He J G, Sun C B, et al. Characterization of the shrimp neuroparsin (MeNPLP): RNAi silencing resulted in inhibition of vitellogenesis [J]. FEBS Open Bio, 2014, 4(1): 976—986
[83]Dai W, Qiu L, Zhao C, et al. Characterization, expression and silencing by RNAi of p53 from Penaeus monodon [J]. Molecular Biology Reports, 2016, 43(6): 549—561
[84]Chan S F, He J G, Chu K H, et al. The shrimp heat shock cognate 70 functions as a negative regulator in vitellogenin gene expression [J]. Biology of Reproduction, 2014, 91(1): 14
[85]Yang F, Qian Y, Ma W, et al. MSG is involved in sperm gelatinolytic activity in the prawn, Macrobrachium rosenbergii [J]. Chinese Science Bulletin, 2013, 58(18): 2113—2118
[86]Ma W M, Qian Y Q, Wang M R, et al. A novel terminal ampullae peptide is involved in the proteolytic activity of sperm in the prawn, Macrobrachium rosenbergii [J]. Reproduction, 2010, 140(2): 235—245
[87]Kato Y, Kobayashi K, Watanabe H, et al. Environmental sex determination in the branchiopod crustacean Daphnia magna: deep conservation of a Doublesex gene in the sex determining pathway [J]. Plos Genet, 2011, 7(3): e1001345
[88]Rosen O, Manor R, Weil S, et al. A sexual shift in-duced by silencing of a single insulin like gene in crayfish: ovarian upregulation and testicular degeneration [J]. Plos One, 2010, 5(12): e15281
[89]Ventura T, Manor R, Aflalo E D, et al. Expression of an androgenic gland specific insulin like peptide during the course of prawn sexual and morphotypic differentiation [J]. ISRN Endocrinology, 2011, 476283: 1—13
[90]Ventura T, Manor R, Aflalo E, et al. Timing sexual differentiation: full functional sex reversal achieved in Macrobrachium rosenbergii through silencing of a single insulin like gene [J]. Biology of Reproduction, 2012, 86(3): 81—89
[91]Lezer Y, Aflalo E D, Manor R, et al. On the safety of RNAi usage in aquaculture: The case of all male prawn stocks generated through manipulation of the insulin like androgenic gland hormone [J]. Aquaculture, 2015, 435: 157—166
[92]Li F, Bai H, Xiong Y, et al. Molecular characterization of insulin like androgenic gland hormone-binding protein gene from the oriental river prawn Macrobrachium nipponense and investigation of its transcriptional relationship with the insulin like androgenic gland hormone gene [J]. General and Comparative Endocrinology, 2015, 216: 152—160
[93]Lugo J M, Morera Y, Rodríguez T, et al. Molecular cloning and characterization of the crustacean hyperglycemic hormone cDNA from Litopenaeus schmitti [J]. FEBS Journal, 2006, 273(24): 5669—5677
[94]Manfrin C, Peruzza L, Bonzi L, et al. Silencing two main isoforms of crustacean hyperglycemic hormone (CHH) induces compensatory expression of two CHH like transcripts in the red swamp crayfish Procambarus clarkii [J]. Invertebrate Survival Journal, 2015, 12(17): 29—37
[95]Soñanez J G, Racotta I S, Yepiz G. Silencing of the hypoxia inducible factor 1(HIF-1) obliterates the effects of hypoxia on glucose and lactate concentrations in a tissue-specific manner in the shrimp Litopenaeus vannamei [J]. Journal of Experimental Marine Biology and Ecology, 2010, 393(1): 51—58
[96]Soñanez-Organis J G, Peregrino-Uriarte A B, Sotelo-Mundo R R, et al. Hexokinase from the white shrimp Litopenaeus vannamei: cDNA sequence, structural protein model and regulation via HIF-1 in response to hypoxia [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2011, 158(3): 242—249
[97]Cota-Ruiz K, Leyva-Carrillo L, Peregrino-Uriarte A B, et al. Role of HIF-1 on phosphofructokinase and fructose 1, 6 bisphosphatase expression during hypoxia in the white shrimp Litopenaeus vannamei [J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2016, 198: 1—7
[98]Tiu S H, He J G, Chan S M. The LvCHH-ITP gene of the shrimp (Litopenaeus vannamei) produces a widely expressed putative ion transport peptide (LvITP) for osmo regulation [J]. Gene, 2007, 396(2): 226—235
[99]Pham D, Charmantier G, Boulo V, et al. Ontogeny of osmoregulation in the Pacific blue shrimp, Litopenaeus stylirostris (Decapoda, Penaeidae): Deciphering the role of the Na+/K+-ATPase [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2016, 196: 27—37
[100]Tian H F, Meng Y, Xiao H B. Advances in vitellogenin research of aquatic animals [J]. South China Fisheries Science, 2014, 10(4): 91—96 [田海峰, 孟彦, 肖汉兵. 水生动物卵黄蛋白原研究新进展. 南方水产科学, 2014, 10(4): 91—96]
[101]Webster S G, Keller R, Dircksen H. The CHH-superfamily of multifunctional peptide hormones controlling crustacean metabolism, osmoregulation, moulting, and reproduction [J]. General and Comparative Endocrinology, 2012, 175(2): 217—233
[102]Hopkins P M. The eyes have it: A brief history of crustacean neuroendocrinology [J]. General and Comparative Endocrinology, 2012, 175(3): 357—366
[103]Han K H, Zhang Z P, Wang Y L, et al. Cyclin-CDKCKI and UPP participate in the regulation of reproduction and the progression of gonad development in crustacean [J]. Biotechnology Bulletin, 2010, 7: 48—54 [韩坤煌, 张子平, 王艺磊, 等. Cyclin-CDK-CKI 及 UPP参与生殖调控及在甲壳动物性腺发育中的研究进展.生物技术通报, 2010, 7: 48—54]
[104]Picard A L, Cosseau C, Mouahid G, et al. The roles of Dmrt (Double sex/Male-abnormal-3 Related Transcription factor) genes in sex determination and differentiation mechanisms: Ubiquity and diversity across the animal kingdom [J]. Comptes Rendus Biologies, 2015, 338: 451—462
[105]Li F, Bai H, Zhang W, et al. Cloning of genomic sequences of three crustacean hyperglycemic hormone superfamily genes and elucidation of their roles of regulating insulin like androgenic gland hormone gene [J]. Gene, 2015, 561(1): 68—75
[106]Yu Y Q, Ma W M, Zeng Q G, et al. Molecular cloning and sexually dimorphic expression of two dmrt genes in the fiant freshwater prawn, Macrobrachium rosenbergii [J]. Agricultural Research, 2014, 3(2): 181—191
[107]Stein A J, Rodríguez-Cerezo E. International trade and the global pipeline of new GM crops [J]. Nature Biotechnology, 2010, 28(1): 23—25
[108]Treerattrakool S, Chartthai C, Phromma-in N, et al. Silencing of gonad-inhibiting hormone gene expression in Penaeus monodon by feeding with GIH dsRNA-enriched Artemia [J]. Aquaculture, 2013, 404: 116—121
[109]Förstemann K, Horwich M D, Wee L, et al. Drosophila microRNAs are sorted into functionally distinct argonaute complexes after production by dicer-1 [J]. Cell, 2007, 130(2): 287—297
[110]Huang T, Xu D, Zhang X. Characterization of host microRNAs that respond to DNA virus infection in a crustacean [J]. BMC Genomics, 2012, 13(1): 159—169
[111]Huang T, Zhang X. Functional analysis of a crustacean microRNA in host-virus interactions [J]. Journal of Virology, 2012, 86(23): 12997—13004
RESEARCH PROGRESS OF RNA INTERFERENCE IN CRUSTACEANS
LI Fa-Jun1,2, FU Chun-Peng1, LI Ming-Shuang3, LI Qun-Feng1and FU Hong-Tuo2
(1. Weifang University of Science and Technology, Shouguang 262700, China; 2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China; 3. National Fisheries Technical Extension Center, Beijing 100125, China)
RNA interference (RNAi) is a post-transcriptional gene regulatory mechanism induced by the specific double-stranded RNA (dsRNA) in eukaryotes. RNAi technology is widely used in the genomic studies of nematode, fruit fly, zebra fish and mice. Recently, significant advancement has also been made in the crustacean research by using the RNAi technology. This review summarizes recent discovery and progress focusing on immunity, growth and development, molting, reproduction, sex differentiation, osmoregulation and metabolism. Finally, the development prospect of RNAi technology usage in crustacean is previewed. The aim of this review is to provide basic scope for studying gene functions and regulatory mechanisms in crustacean.
RNA interference; Gene silencing; Crustaceans; Gene function; Regulatory mechanism
Q137
A
1000-3207(2017)02-0460-13
10.7541/2017.58
2016-06-07;
2016-08-21
国家自然科学基金(31572617); 国家“十二五”科技支撑计划(2012BAD2604-05); 山东省自然科学基金面上项目(ZR2016CM12);中央级基本科研业务费专项(2015JBFM11); 江苏省农业科技自主创新资金(CX(15)1012-4); 江苏省水产三新工程(D2015-16);无锡市科技发展资金(CLE02N1514)资助 [Supported by the National Natural Science Foundation of China (Grant No. 31572617); the National Science & Technology Supporting Program of the 12th Five-year Plan of China (2012BAD26B04-05); Shandong Provincial Natural Science Foundation (ZR2016CM12); the Freshwater Fisheries Research Center, China Central Governmental Research Institutional Basic Special Research Project from the Public Welfare Fund (2015JBFM11), Fund of Independent Innovation of Agricultural Sciences of Jiangsu Province (CX (15)1012-4); the three aquatic projects of Jiangsu Province (D2015-16); the Science and Technology Development Fund of Wuxi (CLE02N1514)]
李法君(1976—), 男, 山东寿光人; 博士; 主要研究方向为水产动物遗传育种。E-mail: lifajun1976@163.com
傅洪拓(1964—), 男, 博士, 研究员; 研究方向为水产动物遗传育种。E-mail: fuht@ffrc.cn
