紊流扰动对水华鱼腥藻细胞生理的影响
2017-04-12遐肖艳石锦安李哲王舒孙
高 遐肖 艳石锦安李 哲王 舒孙 莹
(1. 四川农业大学风景园林学院, 成都 611130; 2. 中国科学院重庆绿色智能技术研究院, 重庆 400714; 3. 中国科学院水库水环境重点实验室, 重庆 400714; 4. 山东药品食品职业学院, 威海 264200)
紊流扰动对水华鱼腥藻细胞生理的影响
高 遐1,2,3肖 艳2,3石锦安1李 哲2,3王 舒2,3孙 莹4
(1. 四川农业大学风景园林学院, 成都 611130; 2. 中国科学院重庆绿色智能技术研究院, 重庆 400714; 3. 中国科学院水库水环境重点实验室, 重庆 400714; 4. 山东药品食品职业学院, 威海 264200)
三峡水库成库以来, 支流回水区频繁出现水华现象,成为近10年来我国水库生态学领域研究热点[1]。水流条件是水华形成的主要诱导因素之一[2], 合适的流速条件能给藻类生长营造有利的外部环境[3]。温度、光照和营养盐是影响藻类生长的重要环境因子, 在自然水体中随着深度的变化而变化[4]。普遍认为, 紊流扰动通过改变藻类在水体中的相对位置和分布, 从而改变藻类生长的环境因子, 间接影响藻类生长[5,6]。已有研究表明, 紊流扰动不仅间接影响藻类在水体中的相对位置, 且对藻类生理有直接影响[7—9]。水华鱼腥藻(Anabaena flosaquae)是典型的有害水华藻种[10], 易在氮相对匮乏、磷相对丰足的水体中形成优势, 在大量湖泊、水库中均有发现。其生长总体受磷限制, 生长速率与无机态磷吸收显著相关[11]。
本研究在控制其他外界条件相同的基础上, 比较研究紊流扰动条件的有无对水华鱼腥藻细胞生理、磷吸收与磷储存及形态的影响, 旨在为水华的防治和控制提供理论依据。
1 材料与方法
1.1 藻种及藻种培养
实验选用的水华鱼腥藻FACHB 245(Anabaena flosaquae)购自中国科学院水生生物研究所淡水藻种库(FACHB-collection)。实验前进行水华鱼腥藻扩大培养后, 将藻细胞离心收集, 用无磷的BG11培养基洗涤去除藻细胞表面吸附的磷, 重复洗涤、离心3次, 转入无磷培养基, 饥饿培养10d以消耗细胞内积蓄的磷, 即可作为实验用藻种。
将经过饥饿培养的藻离心收集, 重复洗涤离心3次,接入新鲜培养基。实验采用的BG11培养基, 磷浓度为2 mg/L。将稀释后的藻液搅匀, 分别取1000 mL藻液于2个1 L烧杯中, 采用六联搅拌反应器, 实验组设置转速为400 r/min, 对照组则为0, 在温度28℃, 光照强度50 μmol/ (m2·s), 光周期12∶12h条件下进行单批次培养。通过Fluent模型建立及换算, 已知400 r/min对应的紊流耗散率为6.65×10-5m2/s3, 科莫尺度(Kolmogorov microscale)为0.34 mm, 在自然水体中属较高水平[12,13]。
1.2 测定指标及方法
分别于接种后0、0.5d、1d、1.5d、2d、2.5d、3d、5d、7d和9d取新鲜藻液, 进行细胞密度的测定。于接种后0和9d时取新鲜藻液4 mL进行胞内总磷含量的测定。于9d时进行形态指标、光合活性和溶解性磷酸盐测定。由于取样量较少, 相对于培养液总体积可以近似认为符合实验过程中“无底物和菌体的供应和移走”的要求。对照组藻细胞存在自然沉降现象, 取样前适当搅拌使藻液混合均匀。
细胞密度与比生长速率细胞密度反应水华鱼腥藻的生物量变化。取1 mL藻液, 加入鲁哥试剂, 超声波(功率90 W, 开2s关2s循环共计10s)将藻丝破碎后, 使用血球计数板在显微镜下进行测定。比生长速率根据以下公式计算得到[14]:

其中N表示每1 mL藻液中藻细胞数, t为取样时间。
光合作用活性光合作用活性取最大光化学量子产量Fv/Fm、叶绿素含量Chl. a。取2 mL藻液, 暗适应5 min后用Phyto-PAM浮游植物分析仪测定。
磷吸收与磷储存溶解性磷酸盐(SRP)和胞内总磷(TCP)均采用国标法(钼蓝显色法)测定。根据单位细胞内TCP含量, 根据以下公式计算磷吸收速率[15]:

其中W为胞内总磷含量, N为细胞密度, t为取样时间间隔。
形态指标取水华鱼腥藻藻丝长度和单个细胞长宽。取藻液制作临时装片, 使用显微镜结合Mshot显微拍照软件, 每个样本随机选取50个群体进行拍摄, 用校准好的明美显微数码测量分析系统测量并统计。由于水华鱼腥藻细胞近似椭球形, 其比表面积(sv-1)计算公式如下:

其中w表示细胞宽度, l表示细胞长度。
1.3 数据处理
所有样品测定指标均作三组平行。采用Origin 9.0进行实验数据的统计分析和图表绘制。用ANOVA双尾检验分析数据显著差异性, P<0.05表示显著性差异。数据采用平均值±标准误表示。
2结果与讨论
2.1 紊流扰动对水华鱼腥藻生长的影响
指数生长期, 实验组(0.34 mm)水华鱼腥藻细胞密度始终高于对照组(图 1)。实验组和对照组9d时细胞密度分别为2.28×107和1.24×107cell/mL, 实验组细胞密度几乎是对照组的两倍。从藻类生长周期来看, 对照组1—5d处于指数生长期, 增殖快速, 5—9d为稳定期, 生物量略微降低; 而实验组1—7d均呈指数生长, 相比对照组生长周期延长。
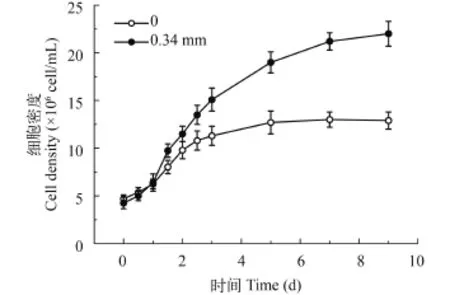
图 1 紊流扰动下水华鱼腥藻细胞密度变化Fig. 1 Cell density of Anabaena flos-aquae under turbulence
同样, 实验组水华鱼腥藻比生长速率明显高于对照组(ANOVA, P<0.05)。指数生长期, 实验组和对照组比生长速率分别为0.216/d和0.109/d, 实验组比生长速率几乎是对照组的两倍。
结果表明紊流扰动显著促进水华鱼腥藻的生长。
2.2 紊流扰动对细胞尺寸与藻丝长度的影响
在紊流扰动条件下, 水华鱼腥藻单个细胞平均长度、宽度及长宽比均发生了变化(表 1)。选取指数生长期进行比较, 发现实验组藻细胞平均长度相比对照组减小了22.2%, 而平均宽度增加了4.5%, 长宽比减小了25.9%。
进一步对实验组和对照组水华鱼腥藻藻细胞比表面积进行比较发现, 实验组和对照组藻细胞比表面积分别为0.84±0.075和0.98±0.082, 实验组相比对照组增加了16.7%。
细胞能够通过调节自身大小和形状以应对和适应环境变化[16]。细胞大小变化伴随着细胞比表面积的变化,细胞体积减小, 比表面积增大[17]。普遍认为, 细胞营养盐吸收速率取决于细胞比表面积大小, 细胞通过减小自身尺寸实现营养盐吸收速率最大化[18,19]。紊流扰动下水华鱼腥藻细胞大小的显著变化(图 2)是其适应紊流扰动环境的一种生存策略, 通过减小细胞尺寸, 增大营养盐吸收速率。

表 1 紊流扰动下指数生长期水华鱼腥藻细胞平均长度、宽度及比表面积Tab. 1 Cell length, width and surface-to-volume ratio of Anabaena flos-aquae under turbulence

图 2 紊流扰动下水华鱼腥藻细胞尺寸变化Fig. 2 Morphological changes of Anabaena flos-aquae under turbulence
经统计分析发现, 实验组(0.34 mm)和对照组(0)藻丝平均长度均随时间变化。实验组和对照组藻丝平均长度分别为(108.2±8.6)和(147.2±11.7) μm, 实验组相比对照组藻丝平均长度缩短了26.5%, 差异显著(ANOVA, P<0.05)。如图 3所示, 在紊流扰动条件下, 实验组不同长度藻丝所占比例相比对照组发生了明显的变化, 实验组0—100 μm群体数量明显多于对照组。
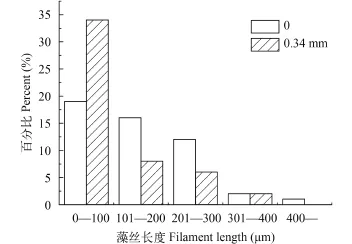
图 3 紊流扰动下水华鱼腥藻藻丝长度频数分布图Fig. 3 Frequency distribution plot of filament length of Anabaena flos-aquae under turbulence
这与Thomas等[20]的研究结果一致, 在紊流扰动条件下培养的项圈藻藻丝长度短于静置水体。一些学者认为紊流扰动造成细胞机械损伤从而导致藻丝变短[21], 在本实验中, 实验组和对照组12h时藻丝长度无明显差异(分别为112和110 μm), 且与0相比略微变长(分别为105和104 μm), 可以认为, 实验采用的紊流扰动强度不会造成机械损伤导致藻丝变短。由于蓝藻藻丝长度与其自身浮力调节机制密切相关[22,23], 藻丝长度变化可能是其对紊流扰动环境的响应。
2.3 紊流扰动对水华鱼腥藻光合作用的影响
通过实验组和对照组光合作用活性的比较分析(表2), 结果表明实验组与对照组最大光化学量子产量Fv/Fm无显著差异(ANOVA, P>0.05), 同时单位细胞内叶绿素含量Chl. a差异不显著(ANOVA, P>0.05), 因此可以认为,紊流扰动对水华鱼腥藻光合作用影响不显著。同时, 实验初期水华鱼腥藻光合活性Fv/Fm为0.270±0.018, 实验结束时(9d)对照组和实验组Fv/Fm分别为0.275±0.019和0.260±0.015, 未发生明显变化, 表明实验过程中营养盐始终充足, 未对细胞生理构成胁迫。

表 2 紊流扰动下水华鱼腥藻光合作用活性及叶绿素含量变化Tab. 2 Photosynthesis activity and Chl. a content of Anabaena flos-aquae under turbulence
该结果与Thomas等[24]的研究结果一致, 表明紊流扰动对藻细胞光合机构无显著影响。但Wang等[26]研究发现, 不同藻种在相同强度的紊流扰动下, 光合活性受到不同程度的影响, 一些藻种则完全不受紊流扰动影响。
紊流扰动对水华鱼腥藻光合作用无显著影响, 可以认为紊流扰动并非通过促进光合作用加快藻细胞生长速率, 可能通过促进藻细胞营养盐吸收等其他代谢途径, 促进水华鱼腥藻的生长。
2.4 紊流扰动对水华鱼腥藻磷吸收速率的影响
在紊流扰动条件下, 实验组培养液中溶解性磷酸盐(SRP)含量相比对照组降低了13.5% (表 3), 紊流扰动促进了水华鱼腥藻对磷元素的吸收。同时对单位细胞内总磷含量(TCP)进行测定, 紊流扰动下水华鱼腥藻单位细胞内总磷含量显著低于对照组(ANOVA, P<0.05), 分别为0.276和0.174 pg/cell。

表 3 紊流扰动下水华鱼腥藻SRP、TCP及磷吸收速率Tab. 3 SRP, TCP and P uptake rate of Anabaena flos-aquae under turbulence
进一步根据细胞内总磷含量变化计算鱼腥藻磷吸收速率, 发现实验组磷吸收速率明显高于对照组, 分别为0.019和0.036 pg/(cell·d), 实验组相比对照组提高了89.5%。
该结果表明紊流扰动显著促进水华鱼腥藻藻细胞磷吸收速率, 这与Wang等[25]的研究结果一致。如前所述,紊流扰动下细胞尺寸变小, 比表面积增大, 细胞营养盐吸收速率加快, 可以认为, 磷吸收速率的增大可能是水华鱼腥藻通过调节自身形态大小以适应紊流扰动环境的结果。单位细胞内磷含量的减少, 可能是藻细胞快速生长带来的影响。
3结论
一定强度的紊流扰动能明显促进水华鱼腥藻的生长, 紊流扰动下藻细胞比生长速率是静置水体中的近两倍。
紊流扰动对水华鱼腥藻细胞光合活性及单位细胞内叶绿素含量影响不显著, 而对藻细胞磷吸收速率有显著的影响, 实验组藻细胞磷吸收速率相比对照组提高了89.5%, 可以认为紊流扰动对藻细胞生长的促进作用并非光合作用带来的影响, 而是通过促进细胞营养盐吸收,从而促进水华鱼腥藻的生长。
紊流扰动下水华鱼腥藻藻细胞形态发生显著变化,细胞尺寸减小, 比表面积增大。潜在机制是藻细胞通过减小细胞尺寸, 加快磷吸收速率以适应紊流扰动环境。磷吸收速率与细胞形态的显著变化为我们研究紊流扰动对藻类生长的影响提供了新的视角, 其生理机制有待进一步研究。
[1]Li Z. On the Habitats Transition & Succession Traits of Phytoplankton Assemblages in the Backwater Area of Xiaojiang River during Preliminary Operation Stage of the Three Gorges Reservoir [D]. Chongqing University, Chongqing. 2009 [李哲. 三峡水库运行初期小江回水区藻类生境变化与群落演替特征研究. 博士学位论文, 重庆大学, 重庆. 2009]
[2]Ren J, Jiang M S, Shang Z T, et al. Study on the meteorological condition of blue green algae fast growth in Lake Tai [J]. Journal of the Meteorological Sciences, 2008, 28(2): 221—226 [任健, 蒋名淑, 商兆堂, 等. 太湖蓝藻暴发的气象条件研究. 气象科学, 2008, 28(2): 221—226]
[3]Li Z, Zhang Z Y, Yang Z H, et al. Effects of flow speed on the change of in situ growth rates of algae in Pengxi River backwater zone of Three Gorges Reservoir [J]. Journal of Lake Sciences, 2015, 27(5): 880—886 [李哲,张曾宇, 杨中华, 等. 三峡澎溪河回水区流速对藻类原位生长速率的影响. 湖泊科学, 2015, 27(5): 880—886]
[4]Long T Y, Zhou P R, Wu L. The simulating experiment for the impacts of environmental factors on Spring algae growth in Xiang xi River [J]. China Environmental Science, 2011, 31(2): 327—331 [龙天渝, 周鹏瑞, 吴磊. 环境因子对香溪河春季藻类生长影响的模拟实验. 中国环境科学, 2011, 31(2): 327—331]
[5]Chai X Y. Behavior Study on the role of Irradiance and Temperature on the Algae Bloom of Typical Algae in Three-Gorges Valley [D]. Chongqing University, Chongqing. 2009 [柴小颖. 光照和温度对三峡库区典型水华藻类生长的影响研究. 硕士学位论文, 重庆大学,重庆. 2009]
[6]Liu C G, Jin X C, Qiu J Q, et al. Influence of interaction of light and phosphorus on growth of two species of algae in freshwaters [J]. China Environmental Science, 2005, 25(1): 32—36 [刘春光, 金相灿, 邱金泉, 等. 光照与磷的交互作用对两种淡水藻类生长的影响. 中国环境科学, 2005, 25(1): 32—36]
[7]Miki H, Alfred W. Do microscopic organisms feel turbulent flows [J]? Environmental Science & Technology, 2009, 43(3): 764—768
[8]Warnaars T A, Hondzo M. Small-scale fluid motion mediates growth and nutrient uptake of Selenastrum capricornutum [J]. Freshwater Biology, 2006, 51(6): 999—1015
[9]Leupold M, Hindersin S, Gust G, et al. Influence of mixing and shear stress on Chlorella vulgaris, Scenedesmus obliquus, and Chlamydomonas reinhardtii [J]. Journal of Applied Phycology, 2012, 25(2): 485—495
[10]Liu Y, Gao H Y, Li X Y, et al. Identification and determination of mycosporine-like amino acids (MAAS) in Dolichospermum flos-aquae [J]. Acta Hydrobiologica Sinica, 2015, 39(3): 549—553 [刘洋, 高合意, 李效宇,等. 水华鱼腥藻类菌胞素氨基酸的分子鉴定和化学检测. 水生生物学报, 2015, 39(3): 549—553]
[11]Li Z, Guo J S, Fang F, et al. Seasonal variation of cyanobacteria and its potential relationship with key environmental factors in Xiaojiang Backwater Area, Three Gorges Reservoir [J]. Acta Scientiae Circumstantiae, 2010, 31(2): 301—309 [李哲, 郭劲松, 方芳, 等. 三峡小江回水区蓝藻季节变化及其与主要环境因素的相互关系. 环境科学, 2010, 31(2): 301—309]
[12]Preston B L, Snell Twfields D M, Weissburg M J. The effects of fluid motion on toxicant sensitivity of the rotifer Brachionus calyciflorus [J]. Aquatic Toxicology, 2001, 52(2): 117—131
[13]Kiørboe T. Turbulence, phytoplankton cell size, and the structure of pelagic food webs [J]. Advances in Marine Biology, 1993, 29(1): 1—72
[14]Pirt S J. Principles of Microbe and Cell Cultivation [M]. Oxford: Blackwell Scientific Publications. 1975, 17—18
[15]Lobban C S, Chapman D J, Kremer B P. Experimental Phycology: a Laboratory Manual [M]. Cambridge University Press. 1988, 268
[16]Montgomery B L. Light-dependent governance of cellshape dimensions in cyanobacteria [J]. Frontiers in Microbiology, 2015, 6: 514
[17]Legendre L, Fèvre J L. Hydrodynamical singularities as controls of recycled versus export production in oceans [J]. Life Sciences Research Report, 1989, 44: 49—63
[18]Jezberová J, Komárková J. Morphometry and growth of three Synechococcus-like picoplanktic cyanobacteria at different culture conditions [J]. Hydrobiologia, 2007, 578(1): 17—27
[19]Young K D. The selective value of bacterial shape [J]. Microbiology & Molecular Biology Reviews, 2006, 70(3): 660—703
[20]Thomas W H, Gibson C H. Effects of small-scale turbulence on microalgae [J]. Journal of Applied Phycology, 1990, 2(1): 71—77
[21]Michels M H A, Goot A J V D, Norsker N H, et al. Effects of shear stress on the microalgae Chaetoceros muelleri [J]. Bioprocess & Biosystems Engineering, 2010, 33(8): 921—927
[22]Wallace B B, Bailey M C, Hamilton D P. Simulation of vertical position of buoyancy regulating Microcystis aeruginosa in a shallow eutrophic lake [J]. Aquatic Sciences, 2000, 62(4): 320—333
[23]Diehl S. Phytoplankton, light, and nutrients in a gradient of mixing depths: theory [J]. Ecology, 2002, 83(2): 386—398
[24]Thomas W H, Vernet M, Gibson C H. Effects of smallscale turbulence on photosynthesis, pigmentation, cell division, and cell size in the marine dinoflagellate Gomaulax polyedra [J]. Journal of Phycology, 1995, 31(1): 50—59
[25]Wang P, Shen H, Ping X. Can hydrodynamics change phosphorus strategies of diatoms? Nutrient levels and diatom blooms in lotic and lentic ecosystems [J]. Microbial Ecology, 2012, 63(2): 369—382
EFFECT OF SMALL-SCALE TURBULENCE ON CELL BIOLOGY OF ANABAENA FLOS-AQUAE
GAO Xia1,2,3, XIAO Yan2,3, SHI Jin-An1, LI Zhe2,3, WANG Shu2,3and SUN Ying4
(1. College of Landscape Architecture, Sichuan Agricultural University, Chengdu 611130, China; 2. Chongqing Institute of Green and Intelligent Technology, Chinese Academy of Sciences, Chongqing 400714, China; 3. CAS Key Laboratory on Reservoir Water Environment, Chinese Academy of Sciences, Chongqing 400714, China; 4. Department of Traditional Chinese Medicine, Shandong Drug And Food Vocational College, Weihai 264200, China)
紊流扰动; 水华鱼腥藻; 细胞生理
Small-scale turbulence; Anabaena flos-aquae; Cell biology
Q142
A
1000-3207(2017)02-0486-05
10.7541/2017.62
2016-04-18;
2016-07-18
国家自然科学基金项目(51309220); 重庆市基础科学和前沿技术研究专项重点项目(cstc2015jcyjBX0006)资助 [Supported by the National Natural Science Foundation of China (51309220); the Chongqing Natural Science Program (cstc2015jcyjBX0006)]
高遐(1992—), 女, 浙江丽水人; 硕士研究生; 主要研究方向为藻类生理生态。E-mail: gaoxia92@outlook.com; 肖艳(1984—), 女,湖北荆州人; 博士; 主要从事藻类生理生态学研究。 E-mail: yxiao@cigit.ac.cn共同第一作者
石锦安, E-mail: shija5778@126.com
