草鱼不同组织胆汁酸组成分析
2017-04-12晶李文祥邹红李明王桂堂吴山功
张 晶李文祥邹 红李 明王桂堂吴山功
(1. 中国科学院水生生物研究所, 中国科学院水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
草鱼不同组织胆汁酸组成分析
张 晶1,2李文祥1,2邹 红1李 明1,2王桂堂1,2吴山功1,2
(1. 中国科学院水生生物研究所, 中国科学院水生生物多样性与保护重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
胆汁酸是由胆固醇通过一系列酶促反应在肝细胞中合成的, 根据侧链羟基数目的多少胆汁酸分为初级胆汁酸和次级胆汁酸。初级胆汁酸随食物到达肠道, 在肠道微生物的作用下脱羟基形成次级胆汁酸[1]。初级胆汁酸和次级胆汁酸都可与牛磺酸或者甘氨酸结合形成结合型胆汁酸。肝脏中合成的以及经由肠肝循环回到肝脏的胆汁酸都被储存在胆囊中。胆汁酸的主要生理功能是帮助脂溶性营养物质的消化吸收, 高脂肪的摄入刺激胆汁酸合成酶基因的表达[2]。除此之外, 胆汁酸可作为信号分子调节能量代谢[3]。
草鱼(Ctenopharyngodon idellus)是重要的经济鱼类, 2013年我国草鱼养殖产量达到5.07×109kg[4]。草鱼养殖过程中受到各种病害的威胁, 其中肝胆综合症是目前草鱼养殖过程中危害严重的一种疾病[5]。患病草鱼肝脏颜色发白或发黄, 胆囊肿大, 但该病的发病机理尚不清楚。陆生脊椎动物的研究发现, 肝胆疾病的发生常伴随有胆汁酸的代谢异常[6], 例如肝硬化病人与健康人粪便胆汁酸含量相比差异显著[7]。胆汁酸可通过“肠-肝轴”调节肝细胞的代谢以及肝脏炎症进程, 在肝脏损伤和自我修复过程中起重要作用[8]。因此, 草鱼肝胆综合症的发生可能与胆汁酸含量的变化有关系, 但迄今我们对草鱼胆汁酸的研究尚处于空白。本研究运用超高效液相色谱-三重四级杆质谱联用仪测定草鱼体内胆汁酸含量, 为解析草鱼肝胆综合症发病机制提供基础数据。
1 材料与方法
1.1 仪器试剂
所用仪器为超高效液相色谱——三重四级杆质谱联用仪。标准曲线的制备需要以下标准品: 胆酸(Cholic acid, CA)、脱氧胆酸(Deoxycholic acid, DCA)、鹅脱氧胆酸(Chenodeoxycholic acid, CDCA)、熊脱氧胆酸(Ursodeoxycholic acid, UDCA)、甘氨酸结合胆酸(Glycocholic acid, G-CA)、石胆酸(Lithocholic acid, LCA)、甘氨酸结合熊脱氧胆酸(Glycoursodeoxycholic acid, G-UDCA)和甘氨酸结合石胆酸(Glycolithocholic acids, G-LCA)购自美国CATO, 牛磺酸结合脱氧胆酸盐(Sodium taurodeoxy-cholic, TDC)和牛磺酸结合鹅脱氧胆酸盐(Sodium taurochenodeoxycholic, TCDC)购自美国SIGMA, 甲醇、乙腈和乙酸铵为色谱纯, 购自美国TEDIA。样品处理过程中所用乙醇为分析纯, 购自中国上海国药。
1.2 样品采集及处理
2014年9月于武汉市水产科学研究所实验基地一鱼塘和武汉市江夏多福农场两鱼塘每个鱼塘取3条草鱼。3个取样点的平均体长分别为(50±1.3)、(39.8±0.6)和(43.8±0.9) cm, 平均体重分别为(1628.4±45.8)、(978.4± 77.6)和(1172.0±17.7) g。肥满度是反应鱼体肥瘦程度和生长情况的指标, 计算公式为K=(W/L3)×100其中W为体重(g), L为体长(cm)。
鱼体消毒后尾静脉取血, 无菌剥离肝脏、胆囊和肠道组织。将肝脏组织剪碎装入2 mL无菌离心管中, 并用注射器收集胆汁。草鱼肠道按照倪达书[9]方法分为前、中、后三段, 分别取中肠和后肠内容物混匀后装入5 mL离心管中。样品-80℃保存。
1.3 胆汁酸测定
肠道及肝脏样品的处理参考Hagio的方法[10]。称取100 mg磨碎后的样品加入1 mL乙醇, 超声破碎后加热使蛋白沉淀, 并用乙醇萃取3次, 将萃取液置于氮气流下, 35℃吹干。吹干后的样品复溶于200 μL甲醇中并用C18固相萃取小柱纯化。用冰乙腈沉淀法萃取血清中的胆汁酸。直接取100 μL胆汁样品用C18固相萃取小柱纯化。所有纯化后的样品需氮气吹干后定容, 4℃保存。
超高效液相色谱条件如下: 进样盘温度和柱温分别为10℃和40℃; 流动相流速为0.35 mL/min, 每次进样量5 μL。流动相A为10 mmoL/L乙酸铵, pH 4.0; 流动相B为乙腈, 流动相A的梯度程序(A%)为0—10min, 70%; 10—11min, 30%; 11—13min, 70%。质谱采用电喷雾电离模式, 检测模式为多反应检测; 毛细管电压为2500 V,脱溶剂气温度为350℃; 脱溶剂气大小为650 L/H。每种胆汁酸的质谱条件见表 1。
1.4 数据分析
所有数据用平均值±标准误(Mean±SE)的方式来表示。用SPSS 20进行统计学分析, 采用单因素方差分析(ANOVA)对实验结果进行统计, 如果检测到显著性差异,则采用Duncan多重比较, 用Pearson相关系数表示两个数据之间的相关性, P<0.05被认为差异显著。
2 结果
肝脏中初级胆汁酸检测到CA, 其平均浓度达到(728.68±303.11) ng/mg, 并未检测到CDCA; 在肝脏中没有检测到次级胆汁酸。胆汁中检测到的主要胆汁酸有初级胆汁酸CA和CDCA, 平均含量分别为(11.23±5.00)和(0.83±0.36) ng/μL; 次级胆汁酸DCA, 平均含量为(0.14± 0.07) ng/μL (图 1)。在个别胆汁样品中检测到G-CA、TDC和T-CDC, 所有胆汁样品中都没有检测到UDCA、LCA、G-UDCA和G-LCA。
肠道内容物中共检测到9种胆汁酸CA、CDCA、DCA、UDCA、LCA、T-CDC、T-DC、G-CA和G-UDCA。中肠和后肠内容物中主要胆汁酸是CA, 其平均含量分别为(6.54±2.30)和(1.23±0.57) ng/mg(图 2)。肠道检测到的主要次级胆汁酸是DCA和UDCA, 在中肠内容物中平均含量分别是(0.13±0.09)和(0.3±0.18) ng/mg; 在后肠内容物中平均含量分别是(0.08±0.04)和(0.2±0.09) ng/mg。只在个别肠道样品中检测到LCA, 但其结合物G-LCA则完全没有检测到。草鱼血清中没有检测到胆汁酸。
单因素方差分析显示中肠和后肠内容物中CA和GCA含量差异显著(P<0.05); CDCA、DCA、UDCA、TDC、T-CDC及G-UDCA含量差异不显著(P>0.05)。将草鱼的肥满度与所检测到的胆汁酸做相关性分析发现肥满度与胆汁中总胆汁酸含量呈负相关关系(r=-0.748, P<0.05)。进一步将草鱼肥满度与胆汁中初级胆汁酸做相关性分析发现肥满度与CA和CDCA的含量呈负相关关系(r=-0.741, P<0.05; r=-0.712, P<0.05)。除此之外, 肥满度与中肠内容物中CA含量也呈负相关关系(r=-0.698, P<0.05)。

表 1 不同种类胆汁酸的质谱条件Tab. 1 The mass spectrometry conditions of different bile acids
3 讨论
3.1 草鱼组织胆汁酸种类
人类肝脏合成CA与CDCA的量几乎相等, 但在老鼠和熊体内CDCA分别转化为m-CA(鼠胆酸)和UDCA[11]。本研究在草鱼肝脏中没有检测到CDCA, 但在胆汁中检测到了, 因此推测草鱼只合成少量的CDCA或者合成的CDCA部分转化为其他形式的胆汁酸。肝脏不能直接合成次级胆酸盐, 因此草鱼胆汁中检测到的次级胆汁酸DCA及T-DC为经过肠肝循环后被肝脏重新吸收的。

图 1 胆汁中主要胆汁酸含量Fig. 1 The concentration of bile acids in gallA为水产科学研究所试验基地鱼塘样品, B和C分别为江夏多福农场两个鱼塘A stands for the samples from the base of aquatic science institute. B and C represent for the samples from two ponds in Duo Fu farm, respectively
草鱼中肠内容物中CA与G-CA的含量显著高于后肠(P<0.05), 而次级胆汁酸DCA、UDCA、T-DC及GUDCA含量差异不显著, 证实胆汁酸在随食物经过肠道的过程中存在重吸收作用[12]。在肠道中, 一部分胆汁酸在微生物的作用下转变为次级胆汁酸, 产胆酸盐脱氢酶的细菌大多为拟杆菌门(Bacteroidetes)、芽孢杆菌属(Bacillus)、胃瘤球菌属(Rumminococcus)和大肠杆菌科(Enterobacteriaceae)的一些细菌[1], 而拟杆菌(Bacteroides)是草鱼肠道的优势类群[13,14], 草鱼肠道的DCA、UDCA、T-DC及G-UDCA可能主要是在拟杆菌的作用下生成的。
哺乳动物肠道次级胆汁酸主要是DCA和LCA[15], 我们的实验结果显示草鱼肠道主要次级胆汁酸是DCA和UDCA, 只在个别肠道样品中检测到LCA。胆汁中的次级胆汁酸DCA为经过肠肝循环后回到胆囊中的, 但在胆汁中并未检测到次级胆汁酸UDCA, 可能的原因是肠道对胆汁酸的吸收有一定的选择性[16]。
血液中的胆汁酸主要来自肠道的吸收, 但血液中的胆汁酸会被肝脏快速吸收, 血液中胆汁酸的含量通常很低(小于10 μmol/L)[17]。我们的研究在草鱼血清中没有发现胆汁酸, 这可能是由于草鱼血清胆汁酸含量较低而没有检测到的缘故。
3.2 草鱼肥满度与胆汁酸含量的关系
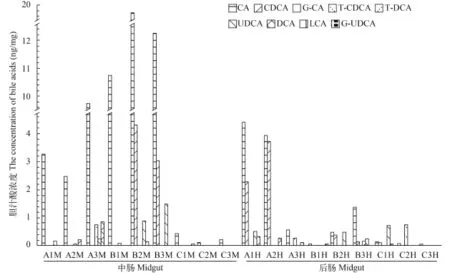
图 2 肠道胆汁酸含量Fig. 2 The concentration of bile acids in intestinal图M为中肠内容物胆汁酸含量, 图H后肠样品胆汁酸含量; A, B, C为三个取样点M and H described the concentrations of bile acids in the midgut and hindgut respectively. A, B and C stand for the three sampling points
草鱼肝胆综合症的主要原因之一是营养物质的过度积累。研究表明CA具有调节能量消耗的作用[18]。本研究将草鱼的肥满度与所检测到的胆汁酸做相关性分析,发现肥满度与胆囊中胆汁酸含量呈负相关关系, 进一步研究发现胆汁中CA和CDCA含量与肥满度呈负相关关系, 即鱼越胖体内CA和CDCA含量越低。这个结果与Suzuki等[19]的研究一致, 他们发现正常人体脂含量与体内胆汁酸含量呈负相关关系; 另外, 在牛蛙的饲料中添加一定量的胆汁酸, 可降低牛蛙的体脂含量[20]。本研究说明若在饲料中添加适量的CA或CDCA, 则可以调节草鱼的能量代谢, 减少脂肪在草鱼肝脏的积累, 从而可以降低草鱼肝胆综合症的发病率。
[1]Ridlon J M, Kang D J, Hylemon P B. Bile salt biotransformations by human intestinal bacteria [J]. Journal of Lipid Research, 2006, 47(2): 241—259
[2]Ye Y T, Cai C F, Xu F, et al. Feeding grass carp (Ctenopharyngodon idellus) with oxidized fish oil up-regulates the gene expression in the cholesterol and bile acid synthesis pathway in intestinal mucosa [J]. Acta Hydrobiologica Sinica, 2015, 39(1): 90—100 [叶元土, 蔡春芳, 许凡, 等. 灌喂氧化鱼油使草鱼肠道黏膜胆固醇胆汁酸合成基因通路表达上调. 水生生物学报, 2015, 39(1): 90—100]
[3]Chiang J Y L. Bile acids: regulation of synthesis [J]. Lipid Research, 2009, 50(10): 1955—1966
[4]Chinese Fishery Statistical Yearbook [M]. Beijing: Chinese Agricultural Press. 2014, 31 [中国渔业统计年鉴. 北京: 中国农业出版社. 2014, 31]
[5]Liu Q. Pathological changes of grass carp (Ctenopharyngodon idellus) with hepatobiliary syndrome and the toxicity of rapeseed meal on liver of grass carp [D]. Thesis for Master of Science. Huazhong Agricultural University, Wuhan. 2009 [刘迁. 草鱼“肝胆综合症”病理变化及菜籽粕对其肝脏毒性的研究.硕士学位论文, 华中农业大学, 武汉, 2009]
[6]Ridlon J M, Alves J M, Hylemon P B, et al. Cirrhosis, bile acids and gut microbiota: unraveling a complex relationship [J]. Gut Microbes, 2013, 4(5): 382—387
[7]Kakiyama G, Patrick W M, Gillevet P M, et al. Modulation of the fecal bile acids profile by gut microbiota in cirrhosis [J]. Journal of Hepatology, 2013, 58(5): 949—955
[8]Liu H X, Keane R, Sheng L, et al. Implications of microbiota and bile acid in liver injury and regeneration [J]. Journal of Hepatology, 2015, 63(6): 1502—1510
[9]Ni D S, Wang J G. Biology and Disease of Grass Carp [M]. Beijing: Science Press, 1999, 29—33 [倪达书, 汪建国. 草鱼生物学与疾病. 北京: 科学出版社, 1999, 29—33]
[10]Hagio M, Matsumoto M, Ishizuka S. Bile acid analysis in various biological samples using ultra performance liquid chromatography/electrospray ionization-mass spectrometry (UPLC/ESI-MS) [J]. Metabolic Profiling: Methods and Protocols, 2011, (708): 119—129
[11]Chiang J Y L. Regulation of bile acid synthesis: pathways, nuclear receptors, and mechanisms [J]. Journal of Hepatology, 2004, 40(3): 539—551
[12]Floch M H. Bile salts, intestinal microflora and enterohepatic circulation [J]. Digest Liver Diseases, 2002, 34(2): 54—57
[13]Hao Y T, Wu S G, Wang G T, et al. The study on the adaptation changes of intestinal microbiota in grass carp (Ctenopharyngodon idellus) fed on different diets [J]. Freshwater Fishery, 2015, 45(3): 46—51 [郝耀彤, 吴山功, 王桂堂, 等. 草鱼肠道微生物对食物改变适应性变化的研究. 淡水渔业, 2015, 45(3): 46—51]
[14]Lü X R. Separation, qualification and preliminary research to that the cellulose degrade of grass carp’s intestinal advantage bacterium [D]. Thesis for Master of Science. Hunan Agricultural University, Changsha. 2008 [吕欣荣. 草鱼肠道优势菌种的分离、鉴定及对纤维素降解的初步研究.硕士学位论文, 湖南农业大学, 长沙, 2008]
[15]Li T, Chiang J Y L. Bile Acid signaling in liver metabolism and diseases [J]. Journal of Lipids, 2011, (4): 1—9
[16]Hofmann A F, Hagey L R. Key discoveries in bile acid chemistry and biology and their clinical applications: history of the last eight decades [J]. Journal of Lipid Research, 2014, 55(8): 1553—1595
[17]Hofmann A F. The continuing importance of bile acids in liver and intestinal disease [J]. Archives of Internal Medicine, 1999, 159(22): 2647—2658
[18]Watanabe M, Houten S M, Mataki C, et al. Bile acids induce energy expenditure by promoting intracellular thyroid hormone activation [J]. Nature, 2006, 439(7075): 484—489
[19]Suzuki T, Aoyama J, Hashimoto M, et al. Correlation between postprandial bile acids and body fat mass in healthy normal-weight subjects [J]. Clinical Biochemistry, 2014, 47(12): 1128—1131
[20]Hu T E, Wang L, Zhang C X, et al. Effects of dietary bile acid supplementation on the growth, whole-body composition and apparent nutrient digestibility of bullfrog (Rana catesbeiana) [J]. Acta Hydrobiologica Sinica, 2015, 39(4): 677—685 [胡田恩, 王玲, 张春晓, 等. 饲料中添加胆汁酸对牛蛙生长性能, 体组成和营养物质表观消化率的影响. 水生生物学报, 2015, 39(4): 677—685]
AN ANALYSIS OF BILE ACID COMPOSITION IN DIFFERENT TISSUES OF GRASS CARP (CTENOPHARYNGODON IDELLUS)
ZHANG Jing1,2, LI Wen-Xiang1,2, ZOU Hong1, LI Ming1,2, WANG Gui-Tang1,2and WU Shan-Gong1,2
(1. The Key Laboratory of Aquatic Biodiversity and Conservation of Chinese Academy of Sciences, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
草鱼; 胆汁酸; 肝胆综合症
Grass carp; Bile acid; Liver and gallbladder syndrome
Q174
A
1000-3207(2017)02-0479-04
10.7541/2017.60
2016-03-14;
2016-07-15
国家自然科学基金(31372571、31272706)资助 [Supported by the National Natural Science Foundation of China (No. 31272706, 31372571)]
张晶(1990—), 女, 河北石家庄人, 硕士研究生; 研究方向为肠道微生物与疾病。E-mail: zhjing926@126.com
吴山功, 副研究员; E-mail: wusgz@ihb.ac.cn
