五个红罗非鱼群体的遗传多样性分析
2017-04-12何金钊陈子桂徐鸿飞赵何勇吕业坚
何金钊 陈 诏 陈子桂 徐鸿飞 赵何勇 吕业坚
(广西壮族自治区水产引育种中心, 南宁 530031)
五个红罗非鱼群体的遗传多样性分析
何金钊 陈 诏 陈子桂 徐鸿飞 赵何勇 吕业坚
(广西壮族自治区水产引育种中心, 南宁 530031)
实验采用微卫星标记技术, 选用22对微卫星引物对5个红罗非鱼群体进行遗传多样性分析。经PCR扩增, 16个微卫星位点扩增产物在关岛红罗非鱼(GD)、珍珠白红罗非鱼(ZZ)、佛罗里达红罗非鱼(FL)、明月红罗非鱼(MY)、马来西亚红罗非鱼(ML)中均获得了清晰稳定的条带。分析结果显示: 16个微卫星标记共检测到146个等位基因。5个群体的平均等位基因数(Na)在6.5625—8.5625, 平均有效等位基因数(Ne)在4.1495—6.1330, 平均杂合度(He)在0.7491—0.8247, 平均多态信息含量(PIC)在0.6939—0.7840, 说明它们的遗传多态性丰富。卡方检验表明5个红罗非鱼群体的大部分位点偏离Hardy-Weinberg平衡。在5个群体中, 关岛红罗非鱼(GD)与珍珠白红罗非鱼(ZZ)遗传相似系数(0.6171)最小, 遗传距离(0.4827)最大, 说明两者亲缘关系最远; 佛罗里达红罗非鱼(FL)与马来西亚红罗非鱼(ML)遗传相似系数(0.9069)最大, 遗传距离(0.0977)最小, 可推断两者亲缘关系最近。采用UPGMA进行聚类分析, 结果表明: 佛罗里达与马来西亚先聚成一支, 二者再与珍珠白聚在一起, 接着三者与明月聚在一起, 最后, 四者与关岛聚到一起。聚类结果说明关岛群体与其他4个群体亲缘关系最远; 佛罗里达与马来西亚亲缘关系最近, 珍珠白群体次之, 明月群体再次之。以上结果可推断5个红罗非鱼群体遗传多态性丰富, 具有较大的选育潜力。
红罗非鱼; 微卫星DNA; 遗传多样性; 遗传关系
罗非鱼属鲈形目(Perciformes)、鲈形亚目(Percoidei)、丽鱼科(Cichlidae)、罗非鱼属(Tilapia)[1],是全球重要的水产养殖品种之一, 也是我国农业部优先推广的淡水养殖优势品种。自20世纪50年代以来, 我国主要引进、选育和养殖的罗非鱼优良品种有尼罗罗非鱼、奥利亚罗非鱼、吉富罗非鱼等。红罗非鱼(Red tilapia)是罗非鱼属间杂交选育而成的一个综合性状优良的养殖品种[2], 具有生长快, 食性杂, 繁殖力强, 适应盐度广, 耐低氧, 抗病力强, 经济价值高等优点, 因其味道鲜美, 肉质嫩滑, 价格实惠而深受人们喜爱。然而, 因红罗非鱼为属间杂交选育所得, 在种质方面存在遗传渐渗和混杂现象,选育养殖时易出现生长速度慢、体色分离等问题,大大影响了红罗非鱼的推广与销售。国内近年来对红罗非鱼的研究主要集中在生物学特性[3—5]、养殖[6]、体色相关因素[7]、耐寒耐盐[8—10]等方面, 在红罗非鱼种质遗传研究方面却鲜有报道。
微卫星标记(Microsatellite)在现代水产遗传与育种研究中发展迅速, 与传统选育技术相结合, 可有效缩短育种年限, 加快育种进程, 是目前遗传育种研究的新方向[11]。微卫星技术已广泛应用于水生生物的遗传选育研究。庞美霞等[12]利用微卫星标记技术对三峡库区5个鲢群体进行遗传变异分析,王瑾瑾等[13]利用10对多态信息含量>0.5的微卫星标记对2个厚颌鲂野生群体进行遗传多样性分析,杨凯等[14]采用微卫星技术对翘嘴鳜F2代家系进行亲子鉴定。钟建兴等[15]利用15个ISSR引物对5个尼罗罗非鱼群体进行了遗传特性分析。张庭等[16]利用19对微卫星引物对4个奥利亚罗非鱼群体进行了研究和探讨。宋红梅等[17]利用16个微卫星位点对橙色莫桑比克罗非鱼进行研究, 发现其群体遗传多样性较丰富。李建林等[18]利用23对微卫星引物对两个吉富罗非鱼群体进行分析, 结果表明两个群体遗传多样性水平较高, 同时发现4对微卫星引物可用于鉴别两个吉富罗非鱼群体。虽然微卫星标记技术常用于罗非鱼遗传多样性分析, 但有关红罗非鱼遗传变异情况的研究报道却较少。马庆男[19]利用TRAP分子标记技术对红罗非鱼进行相关遗传多样性分析; Romana-Eguia等[20]利用微卫星技术分析了5个亚洲红罗非鱼品系的遗传多样性。 Karuppannan等[21]利用20对引物对马来西亚4个红罗非鱼群体进行微卫星分析。本研究利用22对微卫星引物, 对不同地域的5个红罗非鱼群体进行遗传多态性分析, 以期对今后红罗非鱼选育和品系评估等提供基础资料。
1 材料与方法
1.1 实验材料及实验试剂
关岛品系(GD)、珍珠白品系(ZZ)、佛罗里达品系(FL): 2011年从广西壮族自治区水产科学研究院引进。
明月品系(MY)、马来西亚品系(ML): 2008年于中国水产科学研究院淡水渔业研究中心引进。
本实验所采集的5个品系实验鱼均为2013年广西壮族自治区水产引育种中心选留的育种亲鱼。
1.2 实验方法
样品采集本实验分别从关岛品系(GD)、珍珠白品系(ZZ)、佛罗里达品系(FL)、明月品系(MY)、马来西亚品系(ML)中随机选取30尾, 剪取其尾鳍放入装有无水乙醇的离心管中, 于-80℃冰箱保存备用。每次剪取尾鳍之前, 所用剪刀及镊子依次用酒精、蒸馏水、84消毒液、蒸馏水冲洗, 以防止不同样品之间的污染。
DNA的提取本实验采用血液、组织、细胞基因组提取试剂盒抽提DNA。
微卫星引物筛选本实验所采用的微卫星引物从已报道的文献资料[22—24]中选取, 分为GM系列和UNH系列, 共22组, 由上海捷瑞生物工程有限公司合成(具体信息见表 1)。用5个红罗非鱼群体混合DNA对选取的22对微卫星标记进行PCR扩增、8%聚丙烯酰胺胶电泳检测, 从中筛选出扩增效果好, 电泳图谱清晰的引物再对5个红罗非鱼群体进行遗传背景分析。
PCR扩增反应及电泳PCR反应体系为12.5 μL,其中2×Es Taq MasterMix 6 μL, 上、下游引物(10 μmol/ L)各0.5 μL, ddH2O 4.5 μL, DNA模板(50 mg/L)1 μL,轻微振荡后瞬时离心, 然后进行PCR扩增。微卫星PCR反应程序为: 95℃预变性4min; 95℃变性30s,退火30s, 72℃延伸45s, 30个循环; 72℃终延伸10min, 4℃保存。PCR产物经8.0%聚丙烯酰胺凝胶电泳分离, 硝酸银染色、显色后[25], 数码相机拍照。

表 1 22对微卫星引物特征Tab. 1 Characteristics of 22 pairs of microsatellite primes
1.3 数据分析处理
实验利用PopGene 1.32软件计算每个群体的等位基因数(Number of allele, Na)、有效等位基因数(Effective number of alleles, Ne)、期望杂合度(Expected heterozygosity, He)及群体间遗传距离(Genetic Distance, D)。
利用MEGA6软件, 采取UPGMA(非加权配对算术平均法)方法构建5个红罗非鱼群体的系统树,分析各品系间的亲缘关系。
多态信息含量((Polymorphism information content, PIC)的计算:
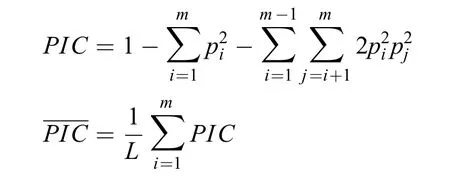
式中 PIC为平均多态信息含量, 反映了基因位点在群体中的多样性程度; L为微卫星位点数; Pi和Pj分别为第i和第j个等位基因在群体中的频率; m为等位基因数。
2 结果
2.1 引物筛选结果
利用红罗非鱼群体混合DNA对22对微卫星标记进行筛选, 电泳结果显示16对微卫星引物扩增出的条带清晰、效果较好, 编号为: UNH104、GM354、UNH168、UNH231、UNH130、UNH106、GM271、UNH180、UNH216、UNH208、UNH925、GM552、UNH998、UNH159、GM201和UNH881。
2.2 五个红罗非鱼品系的等位基因数和有效等位基因数
表 2结果表明, 16个微卫星标记在5个红罗非鱼群体中均表现多态, 共检测到146个等位基因, 其中佛罗里达品系111个、珍珠白品系115个、马来西亚品系108个、关岛品系105个、明月品系137个;明月品系的平均有效等位基因数最高, 为6.1330;佛罗里达品系、珍珠白品系、马来西亚品系、关岛品系的平均有效等位基因数分别为4.4881、4.7338、4.7817和4.1495, 说明5个红罗非鱼品系均具有较高的遗传多态性。
2.3 五个红罗非鱼群体的等位基因频率
从表 3可以看出, 佛罗里达品系在GM354位点处于平衡状态; 珍珠白品系在UNH104位点处于平衡状态; 马来西亚品系在UNH104位点处于平衡状态, 在GM354、UNH881位点处于不平衡状态; 关岛品系在GM354位点处于平衡状态, 在UNH104、UNH168和GM271位点处于不平衡状态; 明月品系在GM354、UNH168、GM271和UNH881位点处于平衡状态, 在UNH130位点处于不平衡状态; 其余位点在各群体中均处于不平衡状态。

表 2 各微卫星位点的等位基因数及有效等位基因数Tab. 2 Number of alleles and effective number of alleles

表 3 五个红罗非鱼群体的χ2检测Tab. 3 Chi-square test of 5 red tilapia populations
2.4 五个红罗非鱼群体的平均杂合度和多态信息含量
PIC和He均为度量群体遗传变异的主要指标。从表 4中可知, 佛罗里达、珍珠白、马来西亚、关岛、明月品系的平均杂合度(He)均较高, 分别为0.7610、0.7661、0.7728、0.7491和0.8247; 其平均多态信息含量(PIC)分别为0.7061、0.7131、0.7212、0.6939和0.7840(PIC>0.5), 均表现为高度多态, 高度多态位点占总位点比例为93.75%、93.75%、100%、100%和93.75%, 说明5个红罗非鱼群体均具有丰富的遗传多态性。
2.5 五个红罗非鱼群体间的遗传距离
表 5结果显示, 关岛品系与珍珠白品系遗传相似性指数最低, 为0.6171, 遗传距离为0.4827, 说明这2个群体间亲缘关系最远; 马来西亚品系与佛罗里达品系遗传相似性指数最高, 为0.9069, 遗传距离为0.0977, 说明这2个群体间亲缘关系最近。
根据5个红罗非鱼群体间的遗传距离, 利用UPGMA法绘制遗传聚类树(图 1), 结果显示佛罗里达、马来西亚、珍珠白、明月、关岛5个品系中, 佛罗里达与马来西亚先聚成一支, 二者再与珍珠白聚在一起, 接着三者与明月聚在一起, 最后, 四者与关岛聚到一起。由此可看出, 关岛与其他4个品系的亲缘关系最远, 佛罗里达与马来西亚的亲缘关系最近。
3 讨论
遗传杂合度(H)、平均有效等位基因(Ne)、多态信息含量(PIC)是反映群体遗传多样性的高低,衡量群体遗传变异的主要参数[26]。本实验中, 5个红罗非鱼群体的平均杂合度分别为0.7610、0.7661、0.7728、0.7491和0.8247, 均比尼罗罗非鱼(0.644)、奥利亚罗非鱼(0.091)、以色列红罗非鱼(0.526)[27]、莫桑比克罗非鱼(0.5248)[17]等的要高, 与Romana-Eguia等[20]报道的红罗非鱼(NIFIred品系)遗传杂合度类似。5个红罗非鱼群体的平均有效等位基因为4.4881、4.7338、4.7817、4.1495和6.1330, 均高于尼罗罗非鱼(4.11)、奥利亚罗非鱼(1.33)、以色列红罗非鱼(3.44)[27]、莫桑比克罗非鱼(2.93)[17]。Botstein等[28]最早提出了衡量基因变异程度高低的多态信息含量指标: 当PIC>0.50 时, 该位点为高度多态位点, 0.25<PIC<0.50时为中度多态性位点, PIC<0.25 时为低度多态位点。5个红罗非鱼群体的平均PIC值分别为0.7061、0.7131、0.7212、0.6939和0.7840, 均大于0.5, 与尼罗罗非鱼(0.580)、奥利亚罗非鱼(0.077)、以色列红罗非鱼(0.466)[27]、莫桑比克罗非鱼(0.4308)[17]等相比较均偏高。因此可
以看出5个红罗非鱼群体总体的遗传多样性处于较高水平, 具有较大的育种潜力。造成5个红罗非鱼群体遗传多样性偏高的原因可能是因为红罗非鱼为属间杂交选育的品种, 有遗传变异增加的情况。已有报道证明杂交后代的遗传多样性会比亲本更高。周翰林等[29]发现两种杂交子一代(青龙斑和虎龙斑)的遗传多样性水平较亲本明显增强。李传阳等[30]利用12个微卫星标记分析表明, 斑鳜(♀)×鳜(♂)杂交后代群体的遗传杂合性均高于斑鳜与鳜。袁文华等[31]也证明了奥尼杂交子代的遗传杂和度(H)和多态信息含量(PIC)比亲本更高。郭瑄等[32]研究显示吉丽罗非鱼(尼罗罗非鱼♀×萨罗罗非鱼♂)的有效等位基因数(Ne)、Nei’s基因多样指数(H)和多态信息含量(PIC)值等群体遗传多样性指标都大于尼罗罗非鱼和萨罗罗非鱼。

表 4 五个红罗非鱼群体16个微卫星座位的遗传变异分析结果Tab. 4 Estimation of genetic variability of 5 red tilapia populations at 16 microsatellite loci
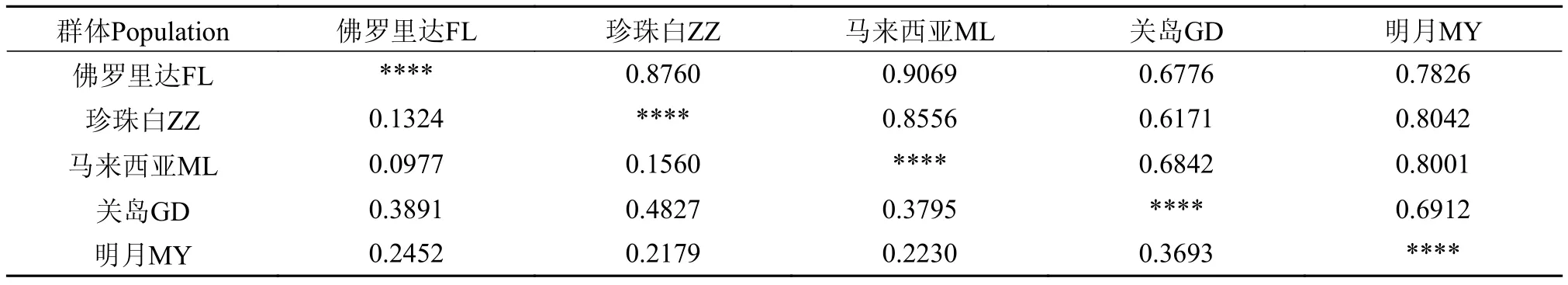
表 5 五个红罗非鱼群体间的Nei’s遗传距离及遗传相似性指数Tab. 5 Nei’s genetic distance and genetic identity among 5 red tilapia populations

图 1 五个红罗非鱼群体亲缘关系的聚类图Fig. 1 Dendrogram of 5 red tilapia populations based on Ds by using UPGMA method
哈迪-温伯格定律(Hardy-Weinberg Equilibrium)是指在理想状态下, 各等位基因的频率和等位基因的基因型频率在遗传中是稳定不变的, 即保持着基因平衡。在本实验中, 16个微卫星卫点在5个红罗非鱼群体大多处于不平衡状态或极不平衡状态, 偏离了哈迪-温伯格定律。不平衡或极不平衡的原因可能是红罗非鱼本身为杂交品种, 易引起遗传突变; 也可能是由于可供选育的亲本有限, 易出现创造者效应(Founder effect)和瓶颈效应(Bottleneck effect)。
遗传相似系数和遗传距离是评价群体间遗传差异大小的重要参数, 常用来描述群体间的遗传关系远近和综合遗传差异。根据Thorp[33]提出的理论可知, 不同物种间遗传相似性指数为0.2—0.8, 同种群体间为0.8—0.97。在本实验中, 珍珠白品系、佛罗里达品系、马来西亚品系的遗传相似性指数均高于0.8, 表明这3个品系可能属于同种群体, 而关岛品系与明月品系的遗传相似性指数在0.2—0.8, 说明这2个群体可能属于2个独立的种群。而5个红罗非鱼群体间的遗传距离结果也表明, 关岛品系与珍珠白品系遗传距离最大, 为0.4827, 说明这2个群体间亲缘关系最远; 马来西亚品系与佛罗里达品系遗传距离最小, 为0.0977, 聚类图中两者再与珍珠白聚在一起, 接着三者与明月聚在一起。本研究中5个红罗非鱼群体的遗传背景并不明确, 尤其是红罗非鱼本身为杂交选育品种, 这对红罗非鱼的选育造成了很大困难。为了更好地指导红罗非鱼选育, 还需在本文的基础上利用线粒体DNA标记和微卫星标记技术对下一代群体进行深入研究。
[1]Chen S Z, Ye W. Study on the imported tilapias in China [J]. Chinese Journal of Zoology, 1994, 29(3): 18—23 [陈素芝, 叶卫. 我国引进的罗非鱼类的初步研究. 动物学杂志, 1994, 29(3): 18—23]
[2]Li X J, Li S F, Feng J H, et al. Preliminary study on salinity tolerance of Israel red tilapia [J]. Journal of Shanghai Fisheries University, 2003, 12(3): 205—208 [李学军,李思发, 冯金海, 等. 以色列红罗非鱼耐盐性的初步研究. 上海水产大学学报, 2003, 12(3): 205—208]
[3]Yang H, Zhu W B, Dong Z J, et al. Morphological variation analysis of three populations of red tilapia [J]. Journal of Shanghai Ocean University, 2015, 24(5): 678—684 [杨慧, 朱文彬, 董在杰, 等. 3个红罗非鱼群体的形态差异分析. 上海海洋大学学报, 2015, 24(5): 678—684]
[4]Chen T, Xu G X, Huang K. Analysis on fatty acid compositions in muscle of fry, male and female parent fish (Oreochromis sp) [J]. Journal of Southern Agriculture, 2013, 44(5): 850—853 [陈涛, 徐高骁, 黄凯. 红罗非鱼稚鱼与雌雄亲鱼肌肉脂肪酸组成分析. 南方农业学报, 2013, 44(5): 850—853]
[5]Chen T. Comparison of fatty acid composition between fry and female tilapia Oreochromis sp during spawning season [J]. Fisheries Science, 2013, 32(10): 585—589 [陈涛. 红罗非鱼鱼苗与繁殖期雌鱼脂肪酸组成的分析. 水产科学, 2013, 32(10): 585—589]
[6]He J Z, Chen Z, Teng Y, et al. The comparison test on growth of different red tilapia strains in a pond [J]. South of China Agriculture, 2016, (10): 181—182 [何金钊, 陈诏, 滕云, 等. 不同品系红罗非鱼池塘养殖生长对比试验. 南方农业, 2016, (10): 181—182]
[7]Gong C P, Zhu W B, Liu H L, et al. Effect of dietary astaxanthin on carotenoid content and deposition rate in tissues of red tilapia [J]. Journal of Shanghai Ocean University, 2014, 23(3): 417—422 [公翠萍, 朱文彬, 刘浩亮,等. 饲料中添加虾青素对红罗非鱼各组织类胡萝卜素含量和沉积率的影响. 上海海洋大学学报, 2014, 23(3): 417—422]
[8]Zhang T S, Jiang T, Kong J, et al. The growth performance of the hybridization offspring of Israel strain red tilapia and other tilapia populations in sea water [J]. Progress in Fishery Sciences, 2015, 36(3): 56—61 [张天时,姜涛, 孔杰, 等. 以色列红罗非鱼与其他罗非鱼群体杂交子一代在海水中生长性能分析. 渔业科学进展, 2015, 36(3): 56—61]
[9]Lu C W, Yuan C G, Ruan C X, et al. Reciprocal test of red tilapia and nile tilapia in freshwater and brine with the salinity of 9‰ [J]. Journal of Anhui Agricultural Sciences, 2014, 42(8): 2330—2334 [陆成伟, 袁重桂, 阮成旭, 等. 淡水和9‰盐度条件下红罗非鱼和尼罗罗非鱼正反交试验. 安徽农业科学, 2014, 42(8): 2330—2334]
[10]Zhu W B, Liu H L, Chen Z Z, et al. Effects of cooling temperature stress on serum biochemical indexes inmalaysian red tilapia (Oreochromis mossambicus×O. niloticus) [J]. Chinese Journal of Fisheries, 2013, 26(5): 16—20 [朱文彬, 刘浩亮, 陈作志, 等. 水产学杂志, 2013, 26(5): 16—20]
[11]Sun X W, Zhang X F, Zhao Y Y, et al. Development and application of microsatellite markers in aquatic species [J]. Journal of Fishery Sciences of China, 2008, 15(4): 689—703 [孙效文, 张晓锋, 赵莹莹, 等. 水产生物微卫星标记技术研究进展及其应用. 中国水产科学, 2008, 15(4): 689—703]
[12]Pang M X, Yu X M, Tong J G. The microsatellite analysis of genetic diversity of five silver carp populations in the three gorges reservoir of the Yangtze river [J]. Acta Hydrobiologica Sinica, 2015, 39(5): 869—876 [庞美霞,俞小牧, 童金苟. 三峡库区5个鲢群体遗传变异的微卫星分析. 水生生物学报, 2015, 39(5): 869—876]
[13]Wang J J, Tong J G, Zhang Y G, et al. Study on the genetic diversity of two wild populations of Megalobrama pellegrini (Teleostei, Cyprinidae) [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 975—979 [王瑾瑾, 童金苟, 张耀光, 等. 厚颌鲂两个野生群体遗传多样性分析. 水生生物学报, 2014, 38(5): 975—979]
[14]Yang K, Cheng W W, Gao Y A, et al. Parentage analysis of F2selective generation in mandarin fish using microsatellites [J]. Acta Hydrobiologica Sinica, 2015, 39(6): 1231—1235 [杨 凯, 成为为, 高银爱, 等. 翘嘴鳜F2家系选育及微卫星亲子鉴定. 水生生物学报, 2015, 39(6): 1231—1235]
[15]Zhong J X, Li J Q, Zhong R, et al. ISSR analysis on genetic relationships of five nile tilapia O. niloticus populations [J]. Journal of Fujian Fisheries, 2012, 34(5): 349—353 [钟建兴, 李金秋, 钟然, 等. 5个尼罗罗非鱼群体遗传关系的ISSR分析. 福建水产, 2012, 34(5): 349—353]
[16]Zhang T, Lu M X, Ye X, et al. The Genetic structure of four populations of Oreochromis aureus by microsatellite DNA analysis [J]. Acta Hydrobiologica Sinica, 2009, 33(3): 498—508 [张庭, 卢迈新, 叶星, 等. 四个奥利亚罗非鱼群体的微卫星分析. 水生生物学报, 2009, 33(3): 498—508]
[17]Song H M, Bai J J, Ye X, et al. Genetic diversity analysis of red Oreochromis mossambicus with microsatetlites and selection of differential loci between red O. mossambicus and O. niloticu [J]. Journal of Fishery Sciences of China, 2008, 15(3): 400—406 [宋红梅, 白俊杰, 叶星, 等. 橙色莫桑比克罗非鱼微卫星遗传多样性分析及其与尼罗罗非鱼差异位点的筛选. 中国水产科学, 2008, 15(3): 400—406]
[18]Li J L, Li H X, Tang Y K, et al. Genetic difference analysis of two genetically improved farmed tilapia populations by using microsatellite marker [J]. Journal of Southern Agriculture, 2015, 46(1): 138—143 [李建林, 李红霞, 唐永凯, 等. 利用微卫星标记分析两个吉富罗非鱼群体的遗传差异. 南方农业学报, 2015, 46(1): 138—143]
[19]Ma Q N. Screening of TRAP markers and analysis of genetic diversity in red tilapia [D]. Thesis for Master of Science. Nanjing Agricultural University, Nanjing. 2012 [马庆男. 红罗非鱼生长相关TRAP分子标记筛选及其遗传多样性分析. 硕士学位论文, 南京农业大学, 南京. 2012]
[20]Romana-eguia M R R, Ikeda M, Basiao Z U, et al. Genetic diversity in farmed Asian Nile and red hybrid tilapia stocks evaluated from microsatellite and mitochondrial DNA analysis [J]. Aquaculture, 2004, 236(1—4): 131—150
[21]Karuppannan K V, Noraida I, Oyyan S. An assessment on red tilapia stocks in Malaysia using microsatellite markers [J]. International Journal of Fisheries & Aquaculture, 2013, 5(5): 78—82
[22]Cnaani A, Ron M, Zilberman N, et al. Geno-me-scan analysis for quantitative trait loci in an F2tilapia hybrid [J]. Molecular Genetics and Genomics, 2004, 272(2): 162—172
[23]Lee B Y, Hulata G, Koche T D. Two unlinked loci controlling the sex of blue tilapia (Oreochromis aureus) [J]. Heredity, 2004, 92(6): 543—549
[24]Cnaani A, Ron M, Hulata G, et al. Fishing in silico: Searching for tilapia genes using sequences of microsatellite DNA markers [J]. Animal Genetics, 2002, 33(6): 474—476
[25]Zhang Y D, Gan X, Tang Z S, et al. Analysis of genetic diversity in six tilapia populations [J]. Journal of Northwest A & F University (Natural Science Edition), 2010. 38(10): 58—66 [张永德, 甘西, 唐章生, 等. 6个罗非鱼群体的遗传多样性及遗传关系研究. 西北农林科技大学学报(自然科学版), 2010, 38(10): 58—66]
[26]Xiao T Y, Zhang X W, Zhang H Y, et al. RAPD analysis of genetic diversity on genomic DNA among 4 species of Pelteobagrus of Dongting Lake [J]. China Biotechnology, 2004, 24(3): 85—89 [肖调义, 张学文, 章怀云, 等. 洞庭湖四种黄颡鱼基因组DNA遗传多样性的RAPD分析. 中国生物工程杂志, 2004, 24(3): 85—89]
[27]Li L H, Yu D H, Huang G J, et al. Comparison of genetic diversity among stocks of Oreochromis niloticus, O. aureus and red tilapia based on microsatellite DNA [J]. Journal of Tropical Oceanography, 2012, 31(2): 102—109 [李莉好, 喻达辉, 黄桂菊, 等. 尼罗罗非鱼Oreochromis niloticus、奥利亚罗非鱼O. aureus和红罗非鱼群体遗传多样性的比较. 热带海洋学报, 2012, 31(2): 102—109]
[28]Botstein D, White R L, Skolnick M. Construction of a genetic linkage map in man using restriction fragment length polymorphisms [J]. American Journal of Human Genetics, 1980, 32(3): 314—331
[29]Zhou H L, Zhang Y, Qi X, et al. SSR analysis of the heterosis in the two grouper hybrids [J]. Journal of Fisheries of China, 2012, 36(2): 161—169 [周翰林, 张勇, 齐鑫, 等. 两种杂交石斑鱼子一代杂种优势的微卫星标记分析. 水产学报, 2012, 36(2): 161—169]
[30]Li C Y, Xu M Y, Zhao J L. et al. Microsatellite analysis of genetic characteristics in spotted Mandarinfish Siniperca schezeri ♀× Mandarinfish S. chuatsi ♂ Hybrids [J]. Fisheries Science, 2014, 33(2): 97—102 [李传阳, 许淼洋, 赵金良, 等. 斑鳜(♀)×鳜鱼(♂)杂交后代遗传特征的微卫星分析. 水产科学, 2014, 33(2): 97—102]
[31]Yuan W H, Liu L, Liu C W, et al. Microsatellite analysis of Oreochromis niloticus, Oreochromis aureus and their hybrids [J]. Modem Agricultural Sciences, 2009, 16(6): 27—30 [袁文华, 刘丽, 刘楚吾, 等. 奥尼罗非鱼及其亲本的微卫星分析. 现代农业科学, 2009, 16(6): 27—30]
[32]Guo X, Li X J, Nie G X, et al. The genetic variation analysis of microsatellite among the Gili Tilapia (Oreochromis niloticus ♀ × Sarotherodon melanotheron ♂) and its parents [J]. Sichuan Journal of Zoology, 2013, 32(3): 321—324 [郭瑄, 李学军, 聂国兴, 等. 吉丽罗非鱼(尼罗罗非鱼♀ × 萨罗罗非鱼♂) 及其两亲本遗传变异的微卫星分析. 四川动物, 2013, 32(3): 321—324]
[33]Thorp J P. The molecular dock hypothesis: Biochemical evolution, genetic differentiation, and systematic [J]. Annual Review of Ecology Systematics, 1982, 13(1): 139—168
GENETIC DIVERSITY ANALYSIS IN FIVE RED TILAPIA POPULATIONS
HE Jin-Zhao, CHEN Zhao, CHEN Zi-Gui, XU Hong-Fei, ZHAO He-Yong and LÜ Ye-Jian
(Guangxi Introduction and Breeding Center of Aquaculture, Nanning 530031, China)
The genetic diversity and phylogenetic relationships among five breed varieties of red tilapia (GD, ZZ, FL, MY, ML) were analyzed by using 22 pairs of microsatellite primers. Stable and clear amplification bands could be amplified in 16 pairs of primers from 5 red tilapia populations by PCR. 16 pairs of microsatellite DNA primers which were selected and proved to amplify successfully on red tilapia by pre-experiment were used. The genetic diversity index of 5 red tilapia populations showed that: a total of 146 alleles were detected from 16 microsatellite markers. The average allele numbers ranged from 6.5625 to 8.5625 and the average effective allele numbers ranged from 4.1495 to 6.1330, respectively. The expected value of average heterozygosities ranged from 0.7491 to 0.8247 and the average polymorphism information contents were ranged from 0.6939 to 0.7840, respectively. Chi-square tests showed that most loci in the 5 red tilapia groups deviated from Hardy-Weinberg equilibrium. The largest genetic distance (0.4827) and the lowest genetic similarity index (0.6171) were found between red tilapia (GD) and red tilapia (ZZ), which suggested a farthest phylogenetic relationship between these two groups. On the other hand, the highest genetic similarity index (0.9069) and the lowest genetic distance (0.0977) were found between red tilapia (FL) and red tilapia (ML), which indicated a closer phylogenetic relationship between these two populations. Phylogenetic relationship of the five populations was analyzed by using UPGMA methods and the results showed that red tilapia (FL) and red tilapia (ML) populations were clustered in the first group, the red tilapia (ZZ) in the second group, the red tilapia (MY) in the third group, while the red tilapia (GD) was in a separate group. Such results indicated that the five red tilapia populations maintained relatively high genetic diversity and still had potential for breeding.
Red tilapia; Microsatellite DNA; Genetic diversity; Genetic relationship
Q346+.5
A
1000-3207(2017)02-0326-08
10.7541/2017.40
2016-06-27;
2016-11-14
广西科技计划项目(桂科AB16380029); 广西科学研究与技术开发计划项目(桂科能14121008-1-6); 广西水产畜牧兽医局渔业生产项目[桂渔牧财(2013)35、桂渔牧财(2014)52、桂渔牧财(2015)21]; 广西水产遗传育种与健康养殖重点实验室开放课题(GXKL-AQUA-2014-07)资助 [Supported by the Science and Technology Projects in Guangxi Zhuang Autonomous Region (GKAB16380029); the Scientific research and Technological Development Projects in Guangxi Zhuang Autonomous Region (GKN14121008-1-6); Fisheries Production Project of Aquatic Animal Husbandry and Veterinary Bureau of Guangxi Zhuang Autonomous Region [GYMC(2013)35, GYMC(2014)52, GYMC(2015)21]; Open Fund of Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture (GXKL-AQUA-2014-07)]
何金钊(1976—), 男, 广西平南人; 本科, 工程师; 主要从事水产养殖引种育种等工作。E-mail: Hjz5301010@163.com
吕业坚(1961—), 男, 硕士, 高级工程师; 主要从事水产育种研究工作。E-mail: lvyejian@163.com
