利用内标为基础的苹果锈果类病毒RT-PCR检测技术
2017-04-12吕运霞李楠王亚迪王雪静杨金凤
吕运霞, 李楠,王亚迪,王雪静,杨金凤,
胡同乐,王树桐,王亚南, 曹克强
利用内标为基础的苹果锈果类病毒RT-PCR检测技术
吕运霞, 李楠,王亚迪,王雪静,杨金凤,
胡同乐,王树桐,王亚南, 曹克强
(河北农业大学 植物保护学院,河北 保定071001)
为开发准确、灵敏的苹果锈果类病毒(Apple scar skin viroid,ASSVd)RT-PCR检测方法,以田间染病苹果组织为试材,提取高质量总RNA为模板,在常规RT-PCR检测体系中引入苹果线粒体nad5基因作为内标基因,对RT-PCR反应体系和程序进行优化,并测定其灵敏度和稳定性,最后利用优化的检测体系确定苹果果实着色期最佳检测部位。结果表明:以RNA提取改良法提取总RNA为模板合成cDNA后,进行PCR扩增,优化后的PCR体系(25 μL)中cDNA模板2 μL、ASSVd(20 pmol/μL)正反向引物各1.0 μL,nad5(20 pmol/μL)正反向引物各0.1 μL;扩增程序中退火温度为60.9℃,循环次数为35次;检测灵敏度为37.5 ng新鲜样本;果实着色期,染病植株的幼嫩叶片、1 a生枝的韧皮部和木质部、果实及部分种子样本均能检测到病毒,最佳检测部位为幼嫩韧皮部。研究结果可以为ASSVd高效、快速、准确的检测提供可靠方法,并为田间病害诊断及无毒苗木繁育提供依据和借鉴。
苹果锈果类病毒;RT-PCR;nad5;分布部位
苹果锈果病又称“花脸病”,是苹果(MaluspumilaMill.)生产中毁灭性的类病毒病害之一[1]。苹果锈果病的病原为苹果锈果类病毒(Apple skin scar viroid,ASSVd)属于马铃薯(SolanumtuberosumL.)纺锤块茎类病毒科马铃薯纺锤块茎类病毒属(Pospiviroid),一般具有330个左右的核苷酸。近年来,伴随老果园高接换优,苹果锈果病发病率逐年升高。同时,一部分新发展苹果园病情也相当严重[2]。
由于类病毒是裸露 RNA 分子, 没有蛋白质外壳,所以苹果锈果病毒不能用血清学方法检测,而指示植物检测法周期长,并且症状表现受环境条件影响较大,准确度低[3]。近年来,反转录聚合酶链式反应(RT-PCR)技术的发明和应用为果树病毒的检测提供了有力的依据[4]。Shamloul利用RT-PCR技术在梨树(PyruscommunisL. ,P.amygdaliformisL.)上发现了ASSVd的新变种[5];赵英和牛建新利用RT-PCR技术首次在我国杏树(ArmeniacavulgarisLam.)、桃树[Amygdaluspersica(L.)Batsch.]、梨树上检测到了ASSVd[6-8];Yazarlou利用RT-PCR技术首次报道了伊朗苹果树和梨树上ASSVd的分子变异[9];郝璐等利用RT-PCR技术首次对侵染小苹果的ASSVd进行了分离鉴定[10]。郭超等利用RT-PCR技术明确了苹果锈果类病毒在八棱海棠(MalusrobustaRehd.)种子中的分布及氢氧化钠脱毒效果分析[11]。但尚未见利用内标为基础的ASSVd RT-PCR检测技术的相关报道。为此,以感染ASSVd的田间苹果树的幼嫩组织为试材,在常规RT-PCR检测体系中引入苹果线粒体nad5作为内标基因,对其共扩增体系及程序进行优化,以期避免假阴性检测结果的发生,并对优化体系田间样本的检测灵敏度和稳定性进行测定;同时,采用优化好的体系,对果实着色期幼嫩叶片、韧皮部、木质部、果肉和种子进行检测,确定苹果果实着色期ASSVd最佳检测部位,以便为ASSVd的有效检测提供技术手段。
1 材料和方法
1.1 材料
于2014年5—7月在河北农业大学苹果实验园,采集显症苹果幼嫩枝条,作为RT-PCR体系建立及优化的材料;于2014年11月在保定市曲阳县苗圃,采集苹果幼嫩枝条,作为验证检测体系可靠性的材料;于2014年9—10月在保定市顺平县南神南,采集显症苹果树幼嫩组织,作为确定果实着色期最佳检测部位的材料。
1.2 主要试剂
植物总RNA提取试剂购自于天根生化科技(北京)有限公司;M-MLV反转录酶、RNA酶抑制剂、RNA稀释液、DNA Marker、dNTPs、大肠杆菌DH5α为宝生物工程(大连)有限公司产品;DEPC、琼脂糖购自于生工生物工程(上海)股份有限公司;2×Es Taq MasterMix购自于北京康为世纪生物科技有限公司; 其他化学试剂购自于保定市万科实验仪器贸易有限公司。
1.3 引物
参阅GenBank中已经发表的ASSVd序列,选择保守性区域自行设计ASSVd特异性引物, 所用软件为Vector NTI version 10.3(Informax,Frederick,MD,USA)。苹果内源基因参照Menzel的报道[12],由生工生物工程(上海)股份有限公司合成,引物序列信息如表1所示。
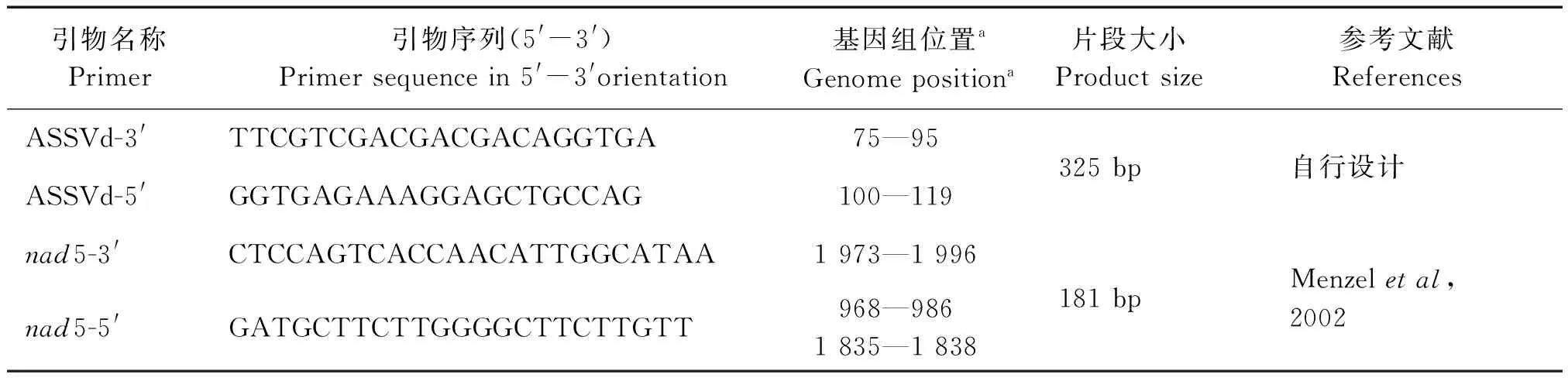
表1 ASSVd RT-PCR检测引物Table 1 Primers used for RT-PCR detection of ASSVd
注:a序列位置参考序列的NCBI登录号分别为:ASSVd(X17696),nad5(D37958)。
1.4 苹果组织总RNA的提取
采用RNA提取改良法[13],取100 mg植物组织,在液氮中充分研磨,加0.5 mL RNAplant 提取液进行提取,最后加入20.00 μL DEPC水充分溶解RNA沉淀,-70.0℃保存备用。
1.5 内标nad5基因与ASSVd共扩增RT-PCR检测体系的优化
以总RNA为模板,按照M-MLV反转录酶说明书合成cDNA第1链,然后进行PCR扩增。自行设计PCR体系及程序如下:PCR反应体系为25.00 μL,包括2×Es Taq MasterMix 12.50 μL、ASSVd(20 pmol/μL)和nad5(20 pmol/μL)正反向引物各0.50 μL、反转录产物3.00 μL,最后用ddH2O补至25.00 μL。PCR反应程序为94.0℃预变性2 min;94.0℃变性1 min,59.0℃退火1 min,72.0℃延伸1 min,共35个循环;最后72.0℃延伸10 min,4.0℃保存。
以上述反应体系为基础,体系的优化分别按照ASSVd(20 pmol/μL)和nad5(20 pmol/μL)引物比例(1∶1,1∶2,1∶5,1∶10,1∶15,1∶20)、cDNA模板用量(4.00 μL,3.00 μL,2.00 μL,1.00 μL,0.50 μL,0.25 μL)、ASSVd(20 pmol/μL)用量(4.00 μL,3.00 μL,2.00 μL,1.00 μL,0.50 μL,0.25 μL)进行逐一优化;程序的优化包括退火温度(70.0℃,68.9℃,67.1℃,64.4℃,60.9℃,58.5℃,56.4℃,55.0℃)和循环次数(25,30,35,40,45)的优化。
1.6 内标nad5基因与ASSVd共扩增RT-PCR检测体系灵敏度的测定
将染病植株的总RNA用RNA稀释液进行系列稀释,稀释比例分别为1∶10、1∶100、1∶1 000、1∶10 000、1∶100 000、1∶1 000 000、1∶10 000 000,然后进行RT-PCR检测,根据扩增效果,确定优化体系的检测灵敏度。
1.7 内标nad5基因与ASSVd共扩增RT-PCR检测体系可靠性的验证
利用优化的RT-PCR检测体系,对曲阳果园124株田间样品进行检测,采用常规RT-PCR体系进行验证[2]。比较2种方法的检测结果,验证本研究内标nad5基因与ASSVd共扩增RT-PCR检测体系检测的准确性。
1.8 序列测定与电泳分析
PCR产物的电泳分析: 1×TAE电泳缓冲液,1.5%琼脂糖凝胶,上样量8.00 μL,100 V稳压电泳40 min,EB染色后观察结果。目的片段的克隆测序:PCR产物切胶回收,纯化后与载体连接,转化大肠杆菌DH5α,通过蓝白斑筛选和PCR鉴定阳性克隆[14],委托生工生物工程(上海)股份有限公司完成测序,测序结果与GenBank中序列进行同源性分析,确定序列的准确性。
1.9 RT-PCR最佳检测组织的确定
为了明确果实着色期ASSVd在苹果树1 a生枝条及果实中的分布情况及最佳检测部位,对田间处于果实着色期的10株果树1 a生枝条叶片、韧皮部、木质部、果肉和种子进行了RNA提取和RT-PCR检测,观察扩增效果,确定果实着色期带毒部位及最佳检测部位。
2 结果与分析
2.1 内标nad5基因与ASSVd共扩增RT-PCR检测体系的建立
对染病植株进行nad5基因、ASSVd基因单独扩增和共扩增,结果如图1所示。

图1 内标为基础的ASSVd RT-PCR体系的建立
Fig.1 Establishment of ASSVd RT-PCR system based on internal standard
注:M:DL2 000;1, 2: 染病植株nad5单独扩增;3, 4:染病植株ASSVd单独扩增;5, 6:染病植株nad5和ASSVd共同扩增。
由图1可知,nad5基因单独扩增得到181 bp目的条带,ASSVd基因单独扩增得到325 bp目的条带,nad5基因和ASSVd基因共扩增同时得到181 bp和325 bp目的条带,表明nad5和ASSVd共同扩增的有效性。
2.2 内标nad5基因与ASSVd共扩增RT-PCR检测体系的优化
以选用的ASSVd和nad5为引物,按照RT-PCR基本体系和程序对引物配比、cDNA模板、引物用量、退火温度、循环次数进行逐一优化。PCR产物经凝胶电泳后观察扩增效果,确定RT-PCR共扩增最佳体系及程序组合。结果如图2所示。
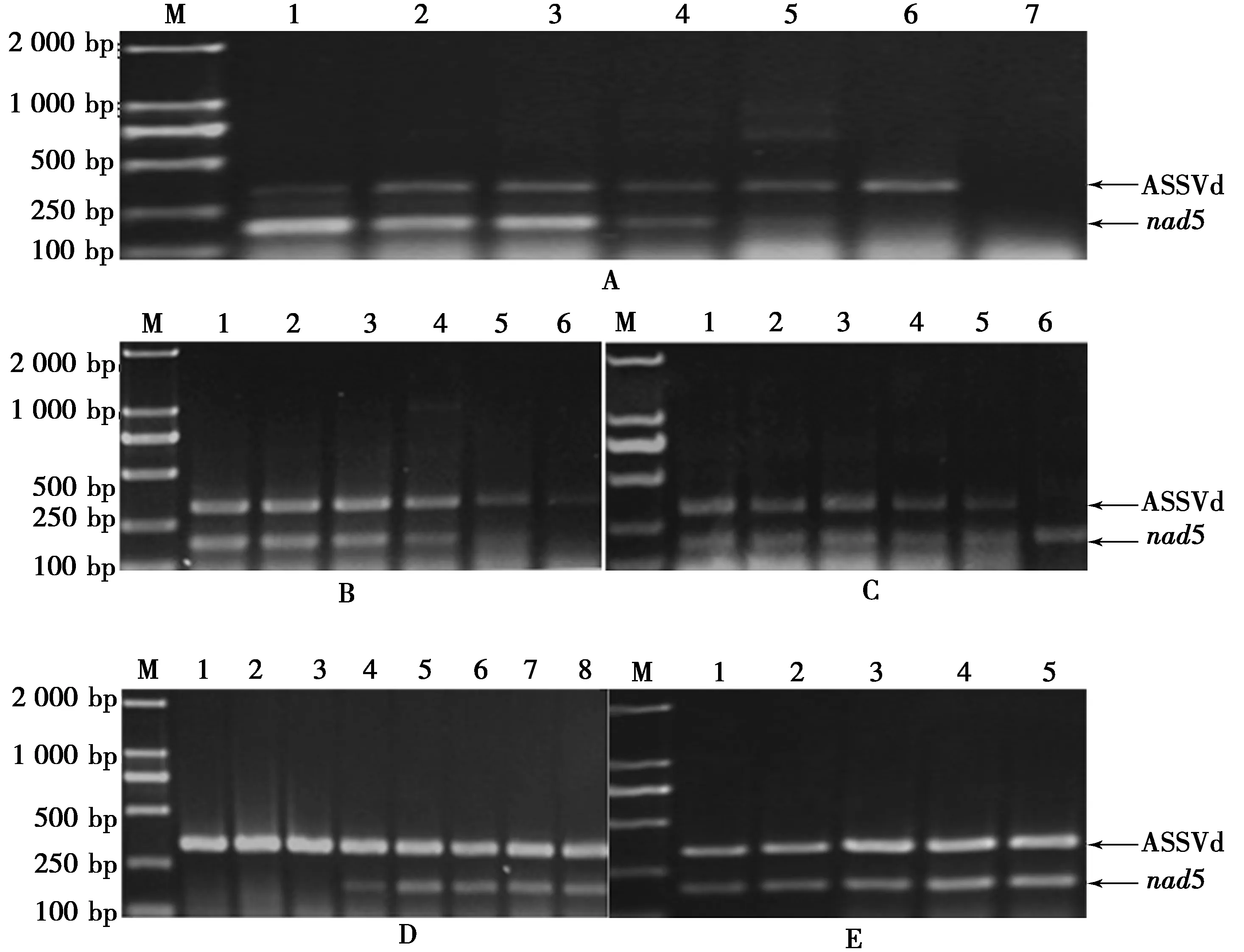
图2 内标为基础的ASSVd RT-PCR体系的优化Fig.2 Optimization of ASSVd RT-PCR system based on internal control
注:M:DL2 000;A:ASSVd:nad5引物比例,(泳道1—7为1∶1,1∶2,1∶5,1∶10,1∶15,1∶20);B:cDNA模板(泳道1—6为4.00 μL,3.00 μL,2.00 μL,1.00 μL,0.50 μL,0.25 μL);C:ASSVd引物用量(泳道1—6为4.00 μL,3.00 μL,2.00 μL,1.00 μL,0.50 μL,0.25 μL);D:退火温度(泳道1—8为70.0℃,68.9 ℃,67.1 ℃,64.4℃,60.9 ℃,58.5 ℃,56.4 ℃,55.0℃);E:不同循环次数(泳道1—5为25,30,35,40,45)
由图2可知,最终确定的体系为25 μL的PCR体系:含cDNA模板2.00 μL、ASSVd(20 pmol/μL)正反向引物各1.00 μL,nad5(20 pmol/μL)正反向引物各0.10 μL,ddH2O 8.30 μL,2×Es Taq MasterMix 12.50 μL;最终优化的程序为:94.0℃预变性2 min;94.0℃变性45 s,60.9℃退火45 s,72.0℃延伸30 s,共35个循环;最后72.0℃延伸10 min。
2.3 内标nad5基因与ASSVd共扩增RT-PCR检测体系灵敏度的确定
将染病植株幼嫩韧皮部提取的总RNA用RNA稀释液进行系列稀释,然后以稀释后的RNA为模板,进行RT-PCR检测,测定体系的灵敏度,结果如图3所示。
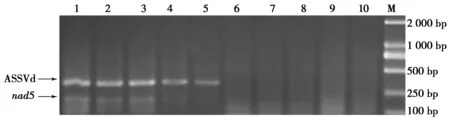
图3 ASSVd RT-PCR灵敏度的测定
Fig.3 Assay of the detection sensitivity of RT-PCR for ASSVd
注:M:DL 2 000;1:未被稀释的染病植株总RNA提取液;2—8:以RNA稀释液系列稀释染病植株总RNA提取液1∶10,1∶100,1∶1 000,
1∶10 000,1∶100 000,1∶1 000 000,1∶10 000 000;9—10:RNA稀释液。
由图3可知,作为阴性对照的RNA稀释液没有扩增出病毒特异性条带,而以总RNA为模板10 000倍稀释液仍有325 bp和181 bp左右的条带出现。经过折算,RT-PCR共扩增体系的灵敏度达到能够检测37.5 ng新鲜植物组织中的ASSVd。
2.4 内标nad5基因与ASSVd共扩增RT-PCR检测体系可靠性的验证
利用内标nad5基因与ASSVd共扩增RT-PCR检测体系和利用常规RT-PCR检测体系对保定市曲阳县124株样品进行检测,部分检测结果如图4所示。本研究检测体系检测出30株带毒,参考的常规检测体系检测出28株带毒,说明本研究检测体系有效控制了假阴性的发生,证明了本研究RT-PCR体系对田间样本检测的准确性和可靠性。
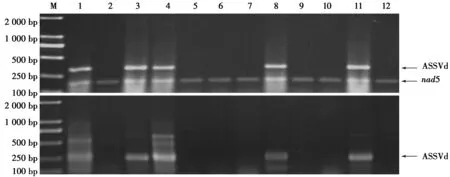
图4 曲阳部分样品ASSVd RT-PCR检测结果
Fig.4 ASSVd RT-PCR detection result of Quyang sample
注: M:DL2 000;1—10:QY-1,QY-2,QY-3,QY-4,QY-5,QY-6,QY-7,QY-8,QY-9,QY-10;11:阳性对照;12:健康植株对照。上为本研究检测体系,下为参考检测体系。
2.5 PCR产物的克隆与测序
对RT-PCR特异条带进行回收、克隆和测序,获得与目的片段大小相符的序列,经过序列比对,ASSVd与GenBank中X71599株系亲缘关系最近,相似性为99%;nad5与GenBank中GU585873.1株系亲缘关系最近,相似性为99%,结果进一步验证了检测结果的可靠性。
2.6 果实着色期ASSVd最佳检测组织部位的确定
对果实着色期田间1 a生枝条不同部位进行了RNA提取和RT-PCR检测,结果如图5所示。
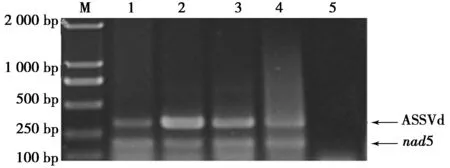
图5 9—10月份苹果各组织部位ASSVd RT-PCR检测结果
Fig.5 Detection of ASSVd in different parts of apple in September and October by RT-PCR
注:M: DL2 000;1:叶片,2:韧皮部,3:木质部,4:果实,5:阴性对照 。
由图5可知,10株果树1 a生枝条叶片、韧皮部、木质部和果实均成功扩增出了ASSVd目的条带,且结果稳定,其中韧皮部条带亮度最高,为最佳检测部位。通过对种子带毒情况检测发现,10个样本中仅7个样本扩增出了目的条带,不宜作为检测部位。
3 结论与讨论
试验利用自行设计的引物,在常规RT-PCR检测体系基础上引入线粒体nad5基因为内标,确定适宜的引物浓度组合为ASSVd引物20 pmol/μL,nad5内标引物2 pmol/μL,采用优化后的内标nad5基因与ASSVd共扩增RT-PCR检测体系进行检测,检测体系灵敏度达到10 000×总RNA模板稀释液,不低于常规RT-PCR检测体系灵敏度[16]。测序结果表明,ASSVd与GenBank中X71599株系亲缘关系最近,相似性为99%;nad5与GenBank中GU585873.1株系亲缘关系最近,相似性为99%。同时,通过对果实着色期不同部位进行检测,最终确定1 a生枝条的韧皮部为苹果植株ASSVd最佳检测部位。
曾有多种内标被报道,但是没有一种可区分RNA与DNA模板,因此在RT-PCR前必须完全消除DNA[15]。nad5基因是苹果线粒体DNA的NADH脱氢酶亚基5基因,利用此基因为RT-PCR的内标不论是健康样或带毒样,当RNA完整且可扩增时,nad5均能成功被扩增出,且不受DNA存在与否的影响。当存在DNA污染、RNA处于抑制状态或降解时,nad5则不能被扩增出。以nad5为内标可减少假阴性出现,使检测结果更加可靠[15]。
在田间样本检测中,不同的检测部位影响着检测的准确性。带有休眠芽的1 a生枝条枝皮组织可以作为果树病毒周年检测的材料[11],检测果树1 a生枝条叶片、韧皮部、木质部和果实都能扩增出ASSVd的目的条带,因韧皮部条带亮度相对较高,从而确定为最佳检测部位,并且树皮为检测材料可以使检测不受季节限制。
[1]张振英,姜中武. 苹果锈果病的发生途径与预防措施[J].河北果树,2008,91(1): 39-40.
[2]赵英, 牛建新. 利用两种方法检测苹果锈果类病毒[J]. 植物保护, 2008, 34(2): 132-138.
[3]赵英, 牛建新. 生物素标记cDNA探针检测苹果锈果类病毒[J]. 西北农业学报, 2008, 17(3): 302-307.
[4]牛建新, 马兵钢, 何梅, 等. 库尔勒香梨主要病毒多重RT-PCR检测技术研究[J]. 植物病理学报, 2006, 36(1): 12-21.
[5]Shamloul A M. Characterization of a new variant of Apple scar skin viroid associated with pear fruit crinkle disease[J]. Journal of Plant Pathology, 2004, 86(3): 249-256.
[6]赵英, 牛建新. 应用RT-PCR和斑点杂交法检测新疆梨树上的苹果锈果类病毒[J]. 果树学报, 2007, 24(6): 761-764.
[7]赵英, 牛建新. 新疆桃树上苹果锈果类病毒(ASSVd)的检测与全序列分析[J]. 果树学报, 2008, 25(2): 274-276.
[8]赵英, 牛建新. 新疆杏树苹果锈果类病毒的检测与全序列分析[J]. 园艺学报, 2008, 35(6): 805-810.
[9]Yazarlou A, Jafarpour B, Habili N,etal. First detection and molecular characterization of new Apple scar skin viroid variants from apple and pear in Iran[J]. Australasian Plant Disease Notes, 2012, 7(1): 99-102.
[10]郝璐, 叶婷. 侵染小苹果的苹果锈果类病毒的检测和全序列分析[J]. 植物保护, 2015, 41(1): 126-128.
[11]郭超, 邵建柱, 乔雪华, 等. 苹果锈果类病毒在八棱海棠种子中的分布及氢氧化钠脱毒效果分析[J]. 植物保护学报, 2014, 41(3): 342-345.
[12]Menzel W, Jelkmann W, Maiss E. Detection of four apple viruses by multiplex RT-PCR assays with coamplification of plant mRNA as internal control[J]. Journal of Virological Methods, 2002, 99(1-2): 81-92.
[13]焦朝霞, 邵建柱, 孙建设. 田间苹果成熟组织RNA高效提取方法[J]. 果树学报, 2011, 28(1): 161-164.
[14]Wang Y N, Li X H, Liu Y,etal. Development of a simple and effective method for specific detection of Pepper mild mottle virus[J]. Acta Virologica, 2009, 53(1): 21-27.
[15]牛建新, 李西平, 赵英, 等. 利用内标为基础的RT-PCR技术检测葡萄茎痘伴随病毒[J]. 园艺学报,2006, 33(5): 1083-1086.
[16]吴然, 李君英, 邵建柱, 等. 苹果锈果类病毒实时荧光PCR检测方法的建立[J]. 果树学报, 2015, 32(1): 150-155.
(编辑 潘秀华)
Internal reference gene-based RT-PCR assay for the detection of apple scar skin viroid
LV Yunxia,LI Nan,WANG Yadi,WANG Xuejing,YANG Jinfeng,HU Tongle,WANG Shutong,WANG Yanan,CAO Keqiang
(CollegeofPlantProtection,HebeiAgriculturalUniversity,Baoding071001,China)
In order to develop an accurate and sensitive method to detect apple scar skin viroid(ASSVd), a RT-PCR assay based on internal standard was developed. The total RNA with high quality was extracted from diseased apple branch. The primers of ASSVd and apple mitochondria genenad5 were added to the assay and the RT-PCR detection method was optimized. In fruit coloring period, the optimal detection tissue was also determined. The total RNA was extracted by improved RNA-extraction method and cDNA was synthesed. Our results showed that the optimized reaction system contained cDNA template 2 μL, the forward and reverse primers of ASSVd(20 pmol/μL) both for 1.0 μL, and the forward and reverse primer ofnad5(20 pmol/μL) both for 0.1 μL. The PCR annealing temperature was 60.9℃ and the cycle was 35. The sensitivity of the optimized RT-PCR method could reach as less as 37.5 ng fresh sample. The tissues, including young leaves, phloem, xylem, fruit and part of seed could be used to detect ASSVd in fruit coloring period, and the young phloem was the best test tissue in this special period. The method provided a reliable way for efficient, rapid and accurate detection of ASSVd and lay a foundation for disease diagnosis and detoxification seedling breeding.
Apple scar skin viroid; RT-PCR;nad5; distribution sites
1007-4961(2017)01-0051-06
10.13320/j.cnki.hjfor.2017.0010
2016-10-25;
2016-12-23
国家苹果现代产业技术体系(CARS-28);河北省高等学校科学技术研究项目“苹果褪绿叶斑病毒运动相关寄主因子研究”(YQ2014023);河北省青年拔尖人才计划。
吕运霞(1990-),女,河北邯郸人,在读硕士研究生,研究方向为植物病害流行与综合防治。 李楠(1994-),女,河北衡水人,在读硕士研究生,研究方向为植物病害流行与综合防治。 吕运霞与李楠为同等贡献作者。
曹克强(1963-),男,河北容城人,博士,教授,从事植物病害流行与综合防治研究。
S 432.4
A
